El desarrollo de lesión renal aguda (FRA) durante la hospitalización por SARS-Cov-2 se ha asociado a una elevada morbimortalidad. El Registro FRA-COVID SEN ha recogido datos de pacientes con este perfil durante los meses de la pandemia. El objetivo de este trabajo fue caracterizar la población española ingresada por COVID-19 que desarrolló FRA, con/sin necesidades de tratamiento renal sustitutivo (TRS), modalidades terapéuticas utilizadas y resultados en términos de mortalidad.
Material y métodoEstudio retrospectivo de datos procedentes de 30 hospitales españoles, recopilados en el Registro español FRA COVID desde mayo de 2020 hasta noviembre 2021. Se registraron variables clínicas y demográficas, datos relacionados con la gravedad de la COVID-19, con el FRA y de supervivencia. Mediante estudio de regresión multivariante se analizan los factores relacionados con la necesidad de TRS y con la mortalidad.
ResultadosSe registraron datos de 730 pacientes. El 71,9% eran hombres, con edad media de 70 años (60-78). El 70,1% eran hipertensos, el 32,9% diabéticos, el 33,3% con enfermedad cardiovascular y el 23,9% presentaban algún grado de enfermedad renal crónica. Desarrollaron neumonía el 94,6%, con necesidad de soporte ventilatorio en el 54,2% e ingreso en UCI en un 44,1% de los casos.
La mediana de tiempo desde el inicio de los síntomas de COVID hasta la aparición de FRA fue de 6 días (4-10). En cuanto a la gravedad: 37,1% KDIGO I, 18,3% KDIGO II y 44,6% KDIGO III; requirieron TRS 235 pacientes (33,9%). Las técnicas continuas (TCRR) fueron las más empleadas (155 pacientes), seguidas de hemodiálisis (HD) intermitente (89 pacientes), HD diaria (36 pacientes), hemodiafiltración (HDF) 17 pacientes y HD expandida (HDexp) en 24 casos. El hábito tabáquico (OR 3,41), la necesidad de soporte ventilatorio (OR 20,2), la cifra de creatinina máxima (OR 2,41) y el tiempo transcurrido desde el inicio de los síntomas hasta la aparición del FRA (OR 1,13) se identificaron como predictores de la necesidad de TRS en nuestra cohorte, mientras la edad se comporta como protector (OR: 0,95). El grupo que no requirió TRS se caracterizó por presentar mayor edad, menor gravedad de FRA y un tiempo de aparición y recuperación de la lesión renal más corto (p<0,05).
El 38,6% de la cohorte falleció durante la hospitalización. La gravedad del FRA y la necesidad de TRS fue más frecuente en el grupo de fallecidos. En el análisis multivariante, la edad (OR 1,03), la enfermedad renal crónica previa (OR 2,21), el desarrollo de neumonía (OR 2,89), el soporte ventilatorio (OR 3,34) y el TRS (OR: 2,28) se comportaron como factores predictores mientras que el tratamiento crónico con ARA II se comportó como factor protector (OR 0,55).
ConclusionesDel análisis del Registro FRA-COVID SEN se deduce que los pacientes que presentaron FRA durante la hospitalización por COVID-19 tenían una edad media elevada, mayores comorbilidades y presentaron un cuadro de infección grave. Definimos 2 patrones clínicos diferentes: un FRA de aparición precoz, en pacientes más ancianos, que se resuelve en pocos días sin necesidad de TRS; y otro patrón más grave, con mayor requerimiento de TRS y aparición tardía en el curso de la enfermedad, que se relacionó con mayor gravedad de la misma. La gravedad de la infección, la edad y la presencia de ERC previa al ingreso fueron factores determinantes en la mortalidad de estos pacientes, identificando el tratamiento crónico con ARA II como un factor protector de mortalidad.
Acute kidney injury (AKI) is common among hospitalized patients with COVID-19 and associated with worse prognosis. The Spanish Society of Nephrology created the AKI-COVID Registry to characterize the population admitted for COVID-19 that developed AKI in Spanish hospitals. The need of renal replacement therapy (RRT) therapeutic modalities, and mortality in these patients were assessed.
Material and methodIn a retrospective study, we analyzed data from the AKI-COVID Registry, which included patients hospitalized in 30 Spanish hospitals from May 2020 to November 2021. Clinical and demographic variables, factors related to the severity of COVID-19 and AKI, and survival data were recorded. A multivariate regression analysis was performed to study factors related to RRT and mortality.
ResultsData from 730 patients were recorded. A total of 71.9% were men, with a mean age of 70 years (60–78), 70.1% were hypertensive, 32.9% diabetic, 33.3% with cardiovascular disease and 23.9% had some degree of chronic kidney disease (CKD). Pneumonia was diagnosed in 94.6%, requiring ventilatory support in 54.2% and admission to the ICU in 44.1% of cases.
The median time from the onset of COVID-19 symptoms to the appearance of AKI (37.1% KDIGO I, 18.3% KDIGO II, 44.6% KDIGO III) was 6 days (4–10). A total of 235 (33.9%) patients required RRT: 155 patients with continuous renal replacement therapy, 89 alternate-day dialysis, 36 daily dialysis, 24 extended hemodialysis and 17 patients with hemodiafiltration. Smoking habit (OR 3.41), ventilatory support (OR 20.2), maximum creatinine value (OR 2.41) and time to AKI onset (OR 1.13) were predictors of the need for RRT; age was a protective factor (0.95). The group without RRT was characterized by older age, less severe AKI, shorter kidney injury onset and recovery time (p<0.05). 38.6% of patients died during hospitalization; serious AKI and RRT were more frequent in the death group. In the multivariate analysis, age (OR 1.03), previous chronic kidney disease (OR 2.21), development of pneumonia (OR 2.89), ventilatory support (OR 3.34) and RRT (OR 2.28) were predictors of mortality while chronic treatment with ARBs was identified as a protective factor (OR 0.55).
ConclusionsPatients with AKI during hospitalization for COVID-19 had a high mean age, comorbidities and severe infection. We defined two different clinical patterns: an AKI of early onset, in older patients that resolves in a few days without the need for RRT; and another more severe pattern, with greater need for RRT, and late onset, which was related to greater severity of the infectious disease. The severity of the infection, age and the presence of CKD prior to admission were identified as risk factors for mortality in these patients. In addition chronic treatment with ARBs was identified as a protective factor for mortality.
La enfermedad por coronavirus (COVID-19) se ha convertido en una de las peores pandemias de la historia humana reciente, con resultados clínicos dramáticos a corto y a largo plazo, más de 250 millones de personas infectadas y más de 5 millones de muertes en todo el mundo1. Durante el tiempo transcurrido la comunidad científica internacional ha realizado un esfuerzo sin precedentes en la historia moderna para comprender mejor la naturaleza y la fisiopatología de esta enfermedad.
La presentación de la COVID-19 varía considerablemente. Aunque se manifiesta principalmente como una enfermedad respiratoria, se exacerba y progresa en algunos individuos debido a respuestas inmunitarias/inflamatorias anormales con daño endotelial generalizado y alteraciones en la coagulación sanguínea, generando un espectro mucho más grave de la enfermedad2. Una proporción sustancial de pacientes con COVID-19 grave muestra signos de daño renal. Clínicamente, la afectación renal varía desde proteinuria leve/moderada y hematuria hasta daño renal agudo (FRA), con necesidad de terapia de reemplazo renal (TRS) en algunos casos. Los mecanismos fisiopatológicos del daño renal en pacientes con COVID-19 siguen sin estar claros, pero se sabe que son multifactoriales. El conocimiento actual implica efectos directos dependientes del SARS-CoV-2 sobre las células renales (células epiteliales tubulares y podocitos) e indirectos a través del efecto sistémico de la infección viral secundaria a la enfermedad pulmonar crítica y secundarios al propio manejo de la enfermedad2–3. La afectación renal es un factor condicionante de mayor mortalidad intrahospitalaria en todas las series publicadas4–7.
La incidencia de FRA reportada es muy variable, oscilando entre 0,5-56% según las series8. La población estudiada y la región del mundo de donde proceden las series impacta directamente en estas diferencias entre los datos publicados. Las cohortes iniciales de procedencia asiática reportaban una incidencia inferior al 7%9,10, mientras que las series occidentales señalan una incidencia entre el 11-46%4–6, alcanzando hasta el 76-80% en pacientes ingresados en la UCI11–13. Los factores relacionados con el desarrollo de lesión renal durante la COVID-19 también difieren ampliamente entre las publicaciones, habiéndose relacionado con características demográficas (edad mayor a 60 años, género masculino o afrodescendencia), situaciones comórbidas (hipertensión arterial (HTA), diabetes mellitus (DM), enfermedad cardiovascular (ECV), obesidad, enfermedad pulmonar obstructiva crónica (EPOC) o enfermedad renal crónica (ERC), así como con la gravedad del estado del paciente (inestabilidad hemodinámica o necesidad de ventilación artificial)8,11–15.
El pilar del tratamiento sigue siendo la prevención del daño renal y, llegado el caso, TRS. En este aspecto también encontramos en la literatura grandes oscilaciones en cuanto a la frecuencia de la necesidad del TRS, oscilando entre el 0,8% al 31%8. En su momento surgieron muchas dudas sobre el abordaje del TRS en estos pacientes: si debíamos abordarlo de la misma manera que en el contexto de otros procesos agudos o de forma diferente, si alguna modalidad de TRS pudiera ser superior para la eliminación de citoquinas, si la terapia adsortiva, postulada repetidamente en el tratamiento de la sepsis, podía aportar ventajas, o si las terapias continuas de baja eficiencia podrían ser más eficientes. En el transcurso de la pandemia numerosos estudios han tenido como objetivo abordar las preocupaciones surgidas en la comunidad nefrológica en diferentes aspectos. Sin embargo, la capacidad de sacar conclusiones significativas de estos estudios ha sido difícil en muchos casos debido a las barreras que han supuesto las limitaciones de datos y la utilización de metodología dudosa que conlleva numerosos sesgos.
La Sociedad Española de Nefrología (SEN), desde el inicio de la pandemia, se ha mostrado muy sensible con la situación, habiendo participado activamente en diferentes iniciativas que han ayudado en la toma de decisiones clínicas. Desde la SEN se ha subrayado reiteradamente que el desarrollo de lesión renal puede ser una complicación severa de COVID-19, destacando la importancia de ahondar en el conocimiento de esta entidad, así como establecer las intervenciones necesarias para mejorar el pronóstico de los pacientes con COVID-19. En este contexto surgió el Registro FRA-COVID de la SEN, donde se han recogido desde mayo de 2020 a noviembre de 2021 datos clínicos de pacientes con FRA secundario a COVID-19, incluyendo básicamente variables relacionadas con la infección por SARS-Cov-2, la afectación renal y la necesidad de TRS en nuestro país. Un comité de expertos de la SEN eligió un conjunto mínimo de variables que nos diera una perspectiva del impacto que la pandemia estaba ocasionando, así como las necesidades de TRS en pacientes agudos a lo largo de nuestro país. Dadas las grandes discrepancias encontradas en los estudios disponibles, la explotación del Registro FRA-COVID de la SEN representa una oportunidad de caracterizar los pacientes con esta lesión en nuestro entorno dentro del contexto de la gran heterogenicidad de las cohortes publicadas, así como conocer el manejo realizado de estos pacientes en nuestro medio, identificar el perfil de pacientes que ha requerido TRS, las modalidades de tratamiento sustitutivo empleadas y los resultados obtenidos en cuanto a recuperación de función renal y mortalidad.
Material y métodoSe trata de un estudio de cohorte observacional retrospectivo en el que se incluyeron todos los datos recopilados en el Registro español FRA COVID desde mayo de 2020 hasta noviembre de 2021. El Registro FRA-COVID presentó una estructura on line con acceso a través de un sitio web (página web de la SEN: www.senefro.org) donde los miembros de esta sociedad, tras identificarse mediante un usuario previamente registrado, pudieron incorporar pacientes hospitalizados con FRA e infección por SARS-CoV-2 confirmada por reacción en cadena de la polimerasa en tiempo real.
El estudio cumplió con las pautas establecidas por la Declaración de Helsinki y la Declaración de Estambul. La investigación fue aprobada por el Comité Ético Regional Institucional de Andalucía. La obtención del consentimiento informado no fue necesaria dada la naturaleza retrospectiva del estudio.
ObjetivosLos objetivos de este trabajo fueron caracterizar la población española ingresada por COVID-19 que ha desarrollado FRA, identificar el perfil de pacientes que ha requerido TRS, así como las modalidades de tratamiento sustitutivo empleadas en nuestro medio y los resultados obtenidos en cuanto a recuperación de la función renal y la mortalidad.
Variables incluidas en el RegistroLas variables registradas se pueden clasificar en los siguientes subgrupos:
- -
Variables demográficas y clínicas en el momento del ingreso: sexo, edad, hábito tabáquico, comorbilidad (HTA, DM, ECV, ERC, antecedentes oncológicos, obesidad, EPOC e inmunosupresión), tratamiento domiciliario previo al ingreso con inhibidores de la enzima convertidora de la angiotensina (IECA) y/o antagonistas de los receptores de la angiotensina (ARA II).
- -
Presentación clínica de la COVID-19: definida «presentación clínica típica» como la presencia de síntomas respiratorios (disnea, tos, expectoración y rinorrea). La detección de otros síntomas se definió como presentación clínica atípica.
- -
Variables relacionadas con la gravedad de la infección: desarrollo de neumonía, necesidad de soporte ventilatorio, ingreso en la unidad de cuidados intensivos (UCI), puntuación APACHE II al ingreso en la UCI, necesidad de ventilación mecánica y uso de oxigenación por membrana extracorpórea (ECMO).
- -
Variables relacionadas con el daño renal agudo: creatinina máxima, clasificación FRA KDIGO, uso de contraste radiológico, necesidad de TRS (tiempo en días y modalidad terapéutica), presencia de albuminuria y/o hematuria durante el ingreso (no cuantificadas, solo se registró presencia o ausencia en alguna de las analíticas de seguimiento durante el ingreso)
- -
Los pacientes fueron tratados de acuerdo con el estándar de atención en cada centro, por lo que las decisiones terapéuticas, así como la realización de terapia de reemplazo renal, se tomaron en función de la opinión del nefrólogo y de los infectólogos responsables del paciente.
- -
Parámetros analíticos al séptimo día del inicio de los síntomas de COVID-19: linfocitos (número absoluto), PCR (mg/l), D-dímero (ng/ml), interleuquina-6 (pg/ml) y ferritina (ng/ml).
- -
Tiempo (días) desde el inicio de los síntomas hasta el diagnóstico de FRA y tiempo (días) hasta recuperación de función renal.
- -
Situación de los pacientes al finalizar la hospitalización: exitus durante el ingreso, recuperación de la función renal o permanencia en TRS al alta.
Para definir FRA, así como para establecer la severidad del episodio, se utilizaron los criterios Kidney Disease: Improving Global Outcomes (KDIGO). El FRA fue definido como el aumento de la concentración de creatinina sérica≥0,3mg/dl (26,5μmol/l) durante un intervalo de 48horas o incremento≥1,5 veces en los últimos 7 días, o diuresis<0,5ml/kg/h durante 6horas; y la severidad del mismo se categorizó según los estadios i, ii y III de KDIGO16.
La recuperación de creatinina basal previa al ingreso o la salida de TRS en un paciente que habría requerido terapias de reemplazo fue considerado recuperación de FRA.
Se definió enfermedad renal crónica como tasa de filtración glomerular estimada<60ml/min/1,73 m2, correspondiente a un estadio G3 o superior según la clasificación KDIGO17. El valor más alto de creatinina y menor de FGe (CKD EPI) que constara en la historia del paciente durante el año previo al ingreso fueron considerados como función renal basal.
Análisis estadísticoSe realizó en primer lugar un análisis estadístico descriptivo, resumiendo las variables cuantitativas con medidas de tendencia central como media y desviación estándar, o mediana y rango intercuartílico en caso de distribución de datos asimétrica. Para las variables categóricas se emplearon frecuencias y porcentajes. Para el análisis bivariado entre variables categóricas se empleó la prueba de Chi cuadrado o la prueba exacta de Fisher según correspondiera. En el caso de variables cuantitativas se utilizó la prueba de la «t» de Student o la U de Mann-Whitney, según las distribuciones se ajustaran o no a la normalidad, respectivamente. Se realizaron 2 modelos de regresión multivariante. Se utilizó técnica de regresión logística binomial, por pasos hacia atrás y ajustada por el estadístico de Wald para estudiar las variables independientemente relacionadas con la mortalidad durante el ingreso hospitalario y aquellas relacionadas con la necesidad de tratamiento renal sustitutivo. Se chequeó la bondad de ajuste del modelo con estadísticos de Hosmer-Lemeshow y se consideraron aquellas variables clínicamente relevantes y las que presentaron diferencias significativas con valor de p asociado al test<0,05 en el análisis bivariante previo.
Para todos los test de hipótesis se consideró como límite de significación estadística un error alfa de 0,05. El análisis de los datos se realizó con el paquete estadístico IBM SPSS 20.0.
ResultadosSe recogieron datos de 730 pacientes con infección por SARS-CoV-2 documentada, que fueron hospitalizados como consecuencia de la COVID-19 y que desarrollaron durante el ingreso un episodio de FRA. Los pacientes procedían de 30 hospitales distribuidos por toda España. En los anexos 1 y 2 se detallan todas las unidades de nefrología que reportaron casos, así como la cobertura geográfica por comunidades autónomas.
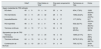
La edad media de estos pacientes fue de 69 años, el 71,9% eran varones, un 70,1% hipertensos, el 32,9% diabéticos, un 33,3% presentaban antecedentes de ECV, el 11,8% antecedentes oncológicos, un 17,3% EPOC, el 13,4% inmunosuprimidos, un 21,1% obesos y el 12,4% eran fumadores. El 23,9% de los pacientes (171 pacientes) presentaban algún grado de ERC previo al ingreso (tabla 1). La mayoría de los pacientes con ERC presentaban un estadio G3 (135 pacientes), siendo menos frecuente los estadios avanzados de enfermedad (G4: 30 pacientes; G5: 6 pacientes).
Características basales de los pacientes incluidos en el estudio, variables relacionadas con la infección por COVID-19 y el daño renal agudo
| Población totalN=730 | SupervivientesN=433 | ExitusN=282 | p | |
|---|---|---|---|---|
| Variables demográficas y clínicas al momento del ingreso | ||||
| Edad años (media, DE) | 69±21 | 67±25 | 72±12 | <0,001 |
| Sexo masculino n (%)a | 514 (71,9) | 127 (29,3) | 74 (26,2) | 0,369 |
| Diabetes mellitusa | 234 (32,9) | 132 (30,5) | 102 (36,6) | 0,092 |
| Hipertensión arteriala | 500 (70,1) | 291 (67,2) | 209 (74,6) | 0,034 |
| Enfermedad cardiovasculara | 237 (33,3) | 125 (28,9) | 112 (40,3) | 0,002 |
| EPOCa | 123 (17,3) | 65 (15) | 58 (20,9) | 0,043 |
| Antecedentes oncológicosa | 84 (11,8) | 39 (9) | 45 (16,2) | 0,004 |
| ERCa | 171 (23,9) | 76 (17,6) | 95 (33,7) | <0,001 |
| Inmunosupresióna | 32 (13,4) | 13 (11,4) | 19 (15,3) | 0,376 |
| Obesidada | 146 (21,1) | 88 (20,9) | 58 (21,3) | 0,894 |
| Hábito tabáquicoa | 87 (12,4) | 49 (11,4) | 38 (13,9) | 0,331 |
| IECAa | 139 (19,6) | 64 (14,8) | 75 (27) | <0,001 |
| ARAIIa | 259 (36,5) | 180 (41,7) | 79 (28,4) | <0,001 |
| Presentación clínica de la enfermedad COVID-19 | ||||
| Presentación clínica típicaa | 635 (91,2) | 388 (91,7) | 247 (90,5) | 0,569 |
| Variables relacionadas con la gravedad de la infección | ||||
| Neumoníaa | 665 (94,6) | 397 (92,8) | 268 (97,5) | 0,007 |
| Soporte ventilatorioa | 384 (54,2) | 174 (40,6) | 210 (75,3) | <0,001 |
| ECMOa | 15 (2,2) | 6 (1,4) | 9 (3,3) | 0,088 |
| Ingreso en UCIa | 312 (44,1) | 139 (32,3) | 173 (62,2) | <0,001 |
| APACHE II (media, DE) | 16 ±7 | 14±7 | 16±6 | 0,017 |
| Días inicio de síntomas hasta ingreso en UCI (media, DE) | 12±15 | 15±18 | 10±10 | 0,060 |
| Variables relacionadas con el daño renal agudo | ||||
| Clasificación KDIGOa | <0,001 | |||
| KDIGO I | 253 (37,1) | 210 (51) | 43 (15,9) | |
| KDIGO II | 125 (18,3) | 79 (19,2) | 46 (17) | |
| KDIGO III | 304 (44,6) | 123 (29,9) | 181 (67) | |
| Creatinina máxima (media, DE) | 2,72±1,95 | 2,33±1,92 | 3,35±1,85 | <0,001 |
| Albuminuriaa | 113 (30,5) | 60 (30) | 53 (21,2) | 0,807 |
| Hematuriaa | 90 (24,3) | 47 (23,6) | 43 (25) | 0,757 |
| Días: inicio síntomas hasta FRA (media, DE) | 8±7 | 8±6 | 10±9 | 0,017 |
| Administración de contraste | 125 (18) | 69 (16,4) | 56 (20,5) | 0,167 |
| Necesidad de TRS | 235 (33,9) | 96 (23) | 139 (50,4) | <0,001 |
| Días en TRS (media, DE) | 15±22 | 13±12 | 18±28 | 0,942 |
| Permanencia en TRSa | 51 (7,5) | 7 (1,6) | 44 (17,5) | <0,001 |
| Días para recuperación del FRA (media, DE) | 9,2±12,4 | 9,2±12,5 | 9,4±11,5 | 0,963 |
| Parámetros analíticos al séptimo día del inicio de los síntomas de COVID-19 (media, DE) | ||||
| Proteína C reactiva (mg/l) | 86,1±115,1 | 82,7±101,2 | 89,5±127,3 | 0,824 |
| D-dímelos (ng/ml) | 4.665,1±5.068,5 | 3.531,2±9.529,1 | 6.524,3±0954,7 | 0,126 |
| Interleucina 6 (pg/ml) | 156,8±917,7 | 167,6±1094,4 | 146,5±611,2 | <0,001 |
| Ferritina (ng/ml) | 1.150,1±2.472,1 | 1.029,1±1.374,9 | 1.364,1±3.620,5 | 0,391 |
| Linfocitos (n. absol./mcl) | 643,6±899,9 | 752,3±1076,2 | 485,1±502,7 | <0,001 |
ARA II: fármacos antagonistas de los receptores de angiotensina II; DE: desviación estándar; ERC: enfermedad renal crónica; EPOC: enfermedad pulmonar obstructiva crónica; FRA: fracaso renal agudo; IECA: fármacos inhibidores del sistema angiotensiona-aldosterona; TRS: tratamiento renal sustitutivo; UCI: unidad de cuidados críticos.
*Las variables cualitativas se expresan en números absolutos (porcentajes sobre la columna correspondiente).
Nota aclaratoria: 240 pacientes requieren TRS. En la tabla aparecen 235 debido a 5 valores perdidos (casos que tiene recogida la variable TRS pero no la de exitus). Número de pacientes con determinaciones de proteína C reactiva 406, D-dímeros 632; Interleucina 6 506, ferritina 646 y linfocitos 701.
En el 91,2% de los casos la forma de presentación de la infección fue la típica con semiología respiratoria, y hasta el 94,6% de los pacientes reportados desarrolló neumonía. Trescientos ochenta y cuatro pacientes (54,2%) precisaron soporte ventilatorio, 312 (44,1%) ingresaron en la UCI y 15 necesitaron ECMO. El tiempo medio transcurrido desde el inicio de los síntomas de la COVID hasta que el paciente precisó ingreso en la UCI fue de 8 días (RIQ: 5-12).
Un 44,6% de los casos reportados desarrolló un KDIGO III, seguido en frecuencia de KDIGO I, que se refirió en un 37,1% de los casos. El 18,3% restante presentó un grado ii. Solo en 4 pacientes se realizó biopsia renal, por lo que no se incluyen los datos en este estudio. En el momento del ingreso solo existen datos respecto a parámetros urinarios en aproximadamente la mitad de los casos (373 para albuminuria y 374 hematuria), siendo positiva la presencia de albuminuria en el 30,5% de los casos recogidos (113 pacientes) y de hematuria en el 24,3% (90 pacientes).
Los valores analíticos a los 7 días del inicio de los síntomas se recogen en la tabla 1, presentando unos niveles medios muy elevados, por encima del rango de normalidad en todos los parámetros analizados (CPR; D-dímeros, IL6, ferritina), así como linfopenia.
Tratamiento renal sustitutivoPrecisaron TRS durante el ingreso 240 pacientes. Las modalidades terapéuticas utilizadas fueron hemodiálisis (HD) diaria en 36 pacientes, HD intermitente en 89 pacientes, hemodiafiltración (HDF) 17 pacientes, hemodiálisis expandida (HDexp) en 24 casos y terapias continuas (TCRR) en 155 pacientes (tabla 2). En muchos casos se utilizó más de una terapia en el mismo paciente: se combinó TCRR y HD intermitente en 49 pacientes, TCRR y HD diaria en 16 pacientes, en 6 pacientes HDexp y TCRR, 11 pacientes combinaron HD intermitente y diarias, 6 pacientes HD intermitente y HDF, y finalmente en 14 pacientes se combinaron HD intermitente y HDexp. El tiempo medio de TRS fue de 15+22 días.
Modalidades de tratamiento renal sustitutivo: desenlace clínico
| Población totalN=730 | SupervivientesN=433 | ExitusN=282 | p | |
|---|---|---|---|---|
| Según modalidad de TRS utilizado | ||||
| Hemodiálisis diaria, n (%) | 36 (5,1) | 17 (3,9) | 19 (7) | <0,001 |
| Tiempo (días), media (DE) | 0,8±2,4 | 0,9±2,3 | 0,76±2,5 | 0,432 |
| Hemodiálisis intermitente, n (%) | 89 (12,6) | 49 (11,3) | 40 (14,7) | <0,001 |
| Tiempo (días), media (DE) | 4,4±19,7 | 3,9±6,8 | 4,5±25,3 | 0,006 |
| Hemodiafiltración, n (%) | 17 (2,4) | 8 (1,9) | 9 (3,3) | <0,001 |
| Tiempo (días), media (DE) | 0,52±2,8 | 0,47±2,1 | 0,57±3,3 | 0,703 |
| Hemodiálisis expandida, n (%) | 24 (3,4) | 9 (2,1) | 15 (5,5) | <0,001 |
| Tiempo (días), media (DE) | 0,9±3,8 | 1,2±5,1 | 0,6±2,6 | 0,963 |
| Terapias continuas, n (%) | 155 (22) | 63 (14,6) | 92 (33,8) | <0,001 |
| Tiempo (días), media (DE) | 9,1±11,4 | 7,2±8,7 | 10,5±12,9 | 0,156 |
| Terapia absortiva, n (%) | 19 (2,7) | 6 (1,4) | 13 (4,8) | <0,001 |
| Tiempo (días), media (DE) | 1,1±5,1 | 0,8±4,4 | 1,3±5,5 | 0,352 |
| Agrupados por tipo de TRS | ||||
| Técnicas intermitentes, n (%) | 72 (9,9) | 31 (7,2) | 40 (14,2) | <0,001 |
| Tiempo (días), media (DE) | 12±34 | 9±9 | 14±45 | 0,536 |
| Técnicas continuas, n (%) | 100 (13,7) | 30 (6,9) | 69 (24,5) | 0,016 |
| Tiempo (días), media (DE) | 14±12 | 11±9 | 16±13 | 0,055 |
| Combinación de técnicas, n (%) | 59 (8,1) | 33 (7,6) | 23 (8,2) | <0,001 |
| Tiempo (días), media (DE) | 23±17 | 20±14 | 26±20 | 0,213 |
(%): porcentaje por columna; DE: desviación estándar.
También se han reportado 19 casos en los que se recurrió a usar terapias adsortivas. En 18 de ellos esta alternativa terapéutica se combinó con TCRR.
En la tabla 2 se recogen los datos de supervivencia y tiempo de tratamiento en cada una de las modalidades, de manera independiente, considerando en cada modalidad a los pacientes que hubieran usado cada una de ellas (tabla 2[«Según la modalidad de TRS utilizado»), y agrupadas en función de que se utilizara terapia intermitente, continua o mixta (tabla 2 [«Agrupados por tipo de TRS»]). Se comprueba que el porcentaje de pacientes que precisó TRS fue significativamente mayor en el grupo de pacientes fallecidos en todas las modalidades terapéuticas y agrupaciones.
Los pacientes que requirieron TRS se caracterizaron por ser en su mayoría varones y tener menor edad que el grupo que no requirió tratamiento. No encontramos diferencias significativas respecto a la prevalencia de comorbilidades entre ambos grupos, salvo para obesidad y los antecedentes de tabaquismo, que eran más frecuentes entre los pacientes que precisaron diálisis (32,3% vs. 15,9% y 17,5% vs. 10,2% respectivamente). El grado de disfunción renal previo no se relacionó con la necesidad de TRS (tabla 3).
Características basales de los pacientes, variables relacionadas con la infección por COVID-19 y el daño renal agudo según la necesidad de tratamiento renal sustitutivo
| Población totalN=703 | No TRSN=463 | TRSN=240 | p | |
|---|---|---|---|---|
| Variables demográficas y clínicas al momento del ingreso | ||||
| Edad años (media, DE) | 69±21 | 71±24 | 64±10 | <0,001 |
| Sexo masculino n(%)a | 505 (71,8) | 308 (66,5) | 197 (82,1) | <0,001 |
| Diabetes mellitusa | 231 (33) | 149 (32,3) | 82 (34,3) | 0,583 |
| Hipertensión arteriala | 490 (69,8) | 322 (69,5) | 168 (70,3) | 0,838 |
| Enfermedad cardiovasculara | 232 (33,1) | 159 (34,4) | 73 (30,7) | 0,319 |
| EPOCa | 122 (17,5) | 80 (17,3) | 42 (17,7) | 0,894 |
| Antecedentes oncológicosa | 79 (11,3) | 50 (10,9) | 29 (12,2) | 0,603 |
| ERCa | 167 (23,8) | 111 (24) | 56 (23,3) | 0,850 |
| Inmunosupresióna | 32 (13,3) | 18 (13) | 14 (13,6) | 0,901 |
| Obesidada | 147 (21,6) | 71 (15) | 76 (32,3) | <0,001 |
| Hábito tabáquicoa | 88 (12,7) | 47 (10,2) | 41 (17,5) | 0,006 |
| IECAa | 140 (20) | 68 (14,8) | 72 (30,3) | <0,001 |
| ARA IIa | 250 (35,8) | 182 (39,5) | 698 (28,6) | 0,004 |
| Presentación clínica de la enfermedad COVID-19 | ||||
| Presentación clínica típicaa | 646 (91,2) | 417 (92,3) | 209 (88,6) | 0,09 |
| Variables relacionadas con la gravedad de la infección | ||||
| Neumoníaa | 657 (94,8) | 426(93,8) | 231(96,7) | 0,112 |
| Soporte ventilatorioa | 390 (55,8) | 167(36,3) | 223(93,3) | <0,001 |
| ECMOa | 16 (2,3) | 3(0,7) | 13(5,7) | <0,001 |
| Ingreso en UCIa | 317 (45,4) | 103(22,4) | 214(89,5) | <0,001 |
| APACHE II (media, DE) | 16±7 | 17±7 | 16±7 | 0,526 |
| Días inicio de síntomas hasta ingreso en UCI (media, DE) | 12±15 | 8±6 | 14±17 | 0,045 |
| Mortalidada | 276 (39,8) | 137 (29,9) | 139 (59,1) | <0,001 |
| Variables relacionadas con el daño renal agudo | ||||
| Creatinina máxima (media, DE) | 2,72±1,95 | 2,00±1,24 | 4,60±2,18 | <0,001 |
| Albuminuria durante el ingresoa | 114 (30,6) | 50 (25) | 63 (37) | 0,012 |
| Hematuria durante el ingresoa | 92 (24,6) | 34 (16,9) | 58 (33,5) | <0,001 |
| Días: inicio síntomas hasta FRA (media, DE) | 9±7 | 7±5 | 12±9 | <0,001 |
| Administración de contrastea | 126 (18,4) | 51 (11,3) | 75 (32,2) | <0,001 |
| Días para recuperación del FRA (media, DE) | 9±13 | 5±6 | 22±18 | <0,001 |
| Parámetros analíticos al séptimo día del inicio de los síntomas de COVID-19 (media, DE) | ||||
| Proteína C reactiva (mg/l) | 86,1±115,1 | 80,3±96,9 | 92,9±131,1 | 0,579 |
| D-dímelos (ng/ml) | 4.665,1±5.068,5 | 4.767±1.345,9 | 4.787±1.856,3 | 0,303 |
| Interleucina 6 (pg/ml) | 156,8±917,7 | 86,1±497,5 | 2.657±1.317,5 | 0,366 |
| Ferritina (ng/ml) | 1.150,1±2472,1 | 936±1197,4 | 1.573,6±3.870,1 | 0,143 |
| Linfocitos (n. absol/mcl) | 643,6±899,9 | 666,6±1065,2 | 593,1±495,7 | 0,286 |
| Resultados finales | ||||
| Mortalidada | 276 (39,8) | 137 (29,9) | 139 (59,1) | <0,001 |
ARA II: fármacos antagonistas de los receptores de angiotensina II; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FRA: fracaso renal agudo; IECA: fármacos inhibidores del sistema angiotensiona-aldosterona; TRS: tratamiento renal sustitutivo; UCI: unidad de cuidados críticos.
aLas variables cualitativas se expresan en números absolutos y porcentajes sobre la columna correspondiente.
Nota aclaratoria: 27 valores perdidos para la variable TRS. Número de pacientes con determinaciones de proteína C reactiva 406, D-dímeros 632, interleucina 6 506, ferritina 646, linfocitos 701.
Respecto a la presentación clínica del cuadro la mayoría de los pacientes del grupo de TRS precisó soporte ventilatorio (93,3% vs. 36,3%; p<0,001) e ingreso en UCI (89,5% vs. 22,4%; p<0,001). La mortalidad durante el ingreso fue mayor en los pacientes con TRS (59,1% vs. 29,9%; p<0,001), indicando una mayor gravedad del cuadro clínico. En los parámetros analíticos recogidos estos pacientes presentaban en una mayor proporción albuminuria y hematuria al ingreso, y alcanzaron mayores cifras de creatinina máxima. No encontramos diferencias significativas en el resto de los parámetros analizados al séptimo día del inicio de los síntomas (tabla 3).
Datos a reseñar son el hecho de que el uso de contraste iodado fue más frecuente en el grupo que precisó TRS (32,2% vs. 11,3%; p<0,001) y los tiempos de instauración y recuperación del FRA entre ambos grupos presentaban diferencias significativas. Los pacientes que requirieron diálisis iniciaron FRA más tardíamente que el resto, 10 vs. 5 días de media desde el inicio de los síntomas, con una media de recuperación de la función renal de 21 días (tabla 3).
De manera global, un 17,5% de los pacientes que requirió TRS permaneció en diálisis en el momento de recoger los datos y un 59,1% falleció durante la hospitalización. En la tabla 4 se recogen algunas características diferenciales de los pacientes y resultados finales según las diferentes modalidades de TRS utilizadas.
Características diferenciales según las modalidades de TRS utilizadas
| Edada | Días totales en TRSa | Días para recuperación FRa | Permanece en TRS | Exitus | |
|---|---|---|---|---|---|
| Según modalidad de TRS utilizado | |||||
| HD diaria | 65±9 | 13±14 | 25±14 | 6/34 (17,6%) | 19/36 (52,8%) |
| HD intermitente | 63±11 | 20±32 | 26±14 | 19/82 (23,2%) | 40/89 (44,9%) |
| Hemodiafiltración | 63±8 | 14±11 | 24±17 | 1/17 (5,9%) | 9/17 (52,9%) |
| HD expandida | 66±6 | 12±9 | 18±12 | 5/22 (22,7%) | 15/24 (62,5%) |
| Técnicas continuas | 63±10 | 17±14 | 24±18 | 32/134 (23,9%) | 92/156 (59%) |
| Agrupados por tipo de TRS | |||||
| Técnicas intermintentes | 67±10 | 12±34 | 18±14 | 18/65 (27,7%) | 40/71 (56%) |
| Técnicas continuas | 64±10 | 14±12 | 19±20 | 25/79 (31,6%) | 69/99 (69,7%) |
| Combinación de técnicas | 62±10 | 23±17 | 31±14 | 7/55 (12,7%) | 23/56 (41,1%) |
FR: función renal; TRS: tratamiento renal sustitutivo.
En la tabla 5 se recogen los resultados del análisis multivariante. El hábito tabáquico (OR 3,41; IC 95%: 1,04-11,2), la necesidad de soporte ventilatorio (OR 20,2; IC 95%: 6,5-62,7), la cifra de creatinina máxima (OR 2,41; IC 95%: 1,87-3,10) y el tiempo transcurrido desde el inicio de los síntomas hasta la aparición del FRA (OR 1,13; IC 95%: 1,07-1,20) se comportan como predictores de la necesidad de TRS en nuestra cohorte, mientras la edad se comporta como protector (0,95).
Análisis multivariante de regresión logística para la variable TRS
| Sig. | OR | IC 95,0% para EXP(B) | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| Edad | 0,001 | 0,951 | 0,923 | 0,979 |
| Hábito tabáquico | 0,043 | 3,415 | 1,040 | 11,214 |
| Creatinina máxima | 0,000 | 2,416 | 1,878 | 3,108 |
| Días desde inicio síntomas hasta FRA | 0,000 | 1,138 | 1,073 | 1,207 |
| Soporte ventilatorio | 0,000 | 20,262 | 6,544 | 62,740 |
| Constante | 0,003 | 0,034 | ||
Variables introducidas: edad (años), obesidad (dicotómica), hábito tabáquico (dicotómica), hematuria (dicotómica), albuminuria (dicotómica), creatinina máxima (mg/dl), ERC (dicotómica), tratamiento con IECA (dicotómica), tratamiento con ARA II (dicotómica), tiempo desde inicio de síntomas COVID hasta FRA (días) y soporte ventilatorio (dicotómica).
ARA II: fármacos antagonistas de los receptores de angiotensina ii; ERC: enfermedad renal crónica; FRA: fracaso renal agudo; IECA: fármacos inhibidores del sistema angiotensina-aldosterona; OR: odds ratio; TRS: tratamiento renal sustitutivo; UCI: unidad de cuidados críticos.
Un total de 282 pacientes de la cohorte (38,6%) fallecieron durante la hospitalización. Este grupo se caracterizó por presentar mayor edad (73 vs. 68 años; p<0,001) y una mayor carga de comorbilidad de base. La HTA, ECV, EPOC y los antecedentes oncológicos e inmunosupresión eran más prevalentes entre los pacientes fallecidos; así mismo, había una mayor proporción de pacientes con ERC previa al ingreso. El tratamiento previo con IECA era más frecuente en el grupo que falleció durante el ingreso, mientras el tratamiento con ARA fue más frecuente entre los supervivientes (tabla 1).
Desde el punto de vista clínico, estos pacientes requirieron con mayor frecuencia ingreso en UCI y soporte ventilatorio (p<0,001), y la puntuación APACHE II en el momento del ingreso en la UCI fue significativamente superior. La gravedad del FRA fue mayor, con un predominio de pacientes KDIGO III (p<0,001) (tabla 1). La necesidad de TRS fue más frecuente en el grupo de fallecidos, donde superaba el 50%. Todas las modalidades terapéuticas de TRS se asociaron con mayor mortalidad y 44 pacientes fallecieron dependientes de TRS (tabla 2).
En el análisis multivariante se identificaron como predictores de mortalidad factores relacionados con el propio individuo y también factores relacionados con la gravedad en la presentación de la COVID-19. La edad (OR 1,03; IC 95%: 1,01-1,04), la presencia de ERC previa (OR 2,21; IC 95%: 1,46-1,34), el desarrollo de neumonía (OR 2,89; IC 95%: 1,09-1,64), la necesidad de ventilación asistida (OR 3,34; IC 95%: 2,19-5,10) y la necesidad de TRS en el contexto del FRA (OR: 2,28; IC 95%: 1,50-3,42) se comportaron como factores predictores relacionados de forma independiente con la mortalidad durante el ingreso hospitalario. Por el contrario, el tratamiento crónico del paciente con ARA II se comportó como factor protector en el análisis (OR 0,55) (tabla 6).
Análisis multivariante de regresión logística para mortalidad
| Sign, | OR | I,C, 95,0% para EXP (B) | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| Edad | 0,000 | 1,032 | 1,017 | 1,047 |
| ERC previa | 0,000 | 2,214 | 1,465 | 3,344 |
| Tratamiento con ARA II | 0,002 | 0,552 | 0,380 | 0,800 |
| Soporte ventilatorio | 0,000 | 3,345 | 2,191 | 5,107 |
| Neumonía | 0,032 | 2,895 | 1,096 | 7,647 |
| TRS | 0,000 | 2,289 | 1,509 | 3,472 |
| Constante | 0,000 | 0,010 | ||
Variables introducidas: edad (años), ERC (dicotómica), tratamiento con IECA (dicotómica), tratamiento con ARA II (dicotómica), soporte ventilatorio (dicotómica), neumonía (dicotómica), TRS (dicotómica), necesidad de UCI (dicotómica).
ARA II: fármacos antagonistas de los receptores de angiotensina ii; ERC: enfermedad renal crónica; FRA: fracaso renal agudo; IECA: fármacos inhibidores del sistema angiotensina-aldosterona; OR: odds ratio; TRS: tratamiento renal sustitutivo; UCI: unidad de cuidados críticos.
Presentamos un estudio descriptivo del perfil clínico de los pacientes que desarrollaron FRA durante la hospitalización por COVID-19 en nuestro país a partir de los datos recogidos en Registro FRA-COVID de la SEN (mayo de 2020-noviembre de 2021). Las variables recogidas no nos permitieron calcular la incidencia que ha presentado esta entidad, pero sí permiten caracterizar de forma adecuada dicha población. De manera global, nuestros pacientes fueron en su mayoría varones, con una edad media elevada (70 años) e hipertensos en un porcentaje considerable (69,8%); DM, ERC, ECV y obesidad fueron comorbilidades observadas con frecuencia. Todos estos factores comórbidos han sido identificados previamente como factores predisponentes, tanto a mayor gravedad de la infección como a aparición de FRA entre los pacientes que requieren ingreso hospitalario4,8,11–15. Llama la atención que la prevalencia de ERC previa al ingreso fue del 23,9%, bastante inferior a otras series recogidas en nuestro medio. Portolés et al.6 señalaron una prevalencia de ERC en el 43,5% de los pacientes ingresados por COVID-19 que desarrollaron FRA durante la primera ola de la pandemia en un hospital de Madrid. En nuestro trabajo se recogieron datos de un largo periodo de tiempo, pudiendo esta diferencia en la prevalencia reflejar la moderación del efecto que la pandemia ha ido presentando a lo largo del tiempo entre los pacientes más frágiles, en los que impactó sobremanera la primera ola.
Publicaciones previas reportan que los factores con mayor impacto en el riesgo de lesión renal aguda en el curso de la COVID-19 se relacionan con la gravedad del estado del paciente, la necesidad de utilizar catecolaminas, shock séptico y/o la necesidad de utilizar ventilación artificial por insuficiencia respiratoria4,8,13. Nuestra cohorte coincidió en estos términos, apareciendo la lesión renal en pacientes con COVID grave y evolución tórpida de la enfermedad infecciosa: casi la totalidad presentaba cuadro de neumonía, la mitad de ellos precisó soporte respiratorio y las cifras medias de marcadores inflamatorios fueron muy elevadas de forma global.
El 32,9% de la cohorte analizada requirió TRS. Hassanein et al.8, en una revisión de la literatura, muestra una gran variación en la frecuencia de la necesidad de terapia de reemplazo renal en estos pacientes. Sin duda, las diferencias en cuanto a incidencia de FRA, manejo clínico del paciente en cada hospital, así como la saturación de los sistemas sanitarios y la disponibilidad de medios técnicos y humanos, han sido factores determinantes en estas oscilaciones. Varios metaanálisis que investigan la frecuencia global de necesidad de TRS en este tipo de pacientes estiman que varía entre el 3,6 y 4,3%0,18,19, alcanzando cifras del 20-40% en series de pacientes ingresados en la UCI20. Hay que tener en cuenta el sesgo de selección que presenta nuestro Registro por el hecho de que los datos proceden de pacientes que han sido valorados por los servicios de nefrología. Es lógico pensar que hayamos seguido los casos más graves, de ahí que nuestro resultado se asemeje más a los obtenidos en las series de pacientes graves ingresados en intensivos.
La presencia de hematuria y la proteinuria en los pacientes con COVID hospitalizados se ha identificado como predictores de lesión renal y de mortalidad durante el ingreso6,11. En nuestros datos solo se registraron estos parámetros urinarios en aproximadamente la mitad de los casos. Aun así, la detección de hematuria y proteinuria fue significativamente más elevada en los pacientes con necesidad de TRS. Dichas alteraciones urinarias probablemente reflejen el desarrollo de la lesión renal severa. En la literatura la lesión histológica más frecuentemente reportada fue la necrosis tubular aguda21, aunque también se han descrito cuadros de nefropatía intersticial, microangiopatía trombótica, glomeruloesclerosis colapsante o incluso invasión directa por SARS-CoV-2 del tejido renal en el contexto de una gran carga viral2,3,20; en todas ellas es posible encontrar hematuria y proteinuria asociadas.
Un aspecto interesante de este trabajo es que se recogieron las características clínicas de un número importante de pacientes que desarrollaron FRA sin llegar a necesitar TRS. En nuestro medio, donde el acceso a la terapia sustitutiva estaba prácticamente garantizado, llama especialmente la atención el hecho de que estos pacientes tuvieran una media de edad 6 años superior a los que recibieron TRS. Además, en este grupo predominaba el FRA más leve (KDIGO I 59,8%) y, tanto el tiempo medio de aparición del FRA como de recuperación fue más corto (5 y 4 días respectivamente). La necesidad de ingreso en la UCI, soporte ventilatorio y tratamiento de la COVID fue menor en este grupo, indicando, de forma global, una menor gravedad del curso de la infección. Este tipo de FRA de aparición precoz en el curso de la infección, y resuelto sin necesidad de TRS, fue el registrado con mayor frecuencia en nuestra serie, constituyendo 2 de cada 3 de los casos reportados. Existen series de pacientes de nuestro entorno que identifican la causa prerrenal como predominante en pacientes con COVID-19 que desarrollan FRA22,23. Aunque en el Registro no se ha recogido la impresión clínica de los nefrólogos sobre el origen del FRA, la rápida aparición y recuperación del cuadro nos lleva a pensar que probablemente, en este grupo, la causa prerrenal justifique la disfunción renal en una población añosa, frágil, con elevada comorbilidad, con mayor riesgo de disfunción renal durante los primeros días de la infección. Solo encontramos en la literatura una descripción similar. Peng et al.24 describieron, sobre un total de 285 casos de lesión renal aguda en pacientes con COVID, 2 patrones de FRA: uno más precoz y otro más tardío que acontece cuando ya existe disfunción de otros órganos. Esta lesión renal más tardía se acompañaba de niveles significativamente más altos de parámetros inflamatorios sistémicos, mayor porcentaje de proteinuria y glucosuria; presión arterial media más baja al ingreso, mayores tasas de linfopenia, trombocitopenia y trastornos de la coagulación al ingreso y mayor mortalidad. Todo ello coincidiría con nuestros datos: un cuadro de FRA más tardío acontece en el contexto de mayor gravedad de la infección, alcanza mayor severidad y tiene mayor probabilidad de requerir TRS. El tiempo transcurrido desde el inicio de los síntomas hasta la aparición del FRA se identificó en nuestro análisis como factor predictor independiente de necesidad de TRS, de forma que cada día de retraso en la aparición incrementa el riesgo en un 13%, lo que vendría a confirmar esta hipótesis propuesta. Y, en la misma línea, la edad se comporta como factor protector, lo que se justificaría por el hecho de que los pacientes mayores son los que han desarrollado un FRA más leve, como ya hemos explicado previamente.
Otros factores relacionados de forma independiente con la necesidad de TRS durante el ingreso por COVID-19 fueron, además de la cifra de creatinina sérica, la necesidad de soporte ventilatorio (OR: 20,20) y el hábito tabáquico (OR: 3,41). La hipoxemia ya ha sido relacionada en otros trabajos con el TRS en los FRA por COVID-1925. De hecho, la hipoxemia puede comprometer el gasto cardíaco y la perfusión renal, así como estimular vías de señalización que determinan mayor trombogenicidad. A su vez, las estrategias de ventilación agresivas pueden condicionar alteraciones neurohormonales y liberación de mediadores inflamatorios sistémicos, que impactan en el flujo sanguíneo intrarrenal y deterioran aún más la perfusión renal, induciendo por todos estos mecanismos una lesión renal más severa.
Otro dato que reflejamos es que a falta de indicaciones claras, y con múltiples interrogantes respecto a qué modalidad de TRS podría ser más eficaz, cada centro ha optado por diferentes modalidades de tratamientos dependiendo fundamentalmente de la experiencia y disponibilidad de recursos en cada uno de ellos. De este modo se ha empleado TCRR, hemodiálisis intermitente, hemodiálisis diaria, hemodiálisis expandida y hemodiafiltración, siendo las 2 primeras las más ampliamente representadas, utilizándolas en muchos casos de forma combinada. Se ha sugerido en la literatura, aunque no existen estudios aleatorizados controlados, que el uso de membranas de adsorción, membranas especiales o modalidades convectivas de diálisis podrían resultar útiles para eliminar moléculas inflamatorias circulantes, así como moléculas de SARS-CoV-2 en pacientes seleccionados26. Todas ellas están representadas en este Registro en mayor o menor medida, sin que hayamos encontrado un beneficio claro a favor de ninguna de ellas en cuanto a resultados. A día de hoy los datos disponibles sobre los resultados del TRS en estos pacientes siguen siendo limitados. La serie más amplia, que incluyó 3.099 pacientes con COVID-19 críticos ingresados en la UCI en 67 hospitales de Estados Unidos, mostró que la modalidad inicial más comúnmente utilizada fue TCRR (52,4%), seguida de hemodiálisis intermitente (30,0%) con una amplia variabilidad interhospitalaria tanto en la frecuencia de utilización como en la modalidad utilizada25.
Todos los trabajos publicados coinciden en afirmar que la coexistencia de FRA durante la hospitalización por COVID-19 se comporta como un factor predictor independiente de mortalidad14,18,19. La mortalidad en nuestra serie fue también elevada, del 38,6% en la cohorte completa, alcanzando el 59,1% en los pacientes que precisaron TRS. Los factores relacionados con una mayor gravedad de la infección fueron los que tuvieron un mayor impacto sobre la mortalidad; así el desarrollo de neumonía y la necesidad de soporte ventilatorio triplicaron el riesgo de muerte. El desarrollo de FRA más severo en el contexto de la infección con requerimiento de TRS duplicó el riesgo de mortalidad. Por otra parte, la edad del paciente y la presencia de ERC previa al ingreso fueron factores dependientes del huésped, que se asociaron con mayor riesgo de mortalidad en nuestra serie. La edad de los pacientes ha sido un factor claramente relacionado con la peor evolución y mayor mortalidad de la COVID en la literatura5,26,27. La fragilidad y la comorbilidad asociada a la edad hace que estos pacientes sean especialmente vulnerables a la infección por la COVID-19.
A diferencia de otras series, no hemos encontrado que la presencia de ERC se relacione de forma independiente con mayor severidad del FRA con requerimientos superiores de TRS que el resto de la población. Sin embargo, se detectó un impacto directo de la ERC sobre la mortalidad (OR: 2,21). La ERC ha sido identificada por el Grupo ERACODA como una de las 4 comorbilidades asociadas con el mayor riesgo de mortalidad por COVID-19. En concreto, el riesgo asociado con los estadios 4 y 5 de la ERC es más alto que el riesgo asociado con la diabetes mellitus o la enfermedad cardíaca crónica28. La publicación Global Burden of Disease identificó que, en todo el mundo, la ERC ha sido el factor de riesgo más frecuente de la COVID-19 grave29. Es probable que exista una relación bidireccional entre la COVID-19 y la ERC: la ERC aumenta el riesgo de COVID-19 grave y la mayor gravedad de la COVID-19 conduce a un mayor riesgo de disfunción renal aguda, condicionando a su vez mayor mortalidad.
Mucho se ha discutido en estos meses sobre el papel desempeñado por los IECA y los ARA II en el curso de la infección por la COVID-19. Aunque la mayoría de los estudios les han atribuido un papel neutro, en nuestro análisis se identificó el tratamiento crónico con ARA II como un factor protector en la mortalidad de aquellos pacientes que desarrollaron FRA. Dado que los ARA II actúan por bloqueo directo de AT1R y no inhiben competitivamente la ECA, se postula la posibilidad de que el uso de ARA II pudiera ser beneficioso por esta vía. Además, los ARA II, bloqueando AT1R, pueden también aumentar la disponibilidad de ACE2 unida a la membrana celular, inhibiendo su internalización, contribuyendo también de este modo a una menor agresividad del SARS-Cov230,31.
Como cualquier estudio retrospectivo basado en registros, nuestro estudio presenta limitaciones. En primer lugar, no se recogió toda la población que sufrió FRA en nuestro país, presentando el sesgo de que los pacientes registrados fueron aquellos atendidos por nefrólogos, por lo que la cohorte puede representar un grupo de pacientes con una evolución más tórpida. La recopilación de datos fue limitada y faltan datos de seguimiento. Por último, la evolución de la pandemia y la aplicación de las vacunas ha variado la virulencia y transmisión, lo que influye en la gravedad y mortalidad de la enfermedad, por lo que los resultados, probablemente, no serían aplicables en la actualidad. Como fortalezas cabe destacar que este análisis nos muestra una visión bastante global de la evolución de los pacientes ingresados por COVID-19 que desarrollaron FRA en las primeras fases de la pandemia en nuestro país, no disponible previamente en sujetos con distinta evolución tanto de la infección como del FRA. Por otro lado, aunque el desarrollo de FRA ha sido una complicación importante de la COVID-19, los datos sobre el TRS en estos pacientes son limitados. Afortunadamente nuestro sistema sanitario no se vio sobrepasado en la mayoría de los casos, y podemos evaluar el impacto sin grandes limitaciones de los recursos, pudiendo revisar así la indicación de TRS en una cohorte grande y no solo limitada a pacientes críticos, comparando, además, las diferentes modalidades utilizadas y los resultados obtenidos, aspecto este que ha sido poco tratado en la literatura hasta la fecha.
En conclusión, los pacientes que presentaron FRA durante la hospitalización por COVID-19 tenían una edad media elevada, asociaban condiciones comórbidas y presentaron un cuadro de infección grave. Diferenciamos 2 patrones clínicos diferentes de lesión renal en estos pacientes: el primero acontece precozmente en pacientes más ancianos, con mayor carga de comorbilidad, y se resuelve en pocos días sin necesidad de TRS y el segundo, más grave y con mayores requerimientos de TRS, apareció más tardíamente en el curso de la enfermedad y se relacionó con mayor gravedad de la misma. La presentación precoz y más leve fue la más frecuente, constituyendo 2 de cada 3 casos reportados. Se refleja también en este análisis que se utilizaron diferentes modalidades de TRS sin un claro beneficio de ninguna de ellas sobre las demás. La gravedad de la infección, la edad y la presencia de ERC previa al ingreso fueron factores determinantes en la mortalidad de estos pacientes, identificando el tratamiento crónico con ARA II como un factor protector de mortalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Hospital Universitario Marqués de Valdecilla (Santander): Lara Belmar Vega |
| Complejo Hospitalario Universitario de Cáceres (Cáceres): Pedro Jesús Labrador Gómez, Elena Davin, yAndré Rocha Rodrigues |
| Hospital Universitario Virgen Macarena (Sevilla): Marina Almenara Tejederas, María de los Ángeles Rodríguez Pérez, Nuria Aresté Fosalba, Javier Burgos Martín, Fabiola Alonso García, Mercedes Salgueira Lazo, María Dolores Salmerón Rodríguez |
| Hospital General Universitario Gregorio Marañón (Madrid): Rosa Melero Martín |
| Hospital Universitario Puerta de Hierro Majadahonda (Madrid): Marisa Serrano Salazar |
| Hospital Clinic Barcelona (Barcelona): Alicia Molina Andújar, Esteban Poch López de Briñas |
| Hospital Vall d’Hebron (Barcelona): Natalia Ramos Terrades |
| Fundació Puigvert (Barcelona): María Jesús Lloret |
| Hospital Universitario Infanta Sofía (Madrid): Rocío Echarri Carrillo, Raquel Díaz Mancebo |
| Complejo Hospitalario Universitario de Toledo (Toledo): Diego Mauricio González Lara, Francisco Javier Ahijado Hormigos |
| Hospital Clínico Universitario Lozano Blesa (Zaragoza): María Pilar Martín Azara |
| Hospital Nuestra Señora de Candelaria (Tenerife): Orlando Siverio Morales, Desiré Luis Rodríguez, Patricia García García |
| Hospital Universitario Juan Ramón Jiménez (Huelva): Fernando Fernández Girón |
| Complejo Hospitalario de Pontevedra(Pontevedra): María Jesús Castro Vilanova, Luz María Cuiña Barja |
| Complejo Hospitalario Universitario de Albacete (Albacete): Sara Piqueras Sánchez |
| Hospital Universitario de Jerez de la Frontera (Cádiz): Gema Velasco Barrero, Marina Almenara Tejederas |
| Hospital General Universitario Reina Sofía (Murcia): Antonio Pérez Pérez, Ana Cristina Ródenas Gálvez |
| Hospital Universitario de Torrevieja (Alicante): Beatriz Díez Ojea |
| Hospital Universitario San Agustín (Jaén): Anna Gallardo Pérez |
| Hospital de Poniente (Almería): Francisco Roca Oporto |
| Hospital Ntra. Sra. de Sonsoles (Ávila): Jesús Martín García |
| Hospital Universitario de Badajoz (Badajoz): María Victoria Martín Hidalgo-Barquero |
| Complejo Hospitalario Universitario de Ferrol (A Coruña): Pablo Bouza Piñeiro |
| Fundació Salut Empordà (Gerona): Montserrat Picazo Sánchez |
| Hospital Arquitecto Marcide (A Coruña): Edwin Palomino Guere |
| Hospital General Universitario de Elche (Alicante): Leonidas Cruzado Vega |
| Hospital Universitario Donostia (Donostia): María Teresa Rodrigo de Tomás |
| Hospital Universitario El Bierzo (León): Fernando Simal Blanco |
| Hospital Universitario Reina Sofía (Córdoba): Cristina González Ruiz Moyano |
| Hospital Virgen del Puerto (Cáceres): Miguel Ángel Suárez Santisteban |
| CC. AA. | Servicios nefrología | Participantes |
|---|---|---|
| Galicia | 16 | 3 |
| Asturias | 8 | - |
| Cantabria | 1 | 1 |
| País Vasco | 7 | 1 |
| C. F. Navarra | 3 | - |
| Aragón | 10 | 1 |
| Cataluña | 22 | 4 |
| C. valenciana | 21 | 2 |
| R. de Murcia | 3 | 1 |
| Castilla y León | 10 | 2 |
| Extremadura | 4 | 3 |
| Castilla La Mancha | 7 | 2 |
| C. de Madrid | 25 | 3 |
| La Rioja | 2 | - |
| Baleares | 7 | - |
| Canarias | 10 | 1 |
| Andalucía | 17 | 6 |
| Ceuta | 1 | - |
| Melilla | 1 | - |
| Total | 175 | 30 |