Las alteraciones renales en pacientes con lupus eritematoso sistémico (LES) empeoran el pronóstico y la calidad de vida1, aunque, afortunadamente, los avances en las últimas décadas han permitido conocer y tratar mejor las complicaciones renales agudas, así como las que aparecen en el transcurso de la enfermedad. No obstante, aún queda un número considerable de episodios resistentes y recidivantes, así como situaciones muy preocupantes, como el deterioro agudo o subagudo de la función renal2. Además, el carácter multiorgánico del LES hace que los nefrólogos debamos ampliar nuestro conocimiento a las manifestaciones extrarrenales.
Recientemente se ha elaborado una guía de práctica clínica (GPC) en la que participan especialistas involucrados en el tratamiento del LES, así como pacientes afectos, financiada por el Ministerio de Sanidad dentro del programa de GPC en el SNS. En este editorial se resumen aspectos novedosos en áreas de incertidumbre relacionados con la nefritis lúpica y manifestaciones extrarrenales en las que los nefrólogos pueden verse implicados3.
La metodología para elaborar esta GPC en pacientes con LES se detalla en la publicación original3. En síntesis, el grupo de trabajo llevó a cabo un proceso de identificación de preguntas clínicas que requerían respuesta con la mayor evidencia científica posible, para elaborar las recomendaciones pertinentes (fig. 1). Además, se añadieron las aportaciones más relevantes de una consulta Delphi a las personas afectadas de LES en España3. Cada una de las preguntas clínicas seleccionadas fueron reformuladas de acuerdo con la estrategia Paciente, Intervención, Comparación, Outcome (PICO), las GPC identificadas se evaluaron con el instrumento AGREE II3, y las revisiones sistemáticas y los estudios individuales siguiendo los criterios del SIGN3, así como los niveles de evidencia y fuerza de las recomendaciones. Para los aspectos prácticos importantes sin evidencias científicas disponibles, se formularon recomendaciones de buena práctica clínica (√), acordados por consenso. El grupo de expertos estuvo formado por 13 profesionales de distintas especialidades involucradas en el manejo del LES (Reumatología, Medicina Interna, Hematología, Dermatología, Inmunología, Nefrología, Ginecología, Neurología, Enfermería y Farmacia Hospitalaria).
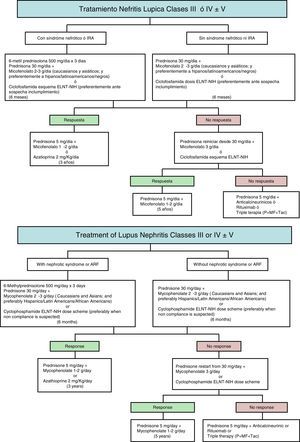
Pregunta n.° 1. ¿Qué dosis de corticoides serían más adecuadas en el tratamiento de inducción? ¿En qué condiciones el micofenolato (MF) aportaría ventajas sobre otros fármacos?
Resumen de la evidencia:
- -
La pulsoterapia con metilprednisolona a dosis de 0,5-0,75g/día en 3 tandas tiene una eficacia similar a las dosis más altas y con menores efectos adversos4. Evidencia científica (EC): 3.
- -
Dosis iniciales de prednisona no superiores a 30mg/día, combinadas con hidroxicloroquina, inmunosupresores o pulsos de metilprednisolona, obtienen tasas de respuesta al menos similares a regímenes con dosis superiores5,6. EC: 1−/2+.
- -
La dosis acumulada y el número de semanas con dosis de prednisona >5mg/día se asocian a mayor toxicidad6. EC: 2+.
- -
Los efectos adversos de la ciclofosfamida (CF) han condicionado la búsqueda de menores dosis y de fármacos alternativos que, al menos, la igualaran en eficacia. Una dosis acumulada de más de 8g de CF aumenta el riesgo de insuficiencia ovárica. A mayor edad, la dosis de seguridad se reduce a unos 5g aproximadamente7. EC: 2+.
- -
Para hispanos/latinoamericanos y afroamericanos, el MF ofrece ventajas en eficacia sobre la CF8. EC 1+. En inducción, la dosis de MF mofetil (MFM) más utilizada en estudios de calidad es 2g/día para las nefritis leves-moderadas en Europa y de 3g/día para las más graves en Norteamérica9,10. EC: 2+.
Recomendaciones:
- -
Se sugiere pulsoterapia con metilprednisolona en los casos más graves, con síndrome nefrótico o insuficiencia renal, y como ahorrador de prednisona oral. Grado de recomendación (GR): √.
- -
Se sugiere comenzar con dosis de prednisona oral no mayor de 30mg/día. GR: C.
- -
El ritmo descendente de prednisona debe ser rápido hasta dosis ≤5mg/día; se recomienda que se hayan alcanzado los 5mg/día alrededor de los 3 meses y nunca después de los 6. GR: C.
- -
En mujeres mayores de 30 años o con riesgo de insuficiencia ovárica, se sugiere usar dosis mínima de CF (pauta ELNT) o elegir MF tanto en inducción como en mantenimiento. GR: C.
- -
En mujeres en edad fértil que hayan recibido CF y hayan alcanzado una dosis acumulada mayor de 8 g (o 5 g si es mayor de 30 años), se sugiere MF de primera elección en inducción y mantenimiento (o azatioprina) en episodios sucesivos. GR: C.
- -
Se sugiere CF en lugar de MF si existe sospecha de incumplimiento terapéutico. GR: √.
- -
En pacientes hispanos procedentes de Latinoamérica o afroamericanos, se sugiere la administración de MF. GR: C.
- -
La dosis recomendada para MFM en inducción es de 2-3g/día o dosis equivalente de MF sódico. GR: B.
Pregunta n.° 2: ¿Cuál debería ser el tratamiento de inducción de NL con insuficiencia renal aguda (IRA)?
Resumen de la evidencia:
En general, se ha considerado IRA al incremento de creatinina sérica mayor de 1,5 veces respecto a la basal en menos de 7 días, o incremento de 0,3mg/dl en menos de 48 h con o sin oliguria11.
- -
La incidencia de IRA es probablemente baja, pero desconocida o indeterminada, ya que la mayoría de los grandes estudios excluyen a este tipo de pacientes, quedando solo casos, series de casos y cohortes retrospectivas. De su existencia se infiere peor pronóstico en supervivencia renal a largo plazo11,12. EC: 2+.
- -
Las causas más habituales de IRA, además de las tradicionales de la población general, son: proliferación extracapilar, vasculitis necrosante ANCA+, microangiopatía trombótica y nefritis tubulointersticial aguda. Los autores que han descrito la presencia de ANCA positivos en NL asociadas a semilunas o lesiones necrosantes han usado prednisolona y CF en inducción13. EC: 2+.
- -
En pacientes con IRA leve-moderada (GRF<60ml/min/1,73m2), MFM ha demostrado ser tan eficaz como en los pacientes con GFR normal14,15. EC: 2+.
- -
En un estudio post hoc de ensayo clínico controlado (ECC), pacientes con GRF<30ml/min responden de forma favorable y sin diferencias a MFM y CF16. EC 2+.
- -
El tratamiento con CF fue eficaz en pacientes con GFR entre 25-80ml/min/1,73m2, aunque a medio plazo la recuperación de la función renal fue limitada17. EC: 1+.
- -
La pulsoterapia esteroidea se ha utilizado en casos graves de NL con IRA. Dosis de 500mg durante 3 días pueden ser suficientes18. EC: 3.
Recomendaciones:
- -
Se sugiere usar CF o MFM como inmunosupresor de inducción tanto en casos de IRA leve-moderada (GFR>30ml/min/1,73m2) como grave (GFR<30ml/min/1,73m2). GR: C.
- -
Se sugiere el tratamiento con pulsoterapia esteroidea en todos los casos de NL con IRA, salvo que exista contraindicación. GR: √.
- -
Se sugiere el tratamiento con CF de inducción en pacientes con NL e IRA con lesiones de vasculitis/gomerulonefritis necrosante, en caso de que los anticuerpos ANCA sean positivos. GR: D.
Pregunta n.° 3. ¿Cuándo se podría suspender el tratamiento de mantenimiento?
Resumen de la evidencia:
La incidencia de brote renal en NL a pesar del tratamiento inmunosupresor es elevada, variando desde un 12 hasta un 45% en los primeros 2-5 años en los ECC y de cohortes en los que la duración mínima de la terapia fue de 24-36 meses. A partir de los 5 años, la aparición de un brote renal sería progresivamente menor, y excepcional a partir de los 10 años de remisión19–22. EC 1++/1+/2+.
- -
En las NL proliferativas, la aparición de un brote renal condiciona peor supervivencia renal y del paciente22. El tipo nefrítico se asocia con peor supervivencia renal que el nefrótico19,23–25. Sin embargo, en la clase membranosa, el brote renal no parece influir tanto en la supervivencia renal25. EC: 2+.
- -
Ampliar la duración del tratamiento de mantenimiento hasta 30 meses reduce el riesgo precoz de recaídas y aumenta la supervivencia renal y del paciente20,26. No obstante, no existen ECC que comparen directamente mayor o menor tiempo de tratamiento usando el mismo régimen terapéutico. EC: 1+/2+.
- -
La actividad lúpica renal suele ser mínima en estadios avanzados de insuficiencia renal crónica de más de 12-24 meses22. EC: 3.
- -
El tratamiento con hidroxicloroquina ayuda a mantener la remisión de la NL y retarda la progresión de insuficiencia renal27. EC: 2+.
- -
En pacientes en remisión prolongada y sin factores de riesgo de recidiva (tabla 1), parece justificado plantearse la retirada del tratamiento de mantenimiento21,28. EC: 2+.
Tabla 1.Factores de riesgo de recidiva renal descritos en diferentes estudios
- Género varón - Edad<25-30 años - Etnia afroamericana. - Hipertensión arterial - Persistencia de niveles alterados de C4, C3 y anti-ADN - Cariorrexis o proliferación extracapilar - Índice de actividad >10 - Clase IV ISN/RPS - Haber presentado algún brote previamente - Retraso en el inicio del tratamiento>5 meses - Retraso en alcanzar la respuesta - Respuesta parcial frente a respuesta completa - -
En los pacientes de alto riesgo de presentar recaída (tabla 1), se plantea prolongar el tratamiento durante más de 5 años o incluso de forma indefinida, a menos que haya contraindicación29. EC: 4.
- -
Antes de plantear la retirada del tratamiento, parece justificado completar un mínimo de 12 meses de quiescencia21,28,30. EC: 2+.
- -
La suspensión definitiva de la terapia ha de hacerse muy lentamente21,30. Un seguimiento estrecho durante los primeros 5 años que permita la detección y el tratamiento precoz de los brotes condiciona mejor supervivencia renal a largo plazo23,31. EC: 2+.
Recomendaciones:
- -
Se recomienda el tratamiento de mantenimiento para todos los pacientes que hayan alcanzado al menos una respuesta parcial en inducción. GR: A.
- -
Se recomienda prolongar este tratamiento de mantenimiento durante 2-3 años mínimo. GR: B.
- -
Se sugiere prolongar el tratamiento de mantenimiento al menos durante 5 años, en pacientes con frecuentes recidivas sin causa justificable o con factores de riesgo para recidiva renal. GR: √.
- -
Se sugiere que, en los casos en los que se plantee la retirada total del tratamiento inmunosupresor de mantenimiento, no se haga antes de un periodo de quiescencia clínico-analítica mínimo de 12 meses. GR: C.
- -
Se sugiere que la suspensión total del tratamiento inmunosupresor de mantenimiento sea realizada de forma lenta y progresiva. GR: C.
- -
Se sugiere mantener el tratamiento con hidroxicloroquina a largo plazo, siempre que no existan contraindicaciones o efectos secundarios. GR: C.
Pregunta n.° 4. ¿Qué circunstancias definen una pauta terapéutica como ineficaz o una situación como refractaria? ¿Cómo manejarla?
Resumen de la evidencia:
No existe una definición estándar de refractariedad. Sin embargo, considerando el significado pronóstico adverso de no conseguir a los 6 meses una reducción de la proteinuria basal de más del 50% o una proteinuria total por debajo de 1g/24h, se ha propuesto la ausencia de remisión al menos parcial tras 6 meses de tratamiento como el criterio principal de ineficacia. Se define, por tanto, como la ausencia de remisión al menos parcial tras 6 meses de tratamiento32,33. EC: 4.
- -
Una de las primeras razones que hay que descartar antes de considerar un tratamiento como ineficaz es el incumplimiento terapéutico. Este riesgo debe ser comentado con los pacientes en las primeras visitas y, si se sospecha, puede ser una de la razones para realizar niveles de fármacos o para elegir en clases proliferativas, pautas de inducción con pulsos de CF intravenosa33,34. EC 4.
- -
En pacientes refractarios a pautas inmunosupresoras estándares (CF o MMF), se ha utilizado tacrolimus en monoterapia con éxito y seguridad35. También en combinación con MFM, en un enfoque multidiana que permite incrementar la inmunosupresión global con menores dosis individuales36,37. EC: 2−.
- -
En pacientes refractarios a pautas inmunosupresoras estándares se ha utilizado con éxito rituximab como medicamento de rescate38,39. EC: 2+.
- -
Las diferentes GPC de consenso EULAR/ERAEDTA, eGEAS-SEMI/SEN y ACR32,40,41 recomiendan, en casos de NL refractaria sin respuesta satisfactoria al cambio de tratamiento de primera línea (CFM y MFM), utilizar rituximab, anticalcineurínicos, inmunoglobulinas o combinaciones de fármacos. EC: 2++ GPC.
Recomendaciones:
- -
Se sugiere considerar como refractarios a aquellos pacientes que no alcancen la remisión al menos parcial tras 6 meses de tratamiento. GR: D.
- -
Se sugiere como primera medida en NL refractaria asegurar un correcto cumplimiento terapéutico y verificar que las lesiones renales son reversibles. GR: D.
- -
Se sugiere el cambio al otro fármaco de primera línea (MF o CF) en la NL refractaria a CF o MF. GR: D.
- -
Se sugiere utilizar rituximab, anticalcineurínicos o combinaciones de fármacos en casos de no respuesta satisfactoria al cambio de tratamiento de primera línea (CF y MF). GR: D.
Jaime Calvo Alen (Servicio de Reumatología, Hospital Sierrallana, Cantabria, España), María M. Trujillo-Martín (Fundación Canaria de INvestigación Sanitaria, La Laguna, Santa Cruz de Tenerife, España; Red de Investigación en Servicios de Salud en Enfermedades Crónicas, Madrid, España), Iñigo Rúa-Figueroa Fernández de Larrinoa (Servicio de Reumatología, Hospital Universitario Gran Canarias Dr.Negrín, Las Palmas de Gran Canaria, espala), Guillermo Ruíz-Irastorza (Unidad de Investigación de Enfermedades Autoinmunes, Servicio de Medicina Interna, Hospital Universitario de Cruces, Barakaldo, Vizcaya, España), Jose María Pego-Reinosa (Servicio de Reumatología Hospital Meoxoeiro, Vigo, España), Jose Maria Sabio Sanchez (Servicio de Medicina Interna, Hospital Virgen de las Nieves, Granada, España), Pedro Serrano-Aguilar (Red de Investigación en Servicios de Salud en Enfermedades Crónicas, Madrid, España; Servicio de Evaluación Planificación, Servicio Canario de Salud, Santa Cruz de Tenerife, España), Isidro Jarque Ramos (Servicio de Hematología, Hospital Universitario y Politécnico La F,e, Valencia), M.Teresa Martínez Ibáñez (Unidad Docente de Medicina Familiar y Comunitaria, Gran Canaria, España), Pritti M. Melwani (Servicio de Dermatología, Hospital Universitario Insular de Gran Canaria, Las Palmas de Gran Canaria, España), Noemí Martínez López de Castro (Servicio de Farmacia Hospitalaria, Hospital Meixoeiro, Complejo Hospitalario Universitario de Vigo, Vigo, España), M.José Cuadrado Lozano (Servicio de Reumatología, Saint Thomas Hospital, Londres), Silvia García Díaz (Servicio de Reumatología, Hospital Moisés Broggi, Barcelona, España), Inmaculada Alarcón Torres (Servicio de Analisis Clínicos, Sección de Autoinmunidad, Hospital Universitario de Gran Canarias Dr.Negrín, Las Palmas de Gran Canaria, España), Pilar Pazos Casal (Federación Española de Lupus, Galicia, España), Tasmania m del Pino-Sedeño (Fundaci¿n Canaria para el Avance de la Biomedicina y la Biotecnología, Islas Canarias, España).