La lesión renal aguda en los pacientes críticos representa un factor de riesgo independiente de la morbilidad y la mortalidad a corto y a largo plazo, con un tremendo impacto económico en cuanto a los costes en salud pública. Por el momento, el diagnóstico de la lesión renal aguda sigue basándose en la presencia de oliguria o en un aumento gradual de la creatinina sérica, hecho que retrasa el diagnóstico, en detrimento de la llamada «ventana terapéutica». La aparición de nuevos biomarcadores de lesión renal aguda podría mejorar esta situación y contribuir a la detección de la «lesión renal aguda subclínica», lo que permitiría el uso precoz de múltiples estrategias de tratamiento con el objetivo de preservar la funcionalidad renal. No obstante, los nuevos biomarcadores presentan características que podrían vulnerar su capacidad de acción, centrada concretamente en aportar un valor añadido al abordaje precoz de la enfermedad, dada la falta de tratamientos específicos validados para la lesión renal aguda. Esta revisión tiene como objetivo analizar los puntos fuertes y débiles de esta nueva herramienta para el diagnóstico temprano de la lesión renal aguda.
Acute kidney injury in the critically ill represents an independent risk factor of morbidity and mortality in the short and long terms, with significant economic impacts in terms of public health costs. Currently its diagnosis is still based on the presence of oliguria and/or a gradual increase in serum creatinine, which make the diagnosis a delayed event and to detriment of the so-called ‘therapeutic window’. The appearance of new biomarkers of acute kidney injury could potentially improve this situation, contributing to the detection of ‘subclinical acute kidney injury’, which could allow the precocious employment of multiple treatment strategies in order to preserve kidney function. However these new biomarkers display sensitive features that may threaten their full capacity of action, which focus specifically on their additional contribution in the early approach of the situation, given the lack of specific validated treatments for acute kidney injury. This review aims to analyze the strengths and weaknesses of these new tools in the early management of acute kidney injury.
En el artículo «Desacuerdo, dogmatismo y polarización de la creencia»1, publicado en The Journal of Philosophy, Thomas Kelly hace referencia a un fenómeno llamado «polarización de la creencia», por el cual, lejos de que la exposición a una misma evidencia acerque las opiniones de quienes opinan diferente, usualmente el desacuerdo entre ellos se hace más pronunciado: somos más exigentes con la que contradice nuestra creencia y mucho más permisivos con la que favorece nuestro punto de vista.
Este fenómeno podría explicar en parte nuestra aceptación o rechazo a la utilización de los nuevos biomarcadores en el diagnóstico de la lesión renal aguda (LRA).
En el año 2005 la American Society of Nephrology Renal Research Report (ASNRRR) asignó la más alta prioridad de investigación para el descubrimiento y la estandarización de nuevos biomarcadores de LRA2.
La LRA en los pacientes críticos es un factor de riesgo independiente que aumenta la morbilidad y la mortalidad a corto y a largo plazo, con un tremendo impacto económico en términos de costos de salud3. La LRA representa también una puerta de entrada a la enfermedad renal crónica (ERC)4. Es destacable que, después de un episodio de LRA, 7,8 de cada 100 pacientes/año desarrollan ERC y 4,9 por cada 100 pacientes/año derivarán en insuficiencia renal crónica terminal5.
Han proliferado numerosas estrategias preventivas o curativas para la LRA, las cuales han sido o bien ineficaces o bien insuficientemente validadas para ser rutinariamente recomendadas4.
El factor de riesgo más importante para la LRA es la ERC preexistente, que aumenta el riesgo de esta hasta 10 veces6-8.
Algunos procesos, como la disfunción endotelial9, la remodelación miocárdica10, los factores epigenéticos11 y el incremento del estrés oxidativo12, son los factores que podrían explicar el elevado riesgo de morbimortalidad que persiste mucho después del episodio de LRA.
Otra de las razones que puede explicar este fracaso en la evolución de los pacientes es el reconocimiento tardío e inevitable de lesión renal que conduce a intervenciones tardías.
Tenemos que tener en cuenta que el diagnóstico de LRA se basa en marcadores indirectos de daño renal, poco sensibles y específicos, en detrimento de la llamada «ventana terapéutica»4.
En dicho contexto las limitaciones de la creatinina sérica (sCr) son varias: la sCr entra en juego como un marcador funcional cuando más del 50% de la tasa de filtrado glomerular se ha perdido y solo es útil después de que se haya alcanzado un estado estacionario. Este último puede diferirse en el tiempo, a veces hasta 48h, especialmente en los pacientes internados en las unidades de cuidados intensivos (UCI)12. Por otro lado, la excreción de la creatinina no depende de la carga filtrada exclusivamente por los glomérulos, sino también de la secretada por los túbulos renales, que en condiciones normales varía del 5 al 20% de la excreción total, y podría elevarse hasta el 50% como mecanismo compensador cuando la tasa de filtración glomerular (TFG) disminuye13. Además, si incluso genuinamente existiese una caída de la TFG, la sCr podría no elevarse o elevarse tardíamente, como consecuencia del reclutamiento de la reserva funcional renal, o bien esta podría estar «diluida» como consecuencia de un profuso balance positivo, un evento frecuente de observar luego de las maniobras de reanimación, en especial en los pacientes internados en la UCI14. Por último, la TFG estimada parece sobreestimar la función renal en los pacientes ingresados en la UCI durante más tiempo, situación que está muy bien demostrada en un análisis secundario del estudio EPANIC, en el que participaron 757 pacientes y en el cual se demostró que una reducción en la producción de sCr se correlacionaba positivamente con la duración de la estancia en la UCI, probablemente debido a la pérdida de masa muscular15.
El otro parámetro está representado por la oliguria, que no es sensible ni específica, ya que podría producirse como consecuencia de una lesión renal, pero también puede reflejar una respuesta fisiológica adaptativa tanto a la deshidratación intracelular como a la hipovolemia16. En esta línea, solo una pequeña proporción de los pacientes oligúricos en la UCI presentan de hecho una sostenida caída de la TFG que se ve reflejada en un aumento de la sCr16. Del mismo modo, Mandelbaum et al.17 demostraron que solo los episodios de oliguria pronunciados (<0,3ml/kg/h) o prolongados (>12h) se asociaban con la necesidad de iniciar terapia de reemplazo renal (TRR) o con un aumento de la mortalidad hospitalaria.
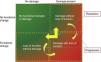
Los biomarcadores más recientes prometen identificar precozmente a los pacientes con riesgo de LRA, diagnosticar la LRA antes que las pruebas convencionales, indicar la necesidad de iniciar TRR y pronosticar el riesgo de progresión a ERC18-19. El objetivo es que con este enfoque y las intervenciones más oportunas puedan mejorarse los resultados de los pacientes con LRA. La disponibilidad de estos nuevos biomarcadores y la evaluación de las combinaciones simultáneas de biomarcadores funcionales y de daño tisular pueden ayudar a estratificar a los pacientes en 4 subgrupos: ningún cambio en los biomarcadores, solo cambios en los biomarcadores funcionales, solo cambios en los biomarcadores de daño, o cambios en los 2 biomarcadores funcionales y de daño (fig. 1).
Utilización funcional de los nuevos biomarcadores de lesión renal aguda. De: Acute Dialysis Quality Initiative (ADQI) [consultado 10 Ene 2013]. Disponible en: www.ADQI.org
Esta nueva forma de abordaje permite la identificación de una nueva categoría de pacientes con LRA, llamada «LRA subclínica» y representada por un aumento de los marcadores de daño sin una pérdida simultánea de la función renal. Sobre la base de este nuevo marco conceptual se ha recomendado una modificación de los criterios KDIGO para incorporar el uso de marcadores de daño renal, además de la sCr, la TFG y la diuresis (fig. 2)20.
Nuevos criterios para el diagnóstico de lesión renal aguda. De: Acute Dialysis Quality Initiative (ADQI) [consultado 10 Ene 2013]. Disponible en: www.ADQI.org
Este nuevo enfoque ha sido reconocido e incorporado recientemente en las definiciones de LRA de las guías de práctica regionales de Australia y Nueva Zelanda, sin aclarar qué tipo de biomarcador a utilizar ni el valor de corte del mismo21.
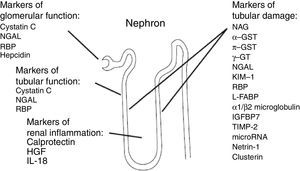
Los nuevos biomarcadores de LRA varían en su origen, en su función, en su distribución y en el momento de su liberación después de la lesión renal (fig. 3).
Origen de los biomarcadores de lesión renal aguda.
g-GT: g-glutamyl transpeptidase; GST: glutathione S-transferase; HGF: hepatocyte growth factor; IGFBP-7 insulin-like growth factor-binding protein 7; IL-18: interleucina 18; KIM-1: kidney injury molecule; L-FABP: liver-type fatty acid-binding protein; NAG: N-acetil-D-glucosaminidasa; NGAL: neutrophil gelatinase-associated lipocalin; RBP: retinol-binding protein; TIMP-2: tissue inhibitor of metalloproteinases38.
La mayor parte de la evidencia se ha centrado en el neutrophil gelatinase-associated lipocalin (NGAL), ya sea urinario o plasmático, la kidney injury molecule (KIM-1), la interleucina 18 (IL-18), la N-acetil-D-glucosaminidasa (NAG), la cistatina c (Cys-C), el tissue inhibitor of metalloproteinases (TIMP-2) y el insulin-like growth factor-binding protein 7 (IGFBP-7)22.
En poblaciones homogéneas representadas por los pacientes sometidos a cirugía de bypass cardiopulmonar, los biomarcadores como el NGAL, la KIM-1, la Cys-C y la IL-18 aparecen como una alternativa atractiva para detectar LRA antes de que se produzcan cambios en la sCr23-27. Sin embargo, en poblaciones heterogéneas con diversas patologías, como las presentes en los pacientes en UCI o en el servicio de emergencias, el desempeño individual de estos biomarcadores es marcadamente menor23,28. El rendimiento de la mayoría de los biomarcadores es variable y depende de la patología que afecta al paciente, la causa de LRA, el entorno clínico, las comorbilidades asociadas y el momento de las mediciones22.
Algunos biomarcadores, como por ejemplo el NGAL, reflejan el nivel de gravedad de la enfermedad desencadenante en forma generalizada, en lugar de ser específica para la lesión renal29-31.
El NGAL es una proteína asociada a la gelatinasa de neutrófilos humanos que existe como un monómero de 25kDa, como un homodímero de 45kDa y como un conjugado de gelatinasa con una conformación heterodimérica 135kDa32. Las formas monoméricas y heterodiméricas son principalmente producidas por las células epiteliales tubulares, mientras que la forma homodimérica se produce principalmente en los neutrófilos activados32. El NGAL circulante se filtra a través de la barrera glomerular y se reabsorbe completamente por endocitosis mediada por megalina a nivel de las células tubulares proximales normales. Existen kits comerciales para calcular el uNGAL (NGAL urinario) o bien el pNGAL (NGAL plasmático). En condiciones estables, las concentraciones de plasma y orina son de alrededor de 20ng/ml. El marcador se eleva a las 2-4h de producido el daño renal. Al NGAL se lo ha asociado con un probable efecto protector renal, dado que este es liberado por segmentos de la nefrona donde pueden formar un complejo con sideróforos que se unen al hierro, quelando el hierro liberado por los túbulos renales dañados y previniendo la formación de radicales hidroxilo y aniones superóxido.
Los niveles de NGAL se elevan también en modelos experimentales de sepsis y de inflamación sistémica, lo que sugiere que su liberación en el sistema urinario es una importante respuesta del riñón a la infección sistémica y a la infección urogenital local33. Esto ha sido considerado una limitación importante para el uso del NGAL, especialmente en cuanto a su rendimiento diagnóstico durante la LRA séptica32.
La cistatina C es una proteína de 13kDa producida por todas las células nucleadas que se libera al plasma a velocidad constante, independientemente del sexo, la raza, la masa muscular y el nivel de hidratación. Circula en plasma sin unión a proteínas, es filtrada libremente por el glomérulo y es totalmente reabsorbida por endocitosis mediada por megalina a nivel de las células tubulares proximales.
La diabetes, las grandes dosis de corticosteroides, la hipertrigliceridemia, la hiperbilirrubinemia o el factor reumatoide pueden afectar el análisis de la Cys-C33. No es secretada por las células tubulares y no es detectable en la orina de sujetos sanos. En consecuencia, el aumento de los valores urinarios de Cys-C durante la LRA refleja la disminución de la reabsorción a nivel de los túbulos proximales33. La uCys-C (orina) aparece como un marcador más precoz y sensible de LRA comparado con la pCys-C (plasmática). Sin embargo, la concentración de la pCys-C se correlaciona principalmente con la TFG, incluso en un rango en el que la sCr no es capaz de detectar cambios tempranos en la TFG (60-90ml/min). Aparece en orina 12-24h después del daño renal.
La KIM-1 representa una glucoproteína de membrana celular tipoi cuyos niveles de ARNm aumentan más que cualquier otro gen después de la lesión renal, el ectodominio soluble de 90kDa forma parte de los complejos de metaloproteinasas dependientes y se libera en el túbulo por las células epiteliales, lo que la hace fácilmente detectable en orina. Durante la lesión renal, la KIM-1 puede facilitar la remodelación del epitelio lesionado. Aparece de 12 a 24h tras la lesión renal.
La IL-18 es una citoquina proinflamatoria de 18kDa producida principalmente por los neutrófilos activados, células mononucleares, macrófagos y células no inmunes, incluyendo las células del túbulo proximal. Es un importante mediador de la LRA isquémica33. Puede encontrarse en orina y plasma. Aparece a las 6-24h del daño renal.
La NAG es una proteína de gran tamaño (alrededor de 140kDa) que se origina en los lisosomas de las células del túbulo proximal. Su alto peso molecular impide la filtración glomerular y, por lo tanto, es poco probable que altos niveles urinarios procedan de una fuente no renal. La NAG se correlaciona con la evidencia histológica de daño del túbulo proximal renal. La NAG urinaria al ingreso en la UCI se correlaciona bien con los resultados en pacientes críticamente enfermos. Sin embargo, desde la NAG urinaria se ha demostrado que es un marcador sensible de lesión tubular, y su especificidad puede reducirse por un umbral bajo para la liberación de la enzima tubular. Valores falsos positivos se han reportado durante la diabetes, la artritis reumatoide y el hipertiroidismo33. Estos aumentan en orina 12h después del daño renal.
En tal sentido, recientemente la Food and Drug Administration (FDA) aprobó la comercialización del Nephrocheck Test y Astute 140Meter (Astute Medical Inc., San Diego, CA, EE.UU.), una prueba rápida que mide en forma cuantitativa los biomarcadores de detención del ciclo celular TIMP-2 y IGFBP-734, los cuales bloquean el efecto de cyclD-CDK4 y CyclE-CDK2 en la promoción del ciclo celular, convirtiéndose en marcadores ideales de la detención del ciclo celular G1. El medidor Astute140 multiplica automáticamente las concentraciones de los 2 biomarcadores juntos y divide este producto por 1.000, reportando un único resultado de la prueba con unidades en (nanogramos/mililitro)2/1.000. En la práctica clínica, después de una lesión aguda el riñón suele activar la división celular y la proliferación celular con el objetivo de repoblar el epitelio tubular denudado. La detención temprana del ciclo celular en G0/G1 podría proteger al riñón de un daño mayor, bloqueando el daño en el ADN y la activación de la caspasa3/7, limitando de esta forma la extensión de los daños y evitando un proceso potencialmente peligroso de mala adaptación generado por una mala reparación. Estos fenómenos se producen 24 a 48h antes del aumento de la sCr debido a una caída significativa en la TFG, y la precocidad de la detección podría facilitar sin lugar a dudas nuevas estrategias terapéuticas y de protección, como sugieren las directivas KDIGO más recientes35.
La combinación de estos 2 biomarcadores parece ser altamente predictiva de los pacientes que desarrollarán LRA moderada a severa en las próximas 12-24h. El desempeño de estos marcadores comparados con otros tiene un área bajo la curva (AUC) con un índice de confiabilidad (IC) del 95% superior a 0,8, especialmente cuando se combinan. La aplicación del MAKE30 (que predice eventos renales adversos dentro de los 30días, como la muerte, la necesidad de TRR o la duplicación de la sCr) aumenta sustancialmente con el uso de TIMP-2/IGFBP-7 cuando los valores son >0,3 (ng/ml)2/1.000 y se duplicaron con valores >2,0 (ng/ml)2/1.00036-37.
El estudio internacional multicéntrico Sapphire, realizado en 728 pacientes críticos, mostró que la elevación de la combinación de estos biomarcadores era específica de LRA (es decir, no es causada por otras comorbilidades como la sepsis o la ERC) y proporcionaba una fuerte señal como «alarma renal» para identificar los pacientes que están en riesgo inminente de desarrollar LRA36-37. Estos biomarcadores urinarios se cree que se elevan en respuesta al estrés de las células del túbulo renal o a la lesión temprana asociada con los tipos de exposiciones conocidas que causan LRA. El valor clínico primario de corte >0,3 (ng/ml)2/1.000 para la combinación de los 2 biomarcadores deriva de los datos del estudio Sapphire, el cual se verificó en el estudio Opal, sobre una cohorte de 153 pacientes críticamente enfermos37.
Este punto de corte fue seleccionado por su alta sensibilidad (92%) para detectar LRA moderada a severa en las subsiguientes 12h, con la intención de ser utilizados en la práctica clínica de rutina para identificar a los pacientes con alto riesgo de LRA e instituir las estrategias de manejo recomendadas por la guías KDIGO para los pacientes de alto riesgo20.
Por otro lado se buscó un segundo punto de corte con alta especificidad >2,0 (ng/ml)2/1.000 con el fin de identificar al subgrupo de pacientes que están con mayor riesgo de LRA y que, por lo tanto, podrían beneficiarse de intervenciones más agresivas. Estos puntos de corte entre 0,3 y 2,0 (ng/ml)2/1.000 fueron posteriormente validados en un estudio que involucró 23 centros y 408 pacientes críticamente enfermos en Estados Unidos (estudio Topaz) y cuyo objetivo primario fue la identificación de pacientes con LRA moderada a grave38.
Las propiedades más destacadas de estos biomarcadores urinarios, y por las cuales fueron seleccionados entre más de 300 biomarcadores, incluyen, por un lado, un excelente rendimiento, y por otro lado, el hecho de haber podido ser validados, como ya se mencionó, en poblaciones heterogéneas con diversas patologías (sepsis, shock, cirugía mayor y trauma) en 3 cohortes diferentes de pacientes críticos37. Así mismo, recientes publicaciones destacan la habilidad de estos biomarcadores en el entorno de la UCI para identificar a los pacientes con LRA que tienen mayor riesgo de mortalidad o requerimiento de TRR en los próximos 9meses39.
La combinación de los biomarcadores entre sí o con otros datos clínicos representa una forma atractiva para refinar la capacidad diagnóstica actual. A pesar de los grandes avances en este campo, cabe destacar que existen diferentes problemas metodológicos en la investigación sobre los biomarcadores de LRA, entre ellos:
- 1)
El rendimiento de los nuevos biomarcadores se juzgó por comparación con la sCr y oliguria ante la falta de un «patrón oro» en el actual diagnóstico de LRA, 2 marcadores que, como ya se mencionó, se ven afectados por factores externos.
- 2)
Los estudios varían en los puntos de corte elegidos para establecer umbrales para eventos predictivos positivos y negativos relacionados con LRA.
- 3)
Existe incertidumbre sobre el método de laboratorio exacto, la plataforma de ensayo y las condiciones de muestreo, y sobre si los niveles de biomarcadores deben ser normalizados respecto a la creatinina urinaria.
- 4)
Como la creatinina, varios biomarcadores novedosos de LRA son en sí mismos no específicos de patologías renales y pueden estar influidos por condiciones comórbidas comunes, como la sepsis.
- 5)
La mayoría de los biomarcadores demuestran un patrón dinámico reflejo de los eventos moleculares y celulares que se producen durante la fase clínica o subclínica de LRA. Por tanto, es probable que un panel de diferentes biomarcadores y mediciones múltiples combinadas sea superior a una sola prueba.
El concepto general es que al menos una parte del tejido renal puede salvaguardarse con la detección e intervención temprana de la LRA. Esto puede ser especialmente cierto en las primeras etapas de la lesión, lo que evitaría mayores daños y preservación de la reserva funcional renal.
Pequeños aumentos en la sCr son necesarios para alcanzar el estadioi de LRA según las normas KDIGO y reflejan una profunda y prolongada disminución de la TFG. Existe, por lo tanto, la necesidad de contar con biomarcadores de LRA que detecten rápidamente cambios que permitan la identificación de lesiones renales subclínicas4.
La detección precoz de tales pacientes permitiría la estratificación de riesgo de acuerdo a los biomarcadores elevados o a una combinación de ellos que podría en última instancia ayudar en la validación de estrategias preventivas y futuras terapias. Más allá de un diagnóstico precoz y de la estratificación de riesgo, los biomarcadores han mejorado nuestra comprensión de los mecanismos fisiopatológicos asociados con LRA. Ellos han ayudado a desafiar la hasta ahora obsoleta dicotomía entre la llamada «LRA prerrenal» y «LRA renal» (mal llamada «necrosis tubular aguda»)40. Los pacientes identificados formalmente como «LRA prerrenal» o «LRA transitoria» y/o con «baja excreción urinaria de sodio» también tienen evidencia de lesión tubular o daño, por lo que la definición actual ha quedado obsoleta, sobre todo a nivel subcelular y molecular40.
Este cambio en nuestra visión global del mecanismo fisiopatológico de la LRA sin duda en un futuro muy próximo nos ayudará en el diseño terapéutico de estrategias alternativas y en centrarse en pacientes con más probabilidades de beneficiarse de estas estrategias con un enfoque individualizado impulsado por los biomarcadores, un diagnóstico y tratamiento a medida40-41.
Por otro lado, la evaluación del pronóstico renal —y puntualmente la recuperación renal después de la LRA— son temas que han surgido recientemente con implicancias directas para todos los sistemas de salud, pues el objetivo se centraría en evitar la evolución a ERC, ya sea mediante la reducción del nivel de la lesión o facilitando la curación y la recuperación del parénquima renal dañado y de los factores de riesgo clínicos presentes. La lesión, sin embargo, reduce la masa renal funcionante y la reserva funcional. Este proceso puede ser la puerta de entrada a la ERC.
La validación de los biomarcadores es insuficiente para recomendar su uso clínico hasta el momento13,16,17,42, e incluso algunos resultados han sido decepcionantes29,43.
Una de las razones, para explicar esto estaría en la elección equivocada de los pacientes a estudiar, dado que la proporción de pacientes de la UCI que pueden requerir el uso de estos biomarcadores es aún desconocido. La prevalencia de acuerdo con la población de interés podría teóricamente influir en el rendimiento diagnóstico de la pruebas44, así como su relevancia clínica junto a la cama del paciente.
Los esfuerzos futuros en este campo probablemente deberían concentrarse en la evaluación de los mejores biomarcadores actuales en grupos bien definidos con alta probabilidad pretest de LRA y en contextos en los cuales los biomarcadores pueden alterar la toma de decisiones clínicas.
Biomarcadores: evidenciaEs atractivo identificar a los pacientes con alto riesgo de LRA, especialmente si esto proporciona una oportunidad para intervenir y evitar que esta se desarrolle. En el caso puntual de la LRA, las estrategias preventivas recomendadas actualmente incluyen la optimización del status hemodinámico, el status volumétrico y evitar fármacos nefrotóxicos, medios de contraste y/o almidones4. Se podría argumentar fácilmente que esto debe hacerse en cualquier paciente crítico, independientemente de si está o no en alto riesgo de desarrollar LRA, y que por lo tanto la información que nos puede otorgar un biomarcador es redundante.
Idealmente, una prueba para identificar a los pacientes de alto riesgo debe ser lo más fiable posible para evitar resultados falsos negativos y falsos positivos. Transpolando la experiencia de otras áreas clínicas, se evidenció que el uso no seleccionado de biomarcadores como el antígeno prostático específico (PSA) o del dímeroD en una población no seleccionada produce un alto número de resultados falsos positivos y potencialmente puede conducir a intervenciones dañinas e innecesarias45. El rendimiento de la mayoría de los biomarcadores para LRA es mejor en los grupos de pacientes seleccionados con alto riesgo de LRA. Por ejemplo, el IGFBP-7 y el TIMP-2 que fueron evaluados y validados para su uso por la FDA en pacientes en estado crítico en las unidades UCI18,39.
¿Pueden los nuevos biomarcadores diagnosticar lesión renal aguda precozmente antes que las pruebas tradicionales?Varios biomarcadores han demostrado indicar el inicio de LRA antes que se den aumentos de la sCr (LRA subclínica). Los resultados son más resonantes en cohortes pediátricas sin comorbilidades que sufren de una enfermedad con un inicio definido de LRA, como por ejemplo en los niños después de una cirugía cardíaca39. En las poblaciones más heterogéneas, donde no se conoce la aparición de la lesión renal (es decir, pacientes con shock séptico), el rendimiento de algunos biomarcadores para detectar precozmente LRA era equivalente a la evaluación clínica y a las mediciones de laboratorio estándar y no fue significativamente mejor29,30,40.
En general se supone que un diagnóstico más precoz de LRA se traduciría directamente en un TRR más temprano y un mejor resultado para el paciente. Desafortunadamente, en la actualidad no hay evidencia de que esto realmente ocurra, dado que no existe un tratamiento específico para LRA.
¿Pueden los nuevos biomarcadores de lesión renal aguda identificar a los pacientes que necesitan terapia de reemplazo renal?Predecir si los pacientes progresarán a la necesidad de TRR nos enfrenta a un conflicto similar a predecir quién desarrollará LRA. Hasta la fecha, no hay intervenciones más allá del tratamiento de la enfermedad subyacente, la atención al detalle y la buena atención médica que impiden la progresión de LRA o inducen la recuperación. Aunque pueda parecer atractivo para saber qué paciente tendrá TRR, es poco probable que este conocimiento cambie la práctica clínica, sobre todo porque no hay evidencias de que a partir de TRR precoz sea más beneficioso46. Sin embargo, saber si un paciente con TRR ha recuperado la función renal puede ser muy útil.
La utilización de los nuevos biomarcadores de lesión renal aguda ¿mejora la evolución de los pacientes?No se ha demostrado la eficacia de una intervención específica basada en el aumento de los biomarcadores. El único estudio de intervención a través de biomarcadores para guiar el tratamiento fue negativo41.
Por lo tanto, la afirmación de que el empleo de biomarcadores beneficia a los pacientes y mejora el resultado sigue sin comprobarse.
¿Cuándo se deben medir los biomarcadores de lesión renal aguda?Una de las dificultades ha sido identificar qué pacientes se beneficiarían más con el uso de los biomarcadores en situaciones en las que el resultado ya parece predecible, basados en parámetros estándares, como el diagnóstico clínico y la oliguria. Claramente en esta situación, hay poco beneficio adicional, del mismo modo que una aplicación en pacientes con bajo riesgo de LRA, lo cual genera una utilización inútil de los mismos, con un innecesario aumento en los costos de atención de salud.
ConclusiónSe ha sugerido que la LRA debería llamarse «ataque renal»46, con el fin de establecer una analogía con el ataque al corazón, y que una «troponina renal» podría ser utilizada para detectar LRA en forma precoz, como en el infarto agudo de miocardio (IAM). Probablemente, la analogía entre las 2 condiciones se desmoronan cuando son consideradas las intervenciones potenciales. El IAM tiene tratamientos específicos. Ahora bien, incluso si un biomarcador fiable mostrara LRA precozmente, no habría actualmente tratamientos específicos que se pudieran ofrecer para el tratamiento de la isquemia tubular o la nefropatía séptica.
Si bien los resultados con respecto a la capacidad de los biomarcadores para mejorar el valor predictivo de LRA47-50 son contradictorios y todavía no han hecho la transición a la rutina clínica, hay que destacar las recientes publicaciones de la Acute Dialysis Quality Initiative (ADQI)20, que promueven la búsqueda de la identificación precoz de daño o riesgo de LRA especialmente en aquellos pacientes en los que la sCr es negativa y los biomarcadores son positivos; la promoción se sustenta en el potencial que tienen estos últimos para transformar la forma de diagnóstico y el tratamiento de LRA. No obstante, estas mismas recomendaciones, junto a las guías KDIGO de LRA4, afirman claramente que hasta el momento la sCr y la diuresis representan los mejores marcadores con aplicabilidad clínica de LRA para ser utilizados en el diagnóstico y seguimiento. De esta manera creemos que la «polarización de la creencia» debe estar orientada a la evidencia, sustentada en el desarrollo de nuevos paradigmas y el uso de los nuevos biomarcadores en la LRA.
Frases clave- •
La lesión renal aguda (LRA) en los pacientes críticos es un factor de riesgo independiente que aumenta la morbilidad y la mortalidad a corto y a largo plazo, con un tremendo impacto económico en términos de costos de salud. La LRA representa también una puerta de entrada a la enfermedad renal crónica (ERC).
- •
El diagnóstico de LRA se basa en marcadores indirectos de daño renal (sCr y diuresis), los cuales son pocos sensibles y específicos, en detrimento de la llamada «ventana terapéutica».
- •
Los nuevos biomarcadores de LRA prometen identificar precozmente a los pacientes con riesgo de LRA, diagnosticar la LRA antes que las pruebas convencionales, indicar la necesidad de iniciar TRR y pronosticar el riesgo de progresión a ERC.
- •
La ADQI propone 4 combinaciones posibles entre los biomarcadores funcionales y de daño tisular: ningún cambio en los biomarcadores, solo cambios en los biomarcadores funcionales, solo cambios en los biomarcadores de daño, o cambios en los 2 biomarcadores, funcionales y de daño.
- •
La FDA aprobó para utilización en una población heterogénea como la de la UCI los biomarcadores de detención del ciclo celular TIMP-2 e IGFBP-7, los cuales parecen ser altamente predictores del desarrollo LRA moderada a severa en las subsiguientes 12-24h.
- •
Los esfuerzos futuros en este campo probablemente deberían concentrarse en la evaluación de los mejores biomarcadores actuales en grupos bien definidos con alta probabilidad pretest de LRA y en contextos en los cuales los biomarcadores pueden alterar la toma de decisiones clínicas.
Los autores declaran no tener ningún conflicto de intereses.







![Utilización funcional de los nuevos biomarcadores de lesión renal aguda. De: Acute Dialysis Quality Initiative (ADQI) [consultado 10 Ene 2013]. Disponible en: www.ADQI.org](https://static.elsevier.es/multimedia/02116995/0000003600000004/v2_201611160150/S0211699516300273/v2_201611160150/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)
![Nuevos criterios para el diagnóstico de lesión renal aguda. De: Acute Dialysis Quality Initiative (ADQI) [consultado 10 Ene 2013]. Disponible en: www.ADQI.org](https://static.elsevier.es/multimedia/02116995/0000003600000004/v2_201611160150/S0211699516300273/v2_201611160150/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)