Las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA) se caracterizan por una inflamación necrotizante de vasos pequeños. Antes de la llegada del tratamiento inmunosupresor solían tener un desenlace fatal. El tratamiento ha transformado las vasculitis en una enfermedad con una importante tasa de respuesta, pero con un porcentaje nada despreciable de recidivas y un daño orgánico acumulado, en gran parte debido a las toxicidades relacionadas con los fármacos. El uso de glucocorticoides (GC), ciclofosfamida (CFM)y otros inmunosupresores (como azatioprina [AZA], micofenolato y metotrexato [MTX]) se optimizó mediante una serie de ensayos clínicos que establecieron un tratamiento de referencia. En los últimos años, la mejora de los conocimientos sobre los linfocitos B y la inhibición del complemento ha revolucionado el curso de la enfermedad y minimizado los efectos adversos (EA) del tratamiento.
El presente documento multidisciplinar de recomendaciones se ha basado en un consenso de tres especialidades (Medicina Interna, Nefrología y Reumatología) y en la mejor evidencia disponible acerca del diagnóstico, tratamiento y seguimiento del paciente con vasculitis asociada a ANCA, incluyendo situaciones especiales. El objetivo es brindar a los médicos que manejan habitualmente este tipo de enfermedades, información actualizada y recomendaciones clínicas bien fundamentadas, que mejoren el enfoque diagnóstico y terapéutico de nuestros pacientes.
Anti-neutrophil cytoplasmic autoantibody (ANCA)-associated vasculitis is characterised by small vessel necrotising inflammatory vasculitis. Prior to immunosupressant therapy availability it usually led to a fatal outcome. Current treatment has changed ANCA-associated vasculitis into a condition with a significant response rate, although with a not negligible relapse occurrence and cumulative organ lesions, mostly due to drug-related toxicities. The use of glucocorticoids, cyclophosphamide and other immunosupressants (such as azathioprine, mychophenolate and methotrexate) was optimised in a series of clinical trials that established the treatment of reference. In recent years, a better knowledge of B lymphocyte function and the role of complement inhibition has transformed the course of this disease while minimising treatment-related adverse effects.
This multidisciplinary document of recommendations is based on the consensus of three scientific societies (Internal Medicine, Nephrology and Rheumatology) and on the best available evidence on diagnosis, treatment and follow-up of patients with ANCA-associated vasculitis, including some special situations. The aim of this document is to provide updated information and well-grounded clinical recommendations to practising physicians as to how to improve the diagnosis and treatment outcome of our patients.
Las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA) se caracterizan por una inflamación necrotizante de los vasos pequeños y, antes de la llegada del tratamiento inmunosupresor solían tener un desenlace mortal. Los nuevos tratamientos han transformado las vasculitis ANCA en una enfermedad crónica con una importante tasa de respuesta, aunque con un porcentaje notable de recidivas y un daño orgánico acumulado en gran parte debido a las toxicidades de los fármacos. El uso de glucocorticoides (GC), ciclofosfamida (CFM) y otros inmunosupresores como azatioprina (AZA); micofenolato mofetilo (MMF) y metotrexato (MTX) se ha optimizado gracias a diversos ensayos clínicos. En los últimos años, los progresos en el conocimiento sobre los linfocitos B y el papel del complemento en las vasculitis asociadas a anticuerpos (VAA), han revolucionado el curso de la enfermedad y reducido los efectos adversos (EA) del tratamiento. Recientemente, hemos asistido a la actualización de las recomendaciones de manejo y tratamiento de las vasculitis ANCA según diferentes sociedades científicas (American College of Rheumatology [ACR], European League Against Rheumatism [EULAR], Kidney Disease Improving Global Outcomes [KDIGO]), que han propuesto importantes cambios en el abordaje de esta entidad.
Este documento de recomendaciones está basado en la mejor evidencia disponible acerca del diagnóstico, tratamiento y seguimiento del paciente con VAA, incluyendo casos de situaciones especiales, y en el consenso de tres sociedades científicas (Medicina Interna, Nefrología y Reumatología). En cada apartado se presentan, en primer lugar, las recomendaciones, seguidas de su justificación científica y un resumen de la información más relevante en el área.
El objetivo principal es brindar una información actualizada y recomendaciones clínicas fundamentadas para mejorar el enfoque diagnóstico y terapéutico de los pacientes con VAA.
MetodologíaEn estas recomendaciones ha participado un panel multidisciplinar formado por 15 médicos expertos en el diagnóstico y tratamiento de pacientes con vasculitis correspondientes a las especialidades de Nefrología (n=5), Medicina Interna (n=5) y Reumatología (n=5). Para ello, se realizaron diversas reuniones de coordinación, discusión y consenso entre marzo de 2023 marzo de 2024.
En primer lugar, se designó un comité científico compuesto por un coordinador de cada una de las tres especialidades. Este comité fue el encargado de proponer a los participantes, diseñar un esquema de trabajo y asignar sus apartados a los autores en función de su experiencia y conocimiento.
Los expertos fueron elegidos en función de los siguientes criterios: contar con la especialización con una antigüedad de más de 10 años, encontrarse en activo en centros públicos o privados, pertenecer a una sociedad científica, ser autor de publicaciones o comunicaciones a congresos sobre VAA, o haber participado en ensayos clínicos en este campo.
A cada participante se le encomendó la tarea de establecer recomendaciones en el apartado asignado, redactando un breve texto de justificación con base en una revisión de la literatura científica y a su propia experiencia. Como fuentes bibliográficas se utilizaron Medline, Embase, Google Scholar y Cochrane Library. Se revisaron, asimismo, los resúmenes de los principales congresos de las tres especialidades o específicos de VAA. La búsqueda se acotó a los últimos 15 años y siguió los criterios detallados en la Tabla S1. Además de la bibliografía seleccionada, se tuvieron en cuenta las guías de práctica clínica sobre VAA en sus versiones actualizadas.
Las recomendaciones propuestas por cada autor fueron revisadas y discutidas de forma crítica, inicialmente por el comité científico y después por todo el grupo, hasta consensuar las recomendaciones definitivas. Para cada recomendación se recogió la bibliografía de apoyo y el grado de acuerdo (GA) del grupo. Para emitir las recomendaciones se consideró necesario un GA igual o superior al 70%.
Los autores firman el documento en orden alfabético, alternando las tres especialidades participantes, excepto los dos primeros y el último, por su mayor contribución al manuscrito.
DiagnósticoDiagnóstico de las VAARecomendaciones- •
Se recomienda determinar los ANCA por inmunofluorescencia indirecta (IFI) y por Enzyme-Linked Immunosorbent Assay (ELISA) como práctica habitual (GA: 100%).
- •
Se recomienda realizar una biopsia que soporte el diagnóstico de VAA siempre que sea posible (GA: 100%).
- •
Se recomienda mantener un alto índice de sospecha de VAA en ausencia de ANCA en pacientes con glomerulonefritis rápidamente progresivas (GNRP), así como en aquellos con procesos inflamatorios localizados, sugestivos de VAA (seudotumor orbitario, otomastoiditis, nódulos pulmonares, etc.) (GA: 82%).
- •
No se recomienda en el momento actual la determinación de otros anticuerpos, tales como los anticuerpos antiendoteliales (AECA) o antimembrana lisosomal humana 2 (LAMP-2), por su falta de validación y estandarización (GA: 83%).
No se justifica con la literatura la sospecha de VAA con ANCA negativos1.
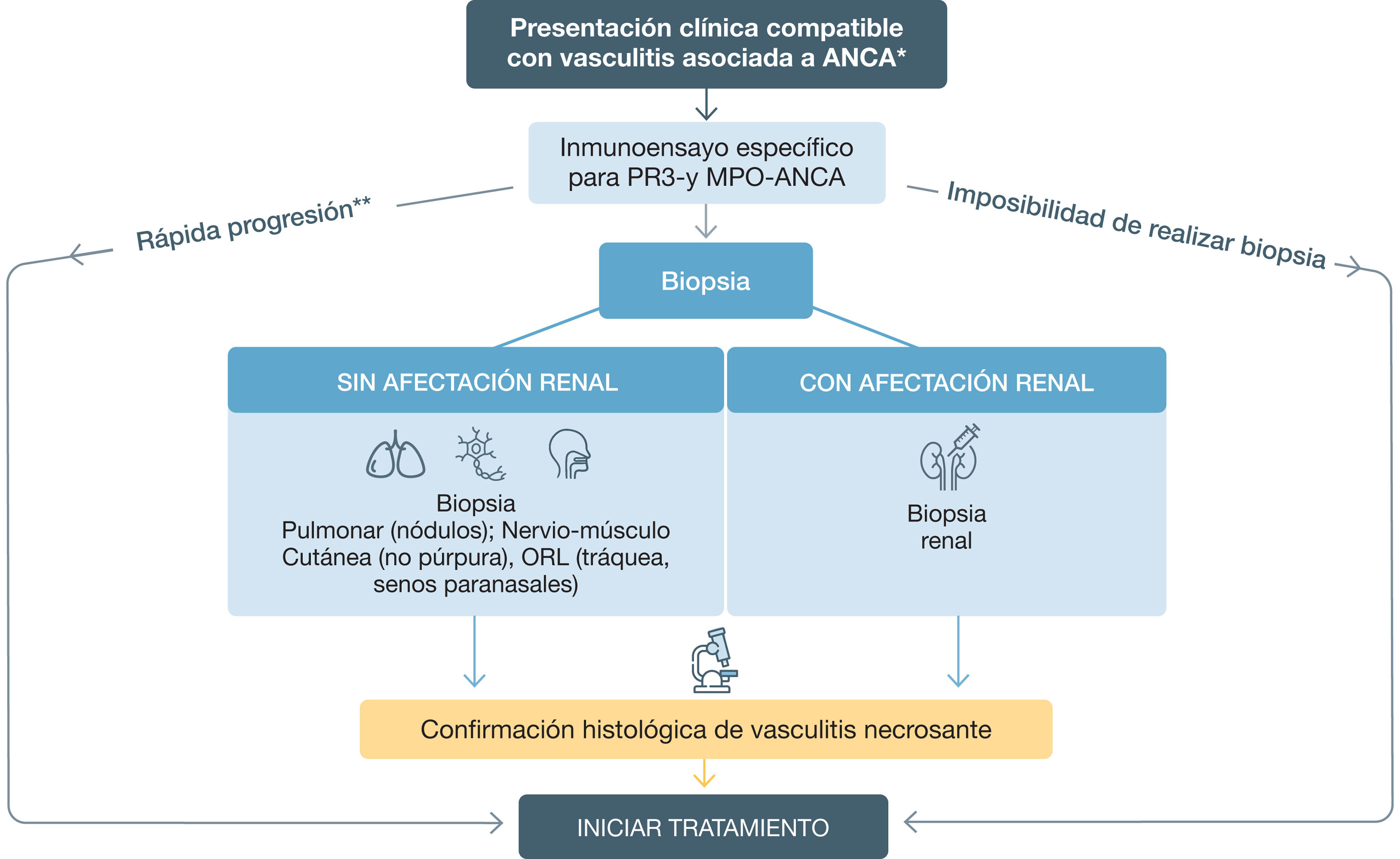
El diagnóstico de las VAA es un desafío dada su gravedad, su naturaleza multisistémica y su gran variabilidad clínica. Se debe sustentar en tres aspectos: manifestaciones clínicas, autoinmunidad serológica y demostración histológica (fig. 1).
Estrategia diagnóstica en las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA). El diagnóstico se debe sustentar en tres aspectos: manifestaciones clínicas, serología e histología.
*Ver Tabla 2.Características clínicas de la GPA y PAM.
**Si rápida progresión y ANCA positivos, no es necesario esperar los resultados de la biopsia para iniciar tratamiento.
ANCA: anticuerpos anticitoplasma de neutrófilo; PR3: proteinasa 3; MPO: mieloperoxidasa; ORL: otorrinolaringológico.
La sospecha clínica debe establecerse en pacientes con síndrome general, fiebre persistente y síntomas indicativos de afectación orgánica, con especial relevancia del compromiso renal y pulmonar2. Las principales manifestaciones indicativas de VAA son: artralgias inflamatorias o artritis, mialgias, púrpura, livedo reticularis, úlceras cutáneas, costras/úlceras nasales, rinorrea purulenta, epistaxis, sinusitis, tos, hemoptisis, disnea, hematuria glomerular o proteinuria, hipertensión arterial, parestesias o pérdida de fuerza en extremidades, diplopía o proptosis ocular, todas ellas no explicadas por otra causa.
Las pruebas de laboratorio e imagen deben incluir un hemograma y un análisis bioquímico básico para detectar alteraciones sugestivas de inflamación sistémica (aumento de la velocidad de sedimentación globular [VSG]; proteína C reactiva [PCR]; alfa-1 y 2 globulinas, anemia inflamatoria, leucocitosis, trombocitosis). Es fundamental valorar la función renal y un sedimento de orina para descartar la existencia de microhematuria o proteinuria3.
En el estudio inmunológico debe incluirse la determinación de ANCA mediante IFI para clasificarlos según su patrón: perinuclear (pANCA), citoplasmático (cANCA) o atípico (xANCA); y mediante ELISA para identificar su especificidad antigénica: proteinasa 3 (PR3) que suele asociarse a un patrón cANCA, o mieloperoxidasa (MPO), usualmente pANCA. En la granulomatosis con poliangeítis (GPA), el 80-90% de los pacientes presentan cANCA-PR3, el 5-20% pANCA-MPO, y hasta un 20% son negativos para ANCA, especialmente cuando existe afectación otorrinolaringológica (ORL) aislada o seudotumor orbitario sin afectación renal. El 80% de los pacientes con poliangeítis microscópica (PAM) presentan pANCA-MPO, un 5-10% cANCA-PR3, y un 10-15% son negativos para ANCA.
Hay que recordar que la especificidad de los ANCA, especialmente de los pANCA, no es del 100%, y que las técnicas de IFI varían entre laboratorios, por lo que se recomienda la determinación de ANCA mediante IFI y ELISA como práctica habitual. Realizar una prueba de imagen torácica de forma rutinaria (tomografía computarizada de tórax preferiblemente) puede ser de gran utilidad, ya que un tercio de los pacientes pueden presentar afectación pulmonar a pesar de no tener manifestaciones clínicas4.
Por último, se recomienda obtener una muestra histológica que permita confirmar el diagnóstico de VAA y evaluar la extensión y gravedad de la enfermedad.
Cuando se plantea una biopsia diagnóstica debe considerarse que5:
- •
Las lesiones cutáneas son muy accesibles, pero suelen mostrar una vasculitis leucocitoclástica con necrosis fibrinoide no específica de VAA.
- •
Las biopsias de mucosa nasal o sinusal tienen una baja sensibilidad (en torno al 20%) a pesar de realizarse en lesiones ulceradas y por cirujanos expertos.
- •
Las biopsias transbronquiales tienen una baja sensibilidad (10%).
- •
Las biopsias pulmonares son muy rentables (90%) cuando existen nódulos pulmonares, observándose granulomas de neutrófilos en la GPA. En caso de infiltrados pulmonares, suele observarse capilaritis o hemorragia pulmonar, y la presencia de granulomas es excepcional, por lo que la diferenciación entre GPA y PAM debe basarse en otros aspectos clínicos.
- •
La biopsia renal es de gran rentabilidad diagnóstica (80%). El patrón característico es la presencia de una glomerulonefritis necrotizante, pauciinmune, con semilunas. La presencia de granulomas es excepcional, y por ello no es posible diferenciar entre la GPA y la PAM, pero permite valorar la extensión, actividad y cronicidad de las lesiones, y tiene gran valor pronóstico.
- •
La biopsia de músculo y nervio periférico puede mostrar vasculitis de los vasa vasorum incluso en pacientes con poca afectación clínica6.
- •
Se recomienda utilizar la nomenclatura de la Conferencia internacional de Consenso de Chapel-Hill (CCCH), en su actualización de 2012, a la hora de referirse a las VAA (GA: 92%).
- •
No se recomienda usar los criterios de clasificación ACR/EULAR propuestos para el diagnóstico de las VAA, si bien pueden ser muy útiles para el diagnóstico diferencial entre las diferentes vasculitis (GA: 100%).
La CCCH, en su actualización de 2012, introduce el grupo de las VAA y lo incluye dentro de las vasculitis de vaso pequeño (capilares, vénulas, arteriolas y arterias pequeñas). Define las VAA como vasculitis necrosantes con depósitos inmunes escasos o ausentes, que afectan a vasos pequeños con asociación a ANCA MPO, ANCA PR3, si bien en algunos pacientes no se detectan ANCA a pesar de un cortejo clínico propio de este grupo de vasculitis7.
En la CCCH 2012 se establecieron las siguientes definiciones:
- •
GPA, antes llamada granulomatosis de Wegener: inflamación granulomatosa necrotizante que, por lo general, implica a las vías respiratorias superiores e inferiores, con vasculitis necrotizante que afecta predominantemente a vasos pequeños y medianos, siendo frecuente la glomerulonefritis necrotizante.
- •
PAM: afecta a vasos pequeños (arteriolas, capilares y vénulas), con posible presencia de arteritis necrosante que involucra a arterias pequeñas y medianas, siendo muy comunes la glomerulonefritis necrotizante y la capilaritis pulmonar, que no cursa con granulomas.
En 1990, reconociendo que la biopsia y el estudio histológico no siempre eran posibles, accesibles o concluyentes, el ACR publicó criterios de clasificación de las vasculitis8. Estos fueron diseñados para incluir, en estudios de investigación, pacientes que compartiesen características inequívocas de la enfermedad, siempre que hubieran sido diagnosticados de vasculitis. Es decir, seleccionaron aquellos hallazgos clínicos que identifican una enfermedad y la diferencian de otros diagnósticos, si bien no incluyen el espectro de manifestaciones clínicas posibles de cada entidad, por lo que no permiten identificar todos los casos y, por tanto, no siempre son útiles para el diagnóstico de pacientes individuales. Estos criterios ACR de 1990 no incluían aún la PAM como entidad diferenciada ni los ANCA como distintivo de grupo9,10.
Las nuevas técnicas de diagnóstico e imagen han contribuido a diferenciar mejor entre diferentes tipos de vasculitis, lo cual ha llevado a cuestionar la sensibilidad y especificidad de los criterios clasificatorios de 199011. Esto obligó a revisarlos utilizando datos del estudio observacional multicéntrico de diagnóstico y criterios de clasificación de las vasculitis sistémicas (DCVAS), dando lugar a los criterios del ACR/ EULAR, actualizados en 202212,13. La aproximación se hizo en función del tamaño de los vasos afectos, pero incorporando datos clínicos detallados, determinación de ANCA, biopsia y nuevas pruebas de imagen, lo cual aumentó su sensibilidad14. Estos criterios de clasificación han de aplicarse cuando el diagnóstico de vasculitis ya está establecido, y sirven para diferenciar unas vasculitis de otras.
Un resumen del proceso de desarrollo de los criterios de clasificación de ACR/EULAR 2022 para GPA y PAM se expone en material suplementario.
Para definir los criterios de clasificación ACR/EULAR de GPA y PAM de 2022 se incluyeron casos y comparadores12,15. Los criterios finales y su peso se muestran en la tabla 112,15. Después de excluir «imitadores» de vasculitis, un paciente con un diagnóstico de vaso pequeño o mediano podría clasificarse como GPA o PAM si la puntuación acumulada es ≥ 5 puntos. Como puede observarse, la presencia de PR3-ANCA (o cANCA) tiene mucho peso en estos criterios, de tal forma que su negatividad, incluso en presencia de un cuadro clínico compatible, haría difícil (no imposible) clasificar como GPA a pacientes que cumplirían la definición de la CCCH 2012 o el algoritmo de la EMA de 200716.
Criterios de clasificación de vasculitis ANCA según ACR/EULAR 202212,15
| Criterios de clasificación | Puntuación |
|---|---|
| Granulomatosis con poliangeítis (GPA) | |
| Afectación nasal: secreción sanguinolenta, costras nasales, congestión o defectos septales/perforación | +3 |
| Afectación cartilaginosa en oreja o cartílago nasal, deformidad en silla de montar o afectación endobronquial | +2 |
| Pérdida de audición conductiva o neurosensorial | +1 |
| cANCA o antiproteinasa 3 (PR3) positivos | +5 |
| Nódulos pulmonares, masa o cavitación en las imágenes de tórax | +2 |
| Granuloma o células gigantes en biopsia | +2 |
| Inflamación o consolidación de los senos nasales/paranasales en las imágenes | +1 |
| Glomerulonefritis pauciinmune | +1 |
| p-ANCA o ANCA anti- mieloperoxidasa (MPO) | -1 |
| Recuento de eosinófilos ≥1×109/l | -4 |
| Poliangeítis microscópica (MPA) | |
| pANCA o ANCA-antimieloperoxidasa | +6 |
| Glomerulonefritis pauciinmune | +3 |
| Fibrosis pulmonar o enfermedad pulmonar intersticial | +3 |
| Síntomas o signos sinonasales | -3 |
| c-ANCA o ANCA- antiPR3 | -1 |
| Recuento de eosinófilos ≥1109/L | 4 |
ANCA: anticuerpos anticitoplasma de neutrófilo; ACR: American College of Rheumatology; EULAR: European Alliance of Associations for Rheumatology.
- •
La biopsia renal es recomendable para confirmar el diagnóstico de VAA cuando existe afectación renal, dada su alta rentabilidad y valor pronóstico, pero su realización no debería retrasar el inicio de tratamiento inmunosupresor, especialmente en formas de progresión rápida (GA: 100%).
- •
En caso de sospecha de recaída con afectación renal, se podría considerar realizar una nueva biopsia renal para confirmar el diagnóstico y establecer el grado de cronicidad (GA: 100%).
La presencia de anticuerpos ANCA en un paciente con GNRP tiene un elevado valor predictivo para el diagnóstico de VAA con afectación renal (98% para PR3 y 90% para MPO)17, por lo que no es imprescindible realizar de forma rutinaria una biopsia renal en pacientes con esta forma de presentación para establecer el diagnóstico, sobre todo si la biopsia renal va a retrasar el inicio del tratamiento inmunosupresor o si el riesgo de sangrado es muy elevado.
Debemos considerar las posibles complicaciones de una biopsia renal, como el riesgo de sangrado en pacientes en tratamiento con plasmaféresis, sobre todo si la reposición no se realiza con plasma18, en sujetos de edad avanzada, y por supuesto en pacientes anticoagulados19.
Sin embargo, existen formas de VAA, con test serológico negativo y cuya afectación renal no es rápidamente progresiva, en las que la biopsia renal continúa siendo fundamental para establecer el diagnóstico. La presencia de inflamación vascular o de necrosis fibrinoide en cualquier órgano continúa siendo criterio diagnóstico de la enfermedad. La biopsia renal, cuando el órgano está afecto, es la que presenta mayor rentabilidad diagnóstica (91,5% en vasculitis PR3)20. Los hallazgos histológicos de la biopsia renal no permiten diferenciar, habitualmente, entre tipos de vasculitis.
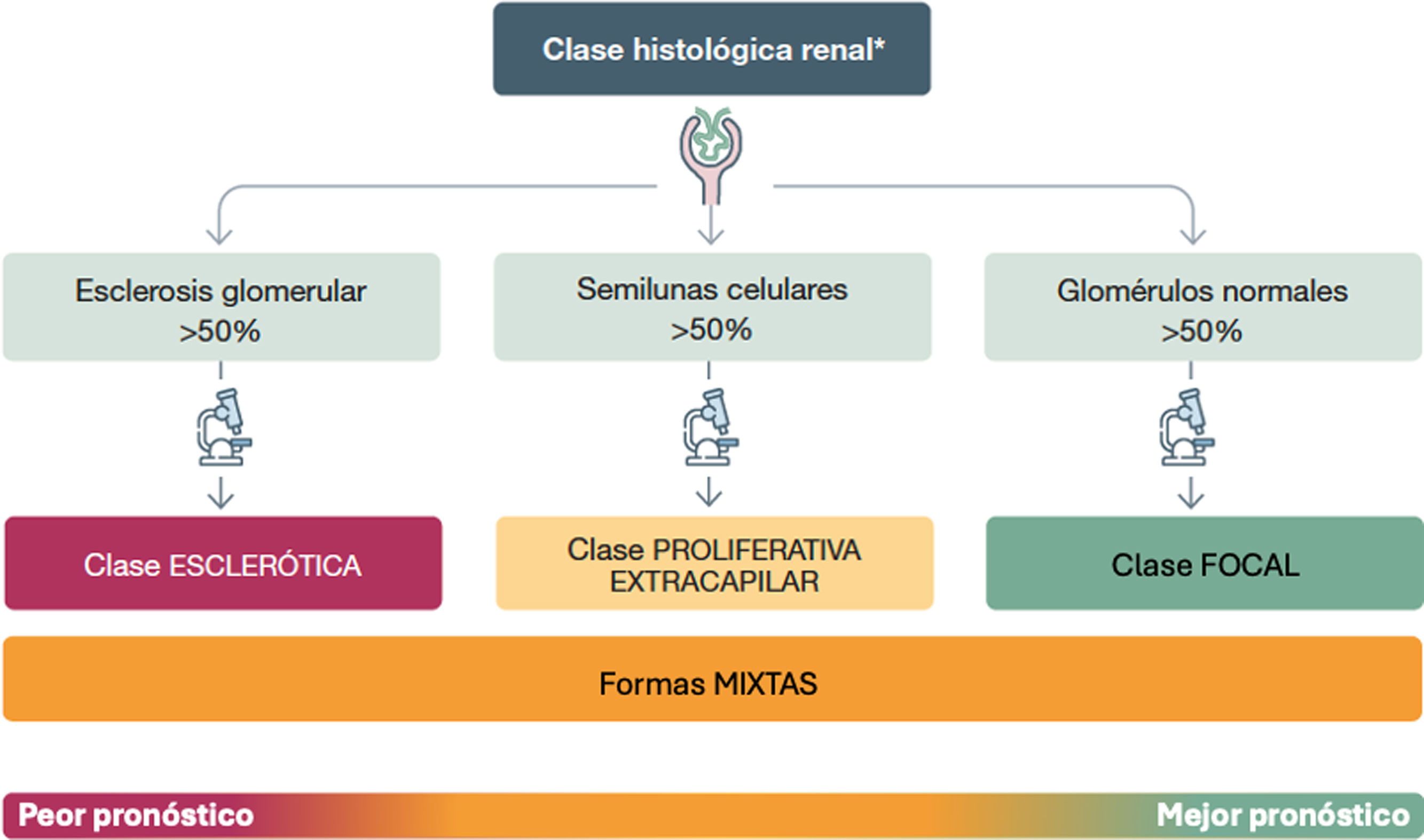
Los hallazgos histológicos no condicionan la elección del tratamiento inmunosupresor en los pacientes con VAA, si bien la clasificación de Berden ha demostrado tener valor pronóstico en diversas poblaciones21,22 y su información puede matizar la intensidad o la duración del tratamiento, estableciendo el grado de actividad o cronicidad en el tejido renal23 (fig. 2).
Clasificación histopatológica renal pronóstica de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA)
*Al tratarse de una enfermedad sistémica, a pesar del diferente pronóstico es imprescindible tratar al paciente: la histología no debe modificar la intensidad del tratamiento.
ANCA: anticuerpos anticitoplasma de neutrófilo, MPO: mieloperoxidasa, PR3: proteinasa 3.
Algunos artículos recientes sugieren que un modelo de riesgo predictivo que incorporara tanto elementos clínicos como patológicos podría ser útil para identificar pacientes con mayor probabilidad de respuesta a la plasmaféresis24.
En caso de sospecha de recaída renal, la biopsia renal podría ayudar a descartar daño crónico u otras patologías alternativas sobreañadidas, cuando existan dudas clínicas sobre este punto, aunque no se recomienda su realización de forma rutinaria.
Papel de otras biopsiasRecomendaciones- •
Se recomienda la biopsia tisular de órgano clínicamente afecto y accesible para confirmar el diagnóstico de vasculitis, siempre que sea factible y valorando cuidadosamente su potencial rendimiento y especificidad frente a posibles secuelas (GA: 100%).
- •
La biopsia no debería retrasar el tratamiento en los casos graves de VAA (GA: 100%)
Además de las biopsias renales, aquellas realizadas en otros órganos afectos por la vasculitis pueden ser de utilidad para el diagnóstico.
La actualización de las recomendaciones EULAR para el manejo de VAA de 20226 establece, en su primera recomendación, que una biopsia positiva respalda firmemente el diagnóstico de vasculitis y recomienda, siempre que sea posible, biopsias para ayudar a establecer un nuevo diagnóstico y para la evaluación adicional en pacientes con sospecha de vasculitis recurrente. Se destaca asimismo que, ante la gravedad de estas entidades, el tratamiento no debe retrasarse mientras se espera el resultado del estudio histológico6.
La biopsia es especialmente necesaria cuando los hallazgos clínicos, serológicos y de imagen no ofrecen criterios suficientes para clasificar la vasculitis. Por ejemplo, puede haber pacientes con síntomas atípicos o limitados, negativos para ANCA o con patrones o especificidades no habituales, o con afectación de órganos poco frecuentes25. En estas situaciones, la biopsia puede ser útil para confirmar la presencia de vasculitis y diferenciar las VAA de otras causas de inflamación vascular2. Según la presentación clínica, se indica la realización de biopsias de piel, nasales, de las vías respiratorias, pulmón, músculo o nervio periférico, variando la accesibilidad y la sensibilidad según la localización3.
Las biopsias más accesibles son las cutáneas. El compromiso vascular puede afectar a los vasos dérmicos superficiales, pero también a la vasculatura dérmica media. Sin embargo, en otras localizaciones no siempre es factible obtener una biopsia en cada paciente con sospecha de VAA. Pueden darse barreras como la dificultad para acceder al tejido (p. ej., el tejido retroorbitario ante masa en GPA), un riesgo injustificado del procedimiento (pacientes en tratamiento anticoagulante) o un bajo rendimiento. La sensibilidad diagnóstica de las biopsias de la vía aérea superior y transbronquial se ha estimado en un 30% y 12%, respectivamente, arrojando a menudo hallazgos histológicos inespecíficos26. En pacientes con lesiones pulmonares que no se puede atribuir claramente a VAA activa, se podría considerar la biopsia toracoscópica abierta, con una alta sensibilidad (80%-90%), si bien se trata de una prueba muy invasiva y no exenta de riesgos.
Los hallazgos histopatológicos de la neuropatía resultante de la VAA se caracterizan por la degeneración axonal de las fibras nerviosas y la inflamación de los vasos epineurales, acompañada de la destrucción de estructuras vasculares y/u obstrucción de la luz, con o sin necrosis fibrinoide. Se afectan tanto fibras mielínicas como amielínicas27.
Aunque la inflamación de la pared vascular acompañada por daño estructural vascular es necesaria para el diagnóstico histopatológico de neuropatía vasculítica, la sensibilidad de este hallazgo es baja. Los estudios neurológicos también evaluaron la utilidad de la biopsia muscular juntamente con la neural en caso de vasculitis de un solo órgano o sistémica, con una sensibilidad del 48-80%28. Tanto en esta como en otras localizaciones de biopsia, en casos de VAA negativos para ANCA o de presentación atípica, podría ser necesario repetirla en caso de que la primera fuese negativa.
Manifestaciones clínicasEl espectro de manifestaciones clínicas de las VAA es muy variado y comprende desde formas con afectación aislada de un solo órgano hasta enfermedad multisistémica con evolución fulminante y compromiso vital29.
La presencia de síndrome general con fiebre, astenia, pérdida de peso y artralgias aparece en un elevado porcentaje de pacientes y puede preceder durante varias semanas a la afectación orgánica, simulando un cuadro infeccioso o neoplásico. Ocasionalmente, algunos pacientes presentan un cuadro explosivo con un curso rápidamente progresivo en pocos días2,30.
Puede existir cierto solapamiento entre los síntomas de la GPA y la PAM. Sin embargo, la afectación ORL o de la vía respiratoria alta es más característica de la GPA, mientras que la lesión del sistema nervioso periférico es más típica de la PAM. La afectación pulmonar en la GPA puede cursar con nódulos cavitados, mientras que en la PAM puede asociarse a fibrosis pulmonar (generalmente con patrón de neumonía intersticial usual [NIU])31.
Los pacientes con VAA tienen un riesgo elevado de enfermedad tromboembólica venosa, con una frecuencia estimada del 8%, especialmente en los periodos de brote de la enfermedad. Asimismo, se ha demostrado un aumento del riesgo de eventos cardiovasculares (CV) tres veces superior al de la población general y ocho veces superior de accidentes cerebrovasculares (ACV)4.
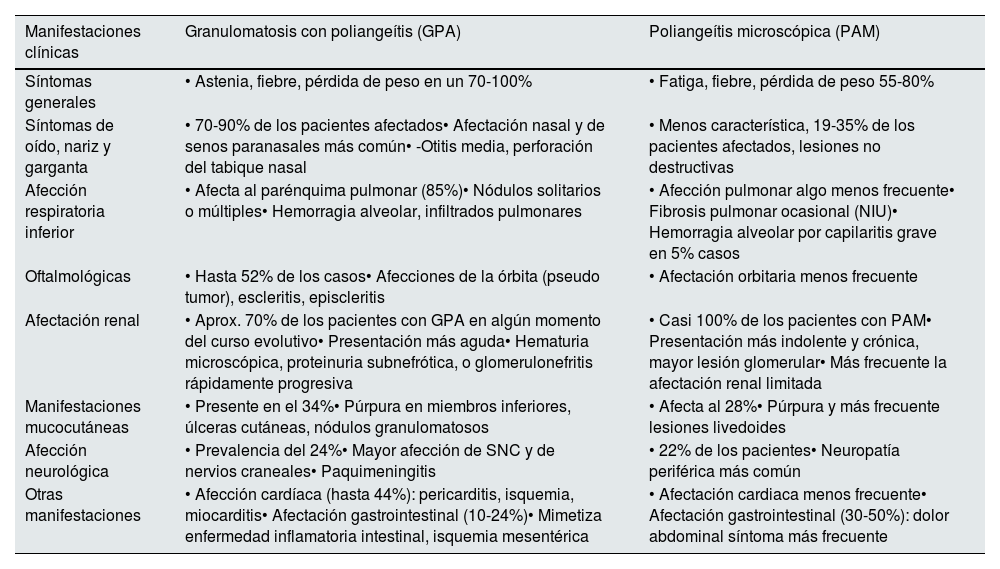
Recientemente se ha destacado la relevancia de la conexión entre manifestaciones clínicas específicas y el perfil de anticuerpos (PR3 o MPO). La presencia de estos anticuerpos tendría un mayor impacto en la frecuencia y el tipo de afectación orgánica, en comparación con el diagnóstico final de GPA o PAM. Asimismo, parece existir una asociación entre ciertas variantes genéticas y diversas manifestaciones clínicas32. En la tabla 22 se resumen las principales características clínicas de la GPA y la PAM.
Características clínicas de la granulomatosis con poliangeítis (GPA) y la poliangeítis microscópica (PAM)2
| Manifestaciones clínicas | Granulomatosis con poliangeítis (GPA) | Poliangeítis microscópica (PAM) |
|---|---|---|
| Síntomas generales | • Astenia, fiebre, pérdida de peso en un 70-100% | • Fatiga, fiebre, pérdida de peso 55-80% |
| Síntomas de oído, nariz y garganta | • 70-90% de los pacientes afectados• Afectación nasal y de senos paranasales más común• -Otitis media, perforación del tabique nasal | • Menos característica, 19-35% de los pacientes afectados, lesiones no destructivas |
| Afección respiratoria inferior | • Afecta al parénquima pulmonar (85%)• Nódulos solitarios o múltiples• Hemorragia alveolar, infiltrados pulmonares | • Afección pulmonar algo menos frecuente• Fibrosis pulmonar ocasional (NIU)• Hemorragia alveolar por capilaritis grave en 5% casos |
| Oftalmológicas | • Hasta 52% de los casos• Afecciones de la órbita (pseudo tumor), escleritis, episcleritis | • Afectación orbitaria menos frecuente |
| Afectación renal | • Aprox. 70% de los pacientes con GPA en algún momento del curso evolutivo• Presentación más aguda• Hematuria microscópica, proteinuria subnefrótica, o glomerulonefritis rápidamente progresiva | • Casi 100% de los pacientes con PAM• Presentación más indolente y crónica, mayor lesión glomerular• Más frecuente la afectación renal limitada |
| Manifestaciones mucocutáneas | • Presente en el 34%• Púrpura en miembros inferiores, úlceras cutáneas, nódulos granulomatosos | • Afecta al 28%• Púrpura y más frecuente lesiones livedoides |
| Afección neurológica | • Prevalencia del 24%• Mayor afección de SNC y de nervios craneales• Paquimeningitis | • 22% de los pacientes• Neuropatía periférica más común |
| Otras manifestaciones | • Afección cardíaca (hasta 44%): pericarditis, isquemia, miocarditis• Afectación gastrointestinal (10-24%)• Mimetiza enfermedad inflamatoria intestinal, isquemia mesentérica | • Afectación cardiaca menos frecuente• Afectación gastrointestinal (30-50%): dolor abdominal síntoma más frecuente |
NIU: neumonía intersticial usual; SNC: sistema nervioso central.
- •
En pacientes con clínica que sugiere una VAA, se recomienda determinar la presencia tanto PR3-ANCA como MPO-ANCA (GA: 100%).
- •
El estado de actividad de una VAA y la necesidad de cambios en el tratamiento no pueden derivarse únicamente de los títulos de ANCA (GA: 100%).
Los ANCA son útiles para el diagnóstico, clasificación, pronóstico y tratamiento de las VAA. Hay dos métodos para determinar los ANCA: la IFI y el ELISA. En IFI existen dos patrones: un patrón citoplasmático (cANCA) y otro perinuclear (pANCA). En ELISA se diferencian los anticuerpos anti-MPO y los anti-PR333. La determinación mediante ELISA tiene una mayor especificidad y valor predictivo positivo que la IFI1, aunque dichos anticuerpos pueden ser negativos y encontrarse en otras enfermedades1.
Se considera que los anticuerpos cANCA (anti-PR3) son más característicos de la GPA y los pANCA (anti-MPO) de la PAM o de la granulomatosis eosinofílica con poliangeítis (GEPA)34.
La sensibilidad y especificidad varían entre IFI y ELISA Tabla S21. Determinados por ELISA, los anti-PR3 tienen una sensibilidad del 79,8%-86,6% y una especificidad del 96,8%-98,3%35. La sensibilidad para GPA es mayor con anti-PR3 (74%) que con anti-MPO (11%). Los anti-MPO tienen una sensibilidad mayor para la PAM que para la GPA (73% vs. 7%) (Tabla S3)36. Hasta un 30% de VAA no presentan ANCA. Esto es más frecuente en la GPA localizada37.
Se ha determinado mediante curvas Receiver Operating Characteristic (ROC), el valor diagnóstico en función de los títulos de ANCA (Tabla S4)35. Aunque las recaídas de las VAA suelen cursar con elevación de los niveles de ANCA respecto a los niveles previos, esta elevación no es necesariamente indicativa de una recaída33, como mostró el metaanálisis llevado a cabo por Mehta et al.38.
El rituximab (RTX) negativiza los anti-PR3 en menos del 50% en 14 meses39. Con anti-MPO las recaídas se asocian a anti-MPO persistentes en caso de recuperación de linfocitos B, pero no si estas no se recuperan (7/12; 58% vs. 0/2; 0%, p=0,2)39. Los anti-PR3 pueden predecir las recaídas.
La proteinuria persistente no se considera un indicador de enfermedad renal activa, sino más bien un reflejo del daño glomerular crónico relacionado con la glomeruloesclerosis o el daño intersticial tubular40. La importancia de la hematuria microscópica persistente no está clara: puede reflejar actividad o daño glomerular41, aunque la persistencia de proteinuria y microhematuria son factores de mal pronóstico renal42.
La activación de la vía alternativa del complemento es fundamental en las VAA. Los productos de su degradación son un biomarcador potencial de vasculitis renal43.
Otros biomarcadores podrían ser la proteína quimioatrayente de monocitos -1 (MCP-1), los autoanticuerpos anti-plasminógeno tisular44, los anti-proteína 2 de membrana asociada a lisosomas (anti-LAMP2)44, un cociente neutrófilos/linfocitos>5,945 y la lipocalina asociada a gelatinasa de neutrófilos (NGAL)46.
Datos recientes indican que el equilibrio entre los linfocitos T reguladores (Tregs) y los B reguladores (Bregs), fundamentales en los mecanismos de tolerancia, se ve afectado en las VAA47.
La Tabla S5 resume los biomarcadores séricos, en sangre periférica y en orina, de las VAA.
Marcadores no serológicos de actividadRecomendaciones- •
En ausencia de marcadores serológicos que permitan valorar la actividad de las VAA, se recomienda utilizar escalas estandarizadas y validadas, diseñadas con esta finalidad, específicamente el Birminghan Vasculitis Activity Score (BVAS) (GA: 92%).
- •
Se sugiere calcular el Five Factor Score (FFS) como escala de gravedad por su información pronóstica respecto a la mortalidad, relevante para la toma de decisiones terapéuticas (GA: 92%).
En ausencia de marcadores serológicos robustos que permitan establecer la actividad de las VAA, se han diseñado distintos instrumentos/escalas para valorar la actividad y el pronóstico de estas enfermedades. Los más utilizados y validados son el BVAS48,49y el FFS50,51.
El BVAS ha sido utilizado en la mayoría de los ensayos clínicos realizados en pacientes con GPA y PAM para estimar la actividad de la enfermedad y valorar la respuesta al tratamiento. Además, se ha usado para estratificar la intensidad del tratamiento y definir el concepto de remisión y recaída de la enfermedad. Su primera versión, publicada en 199448, incluía 66 ítems clínicos y analíticos agrupados en nueve órganos/sistemas (general, cutáneo; mucosas y ojos; manifestaciones ORL; tórax; CV; abdomen; renal y sistema nervioso), cada uno con un valor distinto y con una puntuación máxima para cada órgano/sistema en función de su relevancia clínica. En 1997 fue modificado (BVAS v.2) y en 2001 se adaptó a pacientes con GPA (BVAS/GW). En 2008 se modificó y validó la última versión (BVAS v.3), que incluye 56 ítems agrupados en nueve órganos/sistemas, con una puntuación máxima de 63 puntos (tabla 3)49. El BVAS, además de su utilidad para valorar la actividad de la enfermedad, tiene un valor pronóstico a corto-medio plazo.
Manifestaciones incluidas en el Birmingham Vasculitis Activity Score (BVAS)49
| Puntuación | ||
|---|---|---|
| Manifestaciones persistentes | Manifestaciones nuevas o con empeoramiento | |
| General | Máximo=2 | Máximo=3 |
| Mialgia | 1 | 1 |
| Artralgia o artritis | 1 | 1 |
| Fiebre ≥38° C | 2 | 2 |
| Pérdida de peso ≥2 kg | 2 | 2 |
| Cutáneo | Máximo=3 | Máximo=6 |
| Infarto | 1 | 2 |
| Púrpura | 1 | 2 |
| Úlcera | 1 | 4 |
| Gangrena | 2 | 6 |
| Otras | 1 | 2 |
| Mucosas/ojos | Máximo=3 | Máximo=6 |
| Úlceras orales/granulomas | 1 | 2 |
| Úlceras genitales | 1 | 1 |
| Inflamación glándulas | 2 | 4 |
| Proptosis | 2 | 4 |
| Escleritis/epiescleritis | 1 | 2 |
| Conjuntivitis/blefaritis/1ueratitis | 1 | 1 |
| Visión borrosa | 2 | 3 |
| Pérdida aguda de visión | - | 6 |
| Uveítis | 2 | 6 |
| Alteraciones retinianas | 2 | 6 |
| Otorrinolaringológicas | Máximo=3 | Máximo=6 |
| Secreción nasal sanguinolenta/úlceras/granulomas | 2 | 4 |
| Afectación senos paranasales | 1 | 2 |
| Estenosis subglótica | 3 | 6 |
| Pérdida audición conducción | 1 | 3 |
| Pérdida auditiva neurosensorial | 2 | 6 |
| Tórax | Máximo=3 | Máximo=6 |
| Sibilantes | 1 | 2 |
| Nódulos o cavidades | - | 3 |
| Derrame pleural/pleuritis | 2 | 4 |
| Infiltrado | 2 | 4 |
| Afectación endobronquial | 2 | 4 |
| Hemoptisis/hemorragia alveolar | 4 | 6 |
| Insuficiencia respiratoria | 4 | 6 |
| Cardiovascular | Máximo=3 | Máximo=6 |
| Ausencia de pulsos | 1 | 4 |
| Enfermedad valvular cardiaca | 2 | 4 |
| Pericarditis | 1 | 3 |
| Dolor isquémico cardiaco | 2 | 4 |
| Miocardiopatía | 3 | 6 |
| Insuficiencia cardiaca congestiva | 3 | 6 |
| Abdominal | Máximo=4 | Máximo=9 |
| Peritonitis | 3 | 9 |
| Diarrea sanguinolenta | 3 | 9 |
| Isquemia abdominal | 2 | 6 |
| Renal | Máximo=6 | Máximo=12 |
| Hipertensión | 1 | 4 |
| Proteinuria | 2 | 4 |
| Hematuria | 3 | 6 |
| Creatinina sérica 125-249μmol/l* | 2 | 4 |
| Creatinina sérica 250-499μmol/l* | 3 | 6 |
| Creatinina sérica ≥500μmol/l | 4 | 8 |
| >30% de aumento en la creatinina | - | 6 |
| Sistema nervioso | Máximo=6 | Máximo=9 |
| Dolor de cabeza | 1 | 1 |
| Meningitis | 1 | 3 |
| Síndrome confusional | 1 | 3 |
| Epilepsia | 3 | 9 |
| Accidente cerebrovascular | 3 | 9 |
| Lesión médula espinal | 3 | 9 |
| Parálisis del nervio craneal | 3 | 6 |
| Neuropatía periférica | 3 | 6 |
| Mononeuritis múltiple | 3 | 9 |
Las puntuaciones de manifestaciones persistentes pueden oscilar entre 0 y 33 y las de manifestaciones nuevas o con empeoramiento pueden oscilar entre 0 y 63.
El FFS fue desarrollado en 199650 por el Grupo Francés de Estudio de Vasculitis (FVSG) para predecir la supervivencia en pacientes afectos de poliarteritis nodosa (PAN), el síndrome de Churg-Strauss o GEPA y la PAM, a partir de parámetros biológicos y clínicos presentes en el momento del diagnóstico, con independencia del tratamiento instaurado, las recaídas u otros eventos durante el curso evolutivo. El FFS 1996 incluía cinco factores pronósticos: proteinuria>1g; insuficiencia renal (pico de creatinina 1,40 nmol/L), afectación intestinal, afectación miocárdica y afectación del sistema nervioso central, cada uno de ellos valorados con 1 punto. Para un FFS=0, 1 y≥ 2, la mortalidad a los cinco años fue del 12%, 26% y 46% respectivamente. El FFS 1996 se ha utilizado para estratificar la intensidad del tratamiento en pacientes afectos de GEPA, recomendándose un tratamiento de alta intensidad en pacientes con un FFS 1996≥ 1.
En 2011 se publicó una nueva versión revisada del FFS (FFS 2009) que incluyó además pacientes con GPA51. El FFS 2009 incluye cuatro factores relacionados con mal pronóstico (edad≥ 65 años, afectación miocárdica, afectación gastrointestinal, insuficiencia renal con creatinina pico de 1,50 nmol/L), cada uno valorado con 1 punto, y uno relacionado con buen pronóstico (afectación ORL), cuya ausencia puntúa 1 punto. Para un FFS=0, 1 y≥2, la mortalidad a los cinco años fue del 9%, 21% y 40% respectivamente.
Marcadores pronósticosRecomendaciones- •
No se recomienda el uso rutinario de los biomarcadores emergentes (linfocitos B, complemento, MCP-1, CD125, etc.) en la práctica clínica habitual (GA: 100%).
Aunque en los últimos años ha habido un avance en el número y precisión de los biomarcadores, el valor pronóstico de alguno de los descritos carece de evidencia científica suficiente como para ser recomendado en la práctica clínica habitual en cuanto a pronóstico o actitud terapéutica.
El valor diagnóstico de los ANCA está bien establecido, pero se discuten como factor predictivo de recaídas. Se ha intentado correlacionar las variaciones en el título de ANCA como factor predictivo de respuesta o recaída, sin evidencia suficiente como para ser utilizado para reiniciar tratamiento de inducción40. Otros anticuerpos como los anti-LAMP-2 se coexpresan contra MPO o PR3 en algunos casos de VAA y en GNRP ANCA negativas, pero los métodos de detección no han sido estandarizados. Otros anticuerpos contra antígenos como moesina, plasminógeno o pentraxina-3, que se identifican en algunos subgrupos de pacientes con VAA, no han sido validados como marcadores pronósticos en VAA52.
El uso de los linfocitos B o factores activadores de linfocitos B como B cell-activating factor (BAFF) o proliferation inducing ligand (APRIL) como biomarcador de actividad o pronóstico es limitado. Algunos subgrupos de linfocitos B (Breg), o el total de linfocitos B o células plasmáticas también se han relacionado con la actividad y los niveles de ANCA53,54. Los subgrupos de linfocitos T involucrados en la patogénesis de las VAA se han descrito en numerosos trabajos como potenciales biomarcadores por su interacción con los linfocitos B. En el futuro, se definirá el papel como marcadores de actividad o recidiva40 de diferentes subgrupos de linfocitos B y T, así como de la interacción entre ellos.
El nivel de C3 en el momento del diagnóstico se ha asociado con una mayor gravedad y menor supervivencia renal, al igual que el depósito de C3d y properdina en el tejido renal55. También se han relacionado C3a, C5a o C5b-C9 con la actividad en VAA43, aunque no pueden recomendarse como marcadores validados.
Algunos marcadores como el mediador de la inflamación CXCL13 (BCA-1), la metaloproteinasa de matriz 3 (MMP-3) y el factor inhibidor de metaloproteinasa 1 (TIMP-1) han demostrado discriminar entre VAA activas e inactivas incluso mejor que VSG o PCR, en la cohorte de 137 pacientes del estudio Rituximab versus Cyclophosphamide for ANCA-associated Vasculitis (RAVE)56, pero carecen de solidez como marcadores estandarizados.
Entre los biomarcadores urinarios cabe destacar MCP-1, que se encuentra aumentado en orina en pacientes con VAA y afectación renal y se ha correlacionado con actividad de la enfermedad medida mediante el BVAS57. El CD-163 soluble urinario, liberado por monocitos y macrófagos, también se ha correlacionado con actividad en VAA comparado con VAA en remisión58; incluso se ha descrito su valor en la detección de recaídas combinado con la determinación de CD125 soluble urinario, liberado por linfocitos T activados59. En cualquier caso, son marcadores con poca experiencia clínica que requieren de más estudios de validación.
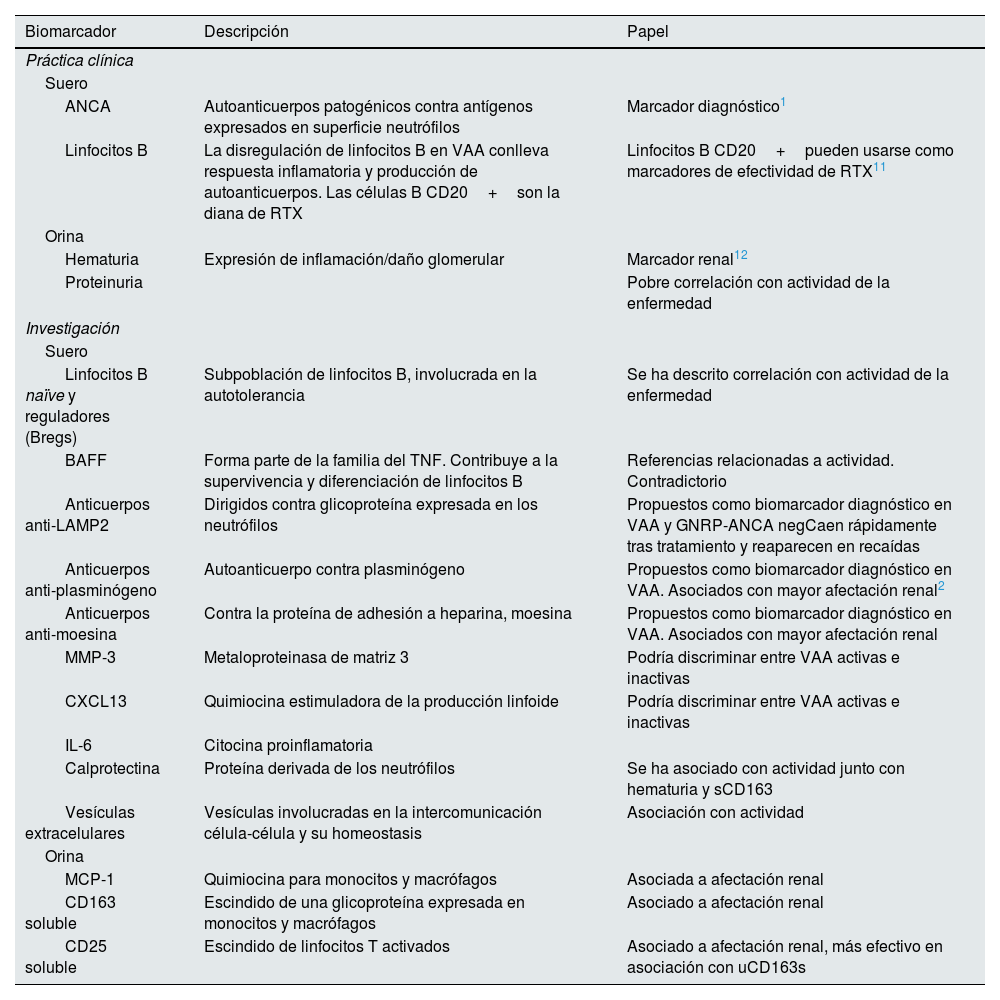
La tabla 440,52 incluye los principales biomarcadores, tanto en la práctica clínica como en investigación sobre VAA.
Biomarcadores en la práctica clínica e investigación en las vasculitis ANCA40,52
| Biomarcador | Descripción | Papel |
|---|---|---|
| Práctica clínica | ||
| Suero | ||
| ANCA | Autoanticuerpos patogénicos contra antígenos expresados en superficie neutrófilos | Marcador diagnóstico1 |
| Linfocitos B | La disregulación de linfocitos B en VAA conlleva respuesta inflamatoria y producción de autoanticuerpos. Las células B CD20+son la diana de RTX | Linfocitos B CD20+pueden usarse como marcadores de efectividad de RTX11 |
| Orina | ||
| Hematuria | Expresión de inflamación/daño glomerular | Marcador renal12 |
| Proteinuria | Pobre correlación con actividad de la enfermedad | |
| Investigación | ||
| Suero | ||
| Linfocitos B naïve y reguladores (Bregs) | Subpoblación de linfocitos B, involucrada en la autotolerancia | Se ha descrito correlación con actividad de la enfermedad |
| BAFF | Forma parte de la familia del TNF. Contribuye a la supervivencia y diferenciación de linfocitos B | Referencias relacionadas a actividad. Contradictorio |
| Anticuerpos anti-LAMP2 | Dirigidos contra glicoproteína expresada en los neutrófilos | Propuestos como biomarcador diagnóstico en VAA y GNRP-ANCA negCaen rápidamente tras tratamiento y reaparecen en recaídas |
| Anticuerpos anti-plasminógeno | Autoanticuerpo contra plasminógeno | Propuestos como biomarcador diagnóstico en VAA. Asociados con mayor afectación renal2 |
| Anticuerpos anti-moesina | Contra la proteína de adhesión a heparina, moesina | Propuestos como biomarcador diagnóstico en VAA. Asociados con mayor afectación renal |
| MMP-3 | Metaloproteinasa de matriz 3 | Podría discriminar entre VAA activas e inactivas |
| CXCL13 | Quimiocina estimuladora de la producción linfoide | Podría discriminar entre VAA activas e inactivas |
| IL-6 | Citocina proinflamatoria | |
| Calprotectina | Proteína derivada de los neutrófilos | Se ha asociado con actividad junto con hematuria y sCD163 |
| Vesículas extracelulares | Vesículas involucradas en la intercomunicación célula-célula y su homeostasis | Asociación con actividad |
| Orina | ||
| MCP-1 | Quimiocina para monocitos y macrófagos | Asociada a afectación renal |
| CD163 soluble | Escindido de una glicoproteína expresada en monocitos y macrófagos | Asociado a afectación renal |
| CD25 soluble | Escindido de linfocitos T activados | Asociado a afectación renal, más efectivo en asociación con uCD163s |
ANCA: anticuerpos anticitoplasma de neutrófilo; VAA: vasculitis asociada a ANCA; RTX: rituximab; TNF: factor de necrosis tumoral; LAMP-2: proteína 2 de membrana asociada a lisosomas; GNRP: glomerulonefritis rápidamente progresiva; MCP-1: proteína quimioatrayente de monocitos -1.
- •
Realizar una evaluación sistemática y estructurada de la situación de actividad y el daño de la enfermedad, mediante índices como el BVAS y el Vasculitis Damage Index (VDI) (GA: 100%).
- •
Considerar como buena respuesta terapéutica una reducción del 50% del BVAS o BVAS/WG después de seis semanas de tratamiento, en ausencia de nuevas manifestaciones (GA: 100%).
Según las recomendaciones de la EULAR6,60, el ACR/VF61 y las guías KDIGO62, se debe realizar una evaluación clínica estructurada y multisistémica a todos los pacientes con VAA. Esta evaluación puede ser facilitada por el uso de índices de actividad y daño orgánico. El BVAS y el BVAS/WG permiten medir, de forma estandarizada, el grado de actividad de la enfermedad y proporcionan información pronóstica49,63. Además, el índice de daño VDI, ayuda a distinguir el daño de la enfermedad activa y evita tratamientos innecesarios6.
Para establecer el grado de afectación sistémica y su potencial valor pronóstico, se utiliza el FFS64. Se ha demostrado que hay una fuerte correlación entre BVAS (tabla 3)49 y FFS en las VAA65.
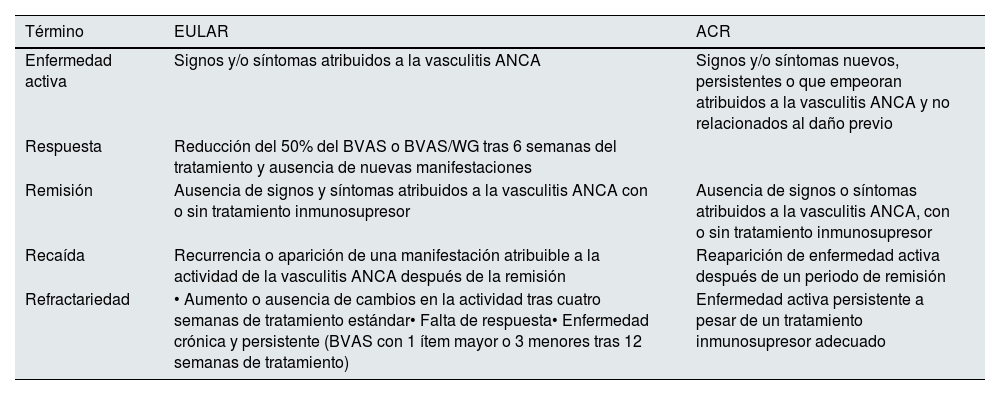
Todos estos índices han demostrado una elevada correlación y fiabilidad66, por lo que se han utilizado en la mayoría de los estudios observacionales y ensayos clínicos en VAA. Según la definición propuesta por la EULAR6,60, se considera que hay respuesta al tratamiento cuando se produce una reducción del 50% del BVAS o BVAS/WG tras seis semanas de tratamiento, junto con la ausencia de nuevas manifestaciones. En cambio, las guías ACR 202161 no especifican el concepto de respuesta, sino que simplifican el término y lo definen como «falta de respuesta o refractariedad a la enfermedad activa persistente, a pesar de un tratamiento inmunosupresor adecuado». Las definiciones de la EULAR y el ACR para los estados de enfermedad se describen en tabla 56,61.
Definiciones EULAR y ACR para los estados de enfermedad en las vasculitis ANCA6,61
| Término | EULAR | ACR |
|---|---|---|
| Enfermedad activa | Signos y/o síntomas atribuidos a la vasculitis ANCA | Signos y/o síntomas nuevos, persistentes o que empeoran atribuidos a la vasculitis ANCA y no relacionados al daño previo |
| Respuesta | Reducción del 50% del BVAS o BVAS/WG tras 6 semanas del tratamiento y ausencia de nuevas manifestaciones | |
| Remisión | Ausencia de signos y síntomas atribuidos a la vasculitis ANCA con o sin tratamiento inmunosupresor | Ausencia de signos o síntomas atribuidos a la vasculitis ANCA, con o sin tratamiento inmunosupresor |
| Recaída | Recurrencia o aparición de una manifestación atribuible a la actividad de la vasculitis ANCA después de la remisión | Reaparición de enfermedad activa después de un periodo de remisión |
| Refractariedad | • Aumento o ausencia de cambios en la actividad tras cuatro semanas de tratamiento estándar• Falta de respuesta• Enfermedad crónica y persistente (BVAS con 1 ítem mayor o 3 menores tras 12 semanas de tratamiento) | Enfermedad activa persistente a pesar de un tratamiento inmunosupresor adecuado |
EULAR: European Alliance of Associations for Rheumatology; ACR: American College of Rheumatology; BVAS: Birminghan Vasculitis Activity Score.
- •
Se recomienda realizar una evaluación periódica de la actividad de la enfermedad en pacientes con VAA debido al riesgo de recaída (GA: 100%).
- •
Considerar como recaída la reaparición de signos o síntomas de vasculitis activa en cualquier sistema corporal después de haber alcanzado la remisión. La positivización de los ANCA, de forma aislada, no debe considerarse criterio de recaída (GA: 100%).
- •
En pacientes con VAA que experimenten una recaída, se recomienda comprobar que las manifestaciones sospechosas sean atribuibles a la vasculitis y excluir otras causas como daño orgánico, infección o malignidad (GA: 100%).
Los pacientes con VAA requieren de un seguimiento estrecho y un control de la enfermedad, incluso después de alcanzar la remisión o el control de la actividad de la enfermedad, debido al alto riesgo de recaída. La mayoría de las formas de VAA pueden recaer. Las recaídas pueden suponer la recurrencia de la enfermedad activa o la aparición de nuevas manifestaciones67,68, y pueden ocurrir años después de la presentación inicial o tras remisión prolongada69. Las tasas de recaída varían mucho de un estudio a otro, oscilando entre el 10% y el 60%67,70. Este amplio rango puede deberse a: diferencias en el tratamiento de inducción o mantenimiento, proporción de pacientes con distintos serotipos ANCA, duración del seguimiento, así como criterios utilizados para definir la recaída. Las recidivas son más frecuentes en las vasculitis PR3 (25-80%) que en la MPO (8-18%)71,72.
Por lo tanto, la evaluación de estos pacientes durante el seguimiento debe incluir procedimientos dirigidos a comprobar el adecuado funcionamiento de órganos vitales, como la presión arterial o la función renal. Además, para controlar la enfermedad a lo largo del seguimiento se pueden emplear índices de actividad como el BVAS y el BVAS/WG.
La recaída de la vasculitis se define como la recurrencia o aparición de signos o síntomas de vasculitis activa en cualquier órgano después de alcanzar la remisión, siempre que estas manifestaciones sean atribuibles a la vasculitis y no a otras causas60,69. No hay consenso entre las diferentes sociedades científicas en la definición de recaída o recidiva; las guías EULAR de 2023 la definen como la reaparición de actividad tras un tiempo de remisión6 y las guías ACR como recurrencia tras un periodo de inactividad61. El diagnóstico de recaída puede ser complejo, ya que deben excluirse otros diagnósticos que pueden originar síntomas similares. Las consecuencias del daño crónico, las infecciones, la aparición de lesiones malignas o un nuevo tipo de glomerulonefritis deben incluirse en el diagnóstico diferencial73. Se han identificado diferentes factores de riesgo de recaída en las vasculitis (tabla 6).
Factores de riesgo de recaída de vasculitis
| Factores de riesgo |
|---|
| • Seropositividad para PR3-ANCA• Historia previa de enfermedad recidivante• Afectación pulmonar antes de la remisión• Afectación de las vías respiratorias superiores antes de la remisión• Persistencia de títulos elevados de ANCA, en particular PR3-ANCA, y aumento de los títulos de ANCA |
ANCA: anticuerpos anticitoplasma de neutrófilo; PR3: proteinasa 3.
Las recaídas pueden clasificarse como graves o leves, según la repercusión en órganos vitales o el compromiso vital. Pueden ocurrir en distintas situaciones: recaída durante el tratamiento de mantenimiento, después de haber completado el tratamiento de mantenimiento o pacientes con recaídas múltiples. Según cada caso se podrán aplicar diferentes opciones terapéuticas e individualizando el tratamiento3.
La mayoría de las recaídas de las GPA o de las PAM se producen en los primeros 12-18 meses tras el cese del tratamiento inmunosupresor74, aunque pueden aparecer hasta más de 10 años después de la presentación inicial. En su mayoría se pueden detectar precozmente y son limitadas en pacientes con seguimiento cercano y que hayan sido educados sobre su enfermedad68. Durante cada visita médica se deben determinar los biomarcadores clínicos y analíticos que se muestran en la tabla 775,76.
Monitorización en cada visita médica del paciente con VAA75,76
| Evaluaciones durante la monitorización de las VAA |
|---|
| • Valoración y evaluación de signos o síntomas de enfermedad activa• Análisis bioquímico que incluya la determinación de función renal, proteinuria, sedimento urinario y transaminasas• Hemograma• Marcadores de inflamación (PCR)• Marcadores serológicos (ANCA, PR3 y MPO) |
ANCA: anticuerpos anticitoplasma de neutrófilo; VAA: vasculitis asociada a ANCA; PCR: proteína C reactiva; PR3: proteinasa 3; MPO: mieloperoxidasa.
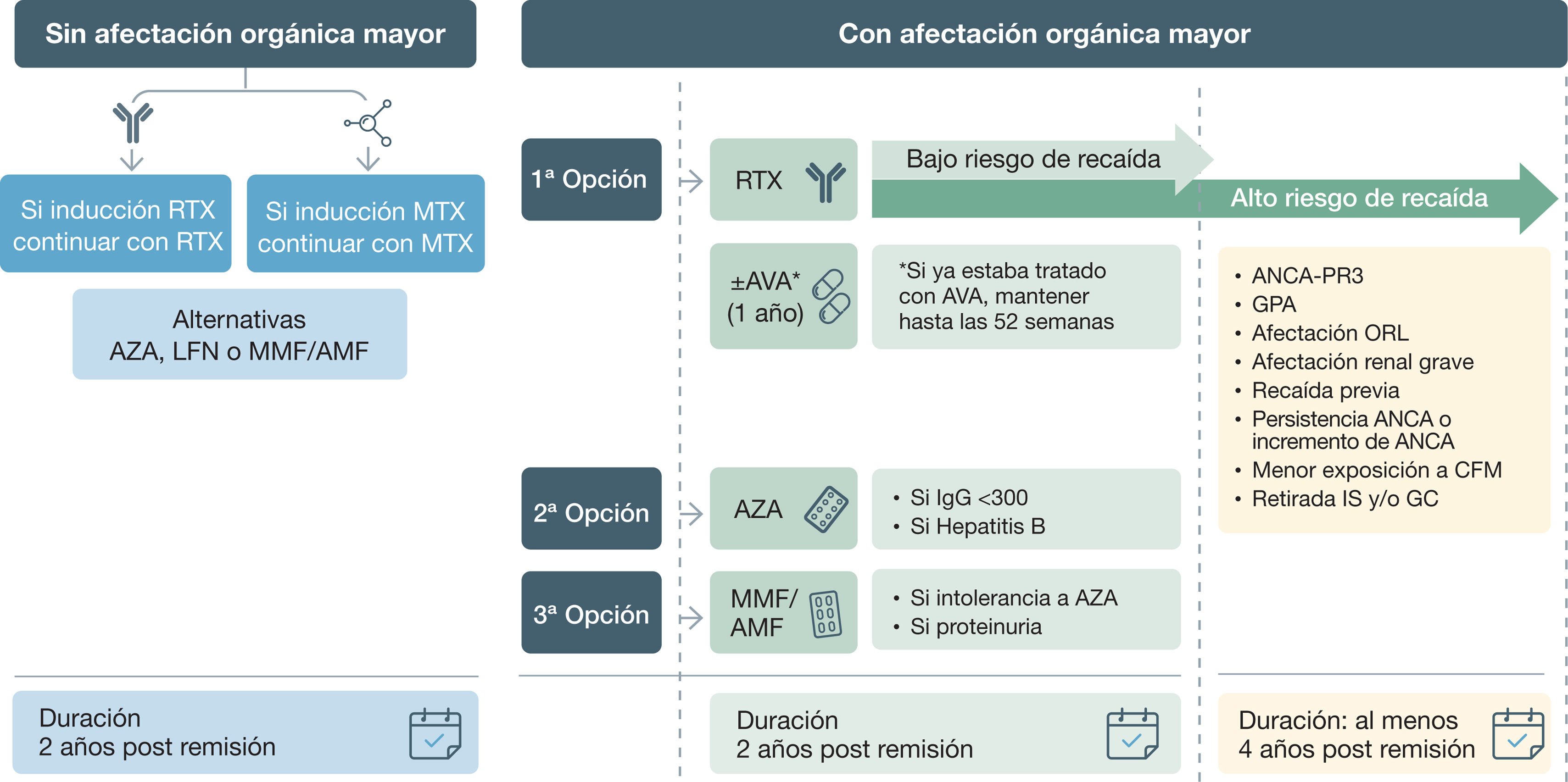
- •
Una vez alcanzada la remisión, se recomienda que la duración del tratamiento de mantenimiento sea de al menos 24 meses (GA: 100%).
- •
En pacientes con recaídas frecuentes, con elevado riesgo de recaída o daño orgánico grave, se debe considerar prolongar el tratamiento de mantenimiento (tres a cinco años), de acuerdo con las preferencias del paciente y el riesgo asociado a la inmunosupresión (GA: 100%).
La duración del tratamiento de inducción en las VAA oscila entre los tres y seis meses, según la forma de presentación de la enfermedad, el tratamiento instaurado y la respuesta al mismo6,77,78. Una vez alcanzada la remisión, se aconseja iniciar tratamiento de mantenimiento durante al menos 24 meses para prevenir recaídas60,78,79. Pasado este periodo, la duración del tratamiento debe individualizarse en función de las características del paciente, el tipo de ANCA (PR3 o MPO), la persistencia de ANCA, la historia de recaídas previas, los órganos afectos y su gravedad, así como las preferencias del paciente6,77.
El ensayo Randomised trial of prolonged remission-maintenance therapy in systemic vasculitis (REMAIN) demostró que la prolongación del tratamiento de remisión con AZA 24 meses adicionales (hasta completar 48 meses) en pacientes con GPA o PAM reduce el porcentaje de recaídas80. Asimismo, el ensayo MAINtenance of Remission Using RITuximab in Systemic ANCA-associated Vasculitis (MAINRITSAN-3) demostró que, en pacientes afectos de GPA o PAM, la prolongación del tratamiento con RTX dos años más, hasta completar cuatro años, disminuye las recaídas sin mayor número de EA81. No obstante, prolongar el tratamiento en todos los pacientes con GPA o MPA es cuestionable, dado que el 75% de los pacientes tratados con RTX durante dos años se hallan libres de enfermedad2. Tampoco existe suficiente evidencia para recomendar prolongar el tratamiento de mantenimiento en función de la persistencia de ANCA6.
En la GEPA no existen tantos estudios como en la GPA y PAM que comparen la duración del tratamiento. Se aconseja que el tratamiento de inducción dure entre tres y seis meses77, y el tratamiento de mantenimiento entre 18 y 24 meses60.
En las últimas recomendaciones del EULAR6 y KDIGO82 se aconseja una duración del tratamiento de mantenimiento en pacientes con GPA o PAM de 24-48 meses una vez alcanzada la remisión.
En pacientes con recaídas frecuentes o con elevado riesgo de recaída, se debe considerar su prolongación de acuerdo con las preferencias del paciente y el riesgo asociado a la inmunosupresión. No existe una recomendación especifica relativa a la duración del tratamiento de mantenimiento en la GEPA.
Daño orgánico, calidad de vida y su mediciónRecomendaciones- •
Se recomienda medir periódicamente el daño orgánico usando una escala estandarizada como el VDI (GA: 100%).
- •
La reducción de riesgo de daño orgánico es un objetivo terapéutico a tener en cuenta en todo paciente con VAA para mejorar su calidad de vida y pronóstico (GA: 100%).
Los pacientes con VAA deberían tener acceso a especialistas médicos con experiencia en esta entidad, idealmente en un contexto multidisciplinar. Una visión holística de la enfermedad mejora la supervivencia y calidad de vida de estos pacientes. La evaluación de la enfermedad debe contemplar los siguientes dominios: la actividad, el daño orgánico, el pronóstico y la calidad de vida49,83.
Para evaluar el daño orgánico crónico producido, tanto por la actividad de la enfermedad como el derivado de la toxicidad de los fármacos inmunosupresores (dosis acumulada de GC), se utiliza el índice VDI, que permite predecir mortalidad6,51.
El deterioro de la calidad de vida resulta de múltiples factores, no sólo de la enfermedad inflamatoria activa, sino también de las secuelas de la enfermedad, que afectan a aspectos psicosociales como la fatiga, la disfuncionalidad y el sistema musculoesquelético84.
La mejora del tratamiento inmunosupresor ha transformado a las vasculitis en una enfermedad crónica y, en consecuencia, las prioridades de los pacientes se han reajustado a esta realidad. En lugar de centrarse en las consecuencias del daño orgánico, los pacientes consideran la fatiga y el dolor crónico como los principales factores de la enfermedad que merman su calidad de vida.
A pesar de los avances de los nuevos fármacos de inducción en las vasculitis, los beneficios en calidad de vida son modestos y rara vez alcanzan la normalidad. Esto puede responder a diferentes razones, como el uso de dosis elevadas de GC, que van acompañadas con mucha frecuencia, de EA. Por ello, los últimos los ensayos clínicos han incorporado el índice de toxicidad de los GC con el objetivo de mejorar su medición, lo cual facilitaría el ahorro de GC reduciendo así el daño orgánico derivado de su uso85. Por otro lado, en los pacientes con vasculitis se han aplicado cuestionarios genéricos de calidad de vida que no recogen aspectos específicos de la vasculitis. En este sentido, disponemos de nuevas herramientas para evaluar con más precisión la calidad de vida de estos pacientes71. El OMERACT Vasculitis Working Group desarrolló el cuestionario ANCA-associated vasculitis patient-reported outcome (AAV-PRO), con 29 ítems que abarca seis dominios (síntomas específicos de órganos, síntomas sistémicos, EA del tratamiento, EA emocionales, preocupaciones sobre el futuro y la función física). Este cuestionario se está usando en ensayos clínicos. Por último, el Patient-Reported Outcomes Measurement Information System (PROMIS) permite medir la fatiga, el estado físico y el papel del dolor en la vida diaria86,87.
Monitorización y control de la actividadRecomendaciones- •
No se recomienda utilizar los títulos de ANCA como único marcador de actividad de la enfermedad (GA: 100%).
- •
Los pacientes deberían ser seguidos mensualmente hasta que alcancen remisión clínica, posteriormente cada uno a tres meses durante el siguiente año, y cada tres a seis meses a partir de entonces (GA: 100%).
Los ANCA tienen un papel fundamental en la fisiopatología de las VAA y no hay duda sobre su valor para establecer el diagnóstico en pacientes con clínica compatible. En la tabla 888 se resumen las indicaciones clínicas que aconsejan la determinación de ANCA de acuerdo con un documento de consenso internacional88. Los ANCA también se han asociado a otras patologías autoinmunes diferentes a las descritas en la tabla (lupus eritematoso sistémico, artritis reumatoide, enfermedad de Crohn, etc.), aunque su interpretación diagnóstica y posible valor pronóstico no están claros, por lo que no se recomienda su solicitud rutinaria89.
Situaciones clínicas en las que se recomienda medir ANCA para establecer el diagnóstico88
| Situaciones clínicas en las que se aconseja medir ANCA |
|---|
| • Glomerulonefritis, especialmente formas rápidamente progresivas• Hemorragia pulmonar• Vasculitis cutáneas asociada a clínica sistémica• Múltiples nódulos pulmonares• Daño crónico y agresivo en las vías respiratorias altas• Otitis/sinusitis de larga evolución• Estenosis traqueal subglótica• Mononeuritis múltiple u otro daño neuropático periférico• Masa retroorbitaria• Escleritis |
ANCA: anticuerpos anticitoplasma de neutrófilo.
Su valor para indicar actividad es controvertido. Está bien establecido que la magnitud del título no se correlaciona con la extensión o la intensidad del daño vasculítico. Por otro lado, se ha hipotetizado sobre la posible utilidad de los ANCA para predecir recaídas. La principal conclusión de un metaanálisis que incluyó estudios que evaluaron el riesgo de recaída en cohortes con vasculitis MPO y PR3 fue que un aumento o niveles persistentemente elevados de ANCA tras alcanzar la remisión clínica es solo un modesto factor predictivo de recaídas futuras90. Un uso pragmático aconsejaría monitorizarlos regularmente y, si aumentan respecto a la situación previa, hacer seguimiento clínico más frecuente en busca de aparición de síntomas/signos de actividad, pero en ningún caso justificaría un cambio en la estrategia terapéutica.
El diagnóstico de recaída siempre debería sustentarse en la aparición de signos o síntomas de vasculitis activa en cualquier órgano. La aparición de microhematuria, especialmente si se acompaña de aumento de creatinina o su persistencia, ha sido reconocida como un signo predictivo de recaídas42,75.
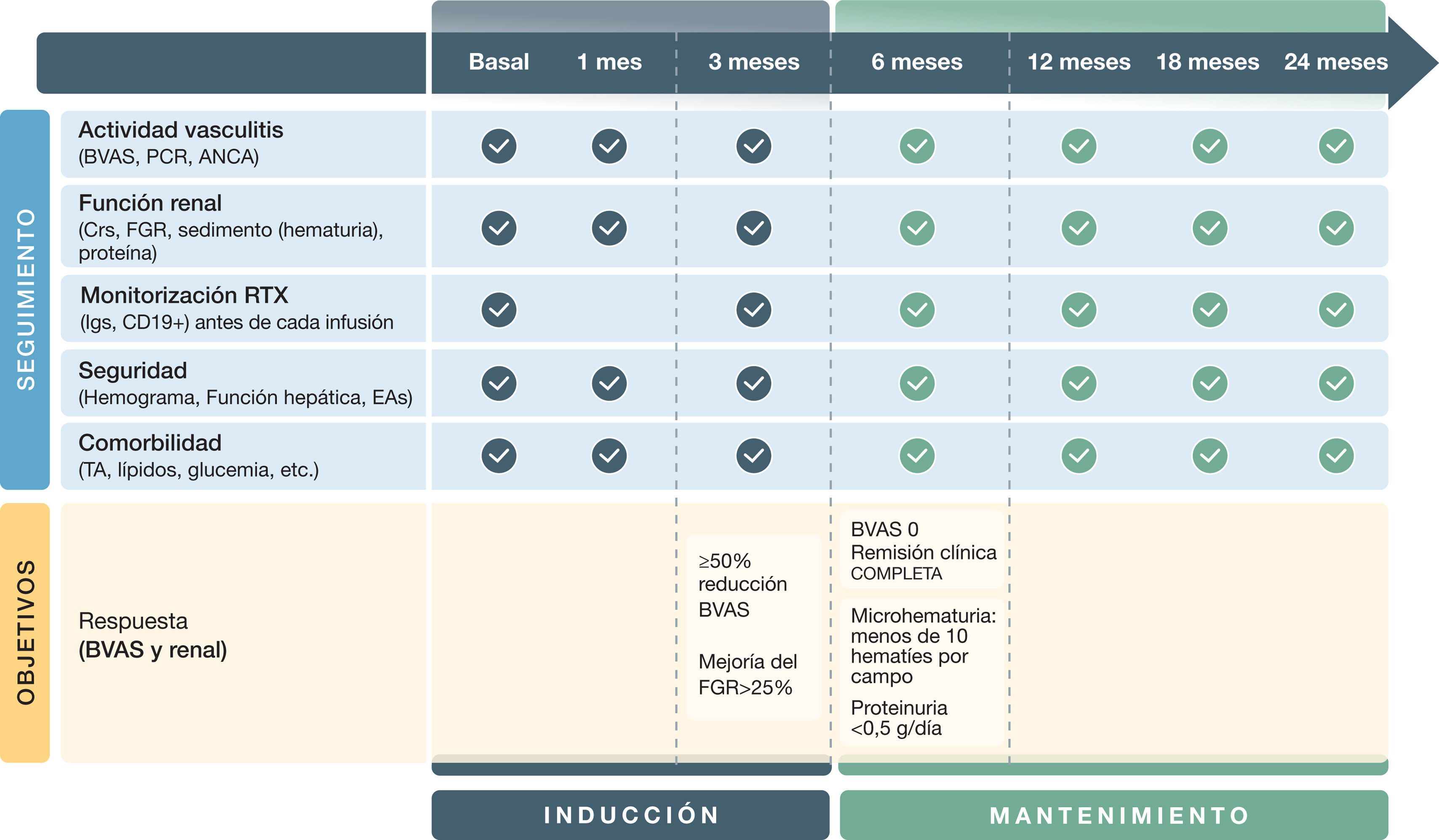
En las visitas de seguimiento se debería realizar un cribado estrecho de los signos o síntomas de actividad, así como un control analítico que incluya función renal, electrolitos, transaminasas, hemograma, cociente proteína/creatinina y estudio del sedimento urinario (fig. 3).
Objetivos y seguimiento de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA) con predominio de afectación renal
PCR: proteína C reactiva; ANCA: anticuerpos anticitoplasma de neutrófilo; BVAS: Birmingham Vasculitis Activity Score; Crs: creatinina sérica; FGR: filtrado glomerular renal; Igs: inmunoglobulinas; RTX: rituximab; EA: efecto adverso; TA: tensión arterial.
- •
En pacientes sin disfunción orgánica grave ni afectación renal, se recomienda valorar el uso de MTX o RTX (GA: 100%).
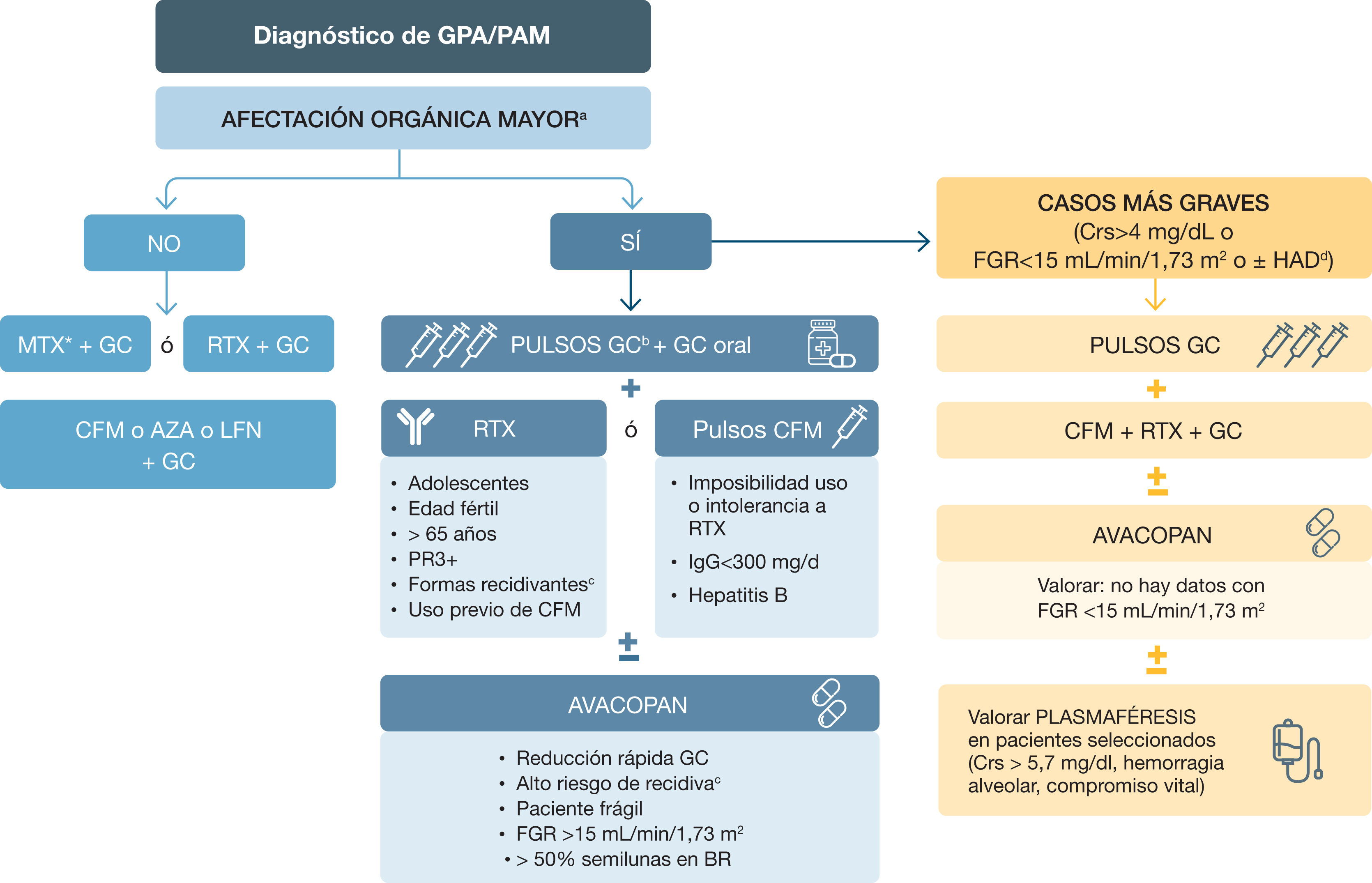
En las formas de GPA limitadas a las vías respiratorias superiores, así como en las formas sistémicas sin afectación de órgano mayor ni compromiso vital, se deberían, en general, utilizar inmunosupresores menos potentes que la CFM en la fase de inducción. En las recomendaciones del ACR 2021, el fármaco de elección en estas situaciones es el MTX acorde al resultado del ensayo clínico aleatorizado Nonrenal Wegener's Granulomatosis Treated Alternatively with Methotrexate (NORAM)91. Sin embargo, en la actualización de 2022 de las guías EULAR6 y KDIGO82 se recomienda también el uso de RTX, aunque se contemplan MTX91 o MMF92 como alternativas (figs. 4 y 5).
Tratamiento de inducción de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA)
GPA: granulomatosis con poliangeítis; PAM: poliangeítis microscópica; MTX: metotrexato; GC: glucocorticoides; RTX: rituximab; PR3: proteinasa 3; CFM: ciclofosfamida; AZA: azatioprina; LFN: leflunomida; Crs: creatinina sérica; FGR: filtrado glomerular renal; BR: biopsia renal; HAD: hemorragia alveolar difusa,
*En función de la gravedad, experiencia de uso y tolerancia del paciente.
a Ver tabla 9- Gravedad de las manifestaciones clínicas, según EULAR 2022; b Pulsos GC: entre 250-500mg x 2-3; c Ver tabla 6 - Factores de riesgo de recaída de vasculitis; d hemorragia alveolar difusa con soporte ventilatorio.
Para inducir la remisión en pacientes con GPA o PAM de inicio reciente o recurrente, con enfermedad que no amenace la vida ni se asocie a daño orgánico grave, se recomienda el tratamiento con una combinación de GC y RTX. El MTX o el MMF se pueden considerar como alternativas6.
Rituximab- •
Se debe priorizar el uso de RTX frente a MTX o MMF en pacientes con GPA y PAM, incluso sin manifestaciones graves, ya que los regímenes de inducción y remisión con RTX se asocian con tasas más altas de remisión sostenida y una menor exposición a GC. La CFM se asocia con complicaciones a largo plazo y debe evitarse como opción de primera línea en vasculitis no graves6.
La eficacia del MTX como tratamiento para inducir la remisión en casos sin afectación de órgano mayor ni compromiso vital se sustenta fundamentalmente en los datos del ensayo aleatorizado controlado (ECA) NORAM91. En este ensayo se compararon la seguridad y la eficacia del tratamiento con MTX 25mg semanal con la pauta clásica de CFM oral en dosis de 2mg/kg, ambos combinados con GC, en 100 pacientes con GPA, la gran mayoría de los cuales (94%) no tenía afectación grave. La tasa de remisión a los seis meses en el grupo MTX fue comparable a la pauta clásica: 89,8% vs. 93,5%. No obstante, la respuesta al MTX fue más lenta en los pacientes con enfermedad más extensa o con afectación pulmonar relevante, alcanzándose la remisión más tarde que con CFM. La tasa de recaída a los 18 meses fue notablemente mayor (69,5% vs. 46,5%) y el tiempo transcurrido desde la remisión hasta la recaída más corto (13 meses vs. 15) con MTX que con CFM91.
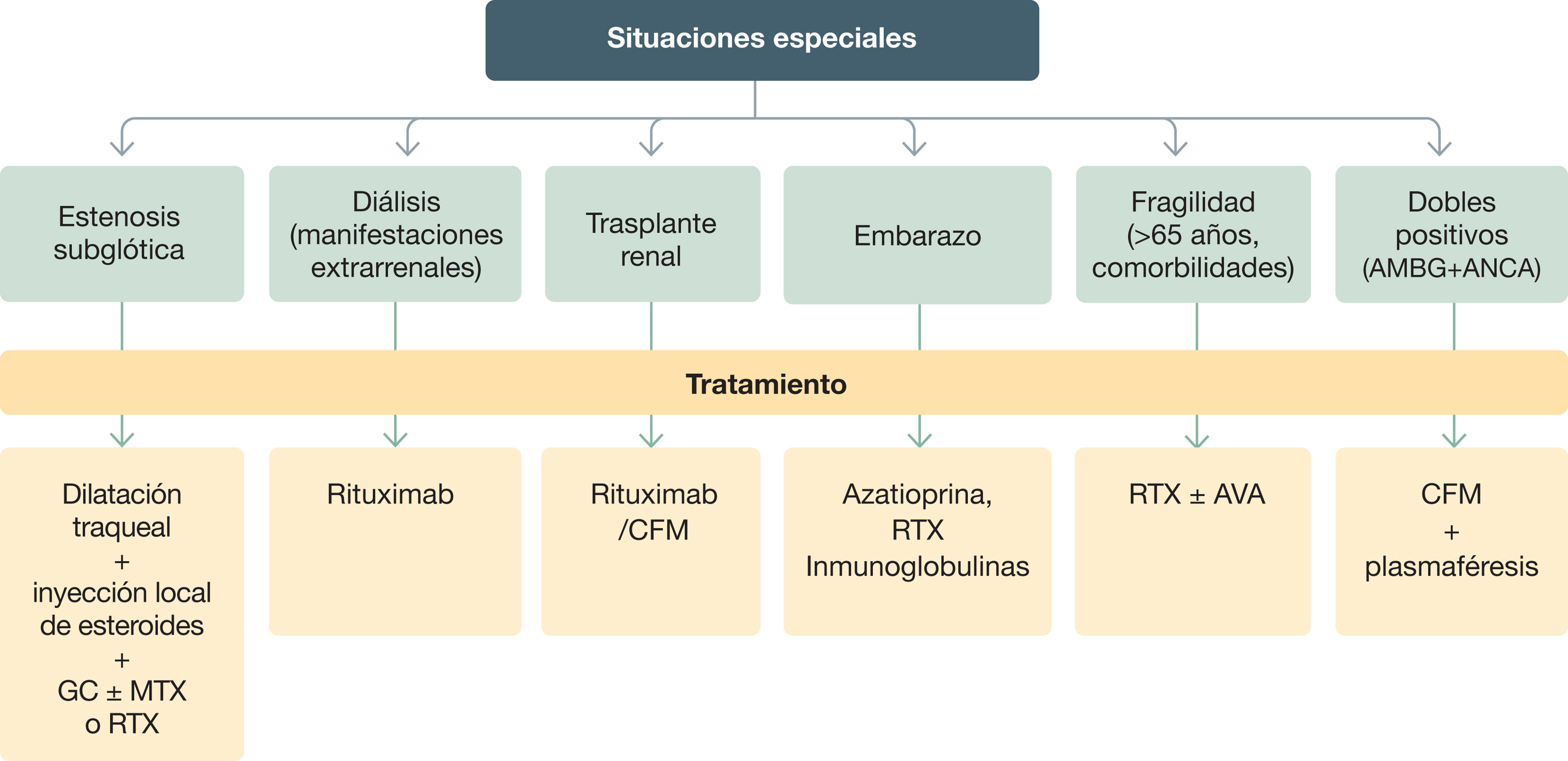
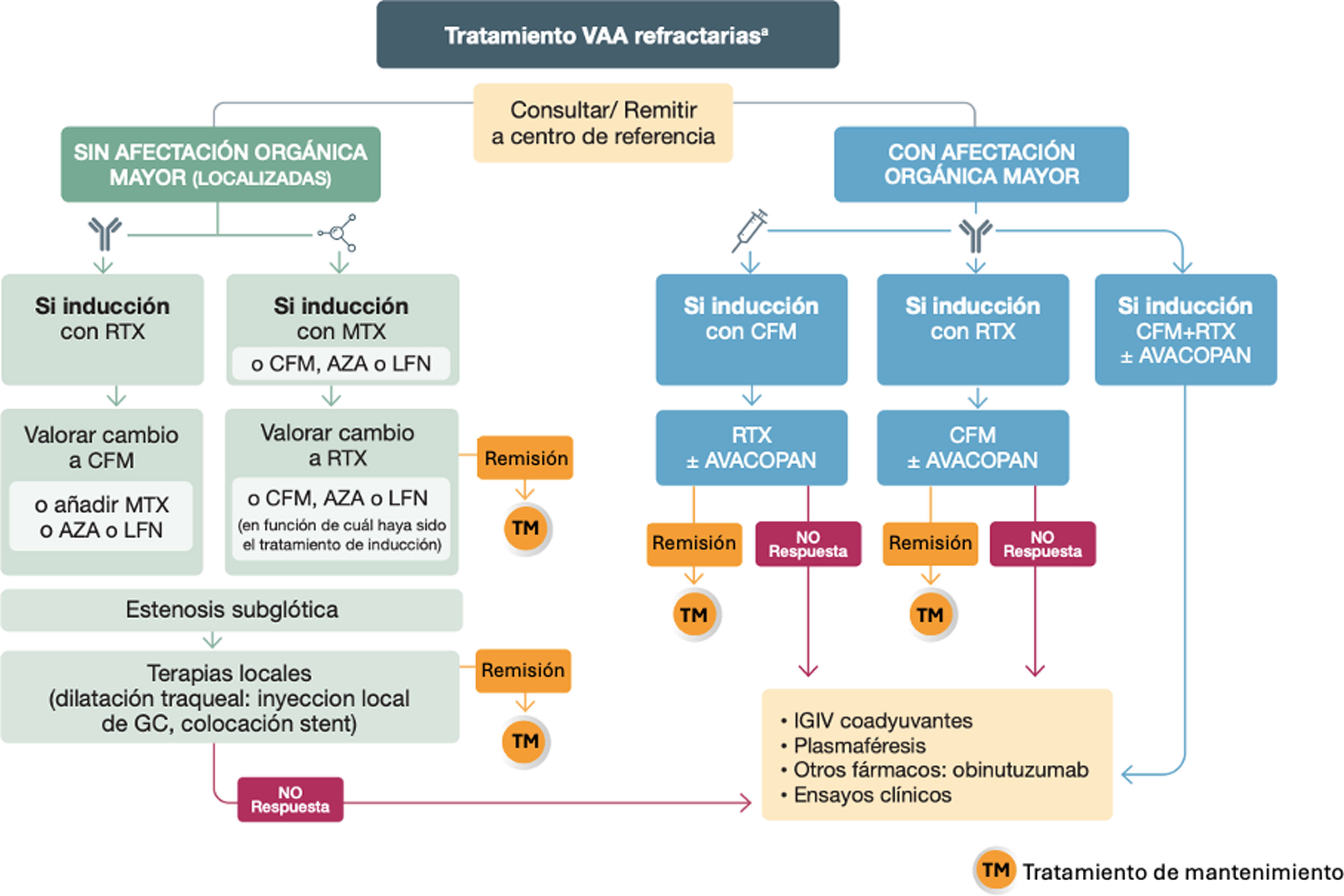
Otros tratamientosTratamiento de las estenosis traqueobronquialesUn 10-20% de los pacientes con GPA presentan estenosis traqueobronquiales (ETB) con riesgo vital93–96. La ETB es una afectación granulomatosa y estenosante que puede aparecer de forma aislada o no, al inicio o durante la evolución de la enfermedad. La más frecuente es la estenosis traqueal subglótica, que suele causar disfonía, tos, disnea, y cuando es severa, estridor. Suele asociarse con otras manifestaciones ORL o con afectación estenótica bronquial, y en el 50% de los casos aparece mientras el paciente está recibiendo tratamiento inmunosupresor por otras causas. Las estenosis bronquiales son menos frecuentes, pueden afectar a bronquios de cualquier tamaño, ser únicas o múltiples, aisladas o asociadas con nódulos pulmonares93–96. Ambas suelen cursar con recaídas frecuentes. La afectación traqueal glótica o supraglótica es más rara y se asocia con riesgo de broncoaspiración por inmovilidad de las cuerdas vocales95–97.
El tratamiento de la ETB es complejo. Usualmente se requiere una combinación de tratamiento médico e intervenciones endoscópicas para mantener el flujo de la vía aérea. Se puede resecar el tejido granulomatoso mediante cirugía o láser; realizar una dilatación mecánica de la estenosis mediante broncoscopio rígido o balones; administrar una inyección local de esteroides o mitomicina C, colocar una prótesis endobronquial o endotraqueal o realizar resección de la zona estenótica traqueal y reanastomosis término-terminal93–98. No existen recomendaciones estandarizadas del procedimiento a seguir.
La dilatación traqueal mecánica es la técnica más utilizada, con buenos resultados93,94,97,99. Suelen ser necesarias dilataciones periódicas por recaídas de la enfermedad y el intervalo entre ellas es más prolongado si se administra tratamiento inmunosupresor (MTX, leflunomida [LFN] o RTX). No obstante, estos tratamientos no suelen indicarse cuando la ETB se presenta de forma aislada. En estos casos, pueden administrarse corticoides orales (0,5mg/kg peso/día) y realizar una dilatación traqueal con infiltración local de esteroides93–97. La administración de RTX reduce el riesgo de recaída95–98,100 (fig. 6).
Tratamiento de inducción de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA). Situaciones especiales
GC: glucocorticoides; MTX: metotrexato; RTX: rituximab; CFM: ciclofosfamida; AVA: avacopan; ANCA: anticuerpos anticitoplasma de neutrófilo; AMBG: anticuerpos antimembrana basal glomerular.
En caso de estenosis traqueal larga (> 1,5cm) y grave (> 70%), se aconseja tratamiento quirúrgico. Cuando existe una estenosis crítica (> 70%) de la luz bronquial y no es posible resecar el tejido granulomatoso y dilatar la zona estenótica, puede colocarse una endoprótesis. Algunos pacientes desarrollan traqueomalacia y precisan una prótesis endotraqueal permanente. En ocasiones es necesario practicar una traqueotomía para asegurar el flujo de la vía aérea.
Otros procedimientos quirúrgicosEn pacientes con colapso del cartílago nasal puede realizarse una reconstrucción mediante implante de cartílago costal. Es importante que la enfermedad se halle en remisión completa durante al menos seis meses, bajo tratamiento inmunosupresor, y en caso de que este se haya suspendido, que hayan transcurrido al menos seis a 12 meses antes de proceder a la intervención101. La reparación de la perforación del tabique nasal solo se recomienda cuando es menor de 2cm y la enfermedad se halla en remisión prolongada, dada su alta tendencia a recaer100,101.
En pacientes con seudotumor orbitario, la descompresión quirúrgica debe considerarse ante un dolor incontrolable, proptosis o compresión del nervio óptico sin respuesta al tratamiento inmunosupresor intensivo101,102.
En pacientes con epífora persistente o dacriocistitis de repetición por afectación del saco lagrimal o del conducto nasolagrimal, puede realizarse una dacriocistostomía quirúrgica o endoscópica101,102. El manejo endoscópico permite de forma simultánea tratar la enfermedad nasosinusal, que habitualmente coexiste y evita el riesgo de aparición de una fístula nasocutánea o de un quiste endonasal, como complicaciones del manejo quirúrgico, por necrosis de la herida101,102.
Tratamiento de inducción con disfunción orgánica graveRecomendaciones- •
Para el tratamiento de inducción de remisión en las formas generalizadas de VAA se recomienda el uso de RTX o CFM, junto con GC. En casos recidivantes, vasculitis PR3 o por razones de seguridad a largo plazo (fertilidad o riesgo oncológico) se priorizará RTX (GA: 100%).
- •
La administración de CFM debería considerarse para inducir remisión en casos graves, situaciones en las que se puede emplear como monoterapia o bien asociada a RTX, evitando superar los 10g de dosis acumulada o más de seis meses de exposición (GA: 100%).
- •
CFM debería usarse preferentemente en forma de pulsos intravenosos (iv), frente a la modalidad oral, asociada a mayor toxicidad (GA: 100%).
- •
Se recomienda administrar de dos a tres pulsos de GC (250-500mg) seguido de una pauta oral (0,5-1mg/kg/peso según gravedad y forma de presentación) y proceder a disminuir la dosis hasta intentar alcanzar los 5mg/día a los cinco meses, siempre que la situación clínica lo permita (GA: 83%).
- •
En pacientes con FG reducido o riesgo elevado de presentar EA asociados a corticoterapia, se puede considerar el uso de avacopan, administrado siempre en combinación con el tratamiento estándar (RTX o CFM) (GA: 83%).
- •
En casos de afectación renal o hemorragia alveolar graves, se recomienda valorar la combinación de RTX y CFM (GA: 100%).
- •
En pacientes con hemorragia alveolar difusa (HAD) grave o insuficiencia renal rápidamente progresiva, se recomienda valorar cuidadosamente la realización de recambio plasmático (GA: 69%).
- •
Los derivados del ácido micofenólico pueden considerarse fármacos alternativos de inducción en pacientes con PAM sin afectación renal grave (GA: 83%).
Debido a sus similitudes clínicas, en la GPA y la PAM se utiliza el mismo esquema de tratamiento. De acuerdo con las recomendaciones para el tratamiento de las VAA elaboradas en el 2022 por la EULAR, la European Renal Association-European Dialysis and Trasplant Association60 (ERA-EDTA) y KDIGO en 2024, el tratamiento se estratifica según la gravedad de la enfermedad (tabla 9) y se divide en una fase de inducción de la remisión y en otra de mantenimiento de la remisión6.
Gravedad de las manifestaciones clínicas, según EULAR 20226
| Potencial riesgo vital o con daño orgánico grave* | Inicialmente sin riesgo vital ni de daño orgánico grave*,a |
|---|---|
| GlomerulonefritisHemorragia alveolar | Enfermedad nasal o paranasal sin lesión ósea, destrucción del cartílago, disfunción olfatoria ni hipoacusia |
| Afectación meníngea | Vasculitis cutánea sin ulceración |
| Lesión del sistema nervioso central | Miositis (músculo esquelético aislado) |
| Enfermedad retro-orbitaria | Nódulos pulmonares no cavitados |
| Enfermedad cardiaca | Epiescleritis |
| Vasculitis intestinal o mesentérica | |
| Mononeuritis múltiple |
De acuerdo con el grupo europeo para el estudio de las vasculitis (EUVAS), se define como enfermedad generalizada la afectación renal con valores de creatinina sérica ≤ 500 mmol/l (5,6mg/dL)103 o de cualquier otro órgano que amenace la vida del paciente.
Para inducir la remisión de la enfermedad pueden utilizarse dos esquemas terapéuticos: CFM más GC o bien, RTX más GC.
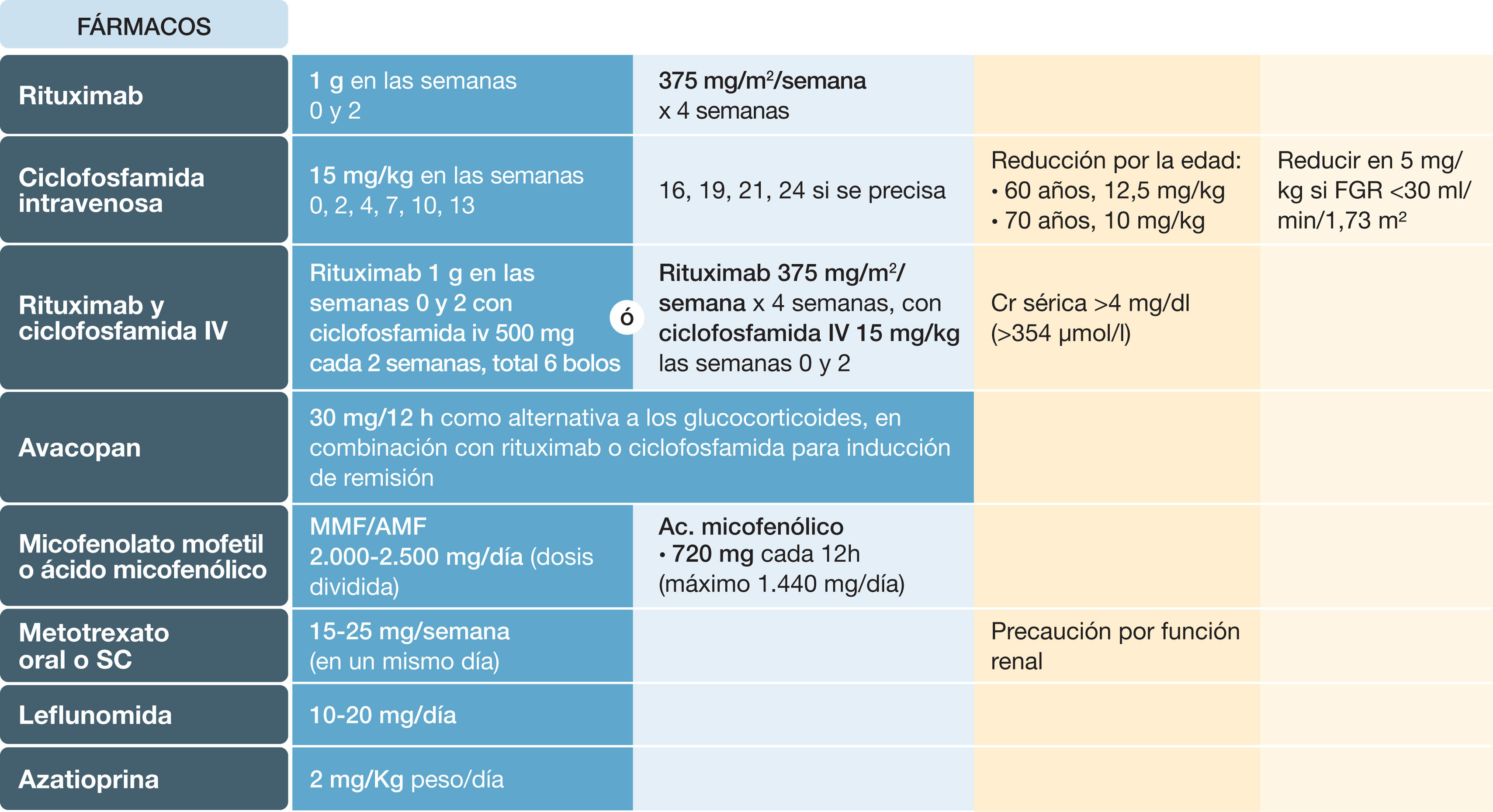
Cuando se utiliza la CFM, es preferible su administración en forma de pulsos mensuales iv, aunque clásicamente se administraba por vía oral en dosis de 2mg/kg/día (en casos graves se administraban 5mg/kg en los primeros tres días de tratamiento y se mantenía un máximo de tres meses tras inducir la remisión). El ensayo controlado aleatorizado Cyclophosphamide Daily Oral versus Pulsed (CYCLOPS) demostró que las tasas de remisión son similares con ambas vías de administración104. Con la CFM oral hubo más EA, pero menores tasas de recaída72.
Los protocolos más utilizados de CFM iv son dos: a) el del grupo francés105, que ajusta la dosis a la superficie corporal administrando tres bolos quincenales de 0,6g/m2 (días 1, 15 y 29) y, posteriormente, pulsos a dosis 0,7g/m2 cada 21 días, hasta un total de seis bolos; y b) el esquema de la Sociedad Británica de Reumatología106 que ajusta la dosis al peso corporal a razón de 15mg/kg (máximo 1.500mg) y también aconseja administrar inicialmente tres pulsos quincenales y, posteriormente cada tres semanas, recomendando también un total de 6. La dosis de CFM se debe ajustar según la creatinina y debe disminuirse un 25% en pacientes mayores de 65 años.
RTX ha demostrado en dos ensayos clínicos aleatorizados (RITUXVAS y RAVE)107,108 ser tan efectivo como la CFM en inducir la remisión de la enfermedad, siendo incluso superior en los casos recidivantes (RAVE)107, con un mejor perfil de seguridad. En las recomendaciones para el tratamiento de las VAA publicadas por ACR/VF en 2021, se priorizaba el uso de RTX sobre la CFM para inducir la remisión61. En cambio, en la actualización de 2022 de las recomendaciones EULAR solo se prioriza el uso de RTX en los casos recidivantes6. Con respecto a la posología, estudios observacionales sugieren que la pauta de 1g de RTX en los días uno y 15 consigue los mismos resultados que la pauta de cuatro infusiones semanales de 375mg/m2109.
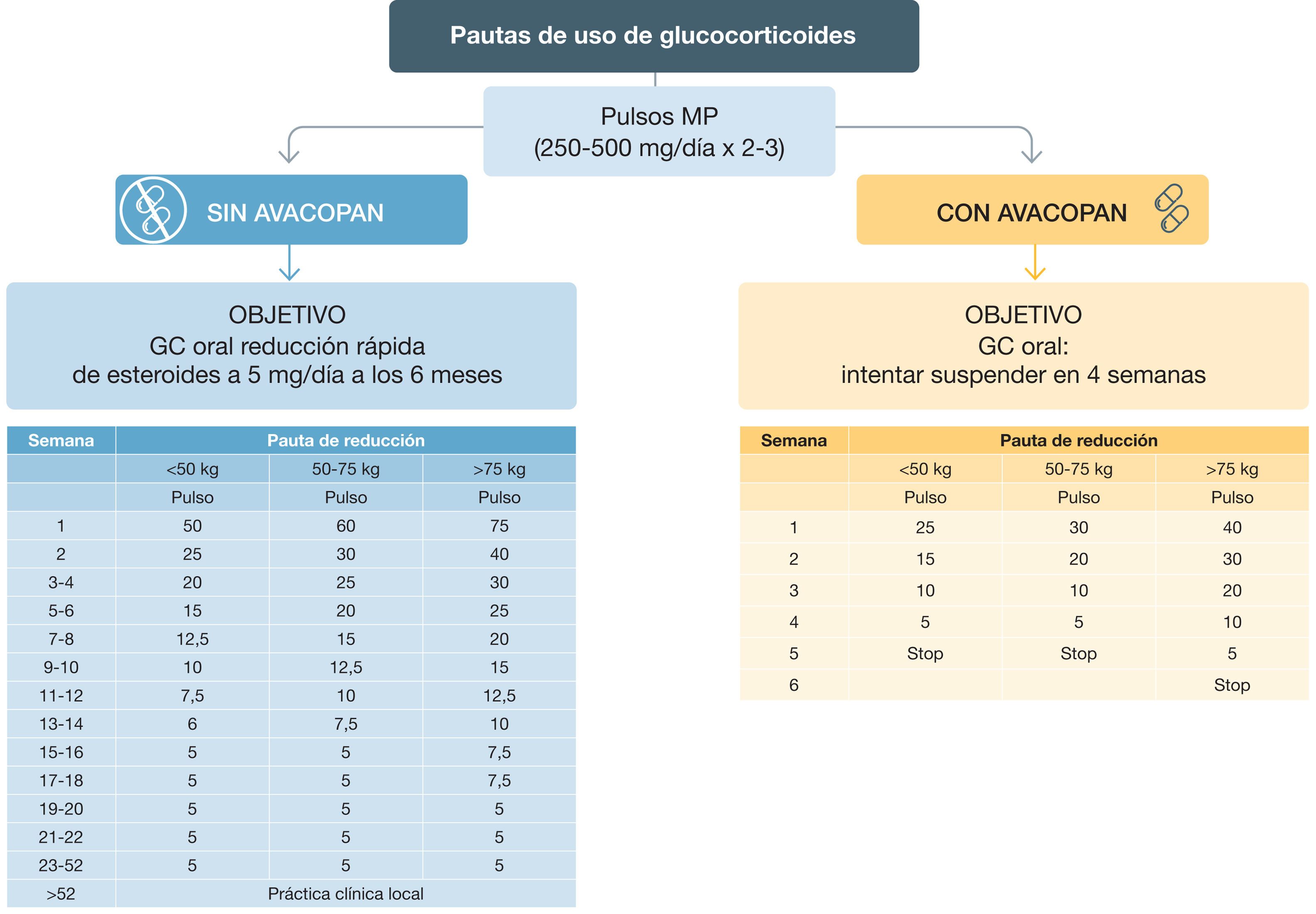
Tanto la CFM como el RTX deben administrarse en combinación con GC. Clásicamente se recomendaban dosis iniciales de 1mg/kg/día de prednisona (PDN) que se reducían progresivamente a partir del primer mes para intentar alcanzar una dosis de 7,5-10mg a los tres a seis meses. Varios ensayos clínicos aleatorizados recientes (Plasma Exchange and Glucocorticoids in Severe Antineutrophil Cytoplasmic Antibody–Associated Vasculitis [PEXIVAS], Low-Dose Glucocorticoid Vasculitis Induction Study [LoVAS] y Rituximab With Azathioprine as Maintenance Therapy in Relapsing ANCA-associated Vasculitis [RITAZAREM])110–112 han demostrado que los regímenes de inducción con dosis reducidas de PDN consiguen la misma eficacia que las dosis altas, con una disminución significativa de las infecciones graves y los EA.
Basándose en esta evidencia, las Recomendaciones ACR/VF ya recomiendan el uso de dosis reducidas de GC para inducir la remisión61. En la actualización de 2022 de las guías EULAR, al igual que en las guías KDIGO, se sigue aconsejando una dosis de PDN de 50 a 75mg/día en la fase de inducción, pero con un descenso rápido, siguendo el protocolo del ensayo clínico aleatorizado PEXIVAS, de manera que, a la semana, la dosis de GC debería reducirse a la mitad, con un descenso progresivo ulterior hasta alcanzar dosis de 5mg/día a los cuatro a cinco meses (fig. 7)6.
Avacopan, un inhibidor oral selectivo del receptor de la fracción C5a del complemento, ha sido aprobado para inducir la remisión en pacientes adultos con GPA o PAM activa y grave administrado siempre en combinación con el tratamiento estándar (RTX o CFM)113. En Estados Unidos no se ha autorizado su uso como alternativa a los GC; en Europa se deja abierta esta posibilidad. La dosis aprobada es de 30mg cada 12 horas por vía oral. Cuando se añade avacopan a la terapia estándar durante 52 semanas, se consigue un mejor control de la actividad de la enfermedad y un marcado efecto ahorrador de GC114 (fig. 4).
Formas muy gravesSe define como enfermedad generalizada grave la afectación renal con valores de creatinina sérica> 500 mmol/L (5,6mg/dL) o la presencia de HAD. La HAD es una emergencia que requiere de un diagnóstico precoz y un tratamiento agresivo. Se refiere a distintas formas de hemorragia que se originan en la microcirculación pulmonar (capilares alveolares, arteriolas y vénulas) y que pueden afectar a diversas áreas del parénquima pulmonar115.
En estas formas generalizadas graves, se valoran dos posibilidades de estrategia terapéutica: 1) bolos de metilprednisolona (500mg o 1g durante tres días) previos al inicio de tratamiento con PDN; y 2) tal y como proponen varios estudios clínicos, combinación de CFM y RTX, con aceptables resultados de eficacia y un buen perfil de seguridad (dos dosis de CFM asociada a cuatro dosis de RTX)116.
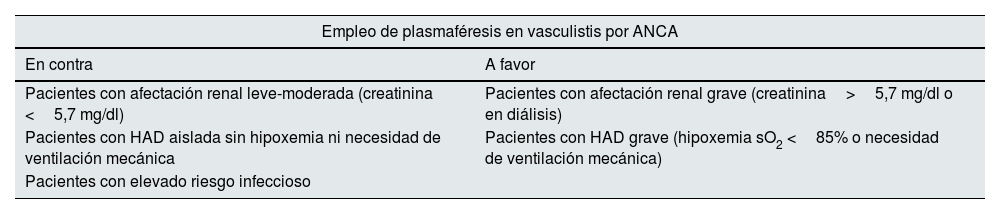
Hasta hace poco se recomendaba la plasmaféresis (siete sesiones en 15 días de acuerdo con los datos del ensayo clínico aleatorizado MEPEX) para evitar o disminuir la progresión a enfermedad renal terminal (ERT). Sin embargo, conforme a la evidencia reciente aportada por el ensayo aleatorizado PEXIVAS110 y varios metaanálisis117, en las recomendaciones ACR/VF 2021 y en la actualización de 2022 de las guías EULAR y guías KDIGO 2024, se desaconseja su uso en los pacientes con hemorragia pulmonar, ya que no aporta ningún beneficio adicional y aumenta el riesgo de infección grave6,61. Tampoco se recomienda su empleo sistemático en todos los pacientes con compromiso renal grave, aunque se deja abierta la posibilidad en el subgrupo de enfermos con mayor riesgo de progresión a ERT (creatinina> 300μmol/L según la última actualización de las guías EULAR), debiéndose individualizar la decisión en cada caso teniendo en cuenta la relación beneficio-riesgo. La plasmaféresis continúa indicada en los pacientes con GPA o MPA que presentan también positividad de anticuerpos anti-MBG (fig. 4).
Se especifica a continuación la evidencia disponible para tratamientos concretos.
RituximabEs una inmunoglobulina (Ig) glicosilada constituida por las regiones constantes de IgG1 humanas y secuencias de la región variable de las cadenas ligeras y pesadas murinas que se une específicamente al antígeno CD20. Los mecanismos posibles de la lisis celular mediada por efector incluyen citotoxicidad dependiente del complemento y citotoxicidad celular dependiente de anticuerpos. Las distintas recomendaciones, especialmente las del ACR, EULAR y KDIGO, suelen consideran de forma conjunta la PAM y la GPA.
Para inducir la remisión en pacientes con GPA o PAM de inicio reciente o recurrente con enfermedad potencialmente mortal o que pueda producir daño grave de órganos, se recomienda el tratamiento con una combinación de GC y RTX o CFM. Se prefiere el RTX en la enfermedad recurrente. El RTX va ganando peso frente a la CFM, principalmente debido a la menor seguridad a largo plazo de esta. La CFM aumenta el riesgo de fallo ovárico prematuro e infertilidad masculina118,119, y se asocia al desarrollo de cáncer de vejiga, así como a insuficiencia de médula ósea, síndrome mielodisplásico, linfoma y otras neoplasias malignas120.
En pacientes con VAA que reciben RTX, se recomienda medir las concentraciones de Ig sérica antes de cada ciclo de RTX para detectar una posible inmunodeficiencia secundaria.
En la actualidad existen cuatro estudios que analizan el uso de RTX para la inducción en las vasculitis (tres ensayos clínicos controlados y aleatorizados y un metaanálisis). En los tres ensayos se utiliza un ciclo de RTX con la pauta de oncología (375mg/m2/semana x cuatro dosis) comparado con CFM. El metaanálisis compara esta pauta de RTX con la de artritis reumatoide (dos dosis de 1g separados dos semanas). El estudio RAVE107 es un estudio de no inferioridad que compara el uso de RTX con CFM (2mg/kg/día vía oral) para inducir la remisión. El tiempo de seguimiento fue de seis meses. Se definió la remisión como una puntuación en BVAS/WG de cero y una disminución exitosa de la PDN a los seis meses. Un 64% de los pacientes tratados con RTX alcanzaron la remisión en comparación con el 53% con CFM (p <0,001), demostrando la no inferioridad de RTX frente a CFM. El estudio RITUXVAS108 incluye 44 pacientes con diagnóstico reciente de una VAA, todos con afectación renal. De ellos 33 fueron tratados con RTX y dos pulsos de CFM iv (15mg/kg) y 11 pacientes con CFM iv durante tres a seis meses. Ambos grupos recibieron la misma pauta de GC (1mg/kg/día inicial, con reducción a 5mg/día a los seis meses). Se definió remisión como una puntuación de BVAS de 0 mantenida durante dos meses, y remisión sostenida si se mantenía al menos seis meses. Tras 12 meses de seguimiento, un 76% de los pacientes tratados con RTX frente al 82% de los tratados con CFM cumplían en objetivo de remisión sostenida. En el estudio RITAZAREM112 hay una fase de inducción de cuatro meses de duración en la que los pacientes recibían RTX según la pauta de oncología. En este estudio se definió la remisión como una puntuación BVAS/WG <1 o una dosis de PDN o equivalente <10mg/día. El 90% de los pacientes alcanzaron la remisión tras cuatro meses de tratamiento. Finalmente, un metaanálisis de estudios observacionales109 comparó la pauta de oncología con la de artritis reumatoide sin encontrar diferencias en eficacia ni en seguridad.
CiclofosfamidaLa CFM, agente alquilante de eficacia incuestionable en VAA, sigue teniendo un papel en la inducción de remisión, reservada para casos graves que comprometen la supervivencia del paciente o de un órgano vital, tal y como se recoge en la reciente actualización de las recomendaciones EULAR6. Dada su elevada toxicidad asociada a la dosis acumulada, en la actualidad no se recomienda en el mantenimiento de remisión.
Su mecanismo de acción no se conoce bien. La CFM tiene un importante efecto sobre el linfocito B y las células plasmáticas. Además, reduce la síntesis de moléculas de adhesión y de citoquinas proinflamatorias, lo cual podría explicar su efecto relativamente rápido en las VAA121.
En un intento de reducir la toxicidad de la CFM manteniendo su eficacia, se han llevado a cabo diferentes estrategias de optimización. Un metaanálisis mostró la superioridad, en términos de EA, de CFM administrada en pulsos frente a la vía oral122, confirmada en el ensayo clínico aleatorizado CYCLOPS104. Aunque algunas recomendaciones, como es el caso de las del ACR/VF, siguen contemplando el uso de CFM oral61, su empleo por esa vía resulta marginal.
Los protocolos vigentes de administración de CFM en pulsos coinciden en tres dosis quincenales de 15mg/kg o bien 600mg/m2, continuando con pulsos cada tres a cuatro semanas hasta alcanzar la remisión (seis meses de exposición como máximo). En total no se viene a acumular más de 8-10g de CFM, dosis considerada segura en términos de riesgo de neoplasia no cutánea123.
Se ha sugerido un ajuste de dosis de los pulsos de CFM en función de la edad y el FG (Tabla S6)60. Pagnoux et al. compararon un régimen de dosis bajas (máximo seis pulsos de 500mg de CFM iv, cada dos a tres semanas, en inducción y mantenimiento con AZA o MTX) frente a dosis de CFM estándar en pacientes ancianos, en un ensayo clínico aleatorizado, sin encontrar diferencias en la tasa de remisión y con una menor incidencia de EA124.
Como consecuencia de los ensayos clínicos aleatorizados que han mostrado no-inferioridad del RTX respecto a la CFM y considerando su mayor seguridad107,108, hemos asistido a una sustitución progresiva de la CFM en favor del RTX6.
En situaciones extremadamente graves, algunos autores proponen, basados en una presunta mayor rapidez de acción, un tratamiento más enérgico, combinando CFM y RTX para inducir la remisión. Esta estrategia se apoya en que RTX no tiene efecto en linfocitos B que no expresan CD20, como los linfocitos B de memoria o las células plasmáticas. Si bien no disponemos de ensayo clínico aleatorizados, estudios retrospectivos no controlados sugieren su utilidad. Se trata en su mayoría de pequeñas series de pacientes con pautas heterogéneas116,125,126. Sin embargo, uno de ellos incluyó 66 pacientes y comparó la combinación con un grupo control histórico, extraído de los ensayos clínicos aleatorizados de EUVAS y ajustado por un propensity score de gravedad. Los pacientes tratados con la combinación tenían menor mortalidad, menor riesgo de progresión a enfermedad renal crónica avanzada y de recidiva, sin eventos relevantes de seguridad127. Sin embargo, la asociación no siempre ha resultado exitosa o segura y provoca un mayor descenso de Ig128. Un ensayo clínico aleatorizado en curso, ENDURRANCE l, tratará de evaluar la presunta superioridad y la seguridad de la asociación sobre cada terapia por separado129.
Los nuevos protocolos de uso de CFM en inducción, con menos tiempo de exposición y una dosis acumulada notoriamente menor, han reducido, pero no eliminado, los riesgos de infección, neoplasia e infertilidad130.
El aumento actual de riesgo de cáncer asociado al uso de CFM parece depender del incremento de cáncer cutáneo no-melanoma, sin un claro aumento del cáncer de vejiga130,131. Sin embargo, en la actualidad se sigue recomendando una vigilancia vesical tras exposición a CFM, sea cual sea el régimen empleado6,132 así como una adecuada fotoprotección, evitando también el tabaquismo131. Otras neoplasias, como las linfoproliferativas, también se han relacionado con el empleo de CFM. En cambio, RTX no se ha asociado con una mayor incidencia de cáncer respecto a la población general120.
En términos de protección de la fertilidad, la opción más segura y con mayor evidencia es el recurso a agonistas de la hormona liberadora de gonadotropina (GnRH) como leuprorelina, evidencia extrapolada de su uso en pacientes con LES133,134.
CorticoidesLos GC continúan siendo, hoy por hoy, esenciales en la terapia de inducción de remisión de las VAA. Son necesarios para reducir de forma rápida la inflamación hasta que actúe el efecto biológico de otros agentes inmunosupresores3,6.
Clásicamente se han utilizado dosis iniciales elevadas, seguidas de un descenso progresivo. Los esquemas terapéuticos más habituales han sido los pulsos iv de metilprednisolona (500-1.000mg/día, tres a cinco días) o PDN oral (1mg/kg peso/día) o su equivalente. En los pacientes con GNRP o HAD se han utilizado más los pulsos de metilprednisolona que la PDN oral de entrada, si bien no existen estudios aleatorizados que comparen ambas pautas3,6. Recientemente, se ha publicado un estudio multicéntrico, observacional, con 114 pacientes de cinco centros de Europa, en el que se observa que la administración de pulsos no tiene mayor beneficio para inducir la remisión y se asocia con mayor riesgo de infecciones y mayor incidencia de diabetes135. En este sentido, las últimas recomendaciones EULAR aconsejan administrar pulsos únicamente en pacientes con afectación renal con un filtrado glomerular renal (FGR) <50mL/min/1,73 m2 o HAD6.
Igualmente, la pauta oral de 1mg/kg peso/día es controvertida, ya que los estudios LoVAS136 y RITAZAREM137 demostraron que tanto en pacientes con VAA de nuevo diagnóstico como en aquellos con recaída, una dosis de 0,5mg/kg/día de GC era suficiente para inducir la remisión. Asimismo, el estudio PEXIVAS110 demostró que el esquema clásico de reducción de GC se podía realizar de forma más rápida, alcanzándose dosis de 20mg/día a las 7 semanas y de 5mg/día a las 19. Esta pauta redujo la dosis total de GC en un 40% durante los primeros seis meses, con lo que descendieron las infecciones graves durante el primer año sin disminuir la eficacia en la obtención de remisión. En las últimas recomendaciones EULAR6, se aconseja la pauta de ajuste y descenso utilizada en este estudio (fig. 7).
El uso de los distintos regímenes de pulsos i.v de metilprednisolona en la fase de inducción queda sujeto a criterio clínico. Dado que su evidencia es solo indirecta a través de estudios como el PEXIVAS o ADVOCATE, los diferentes regímenes deberán ser evaluados en futuros estudios randomizados prospectivos138.
Bloqueantes del complementoEl papel del complemento en las VAA siempre ha sido tema de controversia139; sin embargo, modelos experimentales han demostrado que la activación de los neutrófilos inducida por ANCA daba lugar a la liberación de factores de la vía alternativa del complemento y reducían la actividad de factores reguladores como el factor H, favoreciendo la inflamación leucocitoclástica necrotizante severa característica de la VAA aguda140–143. La activación de la vía alternativa del complemento da lugar a la formación de C5a, una potente anafilotoxina que tras unirse a su receptor (C5aR/CD88), activa a los neutrófilos y al endotelio, aumentando la permeabilidad vascular144,145. Este complejo está implicado en la formación de semilunas. En modelos experimentales con ratones que expresan este receptor, la administración de avacopan (CCX168), una molécula antagonista de C5aR, mejoraba la glomerulonefritis extracapilar necrotizante inducida por anticuerpos anti-MPO, ya que bloquea la migración tisular de neutrófilos de manera dependiente de dosis, reducía la proteinuria, hematuria y leucocituria, y el porcentaje de semilunas140,146,147.
Los resultados positivos en estudios experimentales con avacopan hicieron que se llevasen a cabo ensayos clínicos para demostrar este beneficio. El primero de ellos fue el ensayo en Fase 2 (CLEAR), que analizaba a 67 pacientes con VAA de reciente diagnóstico o recurrente con FGR>20mL/min/m2 (sin GNRP ni HAD con hipoxia), y comparaba el efecto a las 12 semanas de tratamiento con PDN oral 60mg/d frente a avacopan 30mg dos veces al día+PDN 20mg, y avacopan 30mg dos veces al día aislado. En los dos grupos de avacopan se observó una mayor reducción del BVAS y la albuminuria. En el grupo que no recibió PDN los pacientes presentaban mejor calidad de vida y una reducción de los EA asociados a esteroides148. El estudio CLASSIC analizó la seguridad de avacopan en 42 pacientes con VAA de nuevo diagnóstico. No se observaron diferencias en la tasa de EA entre los tres grupos, pero la inmunosupresión estándar más avacopan 30mg fue superior a las otras pautas en inducir remisión precoz, aumentar el FGR y mejorar la calidad de vida149.
El estudio ADVOCATE incluyó a 331 pacientes con VAA de reciente diagnóstico o recurrente y VAA activa grave que requerían inmunosupresión convencional114. El estudio evaluó el efecto de avacopan (30mg/12 horas durante un año) frente a PDN (1mg/kg/d inicial con reducción progresiva hasta retirar al mes 6). El objetivo primario fue la inducción de remisión a la semana 26 (BVAS=0) y mantenerla a las 52 semanas. Avacopan demostró no inferioridad para inducir remisión a las 26 semanas, y superioridad a las 52 semanas, sin presentar más EA. La tasa de recaídas fue inferior en el grupo de avacopan (10 vs 21%). El incremento del FGR fue superior en el grupo de avacopan (7,3 vs. 4mL/min/1,73 m2; p=0,026). Un subanálisis demostró mejores resultados en los pacientes con avacopan tratados con RTX, los MPO ANCA positivos y los recurrentes. Es importante señalar que en los pacientes con un FGR <20mL/min/1,73 m2, avacopan presentó un mayor incremento del FGR respecto al grupo tratado con solo GC (16 vs. 7,7mL/min/1,73 m2)150.
Se han utilizado otros bloqueantes del complemento para el tratamiento de VAA refractarias (eculizumab)151 o están siendo evaluados (vilobelimab), con resultados prometedores152.
PlasmaféresisLa plasmaféresis elimina los ANCA circulantes, que tienen un papel clave en la patogenia de las VAA153. Pese a la reducción de ANCA que se consigue con la plasmaféresis, en pacientes que no presenten deterioro importante de la función renal (Cr>5,7mg/dL) o HAD no se recomienda su uso154. Ello es debido a que la cifra de creatinina en el momento del diagnóstico es uno de los principales factores predictivos de ERT a medio-largo plazo154 y a que los efectos perjudiciales relacionados con el uso de la plasmaféresis (aumento del riesgo de infecciones, problemas relacionados con el catéter, hipocalcemia, etc.), son superiores al beneficio obtenido en pacientes con una buena función renal inicial155,156.
Durante varias décadas se ha utilizado la plasmaféresis para el tratamiento de VAA con afectación renal grave (Cr>5,7mg/dL). El esquema terapéutico más utilizado es de 7 sesiones a lo largo de 14 días. La recomendación se basó en los resultados del ensayo clínico MEPEX, donde se mostraba que, en este tipo de pacientes, la adición de plasmaféresis a la inmunosupresión estándar reducía el riesgo de progresión a ERT en 24% al mes 12 (p<0,03), sin observar diferencias en los EA157. Sin embargo, en un análisis posterior del mismo grupo de pacientes realizado a largo plazo no se observó diferencia en la tasa de ERT ni en la mortalidad entre ambos grupos110. En 2020 se publicó el ensayo PEXIVAS158, donde se comparaba la eficacia de la plasmaféresis asociada a inmunosupresión habitual en más de 700 pacientes con VAA y afectación renal (FGR<50mL/min/1,73 m2) o HAD. No hubo diferencias significativas en alcanzar el objetivo principal compuesto (muerte–ERT) al final del seguimiento entre los dos grupos, en la probabilidad de mantener remisión a largo plazo, y en la tasa de EA graves e infecciones a un año. En los pacientes con afectación renal grave no se observó diferencia significativa en alcanzar la ERT, sin embargo, los amplios intervalos de confianza obtenidos sugieren que el estudio puede no tener potencia suficiente para detectar diferencias entre subgrupos158. Por ello, la recomendación de realizar plasmaféresis en pacientes con afectación renal grave no está clara, y es necesario valorar los beneficios y los riesgos según el tipo de paciente (riesgo más marcado en pacientes de mayor edad y muy inmunodeprimidos, así como en pacientes con peor función renal en el momento del diagnóstico) (tabla 10)2,24,159. La histología puede ayudar en la toma de decisiones, ya que en pacientes que presenten mucho daño crónico en la biopsia renal, la plasmaféresis puede ser más perjudicial que beneficiosa23,24,159.
Recomendación sobre el empleo de plasmaféresis en pacientes con VAA2,24,159
| Empleo de plasmaféresis en vasculistis por ANCA | |
|---|---|
| En contra | A favor |
| Pacientes con afectación renal leve-moderada (creatinina <5,7 mg/dl) | Pacientes con afectación renal grave (creatinina>5,7 mg/dl o en diálisis) |
| Pacientes con HAD aislada sin hipoxemia ni necesidad de ventilación mecánica | Pacientes con HAD grave (hipoxemia sO2 <85% o necesidad de ventilación mecánica) |
| Pacientes con elevado riesgo infeccioso | |
ANCA: anticuerpos anticitoplasma de neutrófilo; HAD: hemorragia alveolar difusa.
En los pacientes con HAD grave (saturación de oxígeno <88%) no se observó beneficio de la plasmaféresis en el ensayo PEXIVAS, pero el número de pacientes incluidos fue muy pequeño (31 vs. 30), y el intervalo de confianza muy amplio (RR 0,67; 0,28-1,64), de nuevo indicando falta de potencia estadística para detectar diferencias entre grupos110. En otro estudio que incluía 73 pacientes de los que 34 requerían ventilación mecánica, la plasmaféresis no redujo la mortalidad, pero el grupo de pacientes que recibió recambio plasmático presentaba signos de mayor gravedad en el momento del diagnóstico160. En las recientes guías KDIGO82 se recomienda que, dada la gravedad de esta afección y la falta de opciones terapéuticas alternativas, se debe evaluar cuidadosamente el beneficio/riesgo de la plasmaféresis161,162.
Derivados del ácido micofenólicoEl ácido micofenólico y sus derivados (MMF y micofenolato sódico) inhiben la proliferación de linfocitos T y B a través de la inhibición de inosin-5 -monofosfato deshidrogenasa, lo cual suprime la respuesta inmunitaria celular y la formación de anticuerpos. Al contrario que la CFM, no se asocian a neoplasia urotelial ni a infertilidad. Ensayos iniciales en fase II y pequeños estudios sugirieron su eficacia para inducir remisión en VAA, sobre todo en ANCA-MPO VAA con afectación renal163,164. Para comprobar esta hipótesis se llevó a cabo el ensayo MYCYC. Este ensayo abierto, aleatorizado, controlado, de no inferioridad compara MMF (2-3g/día) frente a CFM, seguidos por AZA en ambos grupos, para el tratamiento de la VAA en pacientes sin compromiso vital ni afectación renal grave (no formas rápidamente progresivas ni FGR<15). Se analizaron 140 pacientes con VAA de reciente diagnóstico92. MMF fue no inferior a CFM para inducir remisión (67% vs. 61%). Sin embargo, la tasa de recaídas fue superior en el grupo de MMF (33% vs. 19%, p=0,049), sobre todo en pacientes con PR3-ANCA (48 vs. 24%). No hubo diferencias en la tasa de infecciones graves (26% vs. 17%), ni en las de otros EA (incluidas ERT y muerte).
Dos recientes metaanálisis165,166 confirman que la tasa de remisión con MMF es similar a la de CFM, sin disminución en los EA (leucopenia e infecciones) a corto plazo. Analizados los datos con detalle se aprecia mucha heterogeneidad en los pacientes incluidos en los estudios. Se observa una mayor tasa de remisión en los ensayos que incluyen sólo pacientes con afectación renal que en los que hay pacientes con y sin afectación renal (92 vs. 56%)92,163,164,167–171. Los pacientes que responden más a MMF son los MPO-ANCA positivos, con afectación renal leve-moderada y sin afectación de órgano vital.
El ensayo IMPROVE172 comparó en 156 pacientes el tratamiento de mantenimiento en VAA (GPA, PAM) con AZA frente a MMF tras inducción de remisión con GC y CFM. Después de un seguimiento de 39 meses, se observó un aumento de la tasa de recaídas en el grupo de MMF (55% vs. 37,5%, p=0,02). No hubo diferencias en los objetivos secundarios (FGR o incidencia de EA al final del seguimiento), aunque se observó una tendencia a una mayor reducción de proteinuria en el grupo de MMF, que no fue estadísticamente significativa.
Otro estudio retrospectivo con 67 pacientes mayoritariamente MPO (>90%) analizó el mantenimiento con MMF tras inducción con MMF o CFM, y mostró que la tasa de recaídas fue baja (9%), y que en los pacientes tratados inicialmente con CFM hubo más infecciones, presentando neutropenia y neoplasias sólo los pacientes de este grupo173. En una revisión sistemática se observó que las recaídas fueron superiores en los pacientes tratados con MMF (45%) frente a una cohorte previa tratada con CFM (14,5%)165. Un metaanálisis mostró que no hubo diferencias en el mantenimiento de remisión entre MMF y otros tratamientos, pero en los estudios que incluían pacientes con afectación renal, la remisión fue superior con MMF104. Por último, el ensayo IMPROVE, donde AZA se mostró superior a MMF, incluyó a pacientes con y sin afectación renal, lo que ha condicionado el resultado.
No se ha realizado ningún ensayo que compare el mantenimiento de remisión entre MMF y RTX en pacientes con afectación renal.
AzatioprinaLa AZA juega un papel importante en el tratamiento de las VAA. Históricamente, se ha posicionado como el tratamiento preferido para mantener la remisión tras la inducción con CFM (CFM), caracterizándose por su excelente perfil de seguridad y tolerancia, logrando reducir las recaídas a un 14% por año después de la remisión. Se aconseja medir la actividad de la enzima tiopurina metiltransferasa para un mejor ajuste de la dosis, evitando así toxicidades como citopenias, hepatitis, pancreatitis y diarrea. A pesar de que AZA generalmente presenta un buen perfil de seguridad, se ha descrito un aumento del riesgo de neoplasias linfoides y cutáneas6.
En cuanto a la terapia biológica, los estudios MAINRISTAN y RITAZAREM, demostraron la superioridad de RTX vs. AZA en la prevención de recaídas, presentando un perfil de seguridad similar e incluso una menor tasa de mortalidad. El estudio MAINRISTAN evidenció que en pacientes con GPA o PAM de nuevo diagnóstico o con recaídas, RTX era superior a AZA a los 28 meses, manteniendo esta ventaja incluso a los 60 meses (supervivencia libre de recurrencia del 72% vs. 49%), incluso tras haber suspendido el tratamiento con RTX. El estudio RITAZAREM comparó RTX 1.000mg cada cuatro meses durante dos años vs. AZA, y mostró a los 24 meses una mayor eficacia de RTX para prevenir las recurrencias (18% vs. 38%)6,174,175.
Tratamiento de mantenimientoTratamiento de mantenimiento sin disfunción orgánica mayorRecomendaciones- •
RTX o MTX deberían ser considerados como opciones de primera línea para el mantenimiento de la remisión sin afectación orgánica mayor (GA: 100%).
- •
AZA, LFN o los derivados del ácido micofenólico podrían ser de utilidad como fármacos de segunda línea en mantenimiento en formas no graves de VAA (GA: 77%).
La eficacia de MTX para el mantenimiento de la remisión parece similar a la de la AZA. En un ensayo clínico aleatorizado se comparó la eficacia y seguridad de AZA en dosis de 2mg/kg con MTX 25mg/semanales durante 12 meses, en 126 pacientes tras la inducción con CFM y GC176. No hubo diferencias significativas en la tasa de recaídas (36,5% en el grupo tratado con AZA y 33% en el grupo tratado con MTX), pero la frecuencia de EA fue mayor en el grupo MTX (55,5% vs. 46%)176,177. En el caso de formas de afectación ORL de las vasculitis es preferible el uso de MTX.
La eficacia y seguridad de LFN en dosis de 30mg/día para el mantenimiento de la remisión únicamente se ha comparado con MTX en un ensayo clínico aleatorizado realizado en 54 pacientes tras la inducción con CFM y GC. La frecuencia de recaídas fue menor en el grupo tratado con LFN (23% vs. 46,4%) y además se produjeron más recidivas graves en el grupo tratado con MTX, lo cual motivó el cese prematuro del estudio. Sin embargo, la frecuencia de EA fue mayor con LFN. Los malos resultados objetivados con MTX podrían explicarse por la dosis empleada en el estudio (comenzando con 7,5mg semanales, con aumento progresivo de la dosis hasta alcanzar los 20mg a partir de la octava semana)178,179.
La AZA, en comparación con otros inmunosupresores, se considera similar al MTX para el mantenimiento de la remisión, tal y como demostró el estudio WEGENT, y superior a MMF según el estudio IMPROVE, debiéndose utilizar MMF solo en aquellos casos en los que no sea posible usar AZA o MTX172,176.
Tratamiento de mantenimiento con disfunción orgánica mayorRecomendaciones- •
Se recomienda mantener una dosis de PDN o equivalente ≤ 5mg/día hasta 18 meses, dependiendo de la gravedad y el tratamiento adyuvante. En pacientes seleccionados, podría estar justificado el empleo más prolongado como coadyuvante para mantener remisión, siempre que no aparezcan infecciones graves o fracturas vertebrales (GA: 85%).
- •
Se recomienda RTX como fármaco de elección para el mantenimiento de la remisión (GA: 92%).
- •
El mantenimiento con RTX se puede hacer siguiendo un esquema posológico fijo o a demanda (GA: 83%).
- •
Si no se opta por RTX o ante intolerancia o toxicidad por RTX, se recomienda administrar AZA o derivados del ácido micofenólico (GA: 100%).
- •
Avacopan puede emplearse como adyuvante en mantenimiento de remisión hasta completar un año de tratamiento (GA: 92%).
Las figuras 8 y 9 muestran el tratamiento para el mantenimiento de la remisión, con y sin afectación orgánica mayor, y las dosis recomendadas para cada fármaco.
Tratamiento inmunosupresor de mantenimiento de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA)
GC: glucocorticoides; MTX: metotrexato; RTX: rituximab; CFM: ciclofosfamida; AZA: azatioprina; LFN: leflunomida; MMF: micofenolato mofetil; AMF: ácido micofenólico; AVA: avacopan; IgG: inmunoglobulina G; GPA: granulomatosis con poliangeítis; IS: inmunosupresores; ANCA: anticuerpos anticitoplasma de neutrófilo; PR3: proteinasa 3; ORL: otorrinolaringológico.
Se incluye a continuación la evidencia disponible para tratamientos concretos.
GlucocorticoidesAunque no se dispone de evidencia de alta calidad para determinar la dosis y duración óptimas de los GC para el mantenimiento de la remisión, se podría recomendar mantener una dosis de PDN o equivalente 5mg/día hasta 18 meses, dependiendo de la gravedad y el tratamiento adyuvante. Un metaanálisis180 demostró que la utilización prolongada de GC durante la remisión estaba relacionada con una menor frecuencia de recaídas. Sin embargo, los diseños de los ensayos clínicos realizados no permiten obtener conclusiones definitivas. Por ello, no es posible establecer recomendaciones generales sobre el uso de GC para mantener la remisión. La aparición de nuevos tratamientos ahorradores de GC, como el avacopan entre otros (fig. 7)181, modificará probablemente las pautas tradicionales de tratamiento.
En pacientes seleccionados, podría estar justificado el empleo más prolongado como coadyuvante para mantener remisión, siempre que no aparezcan infecciones graves o fracturas vertebrales.
RituximabRTX se recomienda como fármaco de elección para el mantenimiento de la remisión (fig. 8).
Los estudios esenciales de tratamiento de mantenimiento con RTX son los estudios MAINRITSAN 1 y 2, y RITAZAREM. En el ensayo MAINRITSAN174 se comparaba la AZA con una pauta de RTX de 500mg iv cada seis meses (el primer ciclo dos bolos de 500mg) durante 18 meses. El RTX fue significativamente superior a la AZA para mantener la remisión al mes 28 (periodo libre de brotes), diferencia que se mantuvo en la prolongación del estudio a 18 meses más (MAINRITSAN 3)81. Los EA fueron similares en ambos grupos.
En el estudio MAINRITSAN 2182 se evaluaron dos pautas de RTX para el mantenimiento de la remisión: una pauta fija de RTX de 500mg cada seis meses frente a otra de 500mg individualizada a demanda, cuando se positivizaban los ANCA o aumentaba el título o los recuentos de linfocitos B CD19+excedían 0/mm3. La duración del tratamiento fue de 18 meses. Tras 28 meses de seguimiento un 9,9% de los pacientes que recibieron la pauta fija presentaron recaídas, frente al 17,3% de los pacientes que recibieron la pauta a demanda, aunque esta diferencia no fue significativa (p=0,22). En cambio, se consiguió reducir la dosis acumulada de RTX.
En el estudio RITAZAREM, tras una fase de inducción de remisión con RTX de cuatro meses, la pauta de mantenimiento de RTX de 1g/4 meses durante 20 meses resultó superior a AZA (2mg/kg/día)137 (fig. 9).
AzatioprinaEn las diferentes guías y recomendaciones europeas y americanas, la AZA se coloca como segunda línea si no se pudiera optar por RTX.
Derivados del ácido micofenólicoEn el caso del mantenimiento con MMF (fig. 9), un estudio retrospectivo con 67 pacientes, mayoritariamente con fenotipo MPO (>90%), analizó el mantenimiento con MMF tras inducción con MMF o CFM. Se demostró que la tasa de recaídas fue baja (9%), y que en los pacientes tratados inicialmente con CFM hubo más infecciones, presentando neutropenia y neoplasias sólo los pacientes de este grupo173. En una revisión sistemática se observó que las recaídas fueron superiores en los pacientes tratados con MMF (45%) frente a una cohorte previa tratada con CFM (14,5%)165. En un metaanálisis no hubo diferencias en el mantenimiento de remisión entre MMF y otros tratamientos, pero en los estudios que incluían pacientes con afectación renal la remisión fue superior con MMF104. No se ha realizado ningún ensayo que compare el mantenimiento de remisión entre MMF y RTX en pacientes con afectación renal.
AvacopanPor último, avacopan puede emplearse como adyuvante en mantenimiento de remisión hasta completar un año de tratamiento. Sin embargo, la duración óptima del tratamiento con avacopan y su seguridad a largo plazo todavía no están establecidas183 (fig. 9).
Tratamiento de las recaídasRecomendaciones- •
En pacientes con recaídas de VAA se recomienda, preferentemente, tratamiento de reinducción y mantenimiento con RTX (GA: 100%).
Se estima que 25% de los pacientes con GPA tendrán una recaída en los primeros dos años tras el diagnóstico y más del 50% en los primeros cinco años. La mayoría la sufrirán al suprimir el tratamiento de mantenimiento184.
Antes de asumir una recaída, se debe descartar infección, toxicidad del tratamiento o daño irreversible sin franca actividad. Tienen mayor riesgo de recaída los pacientes con ANCA-PR3, recurrencia previa, afectación pulmonar o del tracto respiratorio superior, persistencia de ANCA a pesar de remisión clínica, positivización de los ANCA o aumento significativo de su título, así como portadores nasales de Staphylococcusaureus. Estos parámetros pueden ser de utilidad para decidir la duración del tratamiento de mantenimiento tras una primera recaída (si 24-48 meses o más)6.
De acuerdo con las recomendaciones actuales6,61, el esquema terapéutico estará condicionado por la gravedad de la recaída, según la repercusión en órganos vitales o el compromiso vital (tabla 9).
En cuanto al tratamiento de reinducción en recaídas con riesgo vital o de daño orgánico grave, en los pacientes con GPA o MPA que presentan una recaída tras el tratamiento de inducción con CFM o RTX, se recomienda reinducción preferentemente con RTX, ya que la tasa de respuesta completa a los seis meses fue superior en dos ensayos clínicos a la conseguida con CFM70,107. En el ensayo RITAZAREM112, que incluyó 188 pacientes con recaída que recibieron RTX más corticoides, el 90% consiguieron la remisión a los cuatro meses independientemente del inmunosupresor empleado en el tratamiento de inducción previo. Los resultados de este estudio no estaban disponibles cuando se elaboraron las recomendaciones ACR/VF 202161.
Los pacientes que recayeron durante el tratamiento de mantenimiento con RTX y habían recibido la última dosis <6 meses antes, deberían realizar la reinducción con CFM. Cuando la última dosis de RTX ha sido administrada> 6 meses antes, puede intentarse reinducción con RTX61. En los casos de recaída estando con RTX 500mg/6 meses, puede plantearse incrementar la dosis a 1 gramo, aumentar la frecuencia cada cuatro meses, o ambas6,112.
En las recaídas con HAD o insuficiencia renal grave, algunos autores prefieren la CFM sobre el RTX6. La administración conjunta de ambos fármacos se demostró eficaz para disminuir la dosis de CFM y corticoides en el ensayo RITUXVAS y en otros estudios retrospectivos108. Se está llevando a cabo un ensayo clínico aleatorizado para evaluar la seguridad y eficacia del tratamiento combinado cuyo cierre será en abril de 2025 (ENDURRANCE-1)129. Datos recientes avalan la utilidad de añadir avacopan en este grupo de pacientes más graves185.
Respecto al tratamiento de las recaídas de la GPA y MPA sin riesgo vital ni daño orgánico grave, si la recaída aparece durante el tratamiento de mantenimiento es importante asegurar que la adherencia era adecuada. Tanto si la reactivación ocurrió durante el tratamiento de mantenimiento como si tuvo lugar tras su suspensión, se aconseja tratar la recaída con RTX y corticoides y realizar el mantenimiento con RTX, ya que disminuyen las recurrencias y se ahorran corticoides6.
En el caso del tratamiento de mantenimiento tras la reinducción en recaídas con riesgo vital o de daño orgánico grave, se recomienda, tras la reinducción, utilizar RTX61 y valorar la administración conjunta de avacopan186. Cuando la recaída haya ocurrido tras suspender el tratamiento de mantenimiento, se aconseja reintroducir el mismo fármaco que recibían previamente y considerar la conveniencia de prolongar la duración del mantenimiento187. Los pacientes que han experimentado dos o más recaídas suelen ser subsidiarios de tratamiento inmunosupresor a largo plazo, valorando agregar avacopan186.
Estrategia terapéutica: situaciones especialesVasculitis refractariaRecomendaciones- •
Antes de definir una vasculitis como refractaria, se recomienda optimizar el tratamiento y reevaluar al paciente, descartando falta de adherencia u otras causas que puedan simular actividad persistente (GA: 100%).
- •
En caso de vasculitis refractaria se recomienda consultar o derivar a un centro de referencia (GA: 100%).
- •
Si un paciente con VAA refractaria no responde a CFM, se recomienda realizar tratamiento con RTX o viceversa (GA: 100%).
- •
En ausencia de respuesta al tratamiento de segunda línea, se recomienda derivar al paciente a un centro de referencia para valorar otros tratamientos o la inclusión en ensayos clínicos (GA: 92%).
El tratamiento de la VAA refractaria es un desafío y requiere un enfoque multidisciplinar (fig. 10). Es importante reevaluar el diagnóstico, asegurar que el tratamiento instaurado está optimizado y confirmar que el cuadro clínico identificado como actividad persistente de VAA no se explica por una infección, neoplasia u otra comorbilidad coexistente, especialmente el daño crónico por VAA188.
Tratamiento de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA) refractariasa
RTX: rituximab; CFM: ciclofosfamida; AZA: azatioprina; LFN: leflunomida; GC: glucocorticoides; MTX: metotrexato; IGIV: inmunoglobulinas intravenosas; TM: tratamiento de mantenimiento.
a Antes de clasificar la VAA como refractaria, se replanteará el diagnóstico, descartando otras causas y valorando la actividad del daño.
Las siguientes situaciones clínicas definen a una VAA refractaria6,60.
- •
Enfermedad aguda que no responde a la terapia o empeora después de 4 semanas.
- •
Falta de respuesta adecuada, definida como una reducción <50% en la puntuación BVAS, después de seis semanas de tratamiento.
- •
Enfermedad crónica y persistentemente activa, definida como la presencia de al menos uno de los elementos principales o tres secundarios en la puntuación BVAS después de>12 semanas de tratamiento.
- •
Aquellos casos en los que se producen EA significativos del tratamiento que limitan su uso.
Antes de tratar un caso de VAA refractaria se deben realizar los siguientes procesos6,31:
- •
Evaluación de la enfermedad: es importante realizar una evaluación completa de la enfermedad y determinar su gravedad y extensión.
- •
Reevaluación del tratamiento: es importante revisar el tratamiento actual del paciente y considerar posibles cambios en la dosis, el tipo de medicamento o la frecuencia de administración. También se pueden considerar tratamientos complementarios como el recambio plasmático o la terapia con Ig iv.
- •
Consideración de tratamientos experimentales: en algunos casos, se puede considerar el uso de medicamentos biológicos específicos, que pueden ayudar a reducir la inflamación y mejorar los resultados del paciente. Sin embargo, se necesitan más investigaciones para determinar la eficacia y seguridad de estos tratamientos en la VAA antes de que se pueda recomendar su uso generalizado en esta enfermedad.
- •
Manejo multidisciplinar e individualizado: la atención de los pacientes con VAA refractaria debe ser multidisciplinar e incluir a especialistas en medicina interna, reumatología, nefrología, neurología y otros campos según sea necesario. El tratamiento debe individualizarse para cada paciente en función de su presentación clínica, su respuesta a la terapia y su tolerancia al tratamiento189.
- •
En situación de hemodiálisis, siempre que no existan manifestaciones extrarrenales, se debe valorar el riesgo-beneficio de mantener una terapia inmunosupresora. En estos casos, salvo que existan opciones de recuperación de la función renal, se recomienda una disminución progresiva (tapering) hasta retirar la terapia inmunosupresora (GA: 100%).
- •
Recomendamos diferir el trasplante renal en pacientes con enfermedad renal crónica estadio 5 secundaria a VAA, al menos seis meses tras la respuesta clínica completa. La persistencia de ANCA no debe demorar la inclusión en lista de espera (GA: 100%).
La tasa de recidivas de VAA en pacientes en diálisis no está clara, por lo que se cuestiona la necesidad de mantener el tratamiento inmunosupresor en diálisis. Se ha descrito un aumento de los pacientes en remisión conforme avanza el tiempo en diálisis190, que podría explicarse por la exclusión del órgano diana, o por la alteración de la respuesta inmunitaria asociada a la enfermedad renal. Sin embargo, la mortalidad por infecciones aumenta significativamente en los pacientes con VAA respecto al resto de la población en diálisis, seguidas de la causa CV190. Por todo ello, se recomienda evitar terapias de mantenimiento inmunosupresor en pacientes con VAA en diálisis191–193.
La supervivencia de los pacientes con VAA en programa de tratamiento renal sustitutivo comparado con pacientes no diabéticos ajustados por edad y sexo no difiere194, sin embargo, en el trasplante renal se ha descrito una mejor supervivencia de los pacientes y del injerto en VAA comparado con no diabéticos y ERC-5195.
El momento de inclusión en lista de espera de trasplante renal requiere un análisis individualizado. Las guías KDIGO para el tratamiento de las VAA de 202482, recomiendan diferir el trasplante renal en pacientes con VAA al menos seis meses tras la respuesta clínica completa, haciendo hincapié en que la persistencia de ANCA no debe demorar la inclusión en lista de espera de trasplante renal.
La VAA puede recurrir después del trasplante: se ha cifrado en un 0,02-0,03 por paciente/año (5-6% de los trasplantados), sin haberse relacionado claramente con la duración de la remisión o el nivel de ANCA192. Aunque de manera global no debería ser un criterio restrictivo de inclusión en lista de espera, los pacientes con ANCA deberían seguir una monitorización estrecha de la presencia de sintomatología que sugiera recidiva196.
No se puede recomendar una pauta inmunosupresora para el paciente con VAA que requiere un trasplante renal. La asociación de tacrolimus, MMF y PDN se ha asociado con tasas de recaídas bajas197, si bien no hay consenso sobre cuál es la inmunosupresión más adecuada en VAA (fig. 6).
El diagnóstico de recaída tras el trasplante renal puede ser complicado por la heterogeneidad de los síntomas, y el deterioro de la función renal asociado a las recaídas requiere la realización de biopsia renal. No existen biomarcadores específicos de recaída y no se ha definido el papel de los ANCA en el postrasplante.
El tratamiento de las recaídas de la VAA es similar al de los pacientes no trasplantados, sin poder dar una recomendación sobre el beneficio de CFM o RTX asociados a esteroides. En caso de usar CFM se recomienda suspender temporalmente MMF, no siendo necesario con el uso de RTX194. El riesgo de pérdida del injerto por recidiva de la enfermedad se ha cifrado en <1%198.
EmbarazoRecomendaciones- •
El embarazo en mujeres con VAA debe de ser controlado por equipos multidisciplinares y unidades de embarazo de alto riesgo (GA: 100%).
- •
Se recomienda asesoramiento previo a la concepción y la planificación del embarazo, informando a la paciente de las posibilidades de éxito y los riesgos asociados (GA: 100%).
- •
Se recomienda que la paciente permanezca en remisión estable un mínimo de seis meses antes de la concepción (GA: 100%).
- •
Durante la planificación del embarazo en una mujer con VAA se debe adaptar la medicación inmunosupresora, evitando fármacos teratogénicos o con efectos negativos sobre la gestación (GA: 100%).
Los embarazos en pacientes con VAA son poco frecuentes y, por lo tanto, difíciles de estudiar199. La mayor parte de la evidencia procede de casos aislados y pequeñas series200–203. Existe la posibilidad de tener un embarazo exitoso en las pacientes con vasculitis, especialmente cuando se planifica la concepción por un equipo multidisciplinar y la enfermedad está en remisión. Aunque el pronóstico ha mejorado notablemente en los últimos años, el embarazo en mujeres con vasculitis conlleva una serie de problemas adicionales, por este motivo se recomienda un adecuado control de la enfermedad durante un mínimo de seis meses antes de la concepción204.
Durante el embarazo, las mujeres con VAA activa tienen más riesgo de prematuridad, retraso de crecimiento intrauterino, aborto espontáneo y preeclampsia205. El parto prematuro es una de las complicaciones más frecuentes, especialmente en la GPA, con una incidencia en hasta el 73% de los casos, pero este porcentaje desciende hasta el 7-9% en las pacientes en remisión206,207. Los abortos espontáneos tienen una incidencia variable, entre el 4-20% de los embarazos, mientras que la preeclampsia se presenta en un 10-30%205,207,208 (Tabla S7). Los partos por cesárea se situaron alrededor del 50% de los casos209.
Por otro lado, el efecto del embarazo sobre la VAA puede provocar brotes en un 20-50% de las pacientes con este diagnóstico. Aunque la mayoría de estas exacerbaciones no suelen ser graves, pueden ocurrir manifestaciones con riesgo vital, especialmente en pacientes con daño renal o cardiaco relacionado con la vasculitis200. La enfermedad activa durante el embarazo representa un gran desafío debido al riesgo de daño fetal asociado con varios tratamientos utilizados para la inducción o el mantenimiento de la remisión, como CFM, MTX y MMF. Además, hay datos limitados sobre la seguridad de RTX en el embarazo208. Los fármacos inmunosupresores considerados más seguros durante el embarazo son: GC, AZA y los inhibidores de la calcineurina (ciclosporina o tacrolimus), particularmente en caso de enfermedad leve o moderada210,211. Las alternativas que podrían considerarse incluyen RTX o CFM en el segundo o tercer trimestre una vez que se completa la organogénesis, aunque los datos son limitados y debe valorarse individualmente212. Las Ig iv se pueden usar como intervención a corto plazo hasta que se puedan usar las terapias convencionales de inducción de la remisión212.
Aunque no existen recomendaciones específicas para el tratamiento y manejo de las VAA en el embarazo, se pueden aplicar las que existen sobre el tratamiento inmunosupresor en embarazo y lactancia (Tabla S8)210,211. No existen unas recomendaciones generalizadas, pero debería hacerse una revisión cada cuatro a seis semanas con examen ginecológico y control analítico durante todo el embarazo (fig. 6).
La presión arterial debe controlarse con labetalol, nifedipino, metildopa o hidralazina213. Existe poca información sobre el tratamiento preventivo de la preeclampsia con aspirina en las mujeres con vasculitis, aunque ciertos expertos recomiendan su uso en pacientes con hipertensión arterial o ERC previa214.
En la actualidad el registro de vasculitis durante el embarazo (V-PREG) está recopilando los resultados maternos y fetales en las vasculitis, con el fin de proporcionar una información más exhaustiva a pacientes y médicos215.
Paciente frágilRecomendaciones- •
Aunque todos los regímenes pueden ser recomendables para pacientes frágiles, se valorará el empleo de RTX junto a avacopan para minimizar el uso de GC (GA: 92%) (fig. 6).
Las VAA son enfermedades con mayor prevalencia entre las personas mayores de 65 años216. El concepto de paciente frágil no está bien establecido, por lo que es difícil establecer recomendaciones. En pacientes de edad avanzada, el diagnóstico suele ser más tardío, dado que síntomas propios de la enfermedad, como la astenia y el síndrome constitucional, pueden pasar desapercibidos o solapados con cambios atribuidos a la edad216–218. Por otra parte, es muy frecuente que en este grupo de pacientes las VAA se presenten en el contexto de múltiples comorbilidades: enfermedad cardiovascular (ECV), diabetes o cáncer. Esta asociación aumenta el riesgo de progresión de la ERC y la mortalidad, especialmente durante el primer año de tratamiento de la vasculitis219. La principal causa de mortalidad en este grupo de edad son las complicaciones derivadas del tratamiento de la VAA, fundamentalmente por complicaciones infecciosas, siendo necesario minimizar el tratamiento e insistir en la importancia de la profilaxis infecciosa y de tener un esquema de vacunación específico y actualizado219–222.
El reclutamiento de estos pacientes en los ensayos clínicos controlados realizados en VAA ha sido limitado. Como ya se ha mencionado anteriormente, Pagnoux et al. compararon un régimen de dosis bajas frente a dosis de CFM estándar en pacientes mayores, en un ensayo clínico aleatorizado, sin encontrar diferencias en la tasa de remisión y con una menor incidencia de EA124.
Un reciente estudio retrospectivo analizó tres tipos de terapias de inmunosupresión de inducción (CFM, CFM+RTX y RTX) en mayores de 60 años. No se observaron diferencias significativas en las tasas de remisión ni en las complicaciones infecciosas o de hospitalización223. Por tanto, el tratamiento en pacientes ancianos y frágiles debe individualizarse después de estratificar su riesgo de recaída y EA. El RTX ofrece ventajas en pacientes frágiles para evitar la toxicidad producida por la CFM, pero los datos son limitados en esta población de mayor edad216. La recomendación respecto al tratamiento con corticoesteroides es evitar el uso de la dosis de PDN> 0,8mg/kg/día, factor de riesgo de infección grave en pacientes de edad avanzada, intentando llegar a dosis de 5-7,5mg/día de PDN a los cinco meses en pacientes ancianos con VAA e insuficiencia renal. En las formas graves se recomiendan tres bolos de 250mg iv con pauta descendente rápida de GC220,221. Como alternativa para ahorrar esteroides en este grupo de pacientes se puede considerar el uso de avacopan185 (fig. 6).
Autoinmunidad: dobles positivosRecomendaciones- •
Se recomienda el empleo de GC, CFM y plasmaféresis para el tratamiento de los pacientes con enfermedad por anticuerpos anti-MBG y VAA (GA:100%).
La enfermedad por anticuerpos anti-MBG es una vasculitis de pequeño vaso caracterizada por el depósito lineal de IgG a lo largo de la membrana basal glomerular.
En la mayoría de los pacientes con enfermedad activa se observan autoanticuerpos circulantes específicos para el dominio no colágeno de la cadena alfa 3 del colágeno IV. Un 30-50% de los pacientes con anticuerpos anti-MBG tienen también positividad para ANCA, fundamentalmente MPO ANCA (60%), y 5-10% de los ANCA positivos tienen anti-MBG detectables224. El mecanismo de esta asociación no se conoce, y no hay argumentos fisiopatológicos sólidos a favor de un mecanismo patogénico común225,226. La doble positividad suele detectarse simultáneamente en un paciente que se presenta con la clínica brusca de hemorragia alveolar y una GNRP. En algunas ocasiones, se detecta positividad de anticuerpos anti-MBG en pacientes previamente diagnosticados de VAA, lo cual sugiere que la inflamación glomerular inducida por ANCA puede desencadenar una respuesta anti-MBG, posiblemente por modificación o exposición de epítopos del dominio 3 (IV) CL1227,228.
Los pacientes con doble positividad tienden a ser más mayores que aquellos con anti-MBG aislados, y son predominantemente varones229. La clínica se asemeja más a una enfermedad por anticuerpos anti-MBG que a una VAA. Se manifiesta con hematuria y proteinuria, siendo rara la aparición de síndrome nefrótico. La insuficiencia renal es más grave que los ANCA aislados (> 50% tienen Cr> 7,9mg/dL y> 60% requieren terapia sustitutiva renal en el momento del diagnóstico, frente al 60% en anti-MBG y 28% de ANCA aislados). En estos pacientes se observa más daño crónico en el momento del diagnóstico que en los que presentan anti-MBG aislados. La frecuencia de hemoptisis es mayor, pero con menos síntomas sistémicos que en los pacientes ANCA positivo aislados230–234.
La probabilidad de recaídas en estos pacientes dobles positivos es mayor que en pacientes con enfermedad por anti-MBG, por lo que deben recibir tratamiento de mantenimiento y seguimiento a largo plazo224,235. La mortalidad es también superior a la de pacientes con anti-MBG y ANCA aislados, y en ellos, un título alto de anti-MBG se asocia con una mayor mortalidad.
El tratamiento de los pacientes se basa en el empleo de corticoides en dosis altas, CFM y plasmaféresis. El recambio plasmático se debe mantener hasta que negativicen los anti-MBG, excepto en pacientes que presentan 100% de glomérulos con proliferación extracapilar en la biopsia renal y no tengan HAD, en los que la plasmaféresis se considera fútil230 (fig. 6).
No hay suficiente evidencia que apoye por el momento el empleo de RTX en estos pacientes, ya que el tratamiento se deriva del utilizado en pacientes con enfermedad por anti-MBG. Sin embargo, ya hay serie de casos tratados con RTX con resultados positivos, por lo que puede ser una alternativa en pacientes en los que no se pueda emplear CFM235. Aunque hay alguna experiencia aislada con otras terapias (imlifidasa), no hay evidencia por el momento que justifique su recomendación236.
Los pacientes con doble positividad anti-MBG y ANCA deben recibir tratamiento de mantenimiento debido al elevado riesgo de recaídas224,230,237. Se recomienda el uso de AZA o MMF.
ANCA negativosRecomendacionesSi se confirma el diagnóstico de vasculitis ANCA negativa, se recomienda seguir la pauta terapéutica general en función de la gravedad de los órganos afectos (GA:100%).
JustificaciónPAM con ANCA negativosLas vasculitis de vaso pequeño son la causa más frecuente de GNRP en adultos y ancianos238. A pesar de que la mayoría de estas entidades corresponden a VAA, un subgrupo ellas son persistentemente negativas. La activación de los neutrófilos en las GNRP-ANCA negativas puede deberse a otros autoanticuerpos que tienen trofismo por las células endoteliales (AECA) y facilitan la interacción con receptores de la superficie de los neutrófilos (Fc y C3b)239 o anti-LAMP-2 que pueden activar neutrófilos y producir apoptosis a nivel endotelial, o bien a la activación de la inmunidad celular.
La histología de las GNRP ANCA negativas, se basa en la demostración en la biopsia renal de un porcentaje de semilunas superior al 50% y una intensidad para la tinción de Ig mediante inmunofluorescencia directa de 0-1 en una escala de 0-4240. Las escasas series que se han publicado con revisión de las GNRP cifran en un 10-30% el porcentaje de ANCA negativas241,242. Las características principales de su presentación clínica suelen ser su aparición en pacientes más jóvenes que las VAA, y su afectación extrarrenal es menos frecuente. Aunque se ha descrito una afectación renal más severa en las GNRP-ANCA negativas respecto a VAA, esto podría atribuirse a la demora en el diagnóstico al persistir negatividad en los ANCA243. Estudios in vitro e in vivo sugieren con evidencia importante el papel de los ANCA en la patogenia de las VAA no solamente como marcador diagnóstico, ligando la actividad quimiotáctica e inflamatoria y la activación del complemento por la vía alternativa con la activación de los neutrófilos71. Los neutrófilos son también las células efectoras principales de las GNRP-ANCA negativas, como se ha observado en las biopsias renales estudiadas244. Anticuerpos antiendoteliales o contra LAMP-2 pueden explicar la activación humoral de los neutrófilos, junto con el mecanismo de activación celular mediada por interleucinas (Il-8 o IL-17) en las GNRP-ANCA negativas240.
No hay ensayos controlados de tratamiento de GNRP-ANCA negativas, y los protocolos aceptados son los del tratamiento de las VAA245, habiéndose publicado series con peor evolución que las VAA240. Se han descrito pacientes afectos de PAM con afectación neurológica periférica y ANCA negativos.
GPA con ANCA negativosAproximadamente el 10% de los pacientes afectos de GPA presentan ANCA negativos y en estos casos el diagnóstico se basa en la histología. Existen muy pocos estudios relativos a la evolución y tratamiento de este grupo de pacientes. Los ANCA negativos son más frecuentes en pacientes con formas localizadas de la enfermedad, habitualmente granulomatosas, con afectación del tracto respiratorio superior o inferior y sin afectación renal246. El BVAS suele ser más bajo que en los pacientes ANCA positivos. La biopsia es fundamental para el diagnóstico.
Se han descrito casos de afectación ocular (seudotumor orbitario), neurológica (paquimeningitis, hipofisitis, afectación de múltiples pares craneales), ORL (estenosis traqueal subglótica, otitis media), cutánea (pioderma-gangrenoso-like, úlceras cutáneas), pulmonar (nódulos pulmonares solitarios), con ANCA persistentemente negativos. Holle et al.246 describieron que el 10% de los pacientes con formas localizadas progresaban a formas generalizadas y que el 46% recaían. Puéchal et al.247 hallaron un índice de recaídas similar al de los pacientes con GPA y ANCA positivos, y una supervivencia global similar.
No existen estudios que comparen el tratamiento de los pacientes con GPA ANCA positivos y ANCA negativos, y usualmente se utilizan las mismas pautas terapéuticas que en los ANCA positivos.
Estrategia terapéutica: tratamiento no inmunosupresorControl de los factores de riesgo cardiovascularRecomendaciones- •
Se recomienda tratar los factores de riesgo de ECV modificables (hipertensión arterial, dislipemia, obesidad, tabaquismo, sedentarismo) (GA: 100%).
- •
Se recomienda, en todos los pacientes con VAA, mantener una presión arterial ≤ 120/80mmHg y un LDL-colesterol plasmático ≤ 70mg/dL. En caso de hipertensión arterial o proteinuria se recomienda restricción salina (< 2g de sodio al día, o <90 mmol sodio al día, o <5g de cloruro de sodio al día) (GA: 70%).
Los pacientes con VAA presentan un riesgo significativamente mayor de ECV y ACV que la población general. Un estudio con 144 pacientes, de un centro europeo y otro canadiense, demostró que el 73% de los pacientes presentaba resistencia a la insulina en el momento de la inclusión, independientemente del tratamiento concurrente con PDN248. Otro estudio realizado en Minnesota, con una cohorte de 58 pacientes seguidos durante 10 años, mostró que los pacientes con VAA presentaban un riesgo más de tres veces mayor de ECV y hasta ocho veces mayor de ACV en comparación con la población general, a pesar de tener una prevalencia similar de factores de riesgo CV249. Finalmente, un metaanálisis demostró que los pacientes con VAA tienen un riesgo 1,65 veces mayor de padecer ECV en comparación con la población general250. Este riesgo presenta variaciones geográficas, puede aumentar hasta un 24% en algunas regiones del mundo y se produce en los primeros cinco años después del diagnóstico.
A su vez, la propia enfermedad y su tratamiento condiciona en estos pacientes la presencia de factores de riesgo vascular como hipertensión arterial y diabetes. Sin embargo, más allá de los factores de riesgo tradicionales, existen mecanismos propios de la enfermedad que contribuyen al aumento del riesgo CV, como la disfunción endotelial que provoca un estado procoagulante y antecede a la formación de la placa aterosclerótica. Los niveles elevados de citocinas proinflamatorias circulantes, la formación de trampas extracelulares de neutrófilos, la activación del sistema del complemento, y la regulación defectuosa de los linfocitos T, son sólo algunos de los múltiples factores que potencian este proceso251.
Por todo ello, es necesario realizar una doble aproximación en el manejo de los pacientes con VAA. En primer lugar, es muy importante el diagnóstico precoz y el inicio de un tratamiento adecuado de la enfermedad que permitan controlar la actividad inflamatoria. De forma concomitante, se debe realizar un abordaje intensivo de los factores de riesgo de ECV, especialmente los modificables (hipertensión, dislipemia, tabaquismo, sedentarismo), durante los primeros años tras el diagnóstico de VAA, recomendando ajustes en el estilo de vida, tratamiento farmacológico y seguimiento médico periódico y riguroso. De hecho, un estudio ha demostrado que en este grupo de pacientes los objetivos recomendados para el colesterol LDL y la presión arterial rara vez se cumplen250 (fig. 11).
Tratamiento no inmunosupresor de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA)
Ca: calcio; DEXA: absorciometría con rayos X de doble energía; RASi: inhibidores del sistema renina-angiotensina; iSGLT2: inhibidores del cotransportador de sodio y glucosa tipo 2; TA: tensión arterial.
Las recomendaciones EULAR de 2016 sugerían una revisión anual de los factores de riesgo tradicionales Framingham. Las últimas guías de 2022 no establecen una recomendación temporal específica, pero subrayan la importancia del control de la inflamación vascular, así como el cribado y tratamiento de los factores clásicos de riesgo CV6.
Fármacos cardio-nefroprotectoresRecomendaciones- •
En caso de proteinuria, deberá realizarse bloqueo del sistema renina-angiotensina-aldosterona con inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA-II) a la dosis máxima tolerada (de acuerdo, principalmente, a la presión arterial y función renal) para alcanzar una proteinuria <0,5g/día. Como alternativas o tratamientos complementarios pueden utilizarse los antialdosterónicos (espironolactona, eplerenona, finerenona, aceptada por el momento solo para pacientes con diabetes mellitus tipo 2) o los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) (GA: 91%).
- •
En estadios avanzados de ERC, también es importante abordar otros factores de riesgo CV, como la anemia y el hiperparatiroidismo secundario, siguiendo las guías disponibles al respecto (GA: 100%).
En general, los pacientes con VAA experimentan un mayor riesgo de muerte a largo plazo después de su primer año de diagnóstico en comparación con la población general de la misma edad y sexo y la ECV sigue siendo la causa más importante de muerte junto con las neoplasias y las infecciones252,253.
Además de la naturaleza inflamatoria de la propia enfermedad, incluida la disfunción endotelial y la rigidez arterial, también los efectos a largo plazo del tratamiento inmunosupresor, especialmente si no se controlan adecuadamente, contribuyen significativamente al aumento del riesgo CV en este grupo de pacientes254,255. Entre los factores de riesgo independientes para el exceso de mortalidad, la ERC sigue siendo uno de los principales factores predictivos de un mal pronóstico256. Por lo tanto, los pacientes con VAA y compromiso renal tienen un riesgo significativamente mayor de morbilidad y mortalidad CV como parte de la asociación inherente a la ERC257. Además, varias características fisiopatológicas únicas que afectan el eje cardiorrenal ocurren con mayor frecuencia en pacientes con VAA: la disfunción diastólica e hipertensión pulmonar y la función sistólica reducida258,259. Los iSGLT-2 ejercen efectos cardioprotectores y nefroprotectores inequívocos al reducir la albuminuria y retrasar la progresión de la ERC, porque reducen la hiperfiltración glomerular y modulan la carga de trabajo tubular. Estos profundos efectos clínicos sugieren que la inhibición de SGLT-2 es una vía terapéutica ideal para pacientes con VAA, especialmente cuando ya se han manifestado signos de daño cardíaco o renal. El ensayo DAPA-CKD cambió significativamente nuestra visión del tratamiento de la ERC, que (con todas sus diversas etiologías, que van desde la diabetes y la hipertensión hasta varias formas de GN) debe verse principalmente como una forma única de disfunción orgánica que se puede tratar con éxito260. Actualmente, hay ensayos en preparación para probar dapagliflozina en VAA, como el DAPA-vasculitis. Los pacientes con ERC (albuminuria aislada o con reducción del FGR) deben recibir terapias nefroprotectoras potentes como inhibidores del RAS e iSGLT-2 que afectan tanto la hiperfiltración como la capacidad tubular, reduciendo así la progresión de la ERC y el riesgo CV. (fig. 11).
Por otro lado, debemos considerar el uso de agonistas del receptor GLP1 en pacientes seleccionados (obesos y/o síndrome metabólico), fármacos que han demostrado en diferentes ensayos clínicos su eficacia nefro y cardioprotectora261.
Profilaxis antibiótica y vacunacionesRecomendaciones- •
Se recomienda el cribado sistemático de infección latente por Mycobacterium tuberculosis, virus hepatotropos y virus de la inmunodeficiencia humana (VIH) en todo paciente con VAA. En caso de estar presentes, se manejarán de acuerdo con lo establecido para pacientes inmunocomprometidos de otro origen (GA: 100%).
- •
Todo paciente con VAA sometido a tratamiento con GC en dosis superiores a 15mg/día o con RTX o CFM en dosis de inducción, debería recibir profilaxis con cotrimoxazol (GA: 100%).
- •
Todo paciente diagnosticado de VAA debería recibir vacunación frente a Streptococcus pneumoniae, virus del herpes zóster (VHZ), así como una vacuna o dosis de refuerzo frente al SARS-CoV2 y la gripe estacional (GA: 100%).
- •
En todo paciente sometido a tratamiento con RTX, se recomienda monitorización del nivel de Ig séricas con periodicidad semestral, indicando tratamiento sustitutivo en caso de IgG<200mg/dL, y valorando también su administración en pacientes con deficiencias menos marcadas (IgG>200mg/dL) e infecciones de repetición (GA: 91%).
Las infecciones graves son frecuentes en los pacientes con VAA, con una prevalencia entre el 20 y el 60%, y constituyen la primera causa de muerte en los primeros seis a 12 meses130,262,263, siendo la neumonía bacteriana la infección más frecuente264,265.
Los factores de riesgo de infección son: edad, tabaquismo, insuficiencia renal grave o al debut, dosis acumulada de CFM, leucopenia, hipogammaglobulinemia, número de linfocitos B CD19+o T CD4+y dosis altas de GC al inicio217,264–267. En el ensayo PEXIVAS se compararon dos regímenes de GC, resultando más seguro, en términos de infección grave, el grupo de menor dosis110. Por todo ello, se considera que minimizar el uso de GC constituye una medida eficaz para reducir el riesgo de infección. Estudios recientes sugieren que el avacopan, un antagonista del receptor C5aR2 para la fracción C5a del complemento, permite reducir las dosis de GC y, por consiguiente, el riesgo de infección grave114.
La prevención de infecciones en pacientes con VAA ha sido revisada en las Recomendaciones de Prevención de Infección en Enfermedades Reumáticas Autoinmunes Sistémicas, de la Sociedad Española de Reumatología268. Las medidas generales de higiene, uso de mascarilla en caso de contactos estrechos o convivientes con infección activa, etc., se describen con detalle.
Debería realizarse profilaxis frente a Pneumocystis jirovecii, usualmente con cotrimoxazol, en todo paciente con dosis de PDN>15mg/día, o linfopenia T-CD4 <200 cel/mcl268. Su uso se ha asociado a una menor tasa de infección grave y a una menor mortalidad por infección en pacientes con VAA, particularmente en los tratados con RTX263,267. Las últimas recomendaciones EULAR de manejo de VAA, sugieren mantener cotrimoxazol mientras el paciente reciba tratamiento con RTX o CFM6.
Las recomendaciones para prevención de reactivación de la tuberculosis latente no difieren de las de otros pacientes inmunocomprometidos. Se prefieren los testInterferon-gamma release assay (IGRA) para su cribado, particularmente en presencia de tratamiento inmunosupresor269. El cribado de infección previa o latente por virus de la hepatitis (VHB, VHC) y VIH es también obligado, existiendo recomendaciones específicas respecto a uso de antivirales en pacientes con serología de infección pasada por VHB que vayan a ser sometidos a tratamiento con GC o RTX268.
En general, las vacunas se pueden considerar seguras en estos pacientes268,270. La vacunación frente a neumococo e influenza se recomienda en todos los casos268,271 y resulta habitualmente inmunogénica en pacientes con enfermedad establecida bajo tratamiento estándar272. Se ha recomendado una dosis de refuerzo a las cuatro semanas, además de utilizar la vacuna tetravalente adyuvada, en inmunocomprometidos268.
Los pacientes con VAA tienen mayor riesgo de reactivación del virus varicela-zóster273, por lo que son candidatos a la vacunación con la vacuna recombinante, aunque no existe evidencia directa en esta población271. En la Tabla S9 se resumen las vacunas habitualmente recomendadas.
La terapia con RTX reduce sustancialmente la respuesta a las vacunaciones, siendo recomendable realizar la vacunación al menos dos semanas antes de la dosis de RTX. Sin embargo, la vacuna antigripal no debería retrasarse por este motivo. Se ha recomendado suspender el MTX dos semanas tras la tvacunación antigripal con el objetivo de incrementar la respuesta271.
La hipogammaglobulinemia se ha relacionado con infeción grave274–276. El riesgo de hipogamaglobulinemia con RTX se ha asociado con la edad, el uso de GC y las dosis repetidas130,275. Se recomienda monitorizar los niveles de IgG antes de cada curso de RTX6, junto con una estimación global del riesgo de infección. Aunque la evidencia disponible es limitada, se sugiere administrar Ig en pacientes tratados con RTX con infecciones repetidas, sea cual fuere el nivel de IgG276.
La COVID puede resultar más grave en pacientes con enfermedades sistémicas inmunomediadas277–280, particularmente en aquellos tratados con inmunosupresores y, sobre todo, RTX279,280 (fig. 11). Se recomienda vacunar lo antes posible, con independencia del estado de actividad de la enfermedad, y completar tres dosis y dos dosis de refuerzo más en caso de respuesta inadecuada6,279,280. En caso de infección por SARS-CoV-2, se recomienda suspender los medicamentos antirreumáticos modificadores de la enfermedad (DMARD) dos semanas, y según las directrices locales, el uso precoz de antivirales con el fin de reducir el riesgo de progresión a COVID grave279–282. Paxlovid® y molnupiravir se recomiendan en caso de infección moderada y remdesvir en caso de infeccion grave283. La inmunización pasiva mediante anticuerpos monoclonales está en revisión283.
Prevención de la osteoporosisRecomendaciones- •
Se recomienda la evaluación periódica de osteoporosis en pacientes con VAA, especialmente en aquellos que han recibido o están en tratamiento activo con GC (GA: 100%).
- •
En pacientes con VAA en tratamiento con GC durante ≥ 3 meses se recomiendan suplementos de calcio y vitamina D, individualizando la introducción de la terapia antirresortiva (GA: 100%).
Los pacientes con VAA tienen riesgo de sufrir complicaciones y comorbilidades284,285. La osteoporosis puede ser secundaria a la vasculitis subyacente (por inflamación), al deterioro de la función renal o al tratamiento de la enfermedad, principalmente por el empleo de GC. En una cohorte de pacientes suecos con VAA, la osteoporosis fue la comorbilidad más prevalente, y 4 veces más frecuente que en la población general286. Las fracturas también se han descrito de manera más frecuente en pacientes con VAA que en la población general287,288.
Es importante considerar tanto los efectos beneficiosos de los GC en el control de la enfermedad como su posible toxicidad. Varios estudios han demostrado que la osteoporosis es una complicación frecuente en pacientes con VAA tratados con los GC (14-20%)284,289, y que la dosis acumulada de GC se asocia con la pérdida de masa ósea289. En general, se recomienda utilizar la dosis y la duración de la terapia con GC lo más bajas y cortas posible e introducir otros inmunosupresores como ahorradores de GC290. Sin embargo, algunos pacientes con VAA pueden requerir dosis bajas de GC a largo plazo para mantener la remisión61. En este sentido, algunos estudios recientes en pacientes con VAA han demostrado resultados alentadores utilizando un régimen de tratamiento con bajas dosis de GC o sin GC220,291. El uso de avacopan ha mostrado ser un tratamiento prometedor para el ahorro de GC, aunque se requieren todavía más trabajos114.
La prevención y el manejo de la osteoporosis por GC se abordan en varios guías y revisiones290,292. En estas guías se recomienda medir la densidad mineral ósea (DMO) mediante absorciometría de rayos X de energía dual (DEXA) al inicio de la terapia con GC y después de un año. Si la DMO permanece estable, se podría medir cada dos años. Además, las guías ACR recomiendan hacer una evaluación de fracturas vertebrales290. De forma general, en todos los pacientes que reciben cualquier dosis oral de GC con una duración prevista de ≥ 3 meses se sugiere la suplementación de calcio y vitamina D. En pacientes con fractura previa, T-score en DMO menor de -2, o GC con dosis ≥ 20mg/día, se debe instaurar tratamiento farmacológico, preferentemente con antirresortivos (fig. 11). Esto se basa en la evidencia de que los pacientes que reciben GC se fracturan con valores de DMO más altos, ya que los GC actúan por varios mecanismos que afectan tanto a la calidad como a la DMO293
Contribución de los autoresTodos los autores participaron en las reuniones periódicas de las recomendaciones, desarrollaron al menos un apartado específico del documento principal, incluyendo la búsqueda y revisión bibliográfica, revisaron, aprobaron y firmaron el documento final, incluyendo el manuscrito principal, las tablas y figuras principales y el material suplementario antes de su envío.
Enrique Morales, Roser Solans e Iñigo Rúa-Figueroa, diseñaron y coordinaron el estudio y realizaron la edición general del manuscrito.
Carmen Mon Mon y Néstor Oliva Dámaso aportaron comentarios durante la fase de revisión pública del documento, que fueron parcialmente adoptados.
FinanciaciónEste trabajo no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Los autores de este manuscrito agradecen a CSL Vifor su colaboración en la logística de las reuniones de preparación del manuscrito.
Los autores de este manuscrito agradecen a Adalia Farma S.L el apoyo en la elaboración, realización de gráficos y ejecución final del manuscrito.