La estrategia de la aproximación concentración-dosis (C/D) y los distintos perfiles del tacrolimus (Tac), según los polimorfismos del citocromo P450 (CYPs) se centran en el metabolismo de Tac y se plantean como herramientas para el seguimiento de los pacientes trasplantados. El objetivo de este estudio es comparar la exposición al Tac analizado según ambas estrategias.
Materiales y métodosSe han incluido 425 pacientes trasplantados renales. El cálculo del cociente concentración Tac/dosis (C/D) permitió dividir la población en terciles y clasificar los pacientes según su tasa de metabolismo del Tac en tres grupos (rápida, intermedia y lenta). Con base en los polimorfismos del CYP3A4 y A5, los pacientes se agruparon en metabolizadores rápidos (portadores del CYP3A5*1 y CYP34A *1/*1), intermedios (CYP3A5*3/3 y CYP3A4*1/*1) y lentos (CYP3A5 *3/*3 y portadores del CYP3A4*22).
ResultadosAl comparar los pacientes de cada grupo metabolizador según los dos criterios, coincidieron 47% (65/139) de los metabolizadores rápidos, 85% (125/146) de los intermedios y solo 12% (17/140) de los lentos. Se observaron concentraciones de Tac estadísticamente menores en los metabolizadores rápidos y concentraciones mayores en los lentos, comparándolos con el grupo intermedio según el cociente C/D o según polimorfismos. Los metabolizadores rápidos requirieron alrededor de 60% más de dosis de Tac que los intermedios a lo largo del seguimiento, mientras que los lentos aproximadamente 20% menos de dosis que los intermedios. Los metabolizadores rápidos clasificados por ambos criterios presentan un porcentaje mayor de veces con valores de concentración de Tac en sangre infraterapéuticos.
ConclusiónLa determinación del fenotipo metabolizador según los polimorfismos del CYP o bien cociente C/D permite distinguir los pacientes según su exposición al Tac. Probablemente la combinación de ambos criterios de clasificación sería una buena herramienta en el manejo de la dosificación de Tac para los pacientes trasplantados.
The strategy of the concentration–dose (C/D) approach and the different profiles of tacrolimus (Tac) according to the cytochrome P450 polymorphisms (CYPs) focus on the metabolism of Tac and are proposed as tools for the follow-up of transplant patients. The objective of this study is to analyse both strategies to confirm whether the stratification of patients according to the pharmacokinetic behaviour of C/D corresponds to the classification according to their CYP3A4/5 cluster metabolizer profile.
Materials and methodsFour hundred and twenty-five kidney transplant patients who received Tac as immunosuppressive treatment have been included. The concentration/dose ratio (C/D) was used to divided patients in terciles and classify them according to their Tac metabolism rate (fast, intermediate, and slow). Based on CYP3A4 and A5 polymorphisms, patients were classified into three metabolizer groups: fast (CYP3A5*1 and CYP34A*1/*1 carriers), intermediate (CYP3A5*3/3 and CYP3A4*1/*1) and slow (CYP3A5*3/*3 and CYP3A4*22 carriers).
ResultsWhen comparing patients included in each metabolizer group according to C/D ratio, 47% (65/139) of the fast metabolizers, 85% (125/146) of the intermediate and only 12% (17/140) of the slow also fitted in the homonym genotype group. Statistically lower Tac concentrations were observed in the fast metabolizers group and higher Tac concentrations in the slow metabolizers when compared with the intermediate group both in C/D ratio and polymorphisms criteria. High metabolizers required approximately 60% more Tac doses than intermediates throughout follow-up, while poor metabolizers required approximately 20% fewer doses than intermediates. Fast metabolizers classified by both criteria presented a higher percentage of times with sub-therapeutic blood Tac concentration values.
ConclusionDetermination of the metabolizer phenotype according to CYP polymorphisms or the C/D ratio allows patients to be distinguished according to their exposure to Tac. Probably the combination of both classification criteria would be a good tool for managing Tac dosage for transplant patients.
El tacrolimus (Tac), un inhibidor de la calcineurina, es la piedra angular del tratamiento inmunosupresor en el trasplante de órganos sólidos. Este fármaco es muy eficaz para prevenir el rechazo agudo, pero el ajuste de la dosis clínica sigue siendo complicado debido a su estrecha ventana terapéutica y su alta variabilidad farmacocinética (PK) y farmacodinámica (PD) intra e interpaciente1,2. Quizás, el mayor desafío es conseguir una terapia que se adapte a las características individuales del paciente para lograr un buen balance entre la eficacia y la toxicidad3. Desde hace tres décadas, el ajuste de dosis de Tac en la práctica clínica se realiza de forma empírica según la ficha técnica del fármaco. El cálculo de la dosis inicial de Tac después del trasplante de órganos sólidos se basa en el peso corporal del paciente. Las dosis posteriores se ajustan en función de la concentración matinal previa a la dosis (C0) de Tac para la monitorización terapéutica del fármaco (TDM) según cada centro3.
El metabolismo de Tac y los perfiles PK están cobrando cada vez más importancia. La tasa de metabolismo del Tac de un individuo se ha relacionado con los resultados después del trasplante lo que exacerba aún más el problema de las diferencias entre individuos en la relación dosis-respuesta2. En este sentido, se ha evaluado la exposición al Tac con base en los polimorfismos genéticos que influyen en el metabolismo del Tac del citocromo P450 (CYP3A4 y CYP3A5)4–10. Con la finalidad de definir la población, con base en las características farmacogenéticas del clúster y las diferencias en la metabolización del Tac, se han descrito tres fenotipos: metabolizador rápido, intermedio y lento. Los pacientes metabolizadores rápidos presentan niveles bajos de Tac requiriendo al menos el doble de dosis que los metabolizadores lentos6,9,11.
Por otro lado, la aproximación concentración-dosis (C/D) se ha analizado como una herramienta sencilla para estimar el metabolismo de Tac12–18. En estos estudios, los pacientes con una relación C/D baja (C/D < 1,05 (ng/mL)/mg en receptores de trasplante renal; < 1,09 (ng/mL)/mg en receptores de trasplante de hígado) indica un metabolismo rápido de Tac y está asociado con una función renal disminuida, una tasa más alta de nefrotoxicidad comprobada por biopsia, y cambio más frecuente a un régimen inmunosupresor alternativo que los pacientes con a una relación C/D más alta12,14–16,19–22.
Ambas estrategias, el estudio de los polimorfismos y la relación C/D, se centran en el metabolismo de Tac y se plantean como una herramienta adicional para la individualización de la dosis de TAC en los pacientes trasplantados. Su objetivo es personalizar el tratamiento con Tac y limitar el tiempo en que los receptores de trasplantes están sub- o sobreexpuestos para minimizar los riesgos de rechazo y toxicidad respectivamente. En este trabajo se estudiarán ambas estrategias para identificar si la estratificación de los pacientes según el PK de C/D se corresponde a la clasificación según su perfil metabolizador del clúster CYP3A4/5, y si existe asociación de ambas clasificaciones con la infra- o supraexposición a Tac, con la variabilidad intraindividual, o con la evolución del injerto.
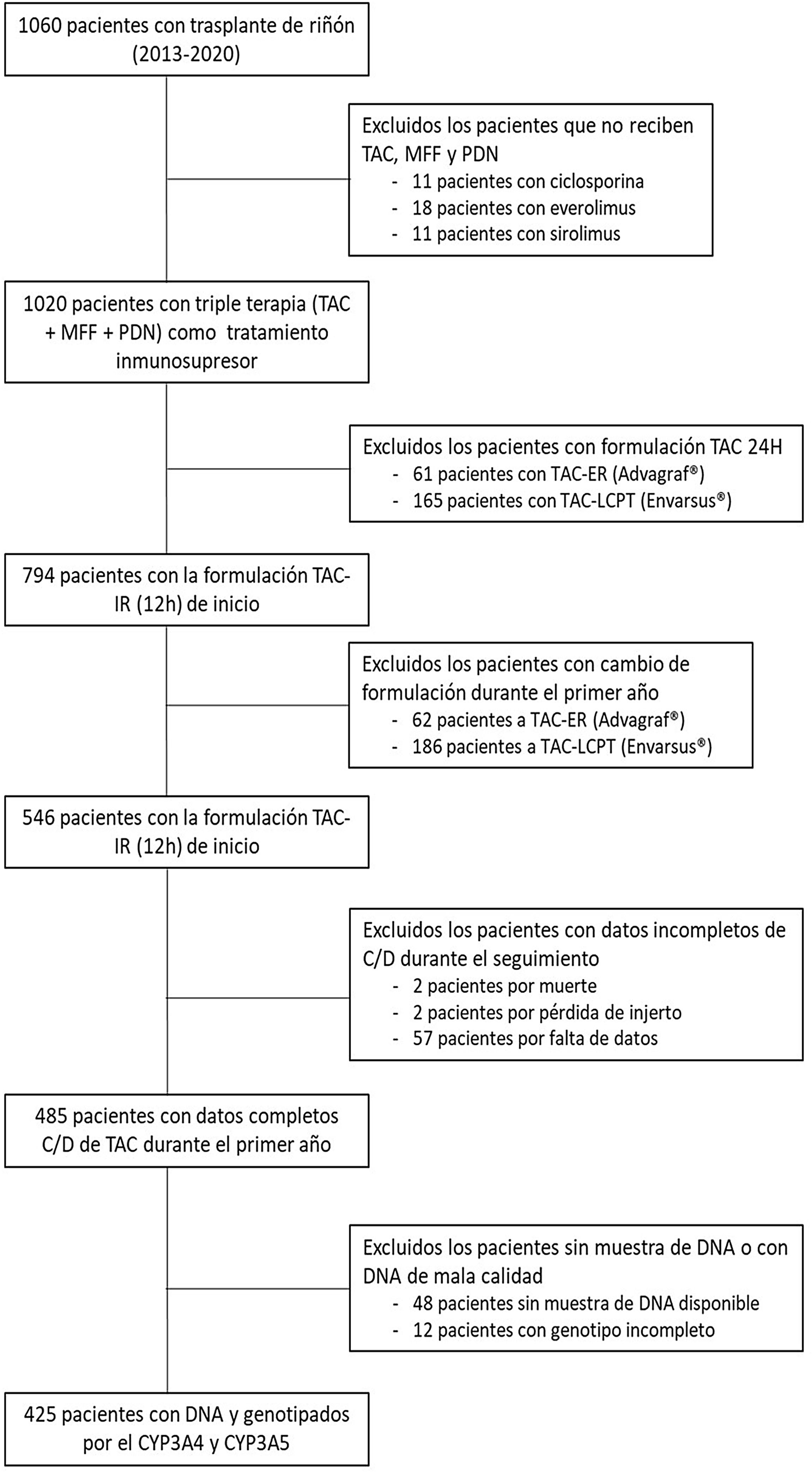
Pacientes y métodosSe han incluido un total de 425 pacientes que recibieron un trasplante de riñón entre 2013 y 2020 (inclusive) (fig. 1). El estudio se llevó a cabo de acuerdo con la Declaración de Helsinki y con la aprobación del comité ético local del Hospital Universitario de Bellvitge, España.
Se incluyeron pacientes que recibían una formulación de administración cada 12 h de Tac y disponían de muestra de ADN. Se excluyeron aquellos que se convirtieron a otras formulaciones de Tac de administración 24 h. Tampoco se consideraron los pacientes que fallecieron o sufrieron pérdida de injerto en el primer mes postrasplante renal y los que tenían datos bioquímicos incompletos para evaluar la relación concentración/dosis (C/D) durante el seguimiento. El tratamiento inmunosupresor habitual que recibieron consistía en globulinas antitimocíticas (ATG) o basiliximab como terapia de inducción, seguido de Tac y micofenolato mofetil (MMF) y esteroides como inmunosupresión de mantenimiento. El seguimiento de los valores de concentración y dosis de Tac se realizó en los días 7 y 15, y al uno, tres, seis y 12 meses postrasplante.
Se recogieron los datos demográficos del donante y del receptor, tipo y número de trasplantes, etiología de la enfermedad renal, anticuerpos anti-HLA reactivos del panel (PRA) e histocompatibilidad en los antígenos HLA A, B y DR. Se recopilaron los valores de la creatinina sérica (??mol/L) a los cinco a siete y 15 días, y al uno, tres, seis y 12 meses después del trasplante. Se evaluó la presencia de función retardada del injerto y rechazo agudo demostrado por biopsia siguiendo la clasificación histológica realizada según el esquema de Banff (2018)23. La función retardada del injerto se definió como la necesidad de sesiones de diálisis durante la primera semana postoperatoria. La pérdida de injerto se definió como el regreso a diálisis o retrasplante.
Determinación del tacrolimus en sangreLa medida de concentración de Tac en sangre total se realizó mediante cromatografía líquida de alta eficacia en tándem con espectrometría de masas (UHPLC-MS/MS; Acquity®-TQD® espectrómetro de masas, de Waters, MA, EE. UU.) usando métodos previamente validados por Rigo-Bonnin et al.24
Metabolismo del tacrolimus según el cociente C/DSiguiendo las pautas descritas en el artículo de Thölking et al.12, la tasa de metabolismo del Tac se determinó a los meses 1, 3 y 6 postrasplante renal mediante la división del valor de concentración de Tac en sangre por el valor de la correspondiente dosis diaria de Tac (D).
C/D = niveles de Tac en sangre predosis (ng/mL)/dosis diaria de Tac (mg).
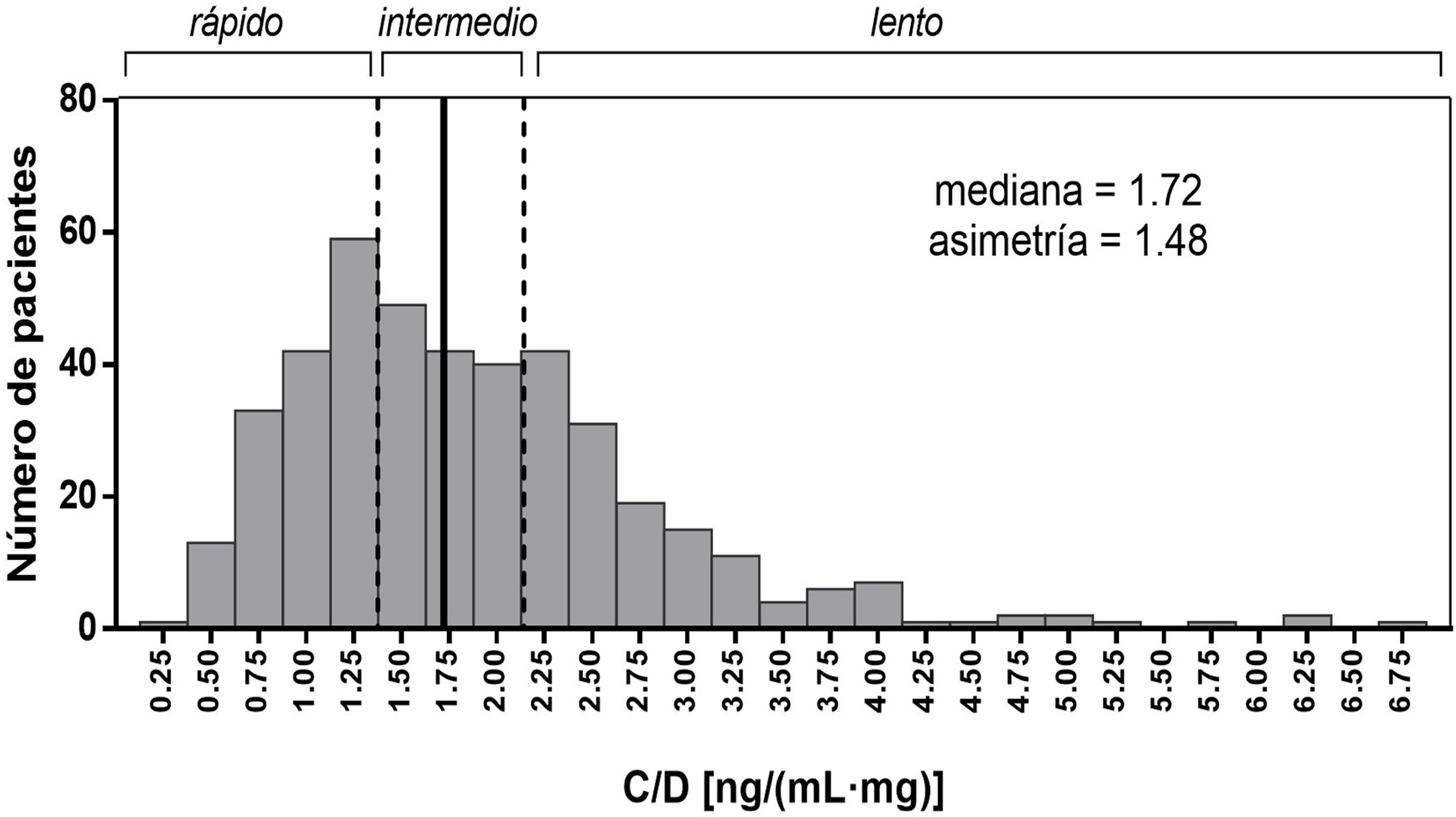
El promedio del cociente C/D de los meses 1, 3 y 6 se usó para categorizar a los tres grupos de pacientes según su tasa de metabolismo del Tac (rápida, intermedia y lenta). Se clasificaron equitativamente los pacientes en tres grupos: los metabolizadores intermedios se agruparon alrededor de la mediana del cociente C/D (1,33-2.156). Un cociente C/D < 1,33 (ng/mL)/mg se definió como metabolizadores rápidos y ≥ 2.156 (ng/mL)/mg como metabolizadores lentos (fig. 2).
Histograma de la distribución de la variable promedio de los valores C/D (ng/mL) /mg de Tac a los 1, 3 y 6 meses postrasplante. Los pacientes con valores C/D < 1,33 (ng/mL)/mg (percentil 33,3%) se consideraron metabolizadores rápidos, con valores C/D ≥ 2.156 (ng/mL) /mg (percentil 66,7%) se consideraron metabolizadores lentos y los intermedios con un valor C/D entre 1,33-2.156.
Las dosis de Tac fueron ajustadas según criterio clínico para mantener los niveles de concentración en sangre dentro del rango terapéutico establecido (6-10 ng/mL). Se usaron los valores de C/D de Tac de los tiempos tres, seis y 12 meses postrasplante para calcular la variabilidad intraindividual mediante una fórmula previamente descrita en la literatura (CV [%] = [desviación estándar/promedio de concentración de Tac] x 100)25. Se consideraron los valores de concentración divididos por la dosis total diaria de Tac con la intención de evitar los efectos en la variabilidad intraindividual provocados por los ajustes de dosis que hubiera durante el seguimiento del paciente a lo largo del primer año postrasplante.
GenotipadoEl DNA genómico se extrajo de sangre periférica mediante los kits Maxwell®RSC Whole Blood DNA Kit o Maxwell®RSC Buffy Coat DNA Kit (Promega Corporation, Sydney, Australia) y se almacenó a -80 ̊C. Para el genotipado, las reacciones de discriminación alélica se realizaron en el aparato 7900HT Fast Real-Time PCR Systems (Applied Biosystems, CA, EE. UU.) usando sondas TaqMan específicas (C__59013445_10 para el CYP3A4*22 rs35599367 y C__26201809_30 para el CYP3A5*3 rs776746 [Thermo Fisher Scientific, MA, EE. UU.]). Los genotipos se asignaron con el software Taqman Genotyper (Thermo Fisher Scientific). De acuerdo con el defecto funcional asociado a ambas variantes alélicas y con los datos reportados en la literatura26, se clasificaron los pacientes en tres grupos metabolizadores: rápidos (portadores del CYP3A5*1 y CYP34A *1/*1), intermedios (CYP3A5 *3/3 y CYP3A4 *1/*1) y lentos (CYP3A5 *3/*3 y portadores del CYP3A4*22).
Análisis estadísticoLas variables categóricas se expresaron como frecuencias y porcentajes y las variables continuas como medianas (rangos intercuartílicos; mínimo-máximo). Los porcentajes se compararon mediante la prueba de χ2 o el test de Fisher, y las variables continuas mediante ANOVA o el test de Kruskal-Wallis según si seguían una distribución normal o no, respectivamente. Para estudiar correlación se usó la prueba de Spearman. El análisis del equilibrio de Hardy-Weinberg se realizó utilizando la prueba de χ2 sobre el conjunto de todos los individuos genotipados. Todos los análisis se realizaron con los programas IBM SPSS Statistics v. 25 (IBM Corp., Armonk, NY, EE. UU.) y GraphPad for Windows v.6.0 (La Jolla, CA, EE. UU.).
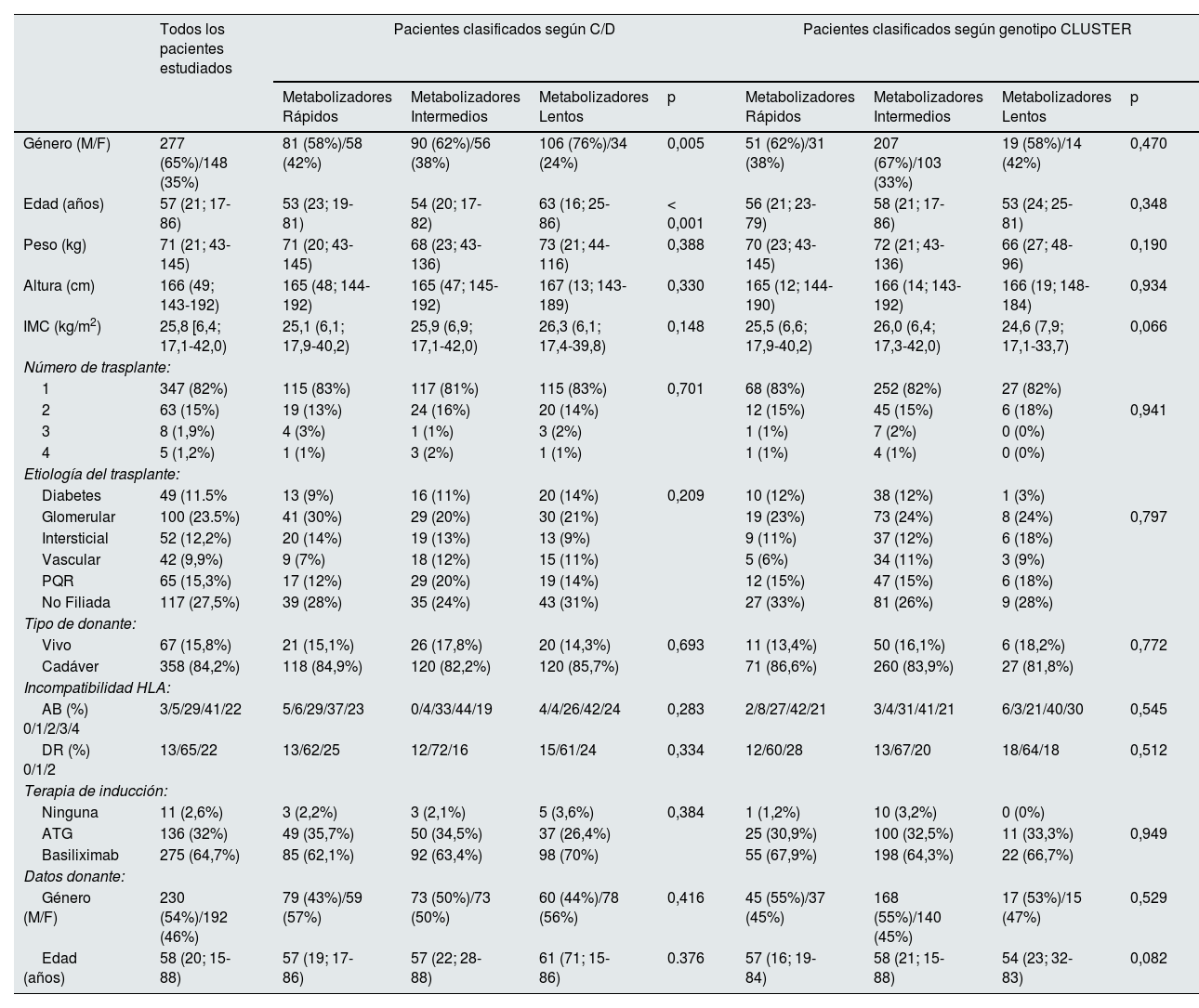
ResultadosCaracterísticas y clasificación de los pacientesDe los 1.060 pacientes de trasplante renal entre los años 2013 y 2020, 425 pacientes cumplieron con los requisitos para entrar en este estudio. La mayoría de los pacientes eran hombres con una mediana de edad de 57 años y sus características demográficas se presentan en la tabla 1.
Datos demográficos de la población de estudio
| Todos los pacientes estudiados | Pacientes clasificados según C/D | Pacientes clasificados según genotipo CLUSTER | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Metabolizadores Rápidos | Metabolizadores Intermedios | Metabolizadores Lentos | p | Metabolizadores Rápidos | Metabolizadores Intermedios | Metabolizadores Lentos | p | ||
| Género (M/F) | 277 (65%)/148 (35%) | 81 (58%)/58 (42%) | 90 (62%)/56 (38%) | 106 (76%)/34 (24%) | 0,005 | 51 (62%)/31 (38%) | 207 (67%)/103 (33%) | 19 (58%)/14 (42%) | 0,470 |
| Edad (años) | 57 (21; 17-86) | 53 (23; 19-81) | 54 (20; 17-82) | 63 (16; 25-86) | < 0,001 | 56 (21; 23-79) | 58 (21; 17-86) | 53 (24; 25-81) | 0,348 |
| Peso (kg) | 71 (21; 43-145) | 71 (20; 43-145) | 68 (23; 43-136) | 73 (21; 44-116) | 0,388 | 70 (23; 43-145) | 72 (21; 43-136) | 66 (27; 48-96) | 0,190 |
| Altura (cm) | 166 (49; 143-192) | 165 (48; 144-192) | 165 (47; 145-192) | 167 (13; 143-189) | 0,330 | 165 (12; 144-190) | 166 (14; 143-192) | 166 (19; 148-184) | 0,934 |
| IMC (kg/m2) | 25,8 [6,4; 17,1-42,0) | 25,1 (6,1; 17,9-40,2) | 25,9 (6,9; 17,1-42,0) | 26,3 (6,1; 17,4-39,8) | 0,148 | 25,5 (6,6; 17,9-40,2) | 26,0 (6,4; 17,3-42,0) | 24,6 (7,9; 17,1-33,7) | 0,066 |
| Número de trasplante: | |||||||||
| 1 | 347 (82%) | 115 (83%) | 117 (81%) | 115 (83%) | 0,701 | 68 (83%) | 252 (82%) | 27 (82%) | |
| 2 | 63 (15%) | 19 (13%) | 24 (16%) | 20 (14%) | 12 (15%) | 45 (15%) | 6 (18%) | 0,941 | |
| 3 | 8 (1,9%) | 4 (3%) | 1 (1%) | 3 (2%) | 1 (1%) | 7 (2%) | 0 (0%) | ||
| 4 | 5 (1,2%) | 1 (1%) | 3 (2%) | 1 (1%) | 1 (1%) | 4 (1%) | 0 (0%) | ||
| Etiología del trasplante: | |||||||||
| Diabetes | 49 (11.5% | 13 (9%) | 16 (11%) | 20 (14%) | 0,209 | 10 (12%) | 38 (12%) | 1 (3%) | |
| Glomerular | 100 (23.5%) | 41 (30%) | 29 (20%) | 30 (21%) | 19 (23%) | 73 (24%) | 8 (24%) | 0,797 | |
| Intersticial | 52 (12,2%) | 20 (14%) | 19 (13%) | 13 (9%) | 9 (11%) | 37 (12%) | 6 (18%) | ||
| Vascular | 42 (9,9%) | 9 (7%) | 18 (12%) | 15 (11%) | 5 (6%) | 34 (11%) | 3 (9%) | ||
| PQR | 65 (15,3%) | 17 (12%) | 29 (20%) | 19 (14%) | 12 (15%) | 47 (15%) | 6 (18%) | ||
| No Filiada | 117 (27,5%) | 39 (28%) | 35 (24%) | 43 (31%) | 27 (33%) | 81 (26%) | 9 (28%) | ||
| Tipo de donante: | |||||||||
| Vivo | 67 (15,8%) | 21 (15,1%) | 26 (17,8%) | 20 (14,3%) | 0,693 | 11 (13,4%) | 50 (16,1%) | 6 (18,2%) | 0,772 |
| Cadáver | 358 (84,2%) | 118 (84,9%) | 120 (82,2%) | 120 (85,7%) | 71 (86,6%) | 260 (83,9%) | 27 (81,8%) | ||
| Incompatibilidad HLA: | |||||||||
| AB (%) 0/1/2/3/4 | 3/5/29/41/22 | 5/6/29/37/23 | 0/4/33/44/19 | 4/4/26/42/24 | 0,283 | 2/8/27/42/21 | 3/4/31/41/21 | 6/3/21/40/30 | 0,545 |
| DR (%) 0/1/2 | 13/65/22 | 13/62/25 | 12/72/16 | 15/61/24 | 0,334 | 12/60/28 | 13/67/20 | 18/64/18 | 0,512 |
| Terapia de inducción: | |||||||||
| Ninguna | 11 (2,6%) | 3 (2,2%) | 3 (2,1%) | 5 (3,6%) | 0,384 | 1 (1,2%) | 10 (3,2%) | 0 (0%) | |
| ATG | 136 (32%) | 49 (35,7%) | 50 (34,5%) | 37 (26,4%) | 25 (30,9%) | 100 (32,5%) | 11 (33,3%) | 0,949 | |
| Basiliximab | 275 (64,7%) | 85 (62,1%) | 92 (63,4%) | 98 (70%) | 55 (67,9%) | 198 (64,3%) | 22 (66,7%) | ||
| Datos donante: | |||||||||
| Género (M/F) | 230 (54%)/192 (46%) | 79 (43%)/59 (57%) | 73 (50%)/73 (50%) | 60 (44%)/78 (56%) | 0,416 | 45 (55%)/37 (45%) | 168 (55%)/140 (45%) | 17 (53%)/15 (47%) | 0,529 |
| Edad (años) | 58 (20; 15-88) | 57 (19; 17-86) | 57 (22; 28-88) | 61 (71; 15-86) | 0.376 | 57 (16; 19-84) | 58 (21; 15-88) | 54 (23; 32-83) | 0,082 |
Se presentan los datos de la mediana [rango intercuartílico; mínimo-máximo] de las variables contínuas y el número de pacientes junto con el porcentaje que representan en el caso de las variables categóricas.
A partir de los datos de concentración y dosis de Tac en los meses 1-3-6 postrasplante, se calculó el cociente C/D de los pacientes obteniéndose un valor de mediana de 1,72 (ng/mL)/mg y se usaron los valores límite establecidos en los terciles para clasificar los pacientes según su capacidad metabolizadora. Los pacientes con valores del cociente C/D inferiores a 1,33 (ng/mL)/mg fueron considerados metabolizadores rápidos (139 pacientes; 32,7% del total); los pacientes con un cociente C/D entre 1,33 y 2,16 (ng/mL)/mg se clasificaron como metabolizadores intermedios (146 pacientes; 34,4%); y los pacientes con un cociente C/D superior a 2.156 (ng/mL)/mg, como metabolizadores lentos (140 pacientes; 32,9%) (fig. 2). Las características demográficas de los tres grupos de pacientes fueron homogéneas, excepto para la edad que fue significativamente mayor en el grupo de metabolizadores lentos (tabla 1).
El genotipado de los 425 pacientes reveló que para el CYP3A4 había 389 (90,8%) pacientes homocigotos CYP3A4 *1/*1 y 39 (9.2%) pacientes heterocigotos CYP3A4 *1/*22, sin detectarse ningún homocigoto CYP3A4 *22/*22. La frecuencia del alelo *22 era de 5%, similar a lo descrito en la literatura6 y la distribución genotípica no se desvió del equilibrio Hardy-Weinberg (χ2 = 0,982; p = 0,322). En el caso del CYP3A5, 10 (2,4%) de los pacientes eran homocigotos CYP3A5 *1/*1, 72 (16,9%) eran heterocigotos CYP3A5 *1/*3 y 343 (80,7%) eran homocigotos CYP3A5 *3/*3, dando una frecuencia de 89% para el alelo *3, acorde con nuestra población de pacientes principalmente caucásicos, y con una distribución genotípica que se desvía significativamente del equilibrio de Hardy-Weinberg (χ2 = 6.368; p = 0,012). Combinando los alelos de los CYP3A4 y CYP3A5 según su fenotipo metabolizador, se clasificaron los pacientes en tres grupos: 82 (19,3%) metabolizadores rápidos, 310 (72,9%) intermedios y 33 (7,8%) lentos. No se encontraron diferencias significativas en las características demográficas de los tres grupos (tabla 1).
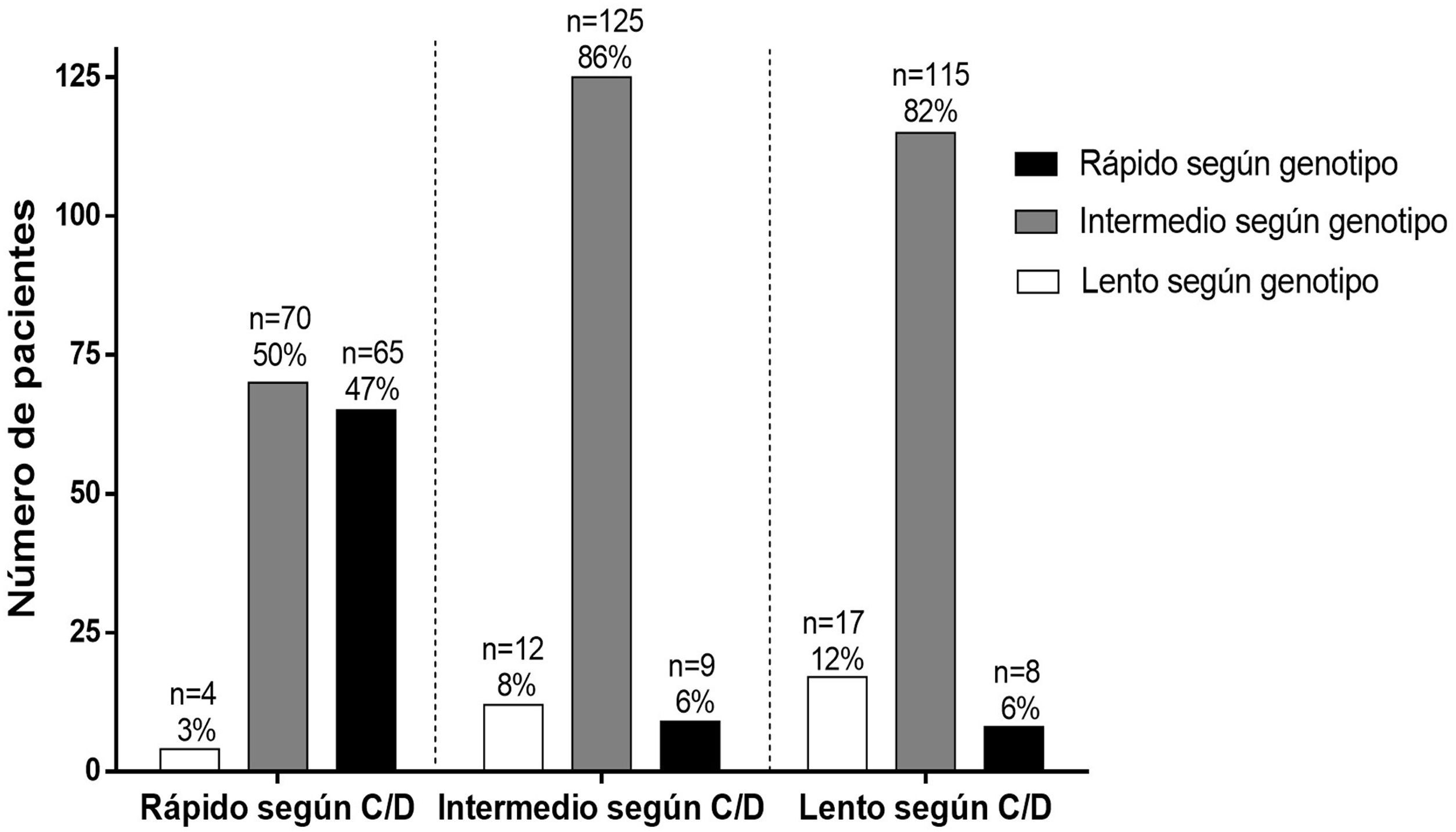
Al comparar los pacientes incluidos en cada grupo metabolizador según los dos criterios de clasificación establecidos, 47% (65/139) de los metabolizadores rápidos según el criterio C/D son también rápidos según el criterio genético. El 85% (125/146) de los metabolizadores intermedios según el criterio C/D también son intermedios según el criterio genético, y solo 12% (17/140) de los metabolizadores lentos según el criterio C/D son lentos según el criterio genético (fig. 3).
Clasificación de los pacientes con los dos criterios de clasificación estudiados: cociente C/D y genotipo del clúster CYP3A4-CYP3A5. Cada columna representa un grupo de pacientes clasificados con ambos criterios con el fin de visualizar cuántos pacientes coinciden con los dos sistemas de clasificación.
Tras el análisis de la clasificación de la población trasplantada según los dos criterios, se exploró el papel de la variable edad de los pacientes en la clasificación donde se agrupaban. Se encontró una ligera correlación positiva considerando la edad de todos los pacientes y el cociente C/D de Tac (r = 0,213; p < 0,0001). Una vez repartidos los pacientes en los grupos metabolizadores según el criterio genético, no se detectaron diferencias de edad entre los grupos (tabla 1); pero si se estratificaba cada grupo según los valores de C/D de los pacientes, los pacientes con valores C/D más pequeños dentro de cada grupo metabolizador tenían menor edad (Figura S1 del Material Suplementario). Por otro lado, con el criterio de clasificación según el cociente C/D, los pacientes de los tres grupos metabolizadores tenían una mediana de edad diferente (tabla 1), pero dentro de cada grupo metabolizador no se detectaba ninguna correlación entre edad y cociente C/D (metabolizadores rápidos r = 0,052, p = 0,540; intermedios r = 0,015, p = 0,857; lentos r = -0,015 y p = 0,857).
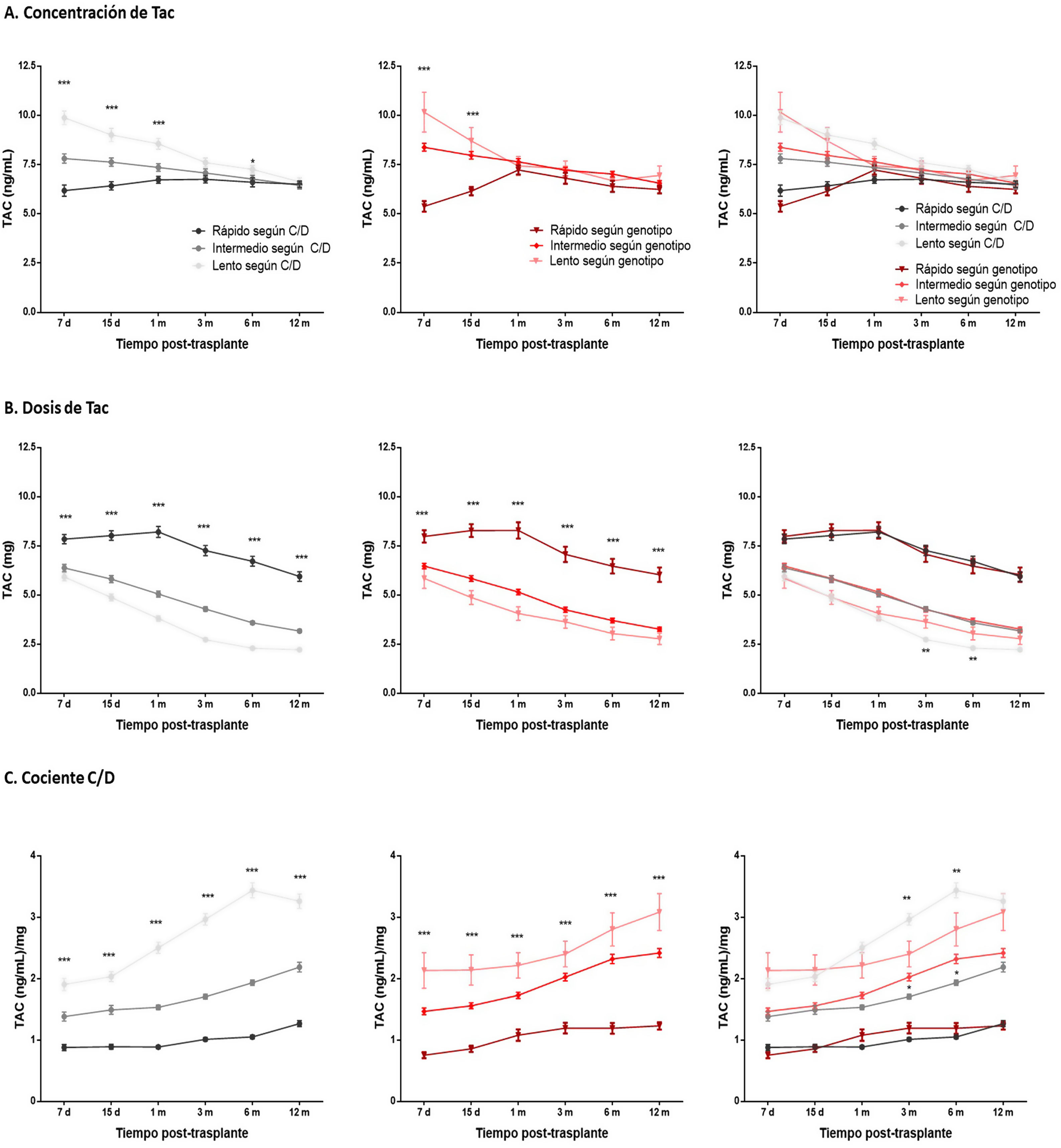
Exposición a tacrolimus según los dos criterios de clasificación estudiadosLa repercusión de los fenotipos metabolizadores sobre los niveles de Tac en sangre predosis fue valorada mediante la comparación de las medianas de los pacientes agrupados según cada criterio de clasificación. En ambos casos, se observaron concentraciones de Tac estadísticamente menores en los metabolizadores rápidos y estadísticamente mayores en los metabolizadores lentos si los comparamos con el grupo metabolizador intermedio. Estas diferencias solamente se detectaron en los primeros días postrasplante (fig. 4A). No se detectaron diferencias significativas cuando se compraron los niveles de Tac entre cada grupo de metabolización: rápidos según C/D vs. genotipo, intermedios según C/D vs. genotipo y lentos según C/D vs. genotipo.
Exposición a Tac de los pacientes a lo largo del primer año postrasplante renal. Los gráficos representan los datos de la media ± error estándar de las determinaciones de los niveles de Tac en sangre (A), de las dosis de Tac (B) y del cociente C/D (C) de los pacientes clasificados según el criterio C/D (paneles de la izquierda), o según el criterio genético (páneles centrales) y ambos criterios (paneles de la derecha).
*** p < 0,001, ** p < 0,01, * p < 0,05 comparando los grupos dentro de cada sistema de clasificación mediante la prueba de Kruskal-Wallis, o comparando los grupos metabolizadores homónimos de cada sistema de clasificación mediante la prueba de Mann-Whitney.
Los pacientes metabolizadores rápidos de ambas clasificaciones requirieron alrededor de 60% más de dosis de Tac que los metabolizadores intermedios a lo largo del seguimiento, mientras que los metabolizadores lentos aproximadamente 20% menos de dosis que los intermedios (fig. 4B). A los tres y seis meses, los metabolizadores lentos según genotipo recibieron dosis de Tac estadísticamente superiores a los pacientes considerados metabolizadores lentos según su cociente C/D (fig. 4B). Por otro lado, comparando las dosis iniciales de cada grupo con las dosis requeridas a lo largo del seguimiento, se observa una disminución estadísticamente significativa de la dosis requerida entre la semana y los 12 meses postrasplante. Tanto para los metabolizadores rápidos según C/D como para los metabolizadores rápidos según genotipo, los pacientes reciben al año postrasplante una dosis 15% menor que la inicial (7-8 mg de dosis mediana a los siete días postrasplante vs. 6 mg al año postrasplante). Ambos sistemas de clasificación también coinciden en que los pacientes considerados metabolizadores intermedios reciben una dosis 50% menor al final del seguimiento respecto a la dosis inicial (6 mg de mediana a los siete días vs. 3 mg al año) y los metabolizadores lentos, 67% menor (6 mg de mediana a los siete días vs. 2 mg al año) (fig. 4B).
Al analizar el cociente C/D durante el primer año postrasplante, los pacientes agrupados según el criterio del cociente C/D presentaron diferentes niveles de C/D a lo largo del seguimiento, tal como establece el propio criterio de clasificación (fig. 4C). Para el sistema de clasificación según genotipo, los metabolizadores rápidos también mostraron valores del cociente C/D significativamente menores que el grupo metabolizador intermedio en todos los tiempos estudiados, mientras que los metabolizadores lentos tuvieron valores del cociente C/D significativamente más altos (fig. 4C). A lo largo del seguimiento, los valores C/D de todos los grupos metabolizadores van aumentando como reflejo de la disminución de la dosis, observándose al año valores de C/D mayores que los iniciales (p < 0,0001).
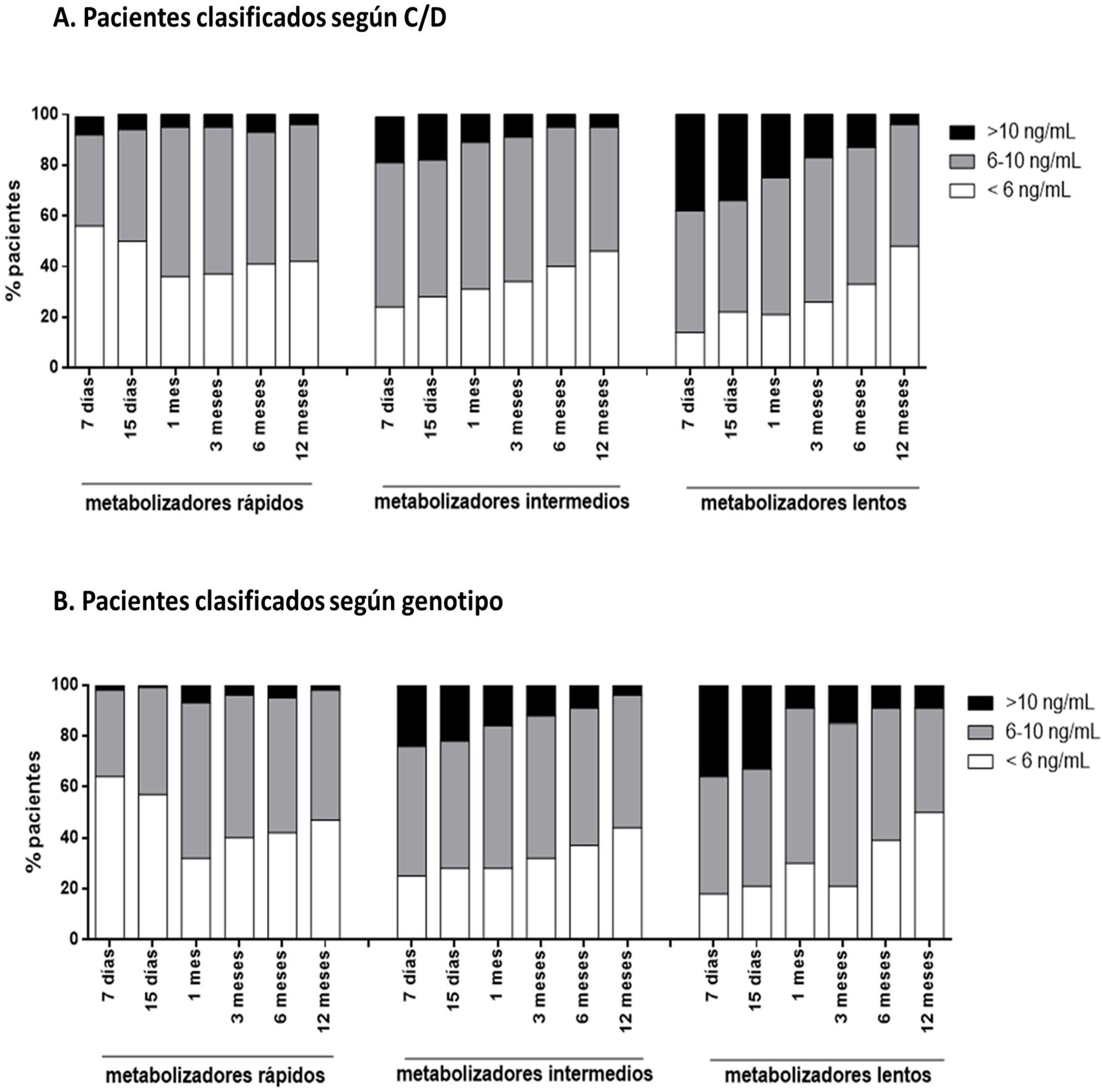
Pacientes en rango terapéuticoSe ha estudiado el porcentaje de pacientes que estaban en el rango terapéutico de Tac (6-10 ng/mL). Los pacientes metabolizadores rápidos clasificados por ambos criterios presentan un porcentaje mayor de veces con valores de concentración de Tac en sangre infraterapéuticos (44% metabolizadores rápidos según C/D, 34% intermedios según C/D, 27% lentos según C/D; p < 0,0001; 47% metabolizadores rápidos según genotipo, 32% intermedios según genotipo, 30% lentos según genotipo p < 0,0001). Por otro lado, los metabolizadores lentos muestran un porcentaje mayor de veces con valores supraterapéuticos (5% metabolizadores rápidos según C/D, 11% intermedios, 22% lentos, p < 0,0001; 4% metabolizadores rápidos según genotipo, 14% intermedios, 19% lentos, p < 0,0001) (fig. 5).
Representación del porcentaje de pacientes que están infra- o supraexpuestos a Tac a lo largo del primer año postrasplante renal. Cada columna representa los valores del porcentaje que un determinado grupo metabolizador de pacientes está en diana (6-10 ng/mL, color gris), infraexpuesto (< 6 ng/mL, color blanco) o supraexpuesto (> 10 ng/mL, color negro) al Tac en un determinado tiempo postrasplante.
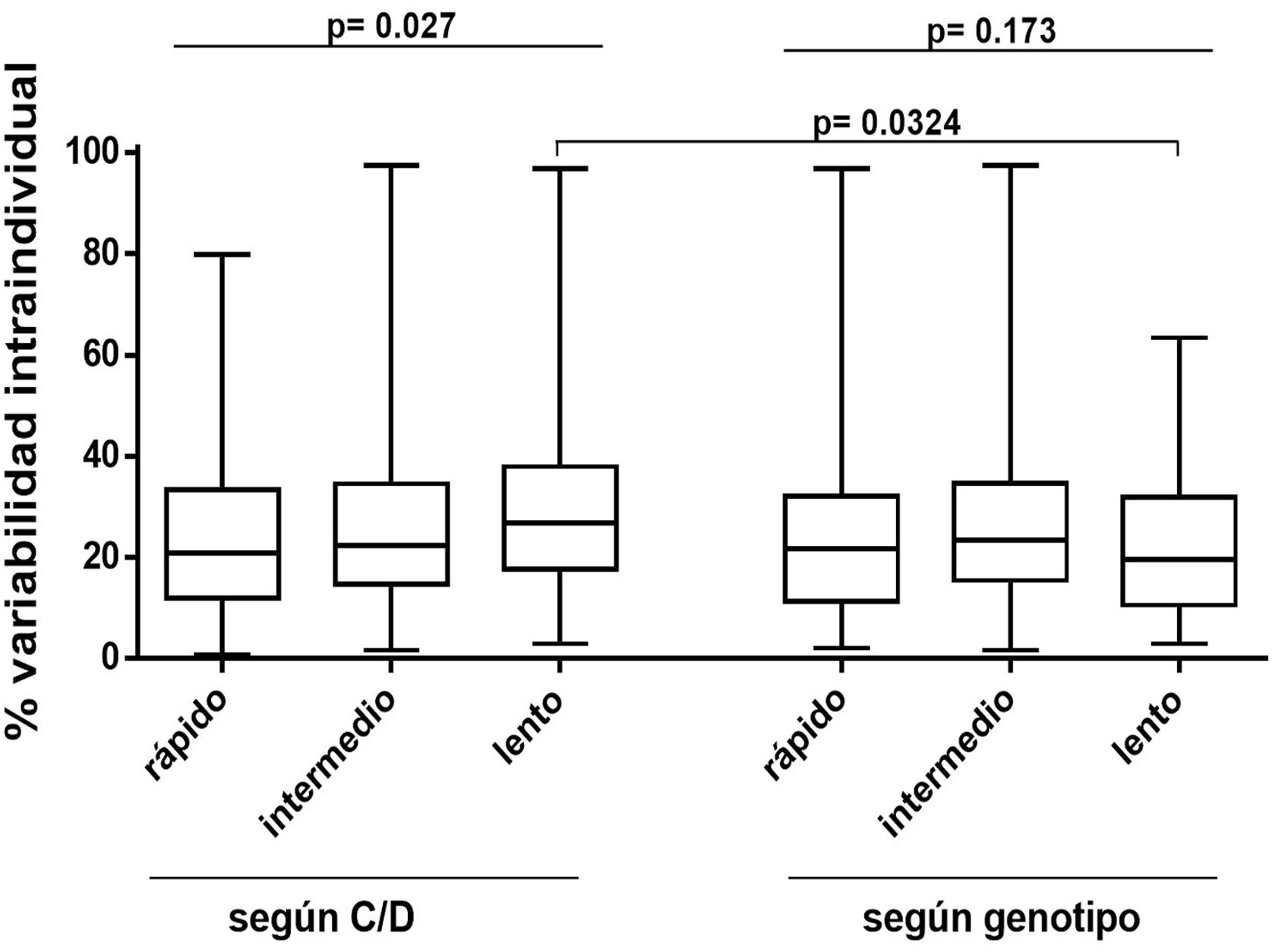
La variabilidad intraindividual durante el primer año fue similar entre los distintos grupos metabolizadores de la clasificación según genotipo (25,6% para los metabolizadores rápidos, 26,7% los intermedios y 23% los lentos; p = 0,173) (fig. 6). En cambio, se observó que en la clasificación según C/D los metabolizadores lentos presentaban mayor variabilidad intraindividual que los rápidos e intermedios (29,8 vs. 24,3% y 25,9%, respectivamente; p = 0,027). No hubo diferencias entre los dos criterios de clasificación estudiados excepto en el caso de los metabolizadores lentos, siendo los clasificados según C/D los que presentaban una variabilidad intraindividual significativamente mayor (fig. 6).
Análisis de la variabilidad intraindividual de los pacientes agrupados según ambos criterios de clasificación del metabolismo del Tac. Se representan los diagramas de cajas de los valores del porcentaje de variabilidad intraindividual de cada grupo. Se muestran los valores del valor p obtenido al comparar los grupos de cada sistema de clasificación mediante la prueba de Kruskal-Wallis, o comparando los grupos metabolizadores homónimos de cada sistema de clasificación mediante la prueba de Mann-Whitney.
Durante el primer año de seguimiento postrasplante, los niveles de creatinina no fueron significativamente diferentes entre los diferentes grupos de los dos criterios de clasificación. Tampoco se encontraron diferencias en la incidencia de función retardada del injerto, de rechazo agudo (Figura S2 del Material Suplementario), ni de pérdida de injerto entre los grupos metabolizadores, independientemente del sistema de clasificación.
DiscusiónMantener un buen régimen inmunosupresor, principalmente en las primeras etapas postrasplante renal es crucial para asegurar un buen pronóstico del injerto a largo plazo. La alta variabilidad intra e interindividual del Tac hace que el ajuste de dosis correcto sea un reto. Conocer el fenotipo metabolizador del paciente trasplantado puede ser de ayuda en este hito.
En los últimos años han aparecido varios estudios que plantean calcular el cociente C/D como estimación de la tasa de metabolización del Tac del paciente trasplantado12–22. No obstante, no existe un criterio consensuado para los estudios C/D. El grupo de Thölking et al.12 dividieron la población en tres grupos según los percentiles de su cohorte, definiendo un coeficiente C/D inferior a 1,05 (ng/mL)/mg para los metabolizadores rápidos, entre 1,05 y 1,55 (ng/mL)/mg para los metabolizadores intermedios, y superior a 1,55 (ng/mL)/mg para los metabolizadores lentos. El valor de 1,05 (ng/mL)/mg para definir la población metabolizadora rápida se ha usado también en otros trabajos, aunque se haya modificado la población de estudio14,19,21. En el caso de la cohorte que se presenta en este estudio, el valor de la mediana del cociente C/D fue (1,74 y 1,29, respectivamente), superior al del estudio de Thölking12. Siguiendo la clasificación de los pacientes según los valores propuestos por Thölking et al.12, la distribución de los pacientes según su metabolización no hubiera sido equitativa (53 rápidos, 81 intermedios y 191 lentos). Por este motivo, se clasificaron los pacientes según los valores límite establecidos en los terciles (C/D < 1,33 [ng/mL]/mg metabolizadores rápidos, C/D 1,33-2.156[(ng/mL]/mg metabolizadores intermedios y C/D ≥ 2.156 [ng/mL]/mg para los metabolizadores lentos). Otros trabajos también han seguido esta estrategia para establecer los valores límite del intervalo17,18. Estas discrepancias en los valores de la mediana de C/D obtenidos en los diferentes estudios podrían explicarse tanto por diferencias en la etnia de los pacientes incluidos en los estudios, como por los diferentes rangos terapéuticos que se instauran en cada hospital.
Para establecer los grupos metabolizadores, en la bibliografía hay estudios C/D que clasifican los pacientes en dos grupos (metabolizadores rápidos y no rápidos)14,17,18,21,22 y estudios con tres grupos (rápidos, intermedios y lentos). Además, y más importante, también existen discrepancias en el número de medidas C/D que se deben considerar para el cálculo del cociente y en qué tiempos a lo largo del postrasplante12,14,17,21. En nuestro estudio, los valores de C/D van aumentando a lo largo del tiempo, así como va disminuyendo la dosis de Tac. En consecuencia, según la estrategia utilizada para establecer el cociente C/D, un mismo paciente podría pertenecer a diferentes grupos metabolizadores.
Por definición, el fenotipo representa el resultado de la interacción entre el genotipo del individuo y su relación con el medio. Para introducir los términos genéticos en la metabolización del Tac, se deben tener en cuenta los polimorfismos de sus enzimas metabolizadores, principalmente el CYP3A4 y CYP3A56,9,26. Siguiendo el criterio genético, la cohorte de pacientes de este estudio se repartió en tres grupos con un número de pacientes no equitativo (82 metabolizadores rápidos, 310 intermedios y 33 lentos) como consecuencia de la baja prevalencia de los alelos CYP3A4*22 y CYP3A5*1 en la población caucásica6,27. En nuestro estudio, los pacientes metabolizadores rápidos requirieron al menos el doble de dosis que los metabolizadores lentos para mantener los niveles de Tac en sangre en el rango terapéutico, corroborando resultados previamente descritos9,26. Las diferencias de dosis comportaron un cociente C/D significativamente diferente entre los tres grupos definidos según genotipo rápido, intermedio o lento en función del clúster de los polimorfismos del CYP3A4 y CYP3A5.
Se compararon la proporción de pacientes de cada grupo metabolizador establecido según genotipo que coincidía con el grupo homónimo definido según el criterio C/D. Los resultados mostraron que no todos los pacientes considerados metabolizadores rápidos según genotipo tenían valores de C/D bajos. A su vez, se observaron los mismos resultados discordantes al analizar con ambos criterios la población intermedia y la población lenta. Para entender esta discrepancia, y teniendo en cuenta que la velocidad del aclaramiento de un fármaco se enlentece con la edad, se consideró esta variable como posible factor para explicar estas diferencias. Los resultados mostraron que la edad de los pacientes de los grupos establecidos según criterio C/D fue significativamente diferente, siendo los pacientes jóvenes quienes presentaron valores menores y los mayores los que presentaban valores más elevados, tal y como también se había descrito previamente en la literatura12,14,17. Cuando analizamos las edades dentro de cada grupo metabolizador establecido según genotipo, se observó una clara tendencia a que los pacientes mayores tuvieran valores de C/D elevados y viceversa. Estas observaciones refuerzan la idea de que, aparte de los criterios genéticos también deben considerarse otras variables (adherencia al tratamiento, diarrea, dosis de corticoides, albúmina plasmática, hematocrito) para el ajuste personalizado del Tac, tal como demuestran varios estudios11,28–30. Para integrar todos los factores que influyen en la exposición de Tac, se han desarrollado modelos PopPK que incluyen los polimorfismos genéticos del CYP3A junto con otros factores que también afectan a la farmacocinética del Tac (edad, albúmina plasmática, superficie corporal, comedicación y hematocrito)1,31,32.
Los períodos en que los pacientes están infra o supraexpuestos al Tac aumentan el riesgo de rechazo y toxicidad respectivamente. Con los dos criterios de clasificación del fenotipo metabolizador de los pacientes analizados en este estudio, los pacientes metabolizadores rápidos presentaron mayor porcentaje de infraexposición al Tac que los otros grupos. Por otro lado, los pacientes considerados lentos presentaron mayor porcentaje de supraexposición que se podría explicar por su menor tasa de aclaramiento total del fármaco. Los metabolizadores lentos según C/D también presentaron mayor variabilidad intraindividual que podría ser inherente a la dificultad de ajustar la dosis en estos pacientes. No se observó esta tendencia en el caso de los metabolizadores lentos según genotipo, posiblemente porque el tamaño de muestra es menor y que los pacientes son más homogéneos, en comparación con el grupo de metabolizadores lentos según C/D quienes pueden tener diferente genotipo metabolizador.
Por último, se investigó la influencia de los grupos metabolizadores en la evolución del injerto durante el primer año postrasplante considerando los niveles de creatinina, la incidencia de función retardada del injerto, la incidencia de rechazo agudo y la de pérdida del injerto. No se detectaron diferencias entre grupos metabolizadores independientemente del criterio de clasificación. En estudios previos que tenían en cuenta el genotipo tampoco se observaron diferencias durante el primer año postrasplante9. Los estudios que analizaban la evolución de los pacientes a más largo plazo (dos a cinco años) observaron que los pacientes metabolizadores rápidos pueden tener mayor incidencia de nefrotoxicidad19, peor función renal12,16,18,22, o menor supervivencia del injerto14. Sin embargo, existen estudios que no encontraron diferencias significativas entre grupos metabolizadores en relación con el progreso del injerto a largo plazo15,17, probablemente por su sistema de clasificación. El grupo de Bartlett et al.17 dividió la población en dos grupos (metabolizadores rápidos y no rápidos) con un valor límite de C/D 2,04 (ng/mL)/mg, mayor que el del resto de estudios que consideran metabolizadores rápidos a los metabolizadores con un valor de C/D alrededor de 1,05 (ng/mL) /mg. En el caso de Bartmann et al.15 consideraron valores C/D de los primeros días postrasplante cuando existe más variabilidad. Sería interesante para nuestro estudio hacer un seguimiento a largo plazo de los pacientes con el fin de analizar si la incidencia de eventos a largo plazo es la misma en los grupos metabolizadores establecidos según los dos criterios de clasificación propuestos.
Conocer el grupo metabolizador según genotipo ofrece la ventaja de adaptar la dosificación del Tac según fenotipo metabolizador del paciente desde el inicio del trasplante mejorando la exposición al Tac. La observación de la evolución de la dosis del Tac a lo largo del seguimiento postrasplante conlleva a recomendar que los pacientes metabolizadores rápidos requieren 60% más de dosis que los intermedios, mientras que los metabolizadores lentos requieren 20% menos que los intermedios. Por otro lado, la clasificación de los pacientes según el cociente C/D, aunque es más simple, tiene la limitación de que requiere recopilar datos durante el seguimiento postrasplante del paciente y, en consecuencia, no se puede usar como herramienta de ayuda a la dosificación en el período inmediato al trasplante cuando es más necesario afinar el ajuste de dosis. Sin embargo, la clasificación C/D permitiría identificar cuáles son los pacientes con más riesgo a largo plazo.
En conclusión, en nuestra cohorte de pacientes tanto la determinación de su fenotipo metabolizador según genotipo o bien según el cociente C/D permiten distinguir los pacientes según su exposición al Tac, sin encontrar diferencias en eventos adversos para el injerto durante el primer año postrasplante renal. Probablemente la combinación de ambos criterios de clasificación sería una buena herramienta en el manejo de la dosificación de Tac para los pacientes trasplantados. La modelización popPK del Tac incorporando estos parámetros podría ser un paso adelante hacia la terapia personalizada en el trasplante de órganos, al refinar el ajuste de la dosis de mantenimiento de Tac.
- 1.
El estudio del clúster de los polimorfismos del CYP3A4 y CYP3A5 ha definido tres poblaciones que presentan diferencias en el aclaramiento al Tac. Los pacientes portadores del alelo funcional *1 requieren al menos el doble de dosis que los que no son portadores.
- 2.
El estudio de la relación C/D distribuye la población en terciles para definir el metabolismo del Tac. Se plantea como una herramienta adicional para el seguimiento del ajuste de Tac en los pacientes trasplantados.
- 3.
Es importante usar nuevas herramientas para poder personalizar el tratamiento de ajuste de dosis del Tac y limitar el tiempo en que los receptores de trasplantes están sub- o sobreexpuestos para minimizar los riesgos de rechazo y toxicidad, respectivamente. Los modelos de cinética poblacional (PPK) en los que se incluyen diferentes factores que pueden explicar la variabilidad del Tac pueden ayudar a optimizar el ajuste individualizado de dosis de Tac en el postrasplante.
Este estudio ha sido financiado con una ayuda del Instituto de Salud Carlos III y del Ministerio de Sanidad y Consumo (PI18/01740), Sociedad Española de Nefrología (17PSJ026), y el Fondo Europeo para el Desarrollo Regional (FEDER) cofinanciado por fondos FEDER/Fondo Europeo de Desarrollo Regional (FEDER), una forma de construir Europa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos el excelente soporte técnico de B. Barroso, E. Castaño y B. Torrejón del Centro Científico y Tecnológico de la Universidad de Barcelona (CCiT-UB).