Objetivos: El objetivo del presente estudio es analizar los factores que influyen en la progresión de la insuficiencia renal crónica en pacientes con enfermedad poliquística autosómica dominante (PQRAD). Material y métodos: Estudiamos a 101 pacientes (edad media: 43,6 ± 17,3, 43,6% varones). La mediana (rango intercuartílico) de seguimiento es de 69 (128-35) meses desde 1997 hasta 2010. Analizamos la progresión de dos formas: 1) tiempo hasta evento renal definido como la reducción del filtrado glomerular estimado (FGe) en un 50% desde la primera visita y/o entrada en diálisis, y 2) cambio medio en el FGe/año. Se recogieron en cada visita datos clínicos y demográficos, presión arterial sistólica (PAS) y diastólica (PAD), medicación concomitante y parámetros analíticos. También se recogió el tamaño renal basal medido por ecografía. Resultados: Treinta y un pacientes tuvieron un evento renal. La mediana de tiempo hasta la aparición del evento es de 102 (131-53) meses. Los pacientes que tuvieron un evento renal tenían basalmente mayor PAS y PAD (p = 0,017 y p = 0,001, respectivamente), mayores niveles de acido úrico (p = 0,041), mayor colesterol LDL (p = 0,001), mayor proteinuria (p = 0,033) y mayor tamaño renal (p = 0,05). El cambio medio de FGe/anual fue de –3,52 ± 7,3 ml/min/1,73 m2, 49 pacientes presentaron un descenso rápido de función renal: Grupo A (> –3,52 ml/min/1,73 m2) y 52 pacientes tuvieron una progresión lenta de la insuficiencia renal: Grupo B (< –3,2 ml/min/1,73 m2). Por regresión de Cox, en un modelo ajustado, la PAS y la menor edad al diagnóstico son las variables que mantienen su poder predictivo de mal pronóstico renal (p = 0,026). Conclusiones: La función renal inicial, proteinuria, tamaño renal, hipercolesterolemia, hiperuricemia y PAS basal son factores que influyen en la progresión de la insuficiencia renal en la PQRAD, siendo la PAS y la menor edad los factores que mantienen su poder predictivo independiente en el análisis multivariante.
Objectives: The aim of this study was to analyse the factors influencing chronic kidney disease (CKD) progression in patients with autosomal dominant polycystic kidney disease (ADPKD). Material and Method: We studied 101 patients (mean age: 43±17.3 years, 43.56% male) followed during a median (interquartile range) follow-up time of 69 (35-128) months from 1997 to 2010. The primary end point was: time to a 50% decrease of estimated glomerular filtration rate (eGFR) (CKD-EPI) since the first-time visit and/or time to initiation of renal replacement therapy, and the annual mean change of eGFR was also analysed. Clinical and demographic data, blood pressure, concomitant medications, and analytical parameters were collected at each visit. Baseline kidney size was also recorded by ultrasound. Results: Thirty-one patients achieved the primary end point after a median (IQR) time of 102 (53-131) months. Those patients who achieved the primary end point had higher SBP and DBP (P=0.017 and P=0.001), higher LDL-cholesterol (P=0.011), higher creatinine (P=0.006), higher uricemia (P=0.041), more severe proteinuria (P=0.033) and greater kidney size (P=0.05). The mean annual eGFR change was of –3.52±7.3ml/min/1.73m2. Forty-nine patients had a rapid decline in renal function: Group A (higher than -3.52ml/min/1.73m2) and 52 patients had a lower renal disease progression: Group B (<–3.2 ml/min/1.73 m2). Adjusted Cox regression analysis showed that higher SBP and younger age at the first visit were independent variables for poorer renal outcome (P=0.026). Conclusions: Initial kidney function, proteinuria, renal size, hypercholesterolemia, hyperuricemia, and SBP are the factors that influence CKD progression in ADPKD. SBP and younger age at diagnosis are the only factors that maintain their independent predictive value in a multivariant analysis.
INTRODUCCIÓN
La enfermedad poliquística autosómica dominante (PQRAD) es una de las enfermedades hereditarias más habituales y la causa genética más frecuente de enfermedad renal crónica (ERC)1-3. Afecta a una de cada 800-1000 personas de la población mundial, suponiendo la etiología de la enfermedad renal crónica terminal (ERCT) en un 5-10% de los pacientes en programa de depuración extrarrenal4.
A pesar de la importancia de la entidad, el estudio de ésta ha sido escaso hasta los últimos años, en que se han llevado a cabo numerosos trabajos con el objetivo de identificar los factores predictivos de la progresión rápida de la enfermedad renal5-7. Algunos de estos factores pueden ser modificados con el empleo de distintas intervenciones terapéuticas que están siendo objeto de análisis en la actualidad, como tolvaptán8,9, inhibidores de m-TOR (mammalian target of rapamycin)10, análogos de la somatostatina11 e incluso rosiglitazona12, empleada con éxito en modelos animales.
Dentro de los factores que se han identificado en la progresión de la PQRAD, el más importante es la hipertensión8,13,14, pero también se han propuesto como posibles factores de progresión la etnia afroamericana15, el sexo masculino, la hematuria, la proteinuria, el volumen de los quistes renales y las mutaciones de la policistina 1 (PKD 1) frente a las de la policistina 2 (PKD2)1.
El objetivo de nuestro estudio es analizar retrospectivamente los factores que condicionan la progresión de la insuficiencia renal crónica en los pacientes incidentes con PQRAD seguidos por nuestro servicio a lo largo de los últimos 13 años.
Nuestro trabajo, pese a recoger pacientes de un único centro y tener por tanto un modesto tamaño muestral, destaca por el tiempo de seguimiento prolongado, aunque retrospectivo, superado tan sólo por trabajos aislados publicados hasta el momento. A diferencia de otros estudios, viene a destacar la importancia de las cifras de presión arterial sistólica (PAS) sobre las de la presión arterial diastólica (PAD) como factor de progresión de la insuficiencia renal en estos pacientes. Además, subraya la importancia de la edad como posible variable orientativa del tipo de mutación genética a la hora de predecir el pronóstico renal. Aporta, por tanto, un enfoque sencillo y práctico como propuesta para la evaluación del riesgo de progresión rápida hacia la ERCT. Revisamos asimismo el papel de otros factores de progresión como la dislipemia y la hiperuricemia, escasamente estudiados hasta el momento actual.
MATERIAL Y MÉTODOS
Incluimos un total de 101 pacientes seguidos en nuestra policlínica desde 1997 hasta la actualidad. Los pacientes habían sido diagnosticados de PQRAD en base a los criterios radiológicos unificados16. Fueron excluidos del análisis los pacientes con PQRAD que tuvieron menos de dos visitas a nuestras consultas, bien por abandono del seguimiento o bien por aparición de un evento renal en el primer año desde el diagnóstico.
Se recogieron en cada visita variables demográficas, cifras de PAS y PAD, medicación concomitante, cifras de hemoglobina, creatinina (Cr), ácido úrico, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, calcio, fósforo, hormona paratiroidea (PTH), proteinuria y hematuria. Las variables bioquímicas se midieron utilizando métodos de rutina estandarizados. La PTH se midió por Irma (molécula intacta 10-60 pg/ml, Irma Allegro Nicholson). La albuminuria se midió en orina recolectada durante 24 horas utilizando un método inmunofelométrico. La hematuria en sedimento de orina se definió como la presencia de más de tres glóbulos rojos por campo microscópico en al menos dos de tres muestras correctamente recogidas17. El tamaño renal fue medido por ecografía renal en centímetros. Aunque a cada paciente le fueron realizadas varias ecografías a lo largo del seguimiento, se tomaron en cuenta para el análisis exclusivamente las medidas basales, tanto del quiste renal mayor como del diámetro renal máximo en centímetros. Al tratarse de un análisis retrospectivo, no se contó con una estandarización inicial en la forma de tomar las medidas ni en el número de profesionales encargados de realizarlas. A lo largo de los 13 años de seguimiento hubo cambios en los radiólogos que evaluaron las ecografías (tres profesionales habían informado la mayoría de las imágenes). No se midió la variabilidad interobservador ni intraobservador.
La presión arterial (PA) se midió con un esfigmomanómetro automático, de acuerdo con las recomendaciones de la Sociedad Española de Hipertensión18. Se consideraron hipertensos aquellos pacientes con PAS y PAD iguales o superiores a 140 y 90 mmHg, respectivamente, y a los que recibían tratamiento antihipertensivo. Se fijó como objetivo de tratamiento cifras de PA 130/80 mmHg de acuerdo con las recomendaciones del séptimo informe del JNC (Joint National Comittee on Prevention, Detection, Evaluation, and Treatment oh High Blood Pressure)19.
La dislipemia se definió como colesterol total mayor de 200 mg/dl, colesterol HDL mayor de 130 mg/dl, de acuerdo con las Guías europeas de prevención cardiovascular20, o tratamiento hipolipemiante.
La función renal fue valorada según el filtrado glomerular estimado (FGe) por fórmula CKD-EPI21.
Analizamos la progresión de la insuficiencia renal de dos formas:
1) En función de la aparición de un evento renal definido como la reducción del FGe por CKD-EPI en un 50% desde la visita basal en consultas externas y/o entrada en programa de diálisis.
2) En función del cambio medio en el FGe/anual. Según la disminución del FGe/anual por encima o debajo de la media, consideramos dos grupos: grupo A: pacientes con progresión rápida de la ERC; grupo B: pacientes con progresión normal de la ERC.
Los pacientes con diagnóstico de PQRAD fueron incluidos en el estudio desde la primera visita que realizaron en consultas externas de Nefrología, siendo esta visita considerada como basal, hasta que presentaron un evento renal. La recogida de datos se hizo anualmente, teniendo un rango de visitas entre 1-10. El seguimiento más largo fue de 13 años. La mediana de tiempo de seguimiento fue de 69 (128-35) meses.
Los valores se expresan como media ± DE (desviación estándar) o mediana (rango intercuartil [RIC]) si las variables no seguían una distribución normal. El test de Kolmogorov-Smirnov se usó para valorar la normalidad de distribución de los parámetros. Para analizar diferencias entre pacientes que habían sufrido un evento renal respecto al grupo de pacientes que no habían tenido eventos se utilizó el test de χ2 para variables cualitativas y la t de Student o el test de Mann-Whitney para variables cuantitativas de distribución normal o con distribución no gaussiana respectivamente. Asumimos una diferencia estadísticamente significativa cuando p < 0,05.
Por regresión lineal multivariable, analizamos las variables que influían en el cambio de FGe anualmente. El poder pronóstico de factores predictivos en la aparición de eventos renales o progresión rápida de la ERC fue valorado mediante un modelo multivariable de regresión de Cox. Introducimos en el modelo todas las covariables que en el modelo univariable predecían con una p < 0,1 los eventos renales o progresión rápida. Los coeficientes de regresión y sus DE fueron calculados en un paquete estadístico SPSS 16.0 (Chicago, IL).
RESULTADOS
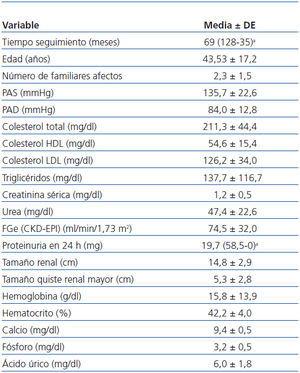
Fueron incluidos 101 pacientes, de los cuales 44 eran varones y 57 mujeres. La edad media fue de 43,5 ± 17,2 años. Las características basales de los pacientes se muestran en la tabla 1 y en la tabla 2.
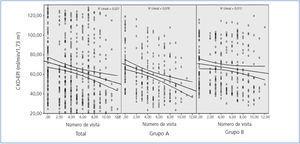
En la figura 1 se representa la evolución del FGe (ml/min/1,73 m2) en el total de pacientes y en los dos grupos de progresión.
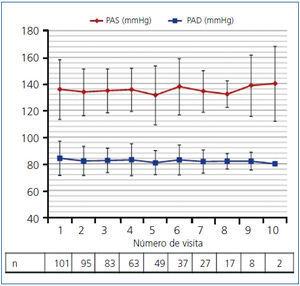
En la figura 2 se representa la evolución de las cifras de PAS y PAD a lo largo del seguimiento. El porcentaje de pacientes que al inicio del seguimiento ya tomaban tratamiento antihipertensivo con inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas del receptor de la aldostenona (ARA II) era de un 41,4%. A lo largo del seguimiento, un 16,9% de los pacientes inició tratamiento con IECA y un 15,7% con ARA II, de manera que el porcentaje de pacientes que a lo largo del seguimiento recibían esta medicación antihipertensiva alcanzó el 74%.
A lo largo del seguimiento, 31 pacientes tuvieron un evento renal. La mediana de tiempo de seguimiento desde la visita basal hasta el evento es de 102 meses (131-53). En el análisis univariante se comprueba que los pacientes que sufrieron un evento renal tenían basalmente mayor PAS, PAD, ácido úrico, colesterol total, colesterol LDL, Cr basal, proteinuria y mayor tamaño renal (tabla 3). Existían diferencias significativas entre el FGe medio inicial entre ambos grupos, siendo éste de 82,5 ± 34,2 ml/min/1,73 m2 en el grupo de pacientes que no desarrollaron evento renal y de 59,8 ± 22,7 ml/min/1,73 m2 en el grupo de pacientes que desarrollaron un evento renal (p = 0,01). No se encontraron diferencias significativas entre variables como la cifra de hematocrito, calcio, fósforo, HDL o triglicéridos (resultados no mostrados en la tabla).
Por regresión de Cox, en un modelo ajustado para la función renal basal, proteinuria, ácido úrico, PA y colesterol, la PAS es la variable que mantiene su poder predictivo de evento renal.
El cambio medio de FG anual en el grupo total de pacientes fue de –3,52 ± 7,3 ml/min/1,73 m2. Por regresión lineal multivariable el cambio de FG se correlacionó de forma independiente con la PAS (coeficiente β = –6,7 * 10-2, p = 0,03).
Se identificaron 49 pacientes con una progresión rápida (caída mayor de 3,52 ml/min/1,73 m2): grupo A, y 52 pacientes con progresión normal (menor de 3,52 ml/min/1,73 m2): grupo B. No había diferencias significativas entre los grupos en cuanto a la media de FGe inicial, siendo éste de 74,1 ± 32,7 ml/min/1,73 m2 en el grupo de progresión normal y 76,7 ± 32,6 ml/min/1,73 m2 en el grupo de progresión rápida (p > 0,05). Los pacientes del grupo A basalmente tuvieron mayor PAS y mayor proteinuria (tabla 4). Por regresión logística, la variable predictiva de progresión rápida, independientemente de la proteinuria, sexo, función renal inicial y PAD, siguió siendo la PAS, y también la menor edad en la primera consulta (tabla 5).
DISCUSIÓN
El principal resultado de nuestro estudio es la confirmación, en una cohorte de pacientes estables diagnosticados de PQRAD y valorados en consultas externas de Nefrología, de que la hipertensión arterial sistólica y la menor edad al diagnóstico son los factores más importantes que influyen en la progresión a largo plazo de la insuficiencia renal.
Muchos de los estudios recientes acerca de la PQRAD se centran en la importancia del volumen renal como factor determinante del deterioro de la función renal que avanza en paralelo con el aumento de tamaño de los quistes22. Existen también otros estudios que correlacionan parámetros clínicos y bioquímicos con el tamaño renal y el filtrado glomerular5. Sin embargo, es escasa la literatura que correlacione las características clínicas basales de los pacientes con su evolución clínica a tan largo plazo como en el presente trabajo. Recientemente, se publicó un estudio de cohortes retrospectivo con un seguimiento de 22 años que incluyó 194 pacientes con PQRAD y analiza la influencia del tipo de mutación con las características clínicas y el desarrollo de eventos renales23. El crecimiento de los quistes parece ser uno de los factores más importantes que determina en la progresión de la ERC en estos pacientes. Por ello, en muchos de los ensayos clínicos de intervención terapéutica, el crecimiento de los quistes se ha utilizado como un marcador de referencia para identificar a los pacientes que se podrían beneficiar del tratamiento5,24. Sin embargo, uno de los métodos más fiables para la medición del volumen y la estructura renal, la resonancia magnética estandarizada25, es un método caro, no disponible en todos los hospitales y que requiere mucho tiempo por parte del radiólogo. Algo similar ocurre con la tomografía computarizada, que ha sido empleada como método para realizar determinaciones volumétricas, encontrándose buena correlación entre el volumen renal total y de los quistes renales y el descenso del FGe26,27. Algunos autores señalan que el deterioro de la función renal no depende tanto del volumen de los quistes como de la cantidad de tejido intermediario existente en los riñones poliquísticos medido por tomografía computarizada28. Otros métodos de medición como la ecografía no ofrecen tan buena correlación con la función renal27, por lo que necesitamos de otras variables en la práctica clínica para identificar a los pacientes que se pudieran beneficiar de tratamientos precoces. En nuestro estudio se evaluó el tamaño renal por medio de ecografía, un método poco preciso, teniendo en cuenta que la medición fue realizada por radiólogos diferentes. Aunque en el análisis univariante encontramos una diferencia entre el tamaño renal en los pacientes que tuvieron un evento renal respecto a los que no lo tuvieron, esta variable no mantiene su poder predictivo cuando se ajusta con otros parámetros.
Por lo tanto, en la clínica rutinaria sería importante disponer de marcadores, aparte del crecimiento de los quistes, que identifiquen a los pacientes que ya desde edades tempranas van a sufrir una progresión rápida de la enfermedad renal, y que por lo tanto serían candidatos a medidas terapéuticas más agresivas, cuando exista en la literatura evidencia suficiente sobre alguna de ellas.
La hipertensión arterial es una manifestación clínica frecuente en los pacientes con PQRAD. Un estudio demográfico reciente desarrollado en Turquía con 1.139 pacientes con PQRAD la sitúa como la manifestación clínica más habitual en estos pacientes, presente en un 76% de los casos29. A menudo aparece de forma precoz, en el 60% de los casos antes de que se aprecie deterioro de la función renal30. Son numerosos los trabajos que relacionan la presencia de hipertensión con la velocidad de progresión de la enfermedad renal. Existe un estudio retrospectivo con 94 pacientes en el que se compara a los que progresan rápidamente con los que lo hacen de forma lenta, encontrando entre los primeros una mayor incidencia de hipertensión, hematuria, proteinuria e infecciones urinarias31. Otro estudio destaca que los pacientes con PQRAD hipertensos presentan peor función renal que los normotensos, con un incremento añadido del riesgo cardiovascular32. También hay trabajos que demuestran una menor mortalidad33 y un retraso progresivo en la edad a la que estos pacientes alcanzan la ERCT, y lo relacionan con el progresivo mejor control de las cifras tensionales a lo largo de los últimos años1,34,, fundamentalmente a expensas del uso de IECA y ARA II, aunque no se han encontrado diferencias entre ambos grupos de fármacos en el control de PA y cifras de Cr en estos pacientes35. En un estudio recientemente publicado en España, se correlaciona el tamaño renal con un perfil patológico de PA medida por monitorización ambulatoria, destacando una mayor variabilidad de la PA, fundamentalmente diastólica, y menor presión del pulso cuanto mayor es el tamaño renal, medido por ecografía, incluso en estadios prehipertensión36. Nuestro estudio viene a corroborar estos datos, destacando como novedad que es la PAS, y no la PAD, la que mantiene su poder predictivo independiente de progresión rápida de la enfermedad renal, en concordancia con lo señalado por otros estudios, como el trabajo de Cadnapaphornchai et al.37, que analiza la asociación entre el volumen renal, la PAS y PAD y el índice de masa ventricular izquierda en pacientes con PQRAD, detectando como nosotros asociación de ambas medidas de PA con el volumen renal en el análisis univariante, pero sólo de la PAS tras ajustar por edad y sexo en el análisis multivariante.
El porcentaje de pacientes que al inicio del seguimiento estaban ya en tratamiento con bloqueantes del sistema renina-angiotensina-aldosterona (SRAA) fue de 41,4%; el 32,6% inició el tratamiento con estos fármacos durante el seguimiento. En total, un 74% recibió tratamiento con bloqueantes del SRAA a lo largo del seguimiento. No encontramos diferencias entre los pacientes en tratamiento con estos fármacos y los que no los tomaban, ni en cuanto a la aparición de eventos renales ni en cuanto a la velocidad de progresión. Sin embargo, es conocido que el control de las cifras de PA, y sobre todo la sistólica, es un factor fundamental para enlentecer la progresión de la enfermedad renal no sólo en la PQRAD, sino en la ERC en general, tal y como lo demuestran numerosos estudios38-40. En el caso concreto de la PQRAD, está en marcha actualmente el estudio HALT, destinado a dilucidar el beneficio potencial del control estricto de la PA con bloqueantes del SRAA sobre el enlentecimiento de la progresión a ERCT41.
En el análisis univariante encontramos que los pacientes que presentaron un evento renal o una progresión rápida tenían al inicio cifras mayores de proteinuria que los que tuvieron progresión lenta o ausencia de eventos renales. Sin embargo, esta variable no mantiene su valor predictivo en la regresión de Cox, pese a ser la proteinuria un factor de progresión conocido de la enfermedad renal42. Probablemente este hecho se deba a que los valores de proteinuria que presentaban nuestros pacientes (mediana 19,75; RIC 58,5-0) eran bajos, como corresponde a esta entidad de la que la proteinuria no es una manifestación característica.
El segundo hallazgo destacable es que en nuestro estudio los pacientes más jóvenes son los que presentan mayor velocidad de descenso del FGe. Estos datos concuerdan con los presentados por Torres et al., quienes señalan que la menor edad al diagnóstico se asocia con un mayor incremento del volumen renal total, y éste, a su vez, con un mayor descenso de la tasa de filtrado glomerular5. Si bien no hemos realizado estudio genético, ponemos este hallazgo en relación con la elevada probabilidad de que en estos pacientes el gen mutado sea el PKD 1, cuya repercusión patológica es mayor y suele producir deterioro de función renal más precoz43,44. Apoyan este hecho los resultados publicados por Torra et al., que realizan estudios genéticos y encuentran, entre los pacientes con EPQAD que no han alcanzado una situación de ERCT a la edad de 63 años, prevalencia de mutaciones de PKD 2 tres veces mayor que la estimada para la población general con EPQAD45. Otros trabajos también coinciden en afirmar que en familias diagnosticadas de la enfermedad en las que algún miembro haya alcanzado la ERCT a una edad menor de 55 años existe alta probabilidad de que se trate de una mutación de PKD 146.
Se pone también de manifiesto en nuestros resultados la importancia del control de otros factores de riesgo cardiovascular como el colesterol y el ácido úrico, tanto en la progresión de la ERC en pacientes con PQRAD como en otras patologías renales. Aunque estos parámetros no influyen en la progresión de la insuficiencia renal de manera independiente, sí parecen ser variables controlables importantes en la aparición de eventos renales en el análisis univariante. Existen en la literatura algunos trabajos que proponen que en la PQRAD se produce un aumento de las cifras del ácido úrico asociado al descenso de la función renal47, pero no hay datos relativos a la influencia de las cifras de ácido úrico sobre la progresión de la enfermedad renal en esta entidad. Sin embargo, en los últimos años, se está poniendo en evidencia la relación entre hiperuricemia y progresión de la ERC48,49, y recientemente se ha demostrado que el empleo de fármacos destinados a la reducción del ácido úrico (alopurinol) disminuye la progresión de la enfermedad50. En lo relativo al control lipídico, algunos trabajos apuntan a que las menores cifras de colesterol HDL se relacionan con un aumento de la progresión del deterioro de función renal5, sin embargo no hemos encontrado en la literatura datos relativos a la influencia del colesterol LDL sobre la función renal en pacientes con PQRAD. Aun así, el hecho de que los pacientes con peores niveles de colesterol presenten más eventos renales apoya la hipótesis de algunos ensayos que tratan de demostrar que la función renal de estos pacientes puede mejorar con el empleo de estatinas mediante un incremento del flujo plasmático renal por medio de la mejora de la función endotelial51.
Nuestro estudio no carece de limitaciones. La principal de ellas es que, si bien el diseño es longitudinal prospectivo, la recogida de datos es retrospectiva, con lo que eso conlleva desde el punto de vista de análisis, por lo que sólo podemos evidenciar una asociación entre hipertensión sistólica y mayor progresión. Y, por otra parte, la muestra no es lo suficientemente grande al tratarse de los datos de un único centro. Sin embargo, a pesar del pequeño tamaño de la muestra, el tiempo de seguimiento es prolongado, superado tan sólo por trabajos aislados publicados en la literatura1,33,34, hecho que refuerza nuestros resultados. Cabe destacar también como limitaciones la carencia de estudio genético, así como la utilización de la ecografía renal en lugar de la tomografía computarizada o la resonancia magnética nuclear para evaluar el volumen renal inicial.
Podemos concluir que la menor edad al diagnóstico y las mayores cifras de PAS son los dos factores que se asocian con una mayor progresión de la enfermedad renal en nuestros pacientes con PQRAD. Estas dos variables, fácilmente medibles, nos permiten detectar, en los centros en los que no se dispone de estudio genético ni de resonancia magnética por cortes, a aquellos pacientes que probablemente progresen más rápidamente hacia la ERCT y así seleccionarlos como candidatos para posibles tratamientos futuros, que demuestren ventajas a largo plazo y que sean capaces de enlentecer la progresión hacia la necesidad de depuración extrarrenal. Son necesarios estudios de intervención para establecer el potencial beneficio del control de las cifras de PAS, el colesterol y el ácido úrico en el enlentecimiento de la progresión hacia la ERCT de estos pacientes.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características basales de los pacientes (variables cualitativas)
Tabla 2. Características basales de los pacientes (variables cuantitativas)
Tabla 3. Factores predictivos de eventos renales. Análisis univariante
Tabla 4. Factores predictivos de progresión rápida de enfermedad renal. Análisis univariante (test t Student)
Tabla 5. Variables predictivas de progresión rápida de enfermedad renal. Regresión logística
Figura 1. Descenso del filtrado glomerular en el total de pacientes y en los dos grupos de progresión
Figura 2. Evolución temporal de las cifras de PAS y PAD durante el seguimiento. Media (DE)