Antecedentes: Hipotéticamente, la utilización de dosis altas de antagonistas del receptor AT1 de angiotensina II, al bloquear más el receptor AT1, debería producir mayores beneficios que el uso de de dosis convencionales. Objetivo: Evaluar los efectos sobre proteinuria y función renal con dosis ultraaltas de irbesartán en la nefropatía diabética establecida. Material y método: Estudio prospectivo de intervención no controlado ni aleatorizado de 3 años de seguimiento, utilizando un tratamiento multifactorial basado en 600 mg diarios de irbesartán. Se analizan variables demográficas, antropométricas y analíticas al inicio y final del estudio. Se incluyeron 40 pacientes (75% con diabetes tipo 2) con promedio de edad de 57,1 ± 10 años, 29 (72,5%) hombres, con índice de masa corporal (IMC) de 30,7 ± 5 kg/m2. Resultados: La presión arterial sistólica (157,6 ± 27 vs. 130,1 ± 14) y diastólica (88,8 ± 10 vs. 76,2 ± 8 mmHg) se redujeron significativamente (p < 0,001) al final del estudio. El perfil lipídico mejoró significativamente. La kaliemia no se modificó. La creatinina sólo aumentó 0,17 mg/dl, aunque fue significativo (p < 0,05), y el filtrado glomerular estimado se redujo (69,8 ± 29,7 vs. 60,25 ± 23,0 ml/min/m2) (p < 0,05). La proteinuria se redujo de 2,4 ± 1,99 a 0,98 ± 1,18 g/24 h (p < 0,001). La reducción promedio fue 59,2%, y el 25% de los pacientes se hizo normoalbuminúrico. Salvo IMC y hemoglobina glucosilada, todos los objetivos recomendados por la American Diabetes Association se alcanzaron. Ningún paciente abandonó el estudio por efectos secundarios. Conclusión: El tratamiento de la nefropatía diabética establecida con dosis ultraaltas de irbesartán se mostró muy eficaz y seguro en reducir la proteinuria y retardar la progresión hacia la insuficiencia renal crónica terminal.
Background: Hypothetically, the greater the blockade of angiotensin AT1 receptors from ultra-high doses of angiotensin receptors blockers (ARB), the greater the expected renoprotection effects. The aim of our study was to evaluate the effects of ultra-high doses of irbesartan on proteinuria and renal function in diabetics with established or overt diabetic nephropathy (ODN). Material and Method: Ours was a prospective, non-randomised 3-year follow-up study, using a multifactorial therapeutic approach based on irbesartan 600mg daily. Demographic variables, anthropometric data, and biochemical parameters were comparatively analysed at the beginning and end of the study. Forty patients (75% with type 2 diabetes) were included, average age 57.1±10, 29 male (72.5%). Results: SBP (157.6±27mm Hg vs 130.1±14mm Hg) and DBP (88.8±10mm Hg vs 76.2±8mm Hg) decreased significantly at the end of follow-up (P<.001). Serum creatinine increased by only 0.17mg/dl, although this was a statistically significant difference (P<.05). Proteinuria markedly decreased from 2.64±1.99 to 0.98±1.18 (P<.0001), i.e. 59.2%. Twenty-five percent of patients had normal albuminuria at the end of the follow-up period. Lipid profiles significantly improved. No patients withdrew from the study due to side effects, and serum potassium did not change significantly over the course of the study. Except for BMI and HbA1c, all other therapeutic targets set out by ADA recommendations improved significantly. Conclusions: The treatment of ODN with ultra-high doses of irbesartan was highly effective and safe in reducing proteinuria and slowing the progressive course to ESRD.
INTRODUCCIÓN
En la actualidad, la nefropatía diabética establecida o abierta (NDE) es la primera causa de entrada en diálisis en nuestro país, siendo su morbilidad y mortalidad cardiovascular acompañantes muy elevadas1,2. En consecuencia, todas las estrategias terapéuticas encaminadas a reducir tanto la progresión hacia la enfermedad renal crónica avanzada (ERCA) como la aparición de complicaciones cardiovasculares son bienvenidas.
Como marcan las guías3,4, el tratamiento del paciente diabético con enfermedad renal crónica (ERC) asociada requiere un enfoque multifactorial con objetivos muy bien definidos tanto en lo que respecta a reducir eficazmente la presión arterial (PA) y la proteinuria y controlar los demás factores de riesgo vascular asociados, como a bloquear farmacológicamente de manera adecuada el sistema renina-angiotensina (SRA). Este enfoque multifactorial ha permitido reducir de forma significativa tanto las complicaciones macro como microangiopáticas de la diabetes5.
Considerando el papel capital que la activación intrarrenal del SRA juega en la fisiopatología de la NDE6, es evidente la importancia terapéutica que un eficaz bloqueo de éste tiene en la progresión hacia la ERCA o terminal.
Múltiples alternativas terapéuticas basadas en el bloqueo farmacológico del SRA han sido utilizadas tanto en la prevención primaria como en la secundaria o terciaria de la NDE7. Entre ellas, destaca el uso de antagonistas del receptor AT1 de angiotensina II (ARA II)8,9. Aunque estos estudios han mostrado beneficios renoprotectores frente a placebo y otros fármacos como amlodipino, a pesar del tratamiento, persiste un elevado riesgo residual de deterioro de la función renal en estos pacientes, de forma que alrededor del 30% progresan a ERCA a medio plazo10.
Los ARA II inhiben, en forma dependiente de la dosis, los efectos de la angiotensina II11; si bien las dosis recomendadas en la práctica clínica, quizás consideradas teniendo en cuenta la correlación directa existente entre aumento de dosis y peor tolerabilidad de los inhibidores de la enzima de conversión de la angiotensina (IECA), se han basado en la eficacia antihipertensiva, la cual presenta una curva dosis-respuesta plana tras titulación al alza. Sin embargo, la titulación de IECA o ARA II basada sólo en su eficacia antihipertensiva resulta inadecuada para bloquear de forma satisfactoria el SRA tisular renal11,12.
Por lo tanto, al menos hipotéticamente, si el efecto fisiopatológico de la angiotensina II (permitiendo su entrada intracelular) es el receptor AT1, cuanto mayor sea el porcentaje de receptores AT1 bloqueados tanto mayor será el beneficio renoprotector derivado de su bloqueo13.
Por ello, el objetivo de este estudio fue evaluar, a largo plazo, los efectos sobre proteinuria y función renal de un tratamiento multifactorial basado en 600 mg diarios de irbesartán en pacientes afectos de NDE, así como el grado de consecución de los objetivos terapéuticos recomendados por la American Diabetes Association (ADA)3.
MATERIAL Y METODOLOGÍA
En el presente estudio prospectivo de intervención multifactorial no controlado ni aleatorizado, se incluyeron pacientes con criterios clínicos definidos para el diagnóstico de NDE4. En 4 pacientes (10%) el diagnóstico fue biópsico. Se excluyeron los pacientes que presentaban una ERC de etiología no diabética, proteinuria < 300 mg/día, creatinina sérica (Crs) ≥ 4 mg/dl, enfermedad neoplásica o infecciosa graves antes o durante el estudio, hepatopatía crónica, mujeres gestantes, supervivencia estimada menor de 3 años o negativa del paciente a participar en el estudio.
Todos los pacientes fueron informados de los objetivos del estudio y dieron su consentimiento informado para participar en él. Tras su inclusión, los pacientes iniciaron un tratamiento multifactorial dirigido a conseguir los objetivos terapéuticos propuestos por la ADA3 y basado en la prescripción de 600 mg diarios (300 mg por la mañana y por la tarde) de irbesartán, cuya elección se realizó basándose en la existencia previa de evidencias en el tratamiento de la NDE9.
A todos los pacientes se les recomendaron medidas higiénico-dietéticas estándares dirigidas a la reducción global del riesgo vascular14,15, junto a una moderada restricción proteica (0,6-0,8 g por kilogramo de peso al día)4. El tratamiento antihipertensivo fue complementado con otros fármacos (tabla 1) con objeto de tratar de alcanzar una PA < 130/80 mmHg, y en casos posibles incluso < 125/75 mmHg14,16, con un promedio de 4 antihipertensivos por paciente, incluyendo irbesartán.
Todos los pacientes fueron seguidos con una periodicidad semestral hasta completar el período de seguimiento de 3 años.
Se recogieron variables demográficas (edad y sexo), tiempo de diagnóstico de diabetes mellitus e hipertensión arterial, tipo de diagnóstico (clínico/histológico), tipo de diabetes (1 o 2), toma de insulina o antidiabéticos orales, estatinas y antiagregantes; medidas antropométricas (índice de masa corporal [IMC], circunferencia de cintura [CC], PA sistólica [PAS] y diastólica [PAD] siguiendo las instrucciones para su medida de la Sociedad Europea2, presión del pulso [PP] en mmHg y frecuencia cardíaca [FC]); factores de riesgo cardiovascular asociados, y complicaciones micro o macroangiopáticas asociadas. La función renal se estimó mediante la determinación de Crs (en mg/dl, método de Jaffe modificado) y del filtrado glomerular (FG) renal según la fórmula de MDRD abreviada [186,3 x Cr (s) exp (-1,154) x edad exp (-0,203) x (0,742 si mujer) x (1,21 si afroamericano]. En orina de 24 horas se determinaron: proteinuria (gramos); concentración urinaria de sodio (mmol) y de urea (g/l, como indicador indirecto de la ingesta proteica). Asimismo se determinaron kaliemia (mEq/l), glucemia basal (mg/dl), hemoglobina glucosilada (HbA1c, %), hemograma, perfil lipídico, proteína C reactiva (PCR) y ácido úrico (mg/dl).
Todas las muestras de sangre se extrajeron con el paciente en ayunas entre las 8 y las 10 horas de la mañana, en la unidad de extracción centralizada del hospital.
Análisis estadístico
Los resultados se expresaron en media + desviación típica (DT) para variables cualitativas y porcentajes con su intervalo de confianza al 95% (IC 95%) para las variables categóricas. El test t-Student se empleó para comparar variables numéricas entre los dos períodos del estudio (basal y final). Para comparar variables categóricas entre dos períodos se empleó el test exacto de Fisher. Para estudiar la relación entre distintas variables cuantitativas se empleó el coeficiente de correlación lineal de Spearman. Para el análisis de la proteinuria se han considerado tres variables: proteinuria al inicio, proteinuria después del tratamiento y porcentaje de reducción. Ninguna de las tres variables se comporta como una normal, por lo que para su análisis estadístico se aplicaron pruebas no paramétricas. No obstante, como el tamaño de muestra era superior a 30 y por aproximación también podrían utilizarse, se incluyeron pruebas paramétricas. Para ambos tipos de pruebas los resultados son consistentes. Para comprobar la normalidad de las tres variables se ha realizado un análisis descriptivo detallado de éstas con objeto de conocer su grado de asimetría y curtosis. Como test de normalidad se ha utilizado la prueba de Shapiro Wilk. La comparación de los resultados antes y después del tratamiento se ha hecho mediante el test de Wilcoxon para datos emparejados. El aclaramiento de creatinina (inicial y final) sí se comporta según una normal, por lo que se ha utilizado la t-student para datos emparejados. Se ha considerado como nivel de significación el correspondiente a una p < 0,05. Para el análisis se empleó el paquete estadístico SPSS 12.0.
RESULTADOS
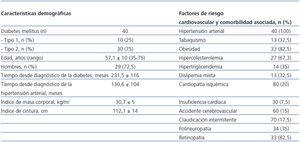
Se incluyeron 40 pacientes (de ellos, 29 [72,5%] eran hombres, con promedio de 57,1 ± 10 [rango 35-76] años). Diez pacientes (25%) tenían diabetes tipo 1, y 30 (75%) tipo 2. Las características demográficas de los pacientes, así como los factores de riesgo CV y comorbilidad asociada se muestran en la tabla 2.
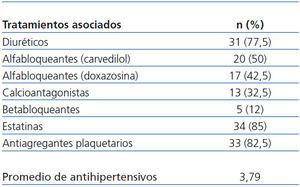
Recibieron tratamiento con estatinas 34 pacientes (85%), y 33 pacientes (82,5%) fueron tratados con antiagregantes plaquetarios. La mayoría de los pacientes utilizaban insulina para el control glucémico (77,5%, 31/40) y el resto usaba antidiabéticos orales (37,5%, 15/40).
En la tabla 1 se indican los antihipertensivos asociados durante el seguimiento, así como la media de antihipertensivos administrados, que fue de 3,7 al final del estudio, significativamente superior respecto a la inclusión en el estudio (n-1,8). Los antihipertensivos más utilizados fueron diuréticos (n-31/77,5%), seguidos de alfabetabloqueantes (carvedilol) (20/50%), alfa-bloqueantes (doxazosina) (17/42,5%), calcioantagonistas (13/32,5%) y betabloqueantes (5/12%). No existieron diferencias significativas en los porcentajes de uso inicial y final entre los distintos grupos de antihipertensivos, salvo alfabloqueantes (p < 0,016).
Análisis de los cambios en la presión arterial y parámetros antropométricos
Comparativamente entre inicio y final, la PA y la PP se redujeron significativamente (p < 0,001), con un promedio de 27,5 mmHg para PAS (157,6 ± 27 vs. 130,1 ± 14 mmHg), 12,6 mmHg para PAD (88,8 ± 10 vs. 76,2 ± 8 mmHg) y 15,3 mmHg (69,0 ± 18 vs. 53,7 ± 11 mmHg) para PP. Sin embargo, el IMC (30,7 ± 5,4 vs. 31,1 ± 5,5 kg/m2), la FC (76,9 ± 9 vs. 75,0 ± 7 lpm) y la circunferencia de la cintura (102,1 ± 14 vs. 101,0 ±13 cm) no presentaron cambios significativos a lo largo del seguimiento.
Análisis de los parámetros bioquímicos
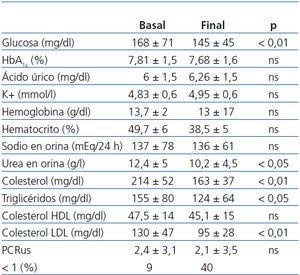
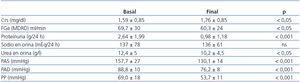
En la tabla 3 se detallan los cambios en algunos de los parámetros bioquímicos desde el inicio hasta el final del estudio.
Como se aprecia en dicha tabla, no observamos diferencias significativas entre valores de HbA1c (7,81 ± 1,5 vs. 7,68 ± 1,6, no significativa [ns]), aunque sí en los valores de glucemia (145 ± 54 vs. 168 ± 71, p < 0,01). El potasio (4,83 ± 0,6 vs. 4,95 ± 0,6 mmol/l), el hematocrito y la hemoglobina no se modificaron significativamente.
La excreción urinaria de Na+, indicativa de su ingesta, se mantuvo estable a lo largo del seguimiento (136 ± 61 vs. 137 ± 78 mmol/24 h, ns). En cuanto, los niveles de urea urinarios, disminuyeron al final del estudio de forma significativa (12,4 ± 5 vs. 10,2 ± 4,5 g/l, p < 0,05), lo que sugiere una reducción de la ingesta proteica.
Los niveles de colesterol total (214 ± 52 vs. 163 ± 37 mg/dl) y colesterol LDL (130 ± 47 vs. 95 ± 28 mg/dl) y triglicéridos (214 ± 52 vs. 163 ± 37 mg/dl) descendieron significativamente (p < 0,01); en cambio, los niveles de colesterol HDL no presentaron diferencias significativas (47,4 ± 14 vs. 45,1 ± 15 mg/dl).
Análisis de la evolución de la función renal y de los cambios en la proteinuria
En cuanto a los cambios en la proteinuria y la función renal (tabla 4), se observó un aumento significativo de la CrS (1,59 ± 0,85 vs. 1,76 ± 0,85 mg/dl, p < 0,05), aunque cuantitativamente fue sólo de 0,17 mg/dl. El filtrado glomerular estimado (FGe) descendió de 69,8 ± 29,7 a 60,25 ± 23,9 ml/min/1,73 m2 al final del tercer año de seguimiento (3,18 ml/min/año), aunque fue muy inferior al descenso esperado con la evolución natural de la NDE (1 ml/min/mes = 12 ml/min/año)17.
En los pacientes con diabetes tipo 1, el descenso fue de 64,4 ± 35,7 a 56,8 ± 23,8 ml/min/1,73 m2, sin significación estadística posiblemente por el bajo tamaño muestral estudiado, mientras que sí lo fue (de 71 ± a 61 ± ml/min/1,73 m2) (p < 0,05) en pacientes con diabetes tipo 2.
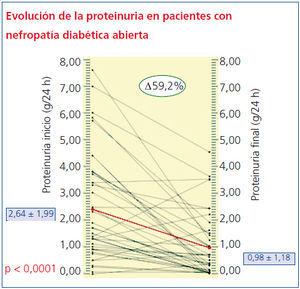
En cuanto a los cambios en la proteinuria durante los 3 años de seguimiento, sólo en 4 sujetos empeoran los niveles de proteinuria en orina (percentil 10 = -4,69%), mientras que más del 65% reduce más de la mitad de sus niveles iniciales y el 95% tiene una recuperación mayor al 90%. La media antes del tratamiento de 2,64 ± 1,99 g/24 h se redujo a 0,98 ± 1,18 g/24 h (p < 0,001) (figura 1). El 25% de los pacientes se hizo normoalbuminúrico (microalbuminuria [MAU] < 30 mg/día).
La reducción en pacientes con diabetes tipo 1 fue de 2,06 ± 1,18 a 0,24 ± 1,99) (p < 0,001), mientras que en pacientes con diabetes tipo 2 el cambio fue de 2,89 ± 2,2 a 1,22 ± 1,27 g/24 h (p < 0,001). Cuando se analiza el porcentaje de reducción en función del tipo de diabetes, la magnitud del efecto parece mayor en pacientes con diabetes tipo 1 que en aquéllos con diabetes tipo 2 (reducción porcentual de 82,32 y 40,44%, respectivamente [p = 0,02]), lo cual parece relacionarse con la existencia de mayor número de factores de progresión en los pacientes con diabetes tipo 2.
Influencia de los factores de progresión de la nefropatía diabética en la reducción de la proteinuria
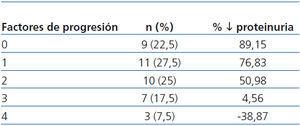
Se observó una correlación negativa entre el número de los factores de progresión (hábito tabáquico, PA ≥ 140/90 mmHg, IMC ≥ 30, proteinuria > 1 g/día, HbA1c ≥ 8% y Hb < 11 g/dl) y el descenso de proteinuria (tabla 5), siendo la reducción menor del 50% en pacientes con 3 y 4 factores de progresión.
Análisis sobre el grado de cumplimiento de los objetivos terapéuticos de la American Diabetes Association
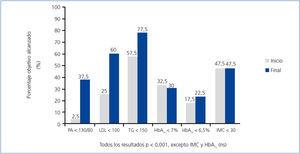
En cuanto al cumplimiento de los objetivos terapéuticos recomendados por la ADA3 (figura 2), salvo la HbA1c y el IMC, que se mantuvieron sin modificaciones, todos los demás objetivos mejoraron significativamente al final del estudio.
DISCUSIÓN
Nuestro estudio demuestra que, a largo plazo, un tratamiento multifactorial basado en dosis ultraaltas (600 mg/día) de irbesartán, además de ser bien tolerado, reduce eficazmente la proteinuria, tendiendo a estabilizar la función renal en pacientes con NDE, lo cual tiene no sólo connotaciones beneficiosas sanitarias, sino también socioeconómicas1,4,7.
El paciente diabético descontrolado presenta un alto riesgo para el desarrollo de complicaciones tanto micro como macrovasculares18. Conocemos hoy en día una serie de factores de progresión de la NDA hacia la ERCA que deben ser evaluados y controlados a fin de retrasar su curso clínico hacia esta situación. Entre esos factores, destacan la PA, la proteinuria y la glucemia como agentes capitales, si bien otros factores como el tabaquismo, la anemia y el exceso ponderal, contribuyen igualmente a acelerar el curso de la NDE16.
En consecuencia, para reducir la aparición y progresión de estas complicaciones, es preciso un enfoque terapéutico multifactorial que conduzca a un control lo más estricto posible de todos los factores de progresión.
Con ese objetivo multifactorial establecimos una estrategia terapéutica múltiple en estos pacientes que, como se muestra en la figura 1, nos permitió incrementar significativamente la consecución de la mayoría de los objetivos terapéuticos propuestos por la ADA3. Sólo el control glucémico y el IMC no mejoraron de forma significativa (posiblemente en relación con un incumplimiento de las medidas higiénico-dietéticas propuestas). Estos resultados concuerdan con los obtenidos por otros autores de relevantes clínicas especializadas en diabetes5.
La necesidad de bloquear farmacológicamente el SRA en los pacientes diabéticos, sobre todo en presencia de complicaciones microangiopáticas, es un hecho bien establecido19,20.
Los ARA II han demostrado su eficacia tanto en controlar la PA como en reducir la excreción urinaria de albúmina21 en la NDE y retardar así la progresión hacia la ERCA8,10,21,22. Sin embargo, en el caso de la NDE los resultados renoprotectores8,9 no han sido del todo brillantes, independientemente de que los objetivos multifactoriales en reducir el riesgo vascular tampoco lo fueran, entre otras razones por la posibilidad de una escasa rentabilidad en el bloqueo del rAT1 alcanzado con las dosis «antihipertensivas» de estos fármacos. Así, dos estudios multicéntricos con dosis ultraaltas de ARA II19,23 han mostrado, a igualdad de control de PA, una correlación directa entre la dosis de ARA II y la reducción de la proteinuria, acompañada de una excelente tolerabilidad clínico-bioquímica.
En esta línea, la hipótesis de nuestro estudio estuvo basada en la posibilidad de incrementar los beneficios antiproteinúricos de los ARA II debido al bloqueo de un mayor porcentaje de receptores AT1 con el uso de dosis más elevadas de estos agentes, ya que si la actuación del receptor de la angiotensina 1 (rAT1) es primordial para permitir los efectos patológicos renales intracelulares de angiotensina II, cuanto mayor fuera el porcentaje de receptores bloqueados, tanto mayor sería el beneficio esperado de esta acción.
El tratamiento se basó en dosis ultraaltas de ARA II21, de acuerdo con esquemas terapéuticos usados en otros estudios19,23. La dosis de irbesartán 600 mg, administrada en pauta de 2 tomas (mañana y tarde), se estableció a fin de que, modificando su curva de distribución plasmática, se mantuvieran unos niveles plasmáticos más elevados durante las 24 horas, consiguiendo así una mayor rentabilidad del fármaco, con objeto no sólo de alcanzar un mayor efecto antihipertensivo durante las 24 horas (estos pacientes suelen presentar un patrón non-dipper de PA14, sino también de conseguir más bloqueo del rAT1 durante el período de decúbito supino nocturno, influyendo así positivamente en este período de tiempo en la reducción de la presión intraglomerular y, por ende, en la caída de la proteinuria y protección renal.
Aunque, siguiendo las recomendaciones de las Guías3,14,15, el objetivo de PA a alcanzar en nuestros pacientes fuera una PA < 125/75 mmHg, ya que la mayoría de ellos presentaban proteinuria superior a 1 g/24 h, en la actualidad este criterio tiende a individualizarse, según el perfil clínico de cada paciente, y a no aplicarse universalmente15. Para ello, como se expresa en la tabla 1, se añadieron al esquema terapéutico con irbesartán cuantos antihipertensivos fueron necesarios para tratar de conseguir el objetivo de PA. Los agentes más utilizados en combinación fueron diuréticos (tiazídicos o de asa según presencia o no de disfunción renal), seguidos de carvedilol y doxazosina. Aunque, de acuerdo con las Guías14,15, los calcioantagonistas se promuevan en combinación con ARA II en pacientes con ERC, al final del estudio su uso fue bajo (32,5%) debido a su retirada a lo largo de éste por efectos secundarios (edemas).
Siguiendo el enfoque terapéutico multifactorial, en la mayoría de los pacientes se añadieron antiagregantes (82,5%) y estatinas (85%), hecho que contribuyó a los cambios favorables en perfil lipídico.
Acorde con los datos de la literatura médica, hubo un predominio de diabéticos tipo 24 con mayor prevalencia de varones y perfil clínico de síndrome metabólico25 (tabla 2), así como una alta prevalencia de factores de riesgo asociados3 y elevada incidencia de complicaciones macro y microangiopáticas (tabla 2). La presencia de retinopatía (82,5%) y neuropatía (35%) diabéticas, situaciones patológicas que acompañan a un deficiente control glucémico (HbA1c 7,81 ± 1,5%) (tabla 3), estaban presentes en un elevado porcentaje de pacientes.
Aunque el promedio de creatinina plasmática era elevado (1,59 ± 0,85 mg/dl, tabla 4), el hecho de que casi las tres cuartas partes de los pacientes de la muestra fueran varones contribuye a que el FG medio estimado por la fórmula de MDRD estuviese a la inclusión en 69,7 ± 30 ml/min/1,73 m2, indicativo de un estadio 2 de ERC9. La proteinuria media era de 2,64 g/24 h e indicativa de un estadio avanzado de NDE.
Al analizar las modificaciones obtenidas al final del período de seguimiento, observamos que, conforme a datos de otros estudios5, no conseguimos modificar favorablemente el IMC medio, el perímetro de cintura (tabla 2) ni el control glucémico (HbA1c 7,68 ± 1,6%, tabla 3), parámetros relacionados, a nuestro juicio, fundamentalmente con una deficiente adherencia dietética y escasa actividad física de los pacientes.
En cambio, sí conseguimos un excelente descenso promedio de PA a niveles de 130,1/76,2 mmHg, factor que contribuye al descenso de la proteinuria en nuestros pacientes3,15.
No observamos modificaciones significativas a lo largo del estudio (tabla 3) en los niveles de ácido úrico, hematocrito, hemoglobina ni potasio. A pesar del uso de diuréticos, la uricemia no se modificó sensiblemente, hecho que, aunque ligado primordialmente a losartán10, puede estar en relación con el efecto uricosúrico atribuible a los ARA II y con el empleo de dosis moderadas de estos agentes. Asimismo, es conocido que, a diferencia del efecto de los IECA25, los ARA II, gracias a su efecto sobrerregulador de la expresión de rAT2, no tienden a disminuir los niveles de hemoglobina y hematocrito26. Por otro lado, a pesar de las dosis ultraaltas de irbesartán, y por mecanismos no bien definidos, los niveles de K+ no se elevaron significativamente, hecho constatado en otros estudios19,23.
En el análisis de los cambios evolutivos en proteinuria y parámetros de función renal (Crs y FGe) observamos globalmente un marcado descenso de la proteinuria y tendencia a estabilizarse la función renal a los 3 años de seguimiento, datos que no alcanzan tanta relevancia en otros estudios de NDE con ARA II10,20. Estos resultados tan beneficiosos respecto a la disminución de la proteinuria y a la estabilización de la función renal con muy pocos efectos secundarios son prometedores de cara a la práctica clínica diaria, pero deben ser necesariamente refrendados en ensayos clínicos prospectivos y bien ponderados, donde se incluyan desenlaces clínicos relevantes como progresión a ERC terminal o comorbilidad cardiovascular. Como se ha descrito11, las dosis estándar antihipertensivas de ARA II permiten bloquear en torno al 35-40% de receptores, porcentaje que prácticamente se dobla al utilizar estos agentes en dosis doble, igualando el grado de bloqueo conseguido con la combinación de ARA II más IECA11,13.
Aunque tanto la Crs como el FGe por MDRD se modificaron estadísticamente (p < 0,05) a los 3 años, los cambios (tabla 4) en estos parámetros no fueron clínicamente relevantes, de forma que ningún paciente dobló sus valores basales de creatinina o precisó diálisis. El decremento más acentuado de estos parámetros correspondió a la proteinuria en 24 horas, que descendió de 2,6 ± 1,99 a 0,98 ± 1,1 g/24 h (p < 0,001), lo cual supone un descenso promedio del 59,2%, significativamente mayor que el obtenido en los estudios RENAAL8 e IDNT9.
Al final del período de seguimiento, sólo en 4 pacientes (aquéllos con más factores de progresión presentes) (tabla 5) empeoran los valores basales de proteinuria. Como puede apreciarse, conforme aumenta la presencia de factores de progresión de la nefropatía, es menor su grado de reducción. En el 75% (aquéllos con 0, 1 o 2 factores de progresión) (tabla 5) el descenso de la proteinuria fue superior al 60% de los valores a la inclusión; de ellos 10 (25%) se hicieron normoalbuminúricos. Globalmente, el descenso de la proteinuria fue mayor en los 10 pacientes con diabetes tipo 1, circunstancia que consideramos debida al bajo porcentaje de ellos (2 fumadores) con factores de progresión de la NDE. Por otro lado, no creemos que en el curso evolutivo de nuestros pacientes influyera el grado de control glucémico que, como hemos comentado, no varió significativamente. Estos resultados puntualizan la necesidad de un enfoque terapéutico multifactorial intensivo que permita conseguir las dianas terapéuticas recomendadas3,14,15.
Los efectos renoprotectores dependientes del bloqueo del rAT1 de angiotensina II en el paciente con NDE parecen fundamentalmente mediados por el bloqueo de la acción tisular renal de angiotensina II, ya que como es sabido esta enzima está muy activada en la corteza renal del diabético donde se aprecia una sobrerregulación de la expresión tanto de renina como del rAT127-29.
Los efectos antiproteinúricos de los ARA II parecen mediados no sólo por cambios en la hemodinámica intraglomerular (disminución de la presión intraglomerular), sino también por cambios estructurales a nivel capilar glomerular e intersticio-mesangial. El bloqueo de angiotensina II mejora la selectividad de la carga y el tamaño de los poros de la membrana glomerular, relacionada en parte con la pérdida de nefrina en los podocitos del capilar glomerular, los cuales juegan un papel central en la función de la barrera de filtración glomerular30. Asimismo, el bloqueo de otros efectos de angiotensina II, como su contribución a la disfunción endotelial, el estrés oxidativo, la inflamación y la producción de colágeno31-36 también parecen participar en el efecto antiproteinúrico de los ARA II. Los beneficios derivados del bloqueo de estos mecanismos fisiopatológicos se ven corroborados por los indicadores de regresión de daño renal obtenidos en estudios experimentales en animales usando altas dosis de ARA II37-39.
¿Podríamos esperar los mismos efectos terapéuticos con el uso de IECA que los observados con ARA II?
Aparte de los beneficios señalados por Lewis et al.40 con captopril en la nefropatía diabética de pacientes con diabetes tipo 1, los escasos datos disponibles, tanto en estudios como en número de pacientes y período de seguimiento, en pacientes con diabetes tipo 2 con NDE tratados con IECA no son especialmente brillantes.
Así, en el estudio REIN41, los beneficios renoprotectores con ramipril en pacientes diabéticos con nefropatía fueron muy limitados, perdiendo los pacientes asignados a ramipril la función renal en mayor medida que los asignados a otros agentes antihipertensivos. Tampoco el estudio ALLHAT42, con un tiempo de seguimiento de 4,9 años, demostró diferencias entre el efecto del tratamiento con lisinopril, ni amlodipino, comparado con clortalidona sobre el desarrollo de ERCA o una reducción mayor del 50% en el FGe. No obstante, hay que tener en cuenta que el estudio ALLHAT no fue diseñado para evaluar la función renal, dado que no aporta información sobre proteinuria/albuminuria basal o durante el seguimiento, ni otros aspectos relacionados con la presencia de insuficiencia renal. Por otro lado, Suissa et al.43 en un estudio comparativo con diuréticos observaron incluso un aumento del riesgo (de hasta 2,5 veces) de desarrollo de ERCA en pacientes diabéticos tratados con IECA. Aunque los autores no justifican las razones para estos resultados, es posible que influyera el hecho de que los pacientes con alto riesgo para el desarrollo de ERCA fuesen los tratados con IECA.
En contraposición, en estadios más precoces de nefropatía diabética, un estudio44 que analiza la evolución de la MAU en pacientes con nefropatía incipiente y diabetes tipo 2 sí indicó que los IECA enlentecían la progresión hacia el desarrollo de NDE.
Esta escasa brillantez en los resultados de estudios con IECA en la NDE puede estar relacionada con las diferencias fisiopatológicas y farmacológicas entre IECA y ARA II respecto a los efectos renales de angiotensina II.
El grado de bloqueo de angiotensina II conseguido con ARA II, al actuar selectivamente sobre el rAT1, puede otorgar a estos fármacos un mayor beneficio renoprotector que con IECA. Aparte de la selectividad, el bloqueo del receptor AT1 es más intenso y duradero que con IECA. Además, este bloqueo selectivo del receptor AT1 reduce la internalización celular de angiotensina II y con ello sus efectos intracelulares, entre los que destaca la capacidad para activar, por un mecanismo de biofeedback positivo, la expresión de nuevos receptores AT1 en la membrana celular, favoreciendo así una mayor internalización de angiotensina II.
Otro factor diferenciador entre IECA y ARA II es el hecho de que, en la nefropatía diabética, la mayor parte de angiotensina II se genera no por vía de la enzima de conversión, sino vía alternativa por activación de la quimasa27,45. Así, en la nefropatía diabética se produciría una infiltración tisular renal de monocitos que liberarían quimasa, la cual activaría el paso directo de angiotensina I a angiotensina II a nivel renal45.
Pero quizás el hecho diferenciador más significativo entre IECA y ARA II para explicar sus diferencias en renoprotección sea la sobrerregulación en la expresión de receptores AT2 que acompaña, por mecanismo de biofeedback, al bloqueo selectivo del receptor AT1 con ARA II, y que no observamos con el uso de IECA. Aparte de su contribución al efecto hemodinámico reductor de la PA, cada día es mayor la evidencia de la contribución de la activación del receptor AT2 a los efectos renoprotectores de ARA II, participando en la autorregulación del flujo plasmático renal (de forma especial en situaciones de bajo gasto cardíaco) y en los cambios estructurales renales que ayudarían a retrasar el curso evolutivo de la NDE a la ERCA25,29,46.
A todo ello hay que añadir diferencias en el manejo clínico de los pacientes renales crónicos diabéticos. Por una parte, gracias a la sobrerregulación del rAT2, parecen reducir en menor medida el hematocrito y la hemoglobina25, como se muestra en nuestros pacientes; y por otra, presentan una mejor tolerabilidad clínica y bioquímica, siendo muy bajo el porcentaje de pacientes con hiperkalemia severa (K+ > 6 mmol/l) o que precisen suspender el tratamiento, a diferencia de lo observado con IECA o su combinación con ARA II47, la cual recientemente en un análisis post-hoc del estudio ONTARGET48 tampoco muestra beneficios renoprotectores en pacientes de alto riesgo con insuficiencia renal crónica o proteinuria. En nuestro estudio, ningún paciente presentó niveles de K+ superiores a 5,5 mmol/l, lo que corrobora los resultados de otros estudios47,48, donde la tasa de hiperkalemia fue igualmente muy baja.
El estado inflamatorio lo analizamos mediante el seguimiento de los niveles séricos de la PCR ultrasensible para valorar la posible influencia del ARA II sobre aquél, pero, aunque el nivel se redujo discretamente, la diferencia no fue significativa (2,4 ± 3,1 basal y 2,1 ± 3,5 mg al final del estudio). El perfil lipídico mejoró de forma sensible como consecuencia esencialmente del tratamiento con estatinas, aunque es posible que altas dosis de irbesartán pudieran contribuir a esta mejora gracias a los efectos beneficiosos sobre la resistencia a la insulina del bloqueo del receptor AT149,50.
El estudio presenta algunas limitaciones. Primero, no es un estudio aleatorizado y el número de pacientes es pequeño, aunque la consistencia de los resultados resta trascendencia a este factor. Segundo, no está diseñado para analizar la mortalidad ni la morbilidad cardiovasculares. No obstante, si tenemos en cuenta los resultados encontrados en estudios previos en los que no se objetivó mayor incidencia de eventos cardiovasculares5,10, estos resultados podrían ser extrapolables al nuestro. Tercero, no disponemos de grupo control con irbesartán en dosis de 300 mg para así comparar su mayor o menor efectividad en la nefroprotección, si bien los resultados del estudio IDNT9,20 con irbesartán 300 mg no son de la misma magnitud que los obtenidos por nosotros. No obstante, serían necesarios estudios aleatorizados donde se enfrentaran dosis ultraaltas frente a dosis convencionales de ARA II. Aparte de las dificultades actuales de índole económica para realizar un estudio amplio de estas características, el análisis de las bases racionales del uso de altas dosis de ARA II en estos pacientes y los resultados obtenidos en la práctica clínica diaria difícilmente nos permitirían usar dosis convencionales en estos pacientes.
En conclusión, un tratamiento multifactorial de la NDE basado en dosis de 600 mg diarios de irbesartán se mostró altamente eficaz y seguro en reducir la proteinuria y retardar el curso evolutivo hacia la insuficiencia renal crónica terminal, por lo que constituye una buena alternativa terapéutica para estos pacientes.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 2. Características demográficas y factores de riesgo cardiovascular y comorbilidad asociada de los pacientes incluidos en el estudio
Tabla 3. Evolución de los parámetros bioquímicos desde el inicio hasta el final del estudio
Tabla 5. Correlación entre los factores de progresión de la insuficiencia renal crónica y la reducción de la proteinuria
Figura 1. Evolución de la proteinuria a lo largo del seguimiento
Figura 2. Cumplimiento de los objetivos según recomendaciones de la ADA
Tabla 4. Diferencias comparativas en parámetros renales y cifras de tensión arterial
Tabla 1. Tratamientos asociados a lo largo del estudio