Introducción: La malnutrición ha sido descrita en los pacientes con enfermedad renal crónica, y su asociación con el riesgo cardiovascular y la mortalidad en pacientes en hemodiálisis. Recientemente se ha propuesto una nueva terminología, protein energy wasting, con nuevos criterios diagnósticos (marcadores bioquímicos y antropométricos), para identificar precozmente a los pacientes con riesgo de presentar desgaste proteico-energético (DPE) y riesgo de mortalidad. El objetivo de este estudio fue observar por primera vez en España la prevalencia, la evolución en el tiempo y el significado pronóstico del DPE en un centro de diálisis español. Pacientes y métodos: estudio observacional que incluyó a 122 pacientes prevalentes en hemodiálisis en nuestro centro. Entre enero de 2010 y octubre de 2012 se realizaron tres visitas, en las cuales se recogieron parámetros clínicos, bioquímicos, antropométricos, composición corporal mediante el uso de bioimpedancia (espectroscópica BIS) y sus características dialíticas respectivas según los criterios de la nueva definición. Se analizó la prevalencia de DPE en cada visita, la progresión de los parámetros de malnutrición y los posibles factores asociados a DPE. Tras un período de seguimiento, media de 461 días, analizamos la supervivencia. El análisis estadístico se realizó utilizando el programa R. Resultados: La prevalencia de DPE se mantuvo constante en el tiempo: 37 % en la visita basal, 40,5 % a los 12 meses y 41,1 % a los 24 meses. La introducción de la variable dinámica pérdida de masa muscular, incluida en la definición de DPE, aumentó la prevalencia a un 50 % a los 24 meses. La situación de DPE es dinámica, como demuestra que un 26-36 % de los pacientes sin DPE lo desarrollan de novo cada año, y un 12-30 % se recuperan anualmente de esta situación. La presencia de DPE se asoció a mayor índice de resistencia a la eritropoyetina (irEPO) y a mayor presión de pulso al final de la diálisis. En el modelo de regresión multivariable, las variables clínicas predictoras de DPE fueron sobrehidratación, irEPO, agua intracelular y ratio agua extracelular/agua intracelular. Veintiséis (21 %) pacientes fallecieron. La curva de Kaplan-Meier no mostró diferencias en el riesgo de mortalidad entre pacientes con y sin DPE, pero la pérdida de masa muscular se asoció con mayor mortalidad. Conclusión: El presente estudio observacional subraya la alta prevalencia de DPE y tiene un carácter dinámico en pacientes en hemodiálisis. Solo el criterio pérdida de masa muscular (aumento del catabolismo proteico) se asoció a un incremento de mortalidad, mientras que el resto de los criterios de DPE según la clasificación ISRMN no se asoció a un incremento de la mortalidad. Igualmente hemos observado un estado de sobrehidratación en los pacientes con DPE. Dicho estado de sobrehidratación (aumento de agua extracelular por ocupación de la pérdida de músculo, sin aumento del agua corporal total) no es valorable ni por el peso seco ni por el índice de masa corporal. Son necesarios estudios de intervención para evaluar si la prevención de la sarcopenia mejora la supervivencia.
Introduction: Malnutrition has been described in patients with chronic kidney disease as well as its association with cardiovascular risk and mortality in haemodialysis patients. Recently, the new term ‘protein energy wasting’ has been proposed with new diagnostic criteria (biochemical and anthropometric markers) for early identification of patients at risk for protein energy wasting and mortality. The aim of this study was to examine the prevalence, evolution over time and prognostic significance of PEW in a Spanish dialysis centre for the first time in Spain. Patients and methods: an observational study that included 122 prevalent haemodialysis patients at our centre. Between January 2010 and October 2012, three visits were carried out in which clinical, biochemical, anthropometric and body composition parameters were collected using BIS (bioelectrical impedance spectroscopy) along with their respective dialytic characteristics, in accordance with the criteria of the new definition. We analysed the prevalence of PEW in each visit, progression of the malnutrition parameters and factors potentially associated with PEW. After a mean follow-up period of 461 days, we analysed survival. Statistical analysis was performed using the R software. Results: The prevalence of PEW remained constant over time: 37% at baseline visit, 40.5% at 12 months and 41.1% at 24 months. With the introduction of the dynamic variable muscle mass loss, included in the definition of PEW, prevalence increased to 50% at 24 months. The PEW situation is dynamic, as demonstrated by the fact that 26%-36% of patients without PEW develop it de novo each year and 12%-30% annually recover from this situation. The presence of PEW was associated with higher rates of resistance to erythropoietin (irEPO) and higher pulse pressure at the end of dialysis. In the multivariable regression model, PEW predictive clinical variables were over-hydration, irEPO, intracellular water and the extracellular water/intracellular water ratio. Twenty-six (21%) patients died. The Kaplan-Meier curve did not show any differences in mortality risk between patients with and those without PEW, but the loss of muscle mass was associated with increased mortality. Conclusion: The present observational study highlights the high prevalence of PEW, which has a dynamic nature in haemodialysis patients. Only the criterion of muscle mass loss (increased protein catabolism) was associated with increased mortality, while the other PEW criteria according to the ISRNM classification were not associated with increased mortality. We also observed a state of over-hydration in patients with PEW. This state of over-hydration (increased extracellular water due to occupation of muscle loss without an increase in total body water) cannot be evaluated by dry weight or the body mass index. Intervention studies are necessary in order to assess whether or not the prevention of sarcopaenia improves survival.
INTRODUCCIÓN
La enfermedad renal crónica (ERC) se ha convertido en los últimos años en un problema de salud pública mundial, por su frecuencia y alta morbimortalidad1,2. La patología cardiovascular es la primera causa de mortalidad de los pacientes con ERC en hemodiálisis3. A pesar de corregir los factores cardiovasculares tradicionales como hipertensión, dislipemia e hipertrofia ventricular izquierda, y mejorar las técnicas de diálisis, persiste una alta tasa de mortalidad no explicada, como se ha demostrado en estudios aleatorizados controlados como el estudio HEMO4. Se han descrito nuevos factores de riesgo no tradicionales de morbimortalidad, como la malnutrición5. El concepto clásico de malnutrición urémica o caquexia urémica6,7 ha evolucionado en los últimos años gracias al mejor conocimiento de los mecanismos fisiopatológicos implicados, como la inflamación, el hipercatabolismo proteico y la anorexia.
El estudio del impacto de la malnutrición sobre la ERC se ha visto dificultado por una gran dispersión de los criterios diagnósticos y definiciones. En la última reunión de la International Society of Renal Metabolism and Nutrition (ISRMN), se ha definido el síndrome de protein energy wasting (PEW)8, en un intento de unificar diferentes terminologías asociadas al concepto de malnutrición en la ERC. Recientemente el Grupo de Trabajo en Nutrición de la Sociedad Española de Nefrología ha propuesto el término desgaste proteico-energético (DPE) como el que mejor define en habla hispana el concepto anglosajón del PEW9. El DPE se define como un estado patológico donde hay un descenso o desgaste continuado tanto de los depósitos proteicos como de las reservas energéticas8. Dicho de otra manera, el síndrome DPE incluye una pérdida simultánea de grasa y de músculo en el paciente urémico. Queda claro desde el primer momento que el concepto DPE es dinámico y difiere de conceptos clásicos más estáticos, pues incluye el concepto de pérdida proteico-energética a lo largo del tiempo.
Siguiendo definiciones clásicas se ha estimado una prevalencia de desnutrición en la población en hemodiálisis del 18-75 %10. Pero todavía no se ha descrito la prevalencia de DPE en pacientes en hemodiálisis en España según los criterios de la ISRMN. Los parámetros propuestos para definir el DPE fueron establecidos en población americana, por lo que se plantea la duda de si son extrapolables a otras distribuciones geográficas y de estilo de vida como Europa, Asia o, en el caso que nos ocupa, los países de la franja mediterránea. En el presente estudio describimos por primera vez la prevalencia de desnutrición según el concepto de DPE en una población en hemodiálisis española, su progresión en el tiempo y el posible impacto que el DPE tiene sobre la mortalidad.
PACIENTES Y MÉTODOS
Pacientes
El estudio fue observacional y prospectivo, no intervencionista. Se incluyeron 122 pacientes prevalentes en hemodiálisis del centro de diálisis satélite de la Fundación Renal Íñigo Álvarez de Toledo-Hospital Fundación Jiménez Díaz de Madrid. Se incluyeron todos los pacientes estables que no hubiesen presentado hospitalización en los dos meses previos al estudio, en hemodiálisis crónica de la unidad el día 1 de enero de 2010. La media de edad al inicio del estudio fue de 63,6 ± 14,3 años y la mediana de tiempo en diálisis fue de 26 (11-79) meses. Todos los pacientes fueron informados del análisis y aceptaron formar parte del estudio. Se excluyeron aquellos pacientes que estuvieran hospitalizados en el momento de su inicio. El reclutamiento comenzó el 1 de enero de 2010 y la supervivencia se calculó hasta el 1 de octubre 2012, con una mediana de seguimiento de 461,4 días (240-931 días). Se valoró anualmente la presencia de DPE (basal, 12 y 24 meses). La etiología de la ERC fue glomerulonefritis 21,8 %, nefritis intersticial 9,7 %, riñón poliquístico 11,3 %, nefroangioesclerosis 27,4 %, nefropatía diabética 15,3 %, y otras causas 14,5 %. El grado de comorbilidad medido de acuerdo con los criterios de Davies11 fue alto en un 37 % (dos o más criterios) y medio en un 51 % (1 criterio de Davies). Veintisiete pacientes (21,8 %) eran diabéticos y 51 (41 %) presentaron historia de enfermedad cardiovascular. El acceso vascular fue fístula arteriovenosa en el 74 %, prótesis en el 18 % y catéter tunelizado en el 8 % de los pacientes. Ningún paciente tuvo un catéter temporal más de 24 horas. La terapia de diálisis incluyó un tiempo al menos de 4 horas tres veces a la semana, la concentración de calcio del baño de diálisis era 1,25-1,5 mmol/l, con un Kt/Ve de 1,42 (1,24-1,6) a una temperatura del baño de 36,5 ºC. Los dializadores usados fueron polisulfona de alto flujo 27 %, polisulfona de bajo flujo 41 % y polinefrona de alto flujo 32 %. El agua reunió criterios de agua ultrapura durante todo el estudio.
Composición corporal y situación nutricional
Las determinaciones antropométricas y de composición corporal fueron realizadas inmediatamente después de la sesión de diálisis intermedia de la semana por un único observador, el mismo día en que se recogieron las muestras de sangre. Con estas medidas se calcularon los criterios de DPE (tabla 1)8.
El índice de masa corporal (IMC) se expresó en kg/m2. El peso fue calculado como peso seco, definido como el peso posdiálisis en el que el paciente se encontraba normotenso y sin signos de sobrehidratación (OH). El pliegue tricipital (PT) se midió en milímetros con plicómetro por triplicado (lipocalibre Holtain, Crymych, Reino Unido) en el brazo contralateral al acceso vascular. La circunferencia braquial (CB) se midió en centímetros en el tercio medio con una cinta métrica flexible (Holtain Ltd, Crymych, Reino Unido). El PT y la CB se utilizaron para calcular la circunferencia muscular del brazo (CMB) según la fórmula CMB = CB - (0,314 x PT)12.
El análisis de la composición corporal se realizó mediante bioimpedancia espectroscópica (BIS), para lo que se utilizó un monitor Body Composition Monitor BCM de Fresenius Medical Care. Se realizó posdiálisis tras 15 minutos de reposo en período corto de diálisis, sin elementos metálicos y colocando los electrodos siempre en el hemicuerpo contralateral a la localización del acceso vascular. La medición de la composición corporal por medio de BIS se realizó cada seis meses. Los tres compartimentos: LTM (tejido magro, principalmente muscular), ATM (tejido adiposo) y OH se identifican a partir de mediciones de peso, talla, agua intracelular (ICW) y agua extracelular (ECW) determinada por BIS.
Se definió presencia de DPE si el paciente cumplía en la visita basal por lo menos tres criterios en las cuatro distintas categorías de marcadores de malnutrición (tabla 1)8. A los 12 meses (visita 1) y a los 24 meses (visita 2) se volvieron a analizar las variables de las cuatro categorías, además de introducir una nueva variable realizada por BIS, la pérdida de masa muscular, que define el concepto de desgaste. Esta variable no se introdujo en la visita basal, ya que requiere medir cambios con respecto a una valoración previa.
Análisis bioquímico y otras muestras
Las muestras de sangre se recogieron al inicio de la segunda diálisis de la semana, el mismo día que los datos antropométricos. Veinte minutos después de la extracción de sangre, las muestras se centrifugaron a 4 °C y aquellas cuyo análisis no se realizó de forma inmediata fueron almacenadas a –40 °C hasta el análisis. La albúmina (técnica bromocresol, rango de referencia 3,8-4,4 g/dl), la creatinina, la proteína C reactiva (PCR) y el colesterol se midieron por autoanalizador, la prealbúmina por técnica nefelométrica (nefelómetro Qm 300, Kalestad Diagnostic, rango de referencia 10-40 mg/dl), la transferrina por inmunoturbidimetría mediante un autoanalizador ADVIA 2400, la 25 hidroxivitamina vitamina D por inmunoensayo (DiaSorin LIAISON®) y la hormona paratiroide (PTH) intacta por electroquimioluminiscencia (Elecsys-2010, Roche Diagnostics) en el laboratorio del Departamento de Bioquímica del Hospital Fundación Jiménez Díaz de Madrid. El coeficiente de resistencia a la eritropoyetina (EPO) se definió como la dosis de EPO alfa semanal (U/kg peso prediálisis) dividida por la cifra de hemoglobina (g/dl) (índice de resistencia a la EPO; irEPO).
Todos los pacientes fueron sometidos al estudio de la cinética de la urea. El nitrógeno ureico en sangre (BUN) se determinó antes (BUN1) y después (BUN2) de la sesión de diálisis de mitad de la semana. La tasa de catabolismo proteico normalizado (nPCR) se utilizó como indicador indirecto de la ingesta proteica y se obtuvo mediante la fórmula: nPCR = (9,35 × G + 0,294 × V [litros])/peso ideal (kg). Donde G es la generación de urea en el período entre diálisis: G (mg/dl) = (BUN pre - BUN post) × V/tiempo entre diálisis (min). El Kt/Ve definido fue el bicompartimental de Daugirdas13.
Se recogieron también la ganancia de peso interdiálisis, la tasa de ultrafiltración total, la presión de pulso al inicio y al final de la diálisis (PPi, PPf) definida como la diferencia entre la tensión arterial sistólica y la tensión arterial diastólica, la medida indirecta de la rigidez vascular y la calcificación vascular. Además se registraron las pérdidas de seguimiento, incluida la muerte de los pacientes, analizando su causa.
Análisis estadístico
El análisis estadístico se realizó utilizando el programa R. Las variables con distribución normal se describieron mediante media ± desviación estándar y las que seguían una distribución no normal fueron descritas mediante mediana y rango (mínimo-máximo) o rango intercuartil (percentil 25 – 75, IQR). Las variables categóricas fueron descritas mediante su distribución de frecuencias. Para las comparaciones de variables cuantitativas se utilizó la prueba de Mann-Whitney, para comparar dos grupos, y la prueba de Kruskal-Wallis, para comparar más de dos grupos. Las comparaciones de la misma variable en las distintas visitas se llevaron a cabo mediante la prueba de Wilcoxon para muestras relacionadas. Se empleó el coeficiente de correlación de Spearman para valorar las relaciones entre marcadores de malnutrición y los parámetros seleccionados. Para estudiar los posibles factores que contribuyen a la presencia de DPE en los pacientes en hemodiálisis, se ajustó un modelo de regresión logística multivariable cuyos resultados fueron resumidos a través de la odds ratio (OR) y su intervalo de confianza al 95 % (IC 95 %). Para el análisis de la mortalidad se estimaron las curvas de supervivencia por el método de Kaplan-Meier y se compararon mediante la prueba log-rank. Además se ajustó un modelo de regresión de Cox multivariable cuyos resultados fueron resumidos mediante la hazard ratio y su IC al 95 %. Todas las comparaciones fueron realizadas con pruebas bilaterales y un nivel de significación de 0,05.
RESULTADOS
Prevalencia de malnutrición según criterios de desgaste proteico-energético
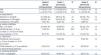
En la visita basal 46 pacientes (37 %) tenían DPE según la definición de la ISRMN, al cumplir tres criterios en las cuatro categorías diferentes. La tabla 1 muestra la distribución de los distintos marcadores de malnutrición según los criterios de DPE. Al inicio del análisis el 49,6 % de la población tenía albúmina < 3,8 g/dl, el 36,7 % presentaba prealbúmina < 30 mg/dl y solo el 5,7 % presentaba colesterol < 100 mg/dl. Entre los parámetros de composición corporal y antropométricos, casi la mitad (44,7 %) presentaba un IMC < 23 kg/m2 y el 41,7 % presentaba una CMB < percentil 50 de la población. El 73,4 % tenía una ingesta proteica insuficiente, definida como una nPCR < 0,8 g/kg/día. Observamos una correlación significativa positiva entre LTM y creatinina plasmática (rho = 0,34; p = 0,013) y entre LTM y albúmina (rho = 0,3; p = 0,011).
Evolución del desgaste proteico-energético en el tiempo
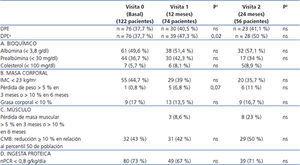
La prevalencia de DPE se mantuvo constante en el tiempo: 40,5 % a los 12 meses (visita 1) y 41,1 % a los 24 meses (visita 2). Pero, cuando se introdujo la variable de pérdida de masa muscular, la prevalencia de DPE aumentó significativamente a un 47,3 % en la visita 1 y a un 50 % en la visita 2 (figura 1). De los 49 pacientes que en la visita basal no presentaban DPE, 13 (26 %) pasan a tener DPE en la visita 1. De 28 pacientes que en la visita 1 no presentaban DPE, 10 (36 %) pasan a tener DPE en la visita 2. La recuperación de la situación de DPE sin una intervención terapéutica se produjo en 3 (12 %) de 25 pacientes con DPE previo en la visita 1 y en 9 (30 %) de 27 pacientes con DPE previo en la visita 2. Como se observa en la tabla 1, el porcentaje de pacientes con parámetros de malnutrición según los criterios de la ISRMN no sufre ningún cambio significativo entre la visita basal, 1 y 2. Pero, al analizar la progresión de los valores de los biomarcadores de malnutrición en las distintas visitas, se observó una progresión significativa en el estatus de malnutrición (tabla 2).
En la visita 1 se observó una disminución significativa de la prealbúmina y la creatinina plasmática, y un aumento significativo de calcio sérico, transferrina y péptido natriurético tipo B ( pro-BNP) (tabla 2). También aumentó significativamente el IMC, la OH, el agua corporal total (TBW), el ECW y el ICW. Disminuyó significativamente el ATM y no se modificó el LTM.
En la visita 2 se observó un descenso significativo en los niveles de albúmina, colesterol y PTH, y un aumento significativo en las cifras de fosfatasa alcalina, gamma glutamil transpeptidasa (GGT) y pro-BNP. En los parámetros antropométricos no se modificó el IMC, descendieron significativamente el ICW y la masa muscular, y hubo una tendencia no significativa a un aumento de la OH (tabla 2).
Factores asociados al desgaste proteico-energético
Se analizaron las características clínicas y fenotípicas de los pacientes con DPE (tabla 3). Los pacientes con DPE presentaban significativamente mayor irEPO, mayor PPf, mayor OH a pesar de tener menor TBW, menor ICW y ECW; menores niveles de triglicéridos y niveles de transferrina. A pesar de no haber diferencia significativa en la ganancia de peso interdiálisis, presentaron una tendencia no significativa a una tasa de ultrafiltración menor con una PPf significativamente mayor. No hubo diferencias significativas en edad, sexo, ni presencia de enfermedad cardiovascular o diabetes mellitus entre los pacientes con y sin DPE.
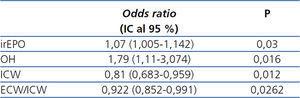
En el modelo de regresión logística univariable, los factores asociados a DPE fueron irEPO (OR: 1,07 [IC 95 %: 1,031-1,12]; p = 0,0005), triglicéridos (OR: 0,994 [IC 95 %: 0,98-0,99]; p = 0,0075), pro-BNP (OR: 1,022 (IC 95 %: 1,005-1,045]; p = 0,0102), ECW (OR: 0,72 [IC 95 %: 0,569-0,877]; p = 0,00008), ICW (OR: 0,88 [IC 95 %: 0,78-0,97]; p = 0,0182), ultrafiltración (OR: 0,53 [IC 95 %: 0,308-0,885]; p = 0,0145), tensión arterial diastólica al inicio de la diálisis (OR: 1,021 [IC 95 %: 1,004-1,04]; p = 0,0146), PPf (OR: 1,038 [IC 95 %: 1,015-1,064]; p = 0,0008). En el modelo de regresión multivariable las únicas variables clínicas que resultaron predictoras significativas de DPE fueron el grado de OH, irEPO, ICW y ratio ECW/ICW (tabla 4).
Desgaste proteico-energético y mortalidad
De los 122 pacientes que iniciaron el estudio, 74 pacientes lo finalizaron vivos, 56 de esos 74 pacientes completaron los 34 meses de seguimiento, 26 fallecieron, 8 (31 %) de causa cardiovascular, 1 paciente secundario a tumor subyacente, 5 (19 %) de causa infecciosa, 6 (23 %) pacientes secundario a deterioro del estado general, 4 (15 %) de otras causas y 2 (7 %) de causa no conocida, 17 se trasplantaron y 5 se cambiaron de centro.
El 53,8 % (14) de los pacientes que murieron tenía DPE. La curva de Kaplan-Meier no mostró diferencias en el riesgo de mortalidad entre pacientes con y sin DPE (figura 2 A). Dado que el DPE es la suma de varios criterios de malnutrición, analizamos individualmente cada variable según la definición de la ISRMN. El único criterio de malnutrición que se asoció con mortalidad fue la pérdida de masa muscular (figura 2 B).
DISCUSIÓN
El presente estudio observacional subraya la alta prevalencia de DPE en los pacientes en hemodiálisis y el aspecto dinámico del estatus de malnutrición en el tiempo. Se observa cómo el irEPO es un factor asociado a malnutrición. Además, nuestros resultados sugieren que elementos individuales de los criterios diagnósticos de DPE pueden tener mayor valor pronóstico que el propio DPE en los pacientes en hemodiálisis españoles. Así, de los criterios de malnutrición según la ISRMN, solo la pérdida de masa muscular se asoció con mortalidad.
En este estudio se ha analizado por primera vez la prevalencia del DPE en hemodiálisis en España. El 40 % de nuestra población en diálisis cumplía criterios de DPE. Hasta la fecha, no existen estudios suficientes que valoren la prevalencia del DPE en otras poblaciones según estos criterios. Esta prevalencia es discretamente inferior a la de otros estudios europeos o americanos que definieron la malnutrición según niveles de albúmina, escala MIS (Evaluación de Malnutrición e Inflamación) o valoración global subjetiva: un 74 % en pacientes en hemodiálisis europeos del estudio CONTRAST14, el 38 % en 331 pacientes de Estados Unidos15 o un 39 % en 221 pacientes en el norte de Europa en hemodiálisis16. Existen datos similares en diálisis peritoneal, con un 65 % en 199 pacientes en diálisis peritoneal en Brasil9. En España hace 20 años se observó que un 65 % de 29 pacientes en hemodiálisis estudiados presentaban malnutrición proteica calórica, definida con otros criterios de medidas antropométricas, proteínas viscerales como la albúmina, la nPCR y la ingesta proteica17. La reducción de las reservas grasa y proteica permitió detectar malnutridos no identificados por el peso corporal relativo, que solo mostró déficit en el 38 %. En ese mismo año el Estudio Cooperativo de Nutrición en Hemodiálisis analizó la malnutrición en 761 pacientes en hemodiálisis según parámetros antropométricos y marcadores bioquímicos (albúmina, transferrina, recuento de linfocitos) y concluyó que la prevalencia de malnutrición moderada-grave era del 52 % en los varones y del 46 % en las mujeres18,19. Estos resultados son muy similares a los obtenidos en el presente estudio, usando criterios diferentes. Sin embargo, ninguno de los estudios previos analizó el impacto de sus respectivas definiciones de malnutrición sobre la mortalidad.
El DPE define de forma dinámica la desnutrición y tiene en cuenta el criterio de pérdida o deterioro en un tiempo concreto. Esto implica que un análisis estático puede infraestimar su prevalencia. En el presente estudio se analizó el DPE de forma estática en la visita inicial y posteriormente se añadieron criterios dinámicos en las siguientes visitas. Al añadir el criterio dinámico de pérdida de masa muscular, la prevalencia de DPE aumenta significativamente y aporta una información mayor sobre la prevalencia de malnutrición que los datos de CMB e IMC, que no varían según los criterios de la ISRMN. Además hay progresión de los parámetros bioquímicos y antropométricos, sin llegar a cumplir los criterios de la ISRMN, lo que alerta de la progresión de la malnutrición.
Entre los parámetros bioquímicos, el descenso de prealbúmina se observa en el primer año y precede al descenso de las cifras de albúmina, que se observa un año más tarde. Estos datos confirman que la prealbúmina (proteína transportadora de tiroxina/proteína ligada a retinol), al tener una vida media más corta que la albúmina, es un indicador más precoz de desnutrición proteica que se recupera rápidamente al inicio de terapias de suplementación20,21. Tanto la albúmina como la prealbúmina se consideran buenos biomarcadores de malnutrición y se han relacionado con mortalidad en población en diálisis22,23. Otro parámetro bioquímico de malnutrición y masa muscular es la creatinina plasmática24. En el presente estudio la creatinina plasmática desciende progresiva y significativamente durante los dos primeros años y se acompaña de un descenso significativo en la masa muscular medida por bioimpedancia (LTM) al final del estudio. Observamos una correlación positiva entre el LTM y marcadores bioquímicos, como creatinina plasmática y albúmina. En este sentido, recientemente se ha publicado una fórmula para el cálculo del LTM basado en la creatinina plasmática en los pacientes en hemodiálisis sin diuresis residual25, así como la medición de la cinética de la creatinina plasmática como marcador de pérdida muscular como buen predictor de mortalidad en hemodiálisis26. En nuestra observación el descenso de la creatinina plasmática antecede en varios meses a la pérdida de masa muscular valorada mediante LTM; mientras que según los criterios de la ISRMN los pacientes con DPE presentaban cifras inferiores, aunque no significativas, respecto a los pacientes que no presentaban DPE, la tendencia individual al descenso nos parece de gran valor diagnóstico.
La asociación entre sobrecarga de volumen y malnutrición ha sido descrita previamente27, aunque más en los pacientes en diálisis peritoneal que en hemodiálisis. En nuestro estudio la OH posdiálisis no solo fue un factor de riesgo que se asociaba de forma independiente a la presencia de DPE, sino que además aumentó progresivamente en las sucesivas visitas. Es cierto que este aumento nunca fue superior a un litro con respecto al peso seco, y por lo tanto no se consideran cifras patológicas. La medida de OH indica el exceso de ECW. Hay distintas fórmulas para expresar la OH, como el ángulo de fase28, la relación entre ECW/TBW29 o el cociente ECW/ICW30. Recientemente se ha postulado una nueva fórmula para el cálculo de OH, debido a que el paciente en hemodiálisis sufre tanto cambios de volumen como de localización entre los diferentes compartimentos, que es el exceso de ECW sobre el peso seco (ECW/body weight)31. Este concepto es importante, ya que los pacientes urémicos malnutridos por definición tienen un IMC más bajo, lo que implica tener menos ATM y menos LTM. Hay que recordar que existe ICW y ECW tanto en el compartimento ATM como en el LTM, aunque en distinta proporción. En el análisis univariable tener bajas la ECW y la ICW es factor de riesgo para la presencia de malnutrición. Sin embargo, en el análisis multivariable el indicador OH (exceso de ECW sobre el peso del paciente) se asoció a mayor riesgo de malnutrición, y el cociente ECW/ICW resultó ser incluso un factor de protección, como ya se ha demostrado en estudios previos32. El cociente ECW/ICW no es un buen indicador de OH, ya que no tiene en cuenta la variabilidad entre los compartimentos ATM y LTM. Por esto, podríamos decir tras nuestro análisis que la malnutrición se asocia a OH, un aumento del ECW (a expensas del agua intersticial) por ocupación del espacio que el consumo del compartimento magro libera, al ser el primer compartimento que se altera, mucho antes que la grasa, ya que el organismo demanda energía inmediata que solamente el músculo puede proporcionar.
En la práctica clínica diaria es difícil la interpretación del estado de OH de los pacientes malnutridos. La hipotensión y los calambres musculares reflejan una reducción del volumen plasmático, pero no necesariamente del ECW. Cuando la tasa de ultrafiltración es mayor que la tasa de refilling, la presión arterial cae, incluso si hay un exceso de ECW33. Nuestros pacientes con criterios de DPE presentaban mayor estado de OH total, pero durante el período de estudio se consiguió ultrafiltrar el líquido deseado sin una reducción de la tensión arterial. La dificultad para ultrafiltrar el exceso de ECW en los pacientes malnutridos puede ser secundaria a un menor paso del agua desde el espacio intersticial al intravascular por disminución de la presión oncótica (disminución de albúmina)34. Posiblemente la presión arterial no desciende, pues la capacidad de refilling está mantenida pese a su estado de DPE y la aparición de una respuesta vasoconstrictora. Parece claro que la situación de DPE no significa un menor refilling en todos los casos. Además, el estado de OH conlleva un aumento en la presión de pulso en los pacientes con DPE significativamente mayor respecto a los pacientes sin DPE35, y como ya se ha descrito en estudios previos la elevación de presión de pulso se asocia a un aumento del riesgo de mortalidad cardiovascular36. Nosotros no encontramos una mayor PPi, aunque sí después. Sin embargo, la caída de la presión con la sesión de diálisis fue similar entre pacientes con y sin DPE, y no presentaron diferencias significativas en la ganancia de peso interdiálisis y sí una tendencia no significativa a una menor ultrafiltración total. En nuestro estudio el estado de malnutrición, pese a representar un estado de OH total, no implica una peor tolerancia a la ultrafiltración en diálisis.
Otro factor asociado independientemente a malnutrición en nuestro estudio fue el irEPO. En los últimos años ha crecido el interés por la relación entre diálisis, inflamación, malnutrición y baja respuesta a EPO. La presencia de altos niveles de marcadores inflamatorios y de parámetros bioquímicos de malnutrición (albúmina y prealbúmina bajas) se asocia con baja respuesta a EPO37. La disminución de la inflamación sistémica puede aumentar la respuesta a EPO, como han demostrado estudios aleatorizados en los que cambios de la técnica de la diálisis resultaron en una reducción significativa de los niveles de PCR o interleucina 6 y en una mejoría en la respuesta a la EPO38. También el déficit de micronutrientes como ácido fólico puede aumentar la resistencia a la EPO39. La presencia de DPE se asocia fuertemente con inflamación sistémica y con riesgo cardiovascular en los pacientes en diálisis40.
Por último, estudiamos si la malnutrición según los criterios de la ISRMN pudiera ser un buen marcador de mortalidad en nuestra población. No se observó asociación entre DPE y mortalidad, confirmando estudios previos como el CONTRAST, y nos hace pensar que dicha clasificación surgió con carácter diagnóstico de pacientes en riesgo de malnutrición y no pronóstico. En el estudio CONTRAST se observó en 560 pacientes en hemodiálisis que parámetros nutricionales individuales, como albúmina y creatinina plasmática, eran factores independientes asociados a mortalidad con igual fuerza y magnitud que varios factores de nutrición combinados14. En nuestra población el único marcador de malnutrición según los criterios de la ISRMN que se asoció con mortalidad fue la pérdida de masa muscular, mientras que un IMC < 23 kg/m2 (figura 2 C) o una CMB baja no se asociaron con mortalidad. Esto sugiere que el IMC o la CMB pudieran no ser buenos indicadores de pérdida de masa muscular en hemodiálisis41. Según estudios recientes, los pacientes con mayor riesgo de mortalidad son aquellos que tienen más pérdida de músculo. Kalantar et al. examinaron en 121 762 pacientes cambios de peso en el tiempo y observaron que el riesgo de mortalidad aumentaba cuando el IMC, la creatinina plasmática y el peso disminuían, pero el riesgo de mortalidad se reducía en los pacientes en los que disminuía el peso pero la creatinina plasmática aumentaba42. Para estos autores el IMC o incluso el peso seco comúnmente usado son malos marcadores del estado nutricional, pues no diferencian la pérdida proteica o la ganancia de agua. Asimismo, Agarwal et al.43 observaron que el IMC no es un buen indicador para distinguir entre masa grasa y masa muscular, y que aquellos pacientes con un IMC alto tendrían una mayor supervivencia por aumento de la masa muscular44. En nuestro estudio la pérdida de masa muscular medida por bioimpedancia fue más relevante que el IMC y la CMB para identificar a aquellos pacientes con mayor catabolismo proteico y riesgo de mortalidad. Pudiera ser que el criterio IMC < 23 kg/m2 según concepto de DPE no refleje dicho estatus de malnutrición para nuestra población, dado que fue descrito según población estadounidense, y requiera una revaluación para una población mediterránea-europea.
En conclusión, el DPE es altamente prevalente y tiene un carácter dinámico en los pacientes en hemodiálisis. Un concepto dinámico, la pérdida de masa muscular a lo largo del tiempo, refleja el desgaste que sufren los pacientes en hemodiálisis y se asocia a mayor mortalidad. Nuestro estudio sugiere una relación entre pérdida de masa muscular y mortalidad. Son necesarios estudios de intervención para evaluar si la prevención de la sarcopenia mejora la supervivencia. De igual modo, y como destacan otros autores, posiblemente debamos replantearnos en un futuro redefinir los criterios diagnósticos del DPE en los pacientes europeos o en la franja mediterránea, como parecen sugerir nuestros resultados.
Agradecimientos
RETIC REDINREN del ISCIII (RD12/0021/0001).
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Prevalencia del desgaste proteico-energético según los criterios de la International Society of Renal Metabolism and Nutrition en 122 pacientes prevalentes en hemodiálisis
Tabla 3. Características clínicas de los 122 pacientes en hemodiálisis según la presencia o no de desgaste proteico-energético
Tabla 4. Odds ratios e intervalos de confianza al 95 % para la presencia de desgaste proteico-energético en 122 pacientes prevalentes en hemodiálisis
Figura 1. Prevalencia de desgaste proteico-energético en 122 pacientes analizada en las tres visitas
Figura 2. A) Curva de supervivencia Kaplan-Meier según la presencia de desgaste proteico-energético o B) de pérdida de masa muscular o C) según índice de masa corporal < 23 kg/m2, en 122 pacientes en hemodiálisis
Tabla 2. Progresión de parámetros de malnutrición y composición corporal en 122 pacientes en hemodiálisis durante tres años