Introducción: Las concentraciones séricas de fósforo muestran una gran variabilidad en los pacientes con enfermedad renal crónica avanzada (ERCA) no en diálisis. El tratamiento con diuréticos puede influir en la severidad de las alteraciones óseo-minerales relacionadas con la ERCA, pero su efecto sobre los niveles de fósforo sérico es menos conocido. Objetivos: Determinar si existe una asociación independiente entre los niveles de fósforo sérico y el tratamiento con diuréticos, e investigar los mecanismos por los que los diuréticos podrían afectar el metabolismo del fósforo. Material y métodos: Estudio transversal en el que fueron incluidos 429 pacientes con ERCA. Además de las determinaciones analíticas convencionales, se incluyeron los siguientes parámetros: excreción urinaria de fósforo en 24 horas, reabsorción tubular máxima de fósforo (TmP) y fracción de excreción de fósforo (FEP). Resultados: El 55 % de los pacientes estaba en tratamiento con diuréticos. Con respecto a los no tratados con diuréticos, los que recibieron este tratamiento mostraron una concentración media de fósforo sérico significativamente superior (4,78 ± 1,23 vs. 4,24 ± 1,04 mg/dl; p < 0,0001), así como una mayor TmP (2,77 ± 0,72 vs. 2,43 ± 0,78 mg/dl; p < 0,0001). Por regresión lineal y logística múltiple, las asociaciones entre diuréticos y concentraciones de fósforo sérico o hiperfosfatemia (fósforo sérico > 4,5 mg/dl) mantuvieron las significaciones estadísticas tras ajuste con las principales variables confundentes. En los pacientes con la máxima carga de fósforo ajustada a función renal, aquellos tratados con diuréticos mostraron una FEP significativamente menor que los no tratados con diuréticos. Conclusión: El tratamiento con diuréticos en la ERCA se asocia a concentraciones más elevadas de fósforo sérico. Los diuréticos podrían interferir de forma indirecta con la máxima capacidad compensatoria renal de excretar fósforo. El tratamiento con diuréticos debería ser tenido en cuenta en los estudios que relacionan las concentraciones de fósforo sérico y las alteraciones cardiovasculares.
Background: Serum phosphate concentrations usually show great variability in patients with advanced chronic kidney disease (ACKD) not on dialysis. Diuretics treatment can have an influence over the severity of mineral-bone metabolism alterations related to ACKD, but their effect on serum phosphate levels is less known. Objectives: This study aims to determine whether diuretics are independently associated with serum phosphate levels, and to investigate the mechanisms by which diuretics may affect phosphate metabolism. Material and Method: 429 Caucasian patients with CKD not on dialysis were included in this cross-sectional study. In addition to conventional serum biochemical measures, the following parameters of renal phosphate excretion were assessed: 24-hours urinary phosphate excretion, tubular maximum phosphate reabsorption (TmP), and fractional excretion of phosphate (FEP). Results: 58% of patients were on treatment with diuretics. Patients on diuretics showed significantly higher mean serum phosphate concentration (4.78±1.23 vs. 4.24±1.04mg/dl; P<.0001), and higher TmP per GFR (2.77±0.72 vs. 2.43±0.78mg/dl; P<.0001) than those not treated with diuretics. By multivariate linear and logistic regression, significant associations between diuretics and serum phosphate concentrations or hyperphosphataemia remained after adjustment for potential confounding variables. In patients with the highest phosphate load adjusted to kidney function, those treated with diuretics showed significantly lower FEP than those untreated with diuretics. Conclusions: Treatment with diuretics is associated with increased serum phosphate concentrations in patients with ACKD. Diuretics may indirectly interfere with the maximum renal compensatory capacity to excrete phosphate. Diuretics should be considered in the studies linking the relationship between serum phosphate concentrations and cardiovascular alterations in patients with CKD.
INTRODUCCIÓN
La alteración del metabolismo del fósforo es una consecuencia invariable de la enfermedad renal crónica (ERC). Según desciende el filtrado glomerular (FG), se requiere un incremento compensador de la fracción de excreción de fósforo para mantener los niveles de fósforo sérico dentro de rangos normales. La carga dietética de fósforo, la hormona paratiroidea (PTH), y las fosfatoninas (factor de crecimiento fibroblástico (FGF) 23, FGF-7, secreted frizzled related protein 4, etc.) regulan la excreción renal de fósforo mediante la modulación de la expresión de los transportadores sodio-fósforo (NaPi-IIa, NaPi-IIc, y PiT-2 tipo III) en la membrana apical de las células del túbulo proximal1,2. Este mecanismo de compensación suele ser eficaz hasta los estadios más avanzados de la insuficiencia renal. Sin embargo, las concentraciones de fósforo sérico muestran una gran variabilidad en pacientes con ERC estadios 3-5 prediálisis3,4. Además de la severidad de la insuficiencia renal y la carga de fósforo, otros factores también podrían favorecer el desarrollo de hiperfosforemia interfiriendo en los mecanismos de compensación de la excreción renal de fósforo.
Los diuréticos se utilizan con mucha frecuencia en la ERC, y estos medicamentos pueden afectar el metabolismo mineral, entre otros efectos adversos5,6. La furosemida aumenta la excreción renal de calcio y puede agravar el hiperparatiroidismo secundario en pacientes con ERC5,6. Por el contrario, las tiazidas reducen la calciuria, aunque este efecto parece tener muy poca repercusión en los niveles de PTH6,7. Sin embargo, el efecto de los diuréticos en el metabolismo del fósforo en la ERC ha sido poco estudiado.
En un estudio previo, observamos una mayor prevalencia de hiperfosfatemia en pacientes con ERC tratados con diuréticos8. Otro estudio reciente también muestra que pacientes con ERC moderada tratados con diuréticos presentan niveles de fósforo significativamente más elevados que los pacientes no tratados con diuréticos6. Aunque esta asociación parece ser independiente de un buen número de potenciales factores de confusión8, la causalidad es todavía incierta.
Los objetivos de este estudio fueron confirmar si los diuréticos se asocian de forma independiente con niveles más elevados de fósforo sérico en la ERC avanzada prediálisis, e investigar los mecanismos por los que los diuréticos podrían afectar el metabolismo del fósforo.
MATERIAL Y MÉTODOS
En este estudio transversal, se incluyeron 429 pacientes caucasianos (edad media 67 ± 14 años, 201 mujeres). Todos los pacientes fueron reclutados de manera consecutiva en la consulta de Enfermedad Renal Crónica Avanzada durante el período comprendido entre junio de 2008 y diciembre de 2011 con los siguientes criterios de inclusión: edad superior a 18 años, FG menor de 40 ml/min/1,73 m2, no haber iniciado diálisis ni ser trasplantado renal, ausencia de proceso intercurrente agudo o alteraciones severas del estado de nutrición. En el momento de la extracción de muestras para el estudio, ningún paciente estaba siendo tratado con captores de fósforo o vitamina D.
Los criterios de exclusión fueron: tratamiento con corticoides y/o anticalcineurínicos, y pacientes con paraproteinemias o mieloma múltiple.
La información sobre el tratamiento que estaban realizando los pacientes se obtuvo mediante anamnesis y revisión de la historia clínica.
Métodos de laboratorio
Todas las muestras para análisis bioquímico se obtuvieron de sangre venosa periférica tras ayuno nocturno. Se pidió a los pacientes que el mismo día de la extracción trajeran la orina recogida en las 24 horas previas. Las concentraciones de fósforo, calcio, urea, creatinina y proteínas en sangre y orina se midieron por métodos convencionales (Advia® Chemistry, Siemens Healthcare Diagnostics). Las concentraciones de bicarbonato y calcio iónico plasmático fueron medidas por gasometría (ABL800 FLEX, Radiometer Ibérica). También se incluyeron en el estudio las determinaciones de albúmina sérica, ácido úrico, magnesio (colorimetría con azul xilidilo) y los niveles de PTH (molécula 1-84, inmunoensayo por quimioluminiscencia, Diasorin).
Se midieron los aclaramientos de creatinina y de urea, y se estimó el FG como la mitad de la suma de estos dos aclaramientos. También se estimó el FG mediante la ecuación MDRD con valores de creatinina estandarizados9.
La estimación indirecta de la ingesta proteica se determinó con el equivalente proteico de la generación de nitrógeno no proteico (PNPNA), calculado mediante las fórmulas combinadas de Cottini et al. y Maroni et al., según la descripción de Bergström et al.10.
La excreción de fósforo se calculó en las muestras de orina de 24 horas, y se presenta como excreción total y normalizada al FG medido (miligramos de fósforo excretado en 24 horas por ml/min/1,73 m2 de FG ). Este último parámetro intenta estimar la carga de fósforo diaria del paciente normalizada a su función renal.
La tasa de excreción de calcio fue calculada según la fórmula: calcio orina x creatinina plasma/creatinina orina.
La reabsorción tubular máxima de fósforo por FG se calculó según la fórmula: fósforo plasma – (fósforo orina/creatinina orina) x creatinina sangre.
La fracción de excreción de fósforo, expresada como porcentaje, fue calculada según la fórmula: (fósforo orina x creatinina plasma x 100)/(fósforo plasma x creatinina orina).
Diseño del estudio y métodos estadísticos
Estudio transversal que compara las concentraciones séricas de fósforo y parámetros de excreción renal de fósforo en pacientes tratados o no tratados con diuréticos. La asociación independiente entre el tratamiento con diuréticos y los niveles de fósforo o hiperfosforemia (fósforo sérico > 4,5 mg/dl) fue también analizada mediante regresión lineal y logística múltiple.
Para establecer la máxima capacidad compensatoria de excreción renal de fósforo se correlacionó la fracción de excreción de fósforo con la carga de fósforo normalizada a la función renal.
Para la estimación del tamaño de la muestra se asumieron las siguientes premisas: error tipo I (alfa) de 0,05; potencia del estudio 80 %; diferencia clínica significativa de las concentraciones de fósforo sérico entre subgrupos de 0,40 mg/dl; y desviación estándar de las concentraciones de fósforo sérico de 1,1 mg/dl. De esta forma, el número mínimo de pacientes que debería ser incluido se estimó en 424.
Para la comparación de variables continuas en pacientes tratados o no con diuréticos se utilizaron el test t de Student o el test de Mann-Whitney, según las características de distribución de la variable. El test χ2 fue utilizado para la comparación de variables categóricas entre subgrupos.
El poder de discriminación de la excreción total de fósforo normalizada al FG para asociarse con hiperfosforemia fue analizado mediante curvas COR (característica operativa del receptor).
Para establecer la asociación independiente del tratamiento diurético con los niveles de fósforo sérico o con la hiperfosforemia, se utilizaron regresión lineal y logística múltiple, respectivamente. Las variables independientes incluidas en estos modelos fueron: edad, sexo, FG, carga de fósforo, diabetes, albúmina sérica, bicarbonato sérico, proteinuria, PTH e ingesta proteica estimada (PNPNA). Para la selección de las covariables con los mejores modelos de predicción se utilizó el proceso automático de eliminación progresiva condicional (hacia atrás).
Los datos se presentan como media ± desviación estándar. Una p inferior a 0,05 indicó significación estadística. Para los análisis estadísticos y realización de los gráficos, se utilizaron el software SPSS versión 15.0 (SPSS, Chicago, EE. UU.) y STATA versión 11.1 (Stata Corporation, Texas, USA).
RESULTADOS
Diferencias entre pacientes con o sin diuréticos
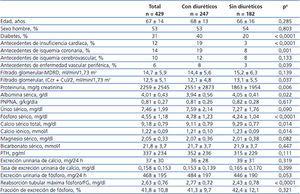
El porcentaje de pacientes tratados con diuréticos fue del 58 %. En la tabla 1 se muestran las características demográficas, clínicas y bioquímicas del grupo total y de los dos subgrupos según tratamiento o no con diuréticos.
Un mayor porcentaje de pacientes tratados con diuréticos presentaba diabetes mellitus, historia previa de insuficiencia cardíaca, cardiopatía isquémica e isquemia periférica. Los pacientes con diuréticos mostraron una proteinuria más elevada y unas concentraciones menores de albúmina sérica que los pacientes no tratados con diuréticos. No se encontraron diferencias significativas en la edad, el sexo y el FG.
Los pacientes tratados con diuréticos mostraron una concentración media de fósforo sérico significativamente superior al de los no tratados (4,78 ± 1,23 vs. 4,24 ± 1,04 mg/dl; intervalo de confianza 95 % de la diferencia = 0,76 y 0,32 mg/dl; p < 0,0001).
La reabsorción tubular máxima de fósforo fue también significativamente más elevada en los pacientes tratados con diuréticos, aunque la excreción urinaria total de fósforo y la fracción de excreción de fósforo no mostraron diferencias significativas entre los subgrupos tratados o no con diuréticos (tabla 1).
Los pacientes tratados con diuréticos mostraron niveles más bajos de calcio total e iónico, aunque las diferencias en los niveles de PTH y la excreción urinaria de calcio no alcanzaron diferencias significativas (tabla 1).
El tipo de diurético más utilizado fue la furosemida (151 pacientes), seguido de la torasemida (68 pacientes) y las tiazidas (23 pacientes). Los niveles de fósforo sérico en cada subgrupo según el tipo de diurético fueron significativamente más elevados que los del subgrupo sin diuréticos: subgrupo furosemida (fósforo sérico 4,80 ± 1,28 mg/dl, p = 0,001); subgrupo torasemida (fósforo sérico = 4,72 ± 1,19 mg/dl; p < 0,05); y subgrupo tiazidas (fósforo sérico = 4,96 ± 1,11 mg/dl, p < 0,05).
La reabsorción tubular máxima de fósforo también fue significativamente más elevada en cada uno de los subgrupos de diuréticos con respecto a los no tratados. No se encontraron diferencias significativas entre subgrupos en el resto de los parámetros estudiados.
Determinantes de los niveles de fósforo sérico e hiperfosforemia
Se observó hiperfosforemia (fósforo sérico > 4,5 mg/dl) en 183 pacientes (43 %).
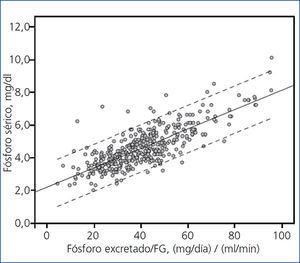
En el análisis de regresión lineal univariante, los niveles de fósforo sérico se correlacionaron con el FG (R2 = 0,360; p < 0,0001) y con la excreción urinaria total de fósforo (R2 = 0,040; p < 0,0001). Sin embargo, la interacción de estos dos parámetros, esto es, la carga de fósforo normalizada al FG, mejoró sustancialmente la correlación con las concentraciones séricas de fósforo (R2 = 0,620) (figura 1).
Los niveles séricos de fósforo también se correlacionaron positivamente con la proteinuria (R2 = 0,126; p < 0,0001) y negativamente con las concentraciones de albúmina sérica (R2 = 0,034; p < 0,0001).
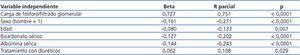
Mediante regresión lineal múltiple (tabla 2), la carga de fósforo normalizada al FG fue el mejor determinante de los niveles séricos de fósforo (beta = 0,721), seguido de la edad, el sexo, la albúmina sérica, el bicarbonato sérico y el tratamiento con diuréticos.
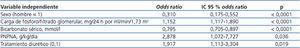
Por regresión logística múltiple (tabla 3), el tratamiento con diuréticos también se asoció de forma independiente con la hiperfosforemia (odds ratio = 1,917; p = 0,019).
En el análisis de curvas COR, la carga de fósforo normalizada al FG se asoció significativamente con la hiperfosforemia (área bajo la curva = 0,861; p < 0,0001). Un valor de 40 mg de excreción urinaria diaria por cada ml/min/1,73 m2 de FG marcó el punto de corte para la hiperfosfatemia, con una sensibilidad y especificidad, ambas, del 75 %.
Diferencias en la fracción de excreción de fósforo en pacientes tratados o no con diuréticos
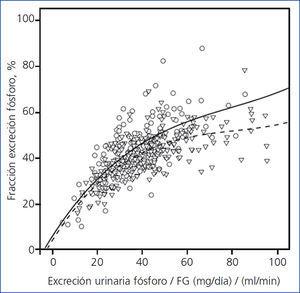
La figura 2 muestra las curvas que mejor ajustaron la correlación entre la fracción de excreción de fósforo y la carga de fósforo normalizada al FG en ambos subgrupos. Las dos curvas fueron virtualmente idénticas en el tramo de menor carga de fósforo. Sin embargo, en los pacientes con sobrecarga de fósforo, la capacidad compensatoria máxima para excretar fósforo, representada por la máxima excreción fraccional de fósforo, alcanzó niveles más elevados en los no tratados con diuréticos.
Analizando de forma separada los datos de los pacientes con mayor carga de fósforo normalizada a FG (tabla 4), se observó que tanto los niveles de fósforo sérico como la reabsorción tubular máxima de fósforo fueron significativamente más elevados en los pacientes tratados con diuréticos, mientras que la fracción de excreción de fósforo fue significativamente más elevada en los pacientes no tratados con diuréticos.
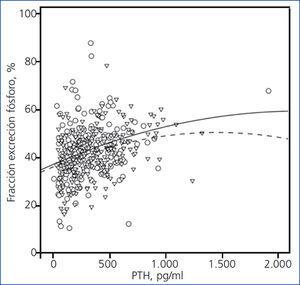
La esperable correlación entre los niveles de PTH y la fracción de excreción de fósforo también mostró diferencias según el paciente estuviera en tratamiento o no con diuréticos (figura 3).
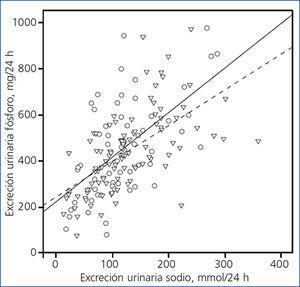
La asociación entre la excreción de fósforo y sodio en orina de 24 horas en un subgrupo de 160 pacientes en los que se determinaron estos dos parámetros mostró una interesante divergencia a partir de unos valores de natriuresis de 50 mmol/24 h (figura 4). A igual excreción de sodio, los pacientes con diuréticos excretaban menos fósforo que los no tratados con esta medicación.
DISCUSIÓN
Los resultados de este estudio muestran que los pacientes con ERC tratados con diuréticos tienen unas concentraciones de fósforo más elevadas que los no tratados. La asociación significativa entre tratamiento diurético e hiperfosforemia se mantuvo tras el ajuste de los resultados teniendo en cuenta variables que potencialmente podrían confundir esta asociación. Los pacientes tratados con diuréticos mostraron una reabsorción máxima de fosfatos más elevada y, en situaciones de mayor carga de fósforo, los pacientes tratados con diuréticos mostraron una fracción de excreción de fósforo significativamente menor que los no tratados.
Aunque en este estudio no se puede probar una relación causal entre el tratamiento diurético y los niveles elevados de fósforo sérico debido al diseño transversal, estos hallazgos sugieren que los diuréticos podrían interferir directa o indirectamente con los mecanismos compensadores de la excreción renal de fósforo en la ERC.
En este estudio se utilizan varios parámetros de excreción renal de fósforo que merecen ser comentados para una mejor comprensión de los resultados. De forma breve, la relación entre la excreción urinaria total de fósforo y la medida de función renal (FG), parámetro denominado «carga de fósforo normalizada a FG», fue el mejor determinante de los niveles de fósforo sérico en la población de estudio. Una excreción urinaria de fósforo superior a 40 mg por cada ml/min/1,73 m2 de FG (p. ej., 400 mg de excreción urinaria de fósforo en pacientes con 10 ml/min de FG u 800 mg en pacientes con 20 ml/min de FG) fue el mejor determinante de la hiperfosforemia. Estos hallazgos están plenamente de acuerdo con la fisiopatología de las alteraciones minerales de la ERC.
La excreción compensadora renal de fósforo, representada como la fracción de excreción de fósforo, aumenta casi de forma lineal según aumenta la carga de fósforo normalizada al FG, pero hasta un nivel máximo, que corresponde aproximadamente al punto de corte en el que comienza a observarse hiperfosforemia. Esta fracción de excreción máxima de fósforo fue significativamente más elevada en pacientes no tratados con diuréticos que en los tratados con esta medicación, hallazgo que podría ayudar a explicar las diferencias observadas en los niveles de fósforo sérico entre subgrupos.
Los diuréticos pueden afectar el metabolismo mineral5,6. Mientras que la furosemida aumenta la excreción renal de calcio, las tiazidas aumentan la reabsorción tubular de calcio, principalmente a través de un mecanismo acoplado con la reabsorción tubular de sodio en respuesta a la reducción del volumen del fluido extracelular11. Así, el tipo de diurético utilizado en pacientes con ERC podría influir en el balance de calcio y en la severidad del hiperparatiroidismo secundario5,6. Sin embargo, el efecto de los diuréticos en los niveles séricos de fósforo en pacientes con ERC ha sido poco estudiado.
Un efecto inhibitorio directo de un diurético sobre la reabsorción de fósforo en el túbulo proximal solo ha sido descrito con la acetazolamida, inhibidor de la anhidrasa carbónica12. El efecto de otros diuréticos en la reabsorción del fósforo en el túbulo proximal se correlaciona en gran medida con su capacidad de inhibición de la anhidrasa carbónica12. Sin embargo, no se ha descrito ningún efecto farmacológico estimulante de los diuréticos sobre el transporte tubular de fósforo, y por tanto parece muy improbable que un efecto directo de los diuréticos sobre el metabolismo del fósforo pudiera explicar nuestros hallazgos.
Las tiazidas han sido utilizadas con éxito para incrementar los niveles de fósforo sérico en el raquitismo hipofosfatémico13, enfermedad caracterizada por una pérdida urinaria de fósforo. La base del éxito de este tratamiento parece estar relacionada con las modificaciones del volumen extracelular. La expansión del fluido extracelular disminuye la reabsorción tubular de fósforo14. Por el contrario, la contracción de volumen extracelular que inducen las tiazidas podría incrementar la reabsorción tubular de fósforo1,2,13. Aunque en el presente estudio no medimos el volumen extracelular de los pacientes, algunos posibles mecanismos para explicar estos hallazgos podrían estar relacionados con la reducción del volumen extracelular o el volumen circulante efectivo, acoplados a los cambios en la reabsorción tubular de sodio y fósforo.
Cada uno de los tres tipos de diuréticos con los que fueron tratados los pacientes en este estudio (furosemida, tiazidas y torasemida) se asoció con una concentración media de fósforo significativamente más elevada que la de los pacientes no tratados con diuréticos. Este hallazgo sugiere la ausencia de especificidad farmacológica en el efecto hiperfosfatémico de los diuréticos.
En el presente estudio, las concentraciones de fósforo sérico se correlacionaron positivamente con la proteinuria y negativamente con la albúmina sérica. En el análisis de regresión lineal múltiple, la albúmina sérica y el tratamiento diurético mantuvieron la significación como variables predictivas de las concentraciones de fósforo, pero no así la proteinuria. Otros estudios también han observado esta interesante relación entre proteinuria y niveles de fósforo en sangre15-18, aunque en ninguno de ellos se aporta información sobre la utilización de diuréticos.
El fósforo ha sido reconocido como un nuevo factor de riesgo cardiovascular y, en pacientes con ERC no en diálisis, la hiperfosforemia se asocia con un aumento de la mortalidad4,19. Ya que el uso de diuréticos se asocia muy frecuentemente con un perfil de riesgo cardiovascular elevado, y al mismo tiempo estos medicamentos podrían incrementar los niveles de fósforo sérico, la inclusión del tratamiento diurético como potencial factor de confusión podría ayudar a definir mejor el papel del fósforo, y quizá de las fosfatoninas, en el desarrollo de complicaciones cardiovasculares en la población general y sobre todo en la ERC.
Este estudio tiene varias limitaciones. El diseño transversal impide establecer inequívocamente la causalidad y temporalidad de esta asociación. Este estudio se realizó en un solo centro, los participantes fueron todos caucasianos y la mayoría de ellos de edad avanzada. No se midieron los niveles de 25-hidroxi-vitamina D, 1,25-dihidroxi-vitamina D ni FGF-23 u otras fosfatoninas. Ocho pacientes (seis de ellos no tratados con diuréticos) mostraron unas fracciones de excreción de fósforo muy elevadas (> 65 %), en probable relación con disfunciones del túbulo proximal. No obstante, la exclusión de estos pacientes no modificó sustancialmente los resultados ni la significación estadística de las diferencias encontradas entre los pacientes tratados o no con diuréticos.
En conclusión, el tratamiento con diuréticos en la ERC avanzada se asocia a concentraciones más elevadas de fósforo sérico. Los diuréticos podrían interferir de forma indirecta con la máxima capacidad compensatoria renal de excretar fósforo. El tratamiento con diuréticos debería tenerse en cuenta en los estudios que relacionan las concentraciones de fósforo sérico y las alteraciones cardiovasculares.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características demográficas, clínicas y bioquímicas del grupo de estudio total y de los subgrupos de acuerdo con el tratamiento diurético o no
Tabla 2. Regresión lineal múltiple sobre los determinantes de las concentraciones de fósforo sérico (a)
Tabla 3. Regresión logística múltiple sobre los determinantes de hiperfosfatemia (fósforo sérico > 4,5 mg/dl)
Tabla 4. Características clínicas y bioquímicas de los pacientes con los niveles más elevados de carga de fósforo ajustada a filtrado glomerular (> 40 mg/día por ml/min/1,73 m2)
Figura 1. Correlación entre niveles de fósforo sérico y carga de fósforo normalizada a filtrado glomerular
Figura 2. Correlación entre la fracción de excreción de fósforo y la carga de fósforo normalizada al filtrado glomerular
Figura 3. Correlación entre fracción de excreción de fósforo y concentraciones séricas de hormona paratiroidea
Figura 4. Correlación entre excreción urinaria de fósforo y sodio en 24 horas