La reducción de las hormonas tiroideas, triyodotironina total (T3) y triyodotironina libre (T3L) en pacientes en hemodiálisis, es un marcador de malnutrición e inflamación y son predictores de mortalidad. El objetivo del estudio fue determinar la prevalencia del síndrome complejo de malnutrición e inflamación en hemodiálisis y su asociación con las hormonas tiroideas: tirotropina, T3, T3L y tiroxina libre (T4L); además de evaluar la incidencia del síndrome de T3L y su correlación con marcadores nutricionales e inflamatorios.
Materiales y métodosEstudio transversal, analítico y comparativo, incluyó 128 pacientes en HD, 50,8% mujeres, edad 45,05±17,01 años, 45,4±38,8 meses en hemodiálisis, 29,7% diabéticos y 79,7% hipertensos. Se determinó en suero la concentración de tirotropina, T3, T3L y T4L, se aplicó la encuesta Malnutrition-Inflammation Score para diagnosticar malnutrición e inflamación.
ResultadosLa media de valores de las hormonas tiroideas fueron: tirotropina 2,48±1,8 mUI/mL (rango 0,015-9,5), T3 1,18±0,39ng/mL (0,67-2,64), T3L 5,21±0,96pmol/l (3,47-9,75), T4L 1,35±0,4ng/mL (0,52-2,57). La prevalencia de síndrome complejo de malnutrición e inflamación es 53,9%; un 11,7% mostró T3L baja. Las concentraciones séricas de T3 y T3L correlacionan negativamente con Malnutrition-Inflammation Score y T4L correlaciona positivamente con Malnutrition-Inflammation Score. El análisis de regresión lineal de T3L baja fue asociado con IL-6 (β=0,265 p=0,031), proteína C reactiva (β=-0,313 p=0,018) y albúmina (β=0,276 p=0,002).
ConclusionesBajos niveles de T3 y T3L correlacionan con parámetros de inflamación y nutrición. El síndrome complejo de malnutrición e inflamación puede afectar la concentración sérica de hormonas tiroideas.
Low levels of thyroid hormones, total triiodothyronine (T3) and free triiodothyronine (FT3) in haemodialysis patients is a marker of malnutrition and inflammation and are predictors of mortality. The aim of this study was to determine the prevalence of malnutrition-inflammation complex syndrome in haemodialysis and its relationship with the thyroid hormones thyrotropin, T3, FT3 and free thyroxine (FT4), as well as to evaluate the prevalence of low FT3 syndrome and its correlation with nutritional and inflammatory markers.
Materials and methodsCross-sectional, analytical and comparative study that enrolled 128 haemodialysis patients: 50.8% females; mean age 45.05±17.01 years; mean time on haemodialysis 45.4±38.8 months; 29.7% diabetics; 79.7% with hypertension. Serum thyroid hormones thyrotropin, T3, FT3 and FT4 concentrations were measured and Malnutritition-Inflammation Score (MIS) was applie to diagnostic.
ResultsMean thyroid hormone values were: thyroid hormones thyrotropin 2.48±1.8 mIU/ml (range: 0.015-9.5), T3 1.18±0.39 ng/ml (range 0.67-2.64), FT3 5.21±0.96pmol/l (range: 3.47-9.75); FT4 1.35±0.4 ng/ml (range: 0.52-2.57). Malnutrition-inflammation complex syndrome prevalence was 53.9%; 11.7% presented low FT3 levels. Serum T3 and FT3 concentrations inversely correlated with Malnutritition-Inflammation Score (MIS), while FT4 correlated positively with Malnutrition-Inflammation Score. In the linear regression analysis, low FT3 was associated with IL-6 (β= 0.265, p=.031), C-reactive protein (CRP) (β= -0.313, p=.018) and albumin (β= 0.276, p=.002).
ConclusionLow T3 and FT3 levels are correlated with malnutrition and inflammation parameters. Malnutrition-inflammation complex syndrome can affect serum concentrations of thyroid hormones.
La malnutrición es un problema frecuente y grave en pacientes en tratamiento con diálisis, su prevalencia estimada es del 18 al 75%1–3. Su etiología es de causas multifactoriales y se ha denominado «síndrome complejo de malnutrición e inflamación»,4 del inglés malnutrition-inflammation complex syndrome (MICS), actualmente denominado síndrome de desgaste proteico energético5.
MICS es una condición de pérdida de las reservas de masa proteica y de energía resultado de condiciones inflamatorias y no inflamatorias en pacientes con enfermedad renal crónica (ERC) como: dieta, estrés oxidativo, acidemia, la pérdida sanguínea por los hemodializadores y por las heces, medio urémico y el efecto de hormonas anabólicas;5 para realizar su diagnóstico se utiliza la encuesta Malnutrition Inflammation Score (MIS)6, la cual ha sido recientemente validada en México7.
Estudios previos han reportado en pacientes en diálisis cifras del 50% de concentraciones séricas disminuidas de triyodotironina libre (T3L), este síndrome de T3L baja se define con el parámetro anterior más la presencia de hormona estimulante de tiroides (TSH) normal y tiroxina libre (T4L) normal o ligeramente baja y se ha correlacionado con parámetros de malnutrición e inflamación8.
En la ERC está alterado el metabolismo, distribución, degradación y excreción de las hormonas tiroideas9,10, lo más común es una mayor disminución en la concentración de triyodotironina total (T3)11.
La etiología de las alteraciones tiroideas en ERC es multifactorial y no del todo entendida, incluye disminución de la actividad de la desyodinasa, reducción en la excreción de iodo inorgánico, toxinas urémicas, acidosis metabólica, desnutrición, uso de heparina en hemodiálisis (HD), edad avanzada, infección por virus de hepatitis C y fármacos (amiodarona, esteroides, betabloqueadores, litio, rifampicina, sunitinib, sorafenib, imatinib, entre otros)9,12,13.
Algunos estudios han correlacionado las bajas concentraciones T3 en pacientes con ERC con concentraciones elevadas de marcadores de inflamación (proteína C reactiva altamente sensible [hsCRP], interleucina 6 [IL-6]), desnutrición (disminución en la concentración sérica de prealbúmina), aumento en la disfunción endotelial, deterioro de la función cardiaca, pobre sobrevida y mayor mortalidad por todas las causas14–19, sin embargo otros autores han demostrado que concentraciones séricas bajas de T3L se asocian con aumento en la mortalidad, explicado en parte por su asociación subyacente con el estado nutricional y la inflamación20,21.
El objetivo de este estudio fue evaluar la frecuencia de MICS en pacientes con HD y su asociación con los cambios en las concentraciones séricas de hormonas tiroideas.
Materiales y métodosSe realizó un estudio transversal, el periodo de estudio fue del 4 de enero al 30 julio de 2016 en el Hospital General Regional N.o 1 del Instituto Mexicano del Seguro Social (IMSS), el protocolo fue aprobado por el Comité de Ética e Investigación y cumple con lo estipulado en la Declaración de Helsinki respecto al desarrollo de protocolos de investigación en seres humanos.
Se incluyeron pacientes con más de 3 meses en tratamiento con HD y 3 sesiones por semana, ambos géneros, entre 18 y 79 años de edad. Sin enfermedad tiroidea conocida o detectada durante el estudio. Con un mínimo de dosis de diálisis de spKt/V de 1.2 de acuerdo a las guías KDOQI22. Se excluyeron pacientes en tratamiento con fármacos que alteraran las concentraciones séricas de hormonas tiroideas, con enfermedades crónicas, con panel viral positivo a virus de inmunodeficiencia humana, virus de hepatitis B y C, o con infección documentada en las últimas 6 semanas.
Se realizó historia clínica, se registró edad, género, diagnósticos previos, tiempo en hemodiálisis y tratamiento médico. Se midieron el peso seco, la talla y se calculó el índice de masa corporal (IMC).
Se tomaron muestras sanguíneas entre las 8:00 y 10:00 a.m, previo ayuno mínimo de 8 h y antes del inicio de la HD (48 h después de la última sesión), se realizó biometría hemática completa, glucosa, urea, creatinina, ferritina, transferrina, albúmina, colesterol, triglicéridos, PCR, IL-6, TSH, T3, T3L y T4L.
La PCR se midió cuantitativamente en suero por inmunocinética a punto final (Vitros products, EE. UU.) con rango dinámico de 7.0 a 110.0mg/l.
La determinación de hormonas tiroideas (TSH, T3, T3L y T4L), se realizó por quimioluminiscencia prolongada (Vitros 3,600 de Johson & Johnson, Ortho Clinical Diagnostics, Reino Unido). Los valores normales de referencia fueron: TSH: 0,465-4,68 mUI/ml; T3: 0,97-1,69 ng/mL; T3L: 4,26-8,1pmol/l; T4L: 0,78-2,19 ng/dl).
Una alícuota de suero fue congelada -70°C para el análisis posterior de IL-6, la cual se realizó con técnica de ELISA (laboratorio novex®, by life technologies, hecho en Bélgica).
El diagnóstico de MICS se realizó mediante la encuesta MIS, por lo que se evaluaron los siguientes 10 elementos: pérdida de peso seco, ingesta alimentaria, síntomas gastrointestinales, capacidad funcional, comorbilidad incluidos años en diálisis, disminución de depósitos grasos o pérdida de grasa subcutánea, signos de pérdida muscular, índice de masa corporal, albúmina sérica, capacidad total de transportar hierro o transferrina. A cada uno de los elementos anteriores se le dio un puntaje de 0 a 3 puntos, la sumatoria final de la encuesta fue de 0 a 30 puntos. Para el diagnóstico de MICS se utilizaron las siguientes categorías: normal (0-2 puntos), desnutrición leve (3-5 puntos), desnutrición moderada (6-8 puntos) y desnutrición severa (mayor o igual de 9 puntos).
Análisis estadísticoPara el análisis estadístico se categorizó la muestra en pacientes con y sin MICS. Se identificó la distribución normal mediante el test de Kolmogorov-Smirnov. Los datos se presentan como promedios±desviación estándar o porcentajes y rangos de acuerdo a la variable. Las diferencias entre grupos con y sin MICS se analizaron con t de Student para muestras independientes para variables de distribución normal. La prueba U Mann Whitney se utilizó para la comparación de variables que no tenían distribución normal y se expresan como mediana con su respectivo rango. Además se realizó el cálculo del coeficiente de correlación lineal de Pearson (o de Spearman cuando alguna variable era ordinal y/o no se distribuía normalmente) para la correlación entre variables.
Se realizó un análisis de regresión lineal simple para descartar aquellas variables confusoras usando las concentraciones de hormonas tiroideas como variable dependiente y otros parámetros demográficos - bioquímicos como variables independientes.
Se consideró significativa toda p<0,05 a dos colas. Se utilizó el programa SPSS® v. 20 en español.
ResultadosSe incluyeron 128 pacientes, 50,8% eran mujeres, 29,7% tenían diagnóstico de diabetes mellitus y 79,7% tenían diagnóstico de hipertensión arterial. Edad 45,05±17,01 años, tiempo promedio en HD fue de 45,4±38,8 meses, el Kt/V fue de 1,37±0,16 con un porcentaje de reducción de urea de 65,9±5,7%, el 96% de los pacientes estaban en tratamiento con eritropoyetina.
Los promedios de las variables clínicas y bioquímicas se muestran en la tabla 1. El promedio de la IL-6 fue de 8,60 pg/ml con un rango de 0-126,6 pg/ml y ferritina de 124mg/dl con un rango de 8-1610mg/dl. La media y los rangos de las concentraciones de las hormonas tiroideas fueron: TSH 2,48±1,8mUI/mL (0,015-9,5), T3 1,18±0,39ng/mL (0,67-2,64), T3L 5,21±0,96pmol/l (3,47-9,75), T4L 1,35±0,4 ng/dl (0,52-2,57).
Principales características clínicas y bioquímicas de los 128 pacientes en hemodiálisis crónica incluidos en el estudio
| Variable | Media±desviaciones estándar |
|---|---|
| Edad (años) | 45,05±17,01 |
| Índice de masa corporal (kg/m2) | 23,96±4,98 |
| Presión arterial sistólica (mmHg) | 138,48±22,87 |
| Presión arterial diastólica (mmHg) | 75,09±13,27 |
| Tiempo en hemodiálisis (meses) | 45,4±38,8 |
| Kt/V | 1,37±0,16 |
| Hemoglobina (g/dl) | 10,1±2,19 |
| Glucosa (mg/dl) | 111,5±56,5 |
| Urea (mg/dl) | 117,8±40 |
| Creatinina (mg/dl) | 10,2±3 |
| Transferrina (mg/dl) | 233±59 |
| Albúmina (g/dl) | 3,89±0,4 |
| Colesterol (mg/dl) | 137,85±35,2 |
| Triglicéridos (mg/dl) | 125,4±72,7 |
| Proteína C reactiva (mg/l) | 26,4±16,6 |
| Hormona estimulante de tiroides (mUI/mL) | 2,48±1,8 |
| T3 total (ng/mL) | 1,18±0,39 |
| T3 libre (pmol/l) | 5,21±0,96 |
| T4 libre (ng/dl) | 1,35±0,4 |
Al analizar los resultados de la encuesta MIS, se presentó MICS en un 53,9% de los pacientes, de los cuales 55 tenían diagnóstico de hipertensión arterial y 25 tenían diagnóstico de diabetes mellitus tipo 2 (DM2) contra 47 pacientes con hipertensión arterial y 13 con diagnósticos de DM2 en el grupo sin MICS, sin diferencias significativas. En el IMC, presión arterial, Kt/V y URR no se encontraron diferencias significativas (tabla 2).
Parámetros antropométricos entre los grupos con y sin MICS
| Variable | Con MICS (N=69) | Sin MICS (N=59) |
|---|---|---|
| Edad (años) | 47,59±17,9 | 42±15,5 |
| Género: (M/F) | 29/40 | 25/34 |
| Índice de masa corporal (kg/m2) | 23,8±5,55 | 24±4,2 |
| Meses en HD (rango) | 58,36 (4-240) | 32,85 (3-87) |
| Peso seco (kg) | 58,1±12,6 | 60,5±10,6 |
| Presión arterial sistólica (mmHg) | 140,1±24,6 | 136,5±20,6 |
| Presión arterial diastólica (mmHg) | 73,2±13,5 | 77,2±12,7 |
| Kt/V | 1,38±0,18 | 1,37±0,16 |
| URR (%) | 66,1±5,2 | 65,6±5,1 |
Se reporta media±desviaciones estándar, entre paréntesis el rango.
F: femenino; Kt/V: índice de diálisis para cuantificación de la dosis de diálisis; K: aclaramiento del dializador; M: masculino; t: tiempo; V: volumen de distribución de la urea; URR: Urea Reduction Ratio, en español sería porcentaje de reducción de urea
Las comparaciones en las variables bioquímicas mostraron diferencias significativas en la mayoría de los parámetros evaluados destacando PCR (MICS 32,3±20,2 vs. sin MICS 12,8±6,3mg/l) (p<0,01). Se encontró además diferencia en las concentraciones séricas de ferritina ([MICS 204,8ng/mL vs. sin MICS 42,2ng/mL, p<0,01] e IL-6 [MICS 11,7 vs. sin MICS 4,8, p<0,01]), (tabla 3).
Diferencias bioquímicas entre pacientes con y sin MICS
| Variable | Con MICS (N=69) | Sin MICS (N=59) |
|---|---|---|
| Hemoglobina (g/dl) | 9,4±2,17 | 10,7±2** |
| Glucosa (mg/dl) | 120,75±75 | 101,37±42 |
| Urea (mg/dl) | 114,2±38,4 | 122,1±41,7 |
| Creatinina (mg/dl) | 9,2±2,7 | 11,4±3,1** |
| Albúmina (g/dl) | 3,72±0,37 | 4,1±0,34** |
| Colesterol (mg/dl) | 130,9±33,3 | 145,8±36, |
| Triglicéridos (mg/dl) | 118±67,5 | 133,9±78,1 |
| Proteína C reactiva (mg/l) | 32,33±20,2 | 12,8±6,31** |
| IL-6 (pg/ml) | 11,7 (0,-126,6) | 4,8 (0-16,4)** |
| Transferrina (mg/dl) | 210,6±59,6 | 259,7±46,1** |
| Ferritina (ng/mL) | 204,8 (8-1610) | 42,2 (8-385)** |
| Hormona estimulante de tiroides (mUI/mL) | 2,8±2,2 | 2,36±1,76* |
| T3 total (ng/mL) | 1,13±0,25 | 1,24±0,35* |
| T3 libre (pmol/l) | 5,1±1 | 5,3±0,84 |
| T4 libre (ng/dl) | 1,48±0,47 | 1,19±0,29** |
Media±DE, DE: desviaciones estándar; entre paréntesis el rango.
Referente a las concentraciones séricas de las hormonas tiroideas se encontró elevación de las concentraciones de TSH (MICS 2,8±2,2 vs. sin MICS 2,36±1,76) y T4L (MICS 1,48±0,47 vs. sin MICS 1,19±0,29) y disminución de T3 (MICS 1,13±0,25 vs. sin MICS 1,24±0,35), p<0,05.
Adicionalmente encontramos incrementada la dosis de eritropoyetina en el grupo MICS 211,24±77,96 UI/kg/semana vs. 154,8±78,04 UI/kg/semana en el grupo sin MICS, con un índice de resistencia a la EPO en el grupo con MICS de 1345,13±570,91 vs. sin MICS 968,58±462,65 (p<0,01), (tabla 3).
De los pacientes con MICS el 28,9% tiene desnutrición leve (n=37), el 15,6% desnutrición moderada (n=20), y el 9,4% desnutrición severa (n=12).
Al realizar la búsqueda intencionada de síndrome de T3L baja (<4,26pmol/l), se diagnosticó en 15 pacientes (11,7%), de los cuales 11 están en el grupo de MICS y 4 en el grupo no MICS, sin diferencia estadística.
Al comparar los 15 pacientes con T3 baja contra los 113 pacientes con T3 normal se encontraron diferencias en edad (55,6±16,3 vs. 43,6±16,6, p=0,01), PCR (41,9±23 vs. 14,5±10,9, p=0,0001), ferritina (246,5±454,24 [rango 8-1610] vs. 104,6±189,2 [rango 8-1400], p=0,04) y albúmina (3,49±0,36 vs. 3,95±0,39, p=0,002).
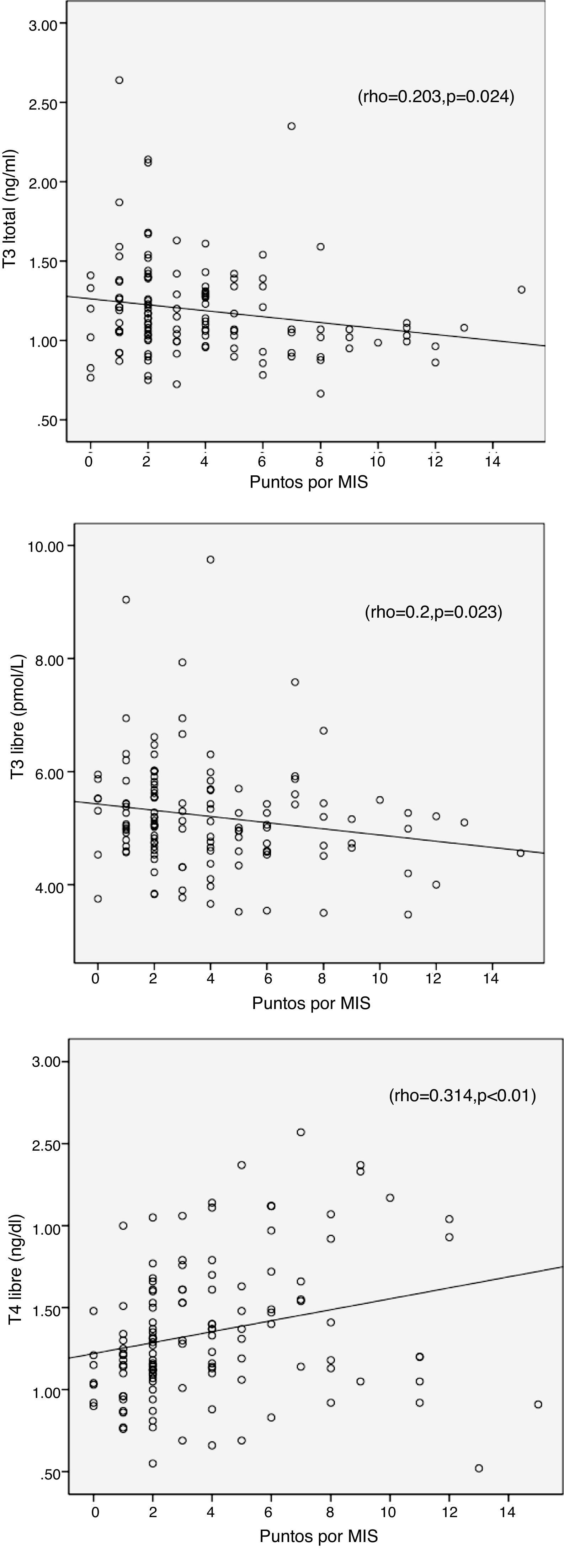
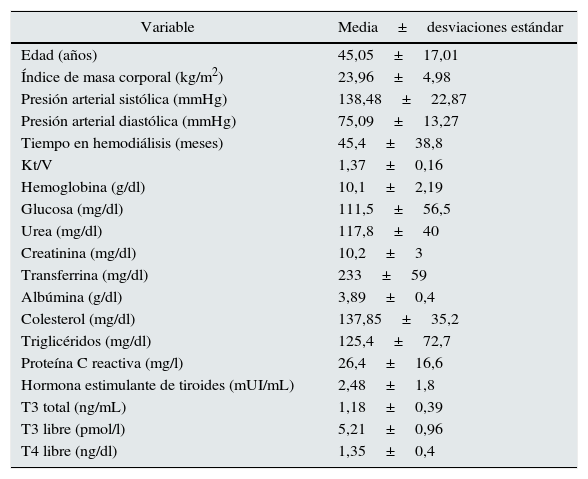
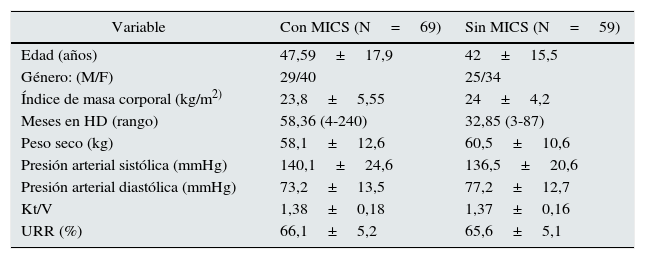
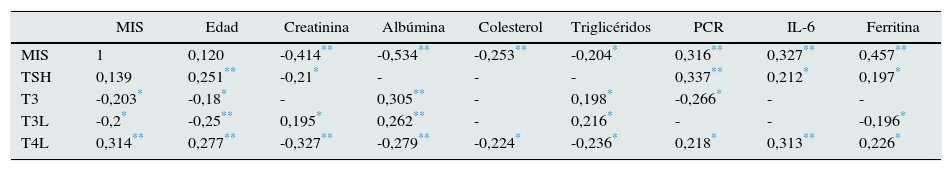
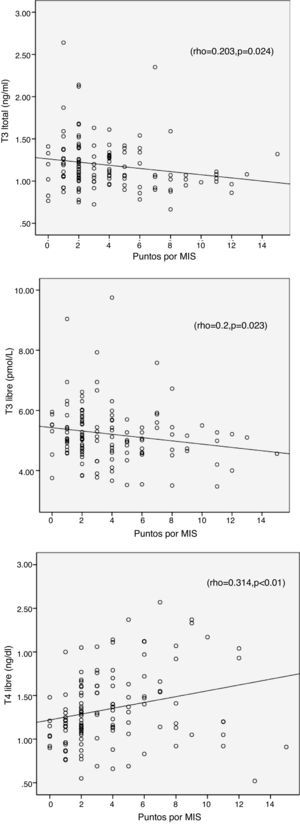
La encuesta MIS no mostró correlación con TSH (r=0,139, p=0,117), pero se asoció positivamente con T4L y negativamente con T3 Y T3L, lo cual se muestra en la tabla 4 y en la figura 1.
Correlación de perfil tiroideo con variables demográficas y bioquímicas
| MIS | Edad | Creatinina | Albúmina | Colesterol | Triglicéridos | PCR | IL-6 | Ferritina | |
|---|---|---|---|---|---|---|---|---|---|
| MIS | 1 | 0,120 | -0,414** | -0,534** | -0,253** | -0,204* | 0,316** | 0,327** | 0,457** |
| TSH | 0,139 | 0,251** | -0,21* | - | - | - | 0,337** | 0,212* | 0,197* |
| T3 | -0,203* | -0,18* | - | 0,305** | - | 0,198* | -0,266* | - | - |
| T3L | -0,2* | -0,25** | 0,195* | 0,262** | - | 0,216* | - | - | -0,196* |
| T4L | 0,314** | 0,277** | -0,327** | -0,279** | -0,224* | -0,236* | 0,218* | 0,313** | 0,226* |
TSH: hormona estimulante de la tiroides; T3: triyodotironina total; T3L: triyodotironina libre; T4L: tiroxina libre.
La edad se correlacionó positivamente con TSH y T4L e inversamente con la T3 y T3L.
Adicionalmente se encontró correlación positiva entre MIS con IL-6, PCR y ferritina, y asociación negativa con albúmina colesterol, triglicéridos y transferrina (r=-0,417, p<0,001) (tabla 4).
Por otro lado se encontró una correlación significativa entre T3 baja con albúmina (-0,317 p=0,004), triglicéridos (0,216 p=0,003), edad (-0,256 p=0,004), PCR (-0,226 p=0,04) y ferritina (-0,153 p=0,054).
En el análisis de regresión univariado se encontró significación estadística entre TSH con la edad (β= 0,388, p=0,005); T3 con albúmina (β= 0,47, p=0,004) y T4L con IL-6 (β=0,466, p=0,002).
La T3L no mostró significación estadística con ningún parámetro analizado, sin embargo al analizar los pacientes con síndrome de T3L baja (<4,26pmol/l) se encontró significación con IL-6 (β=0,265 p=0,031), PCR (β= -0,313, p=0,018), y albúmina (β=0,276, p=0,002).
DiscusiónSon pocos los estudios que asocian la encuesta MIS con las alteraciones tiroideas en pacientes estables en HD crónica, en este estudio la frecuencia de MICS fue de 53,9%, lo cual está dentro de lo reportado por otros autores3,5.
Es importante destacar que en nuestro estudio los pacientes con MICS presentaron mayores concentraciones séricas TSH y T4L con menores concentraciones séricas de T3, creatinina, albúmina, colesterol y triglicéridos. Además de asociación positiva de MICS con concentraciones séricas T4L y asociación negativa con concentraciones séricas T3 y T3L.
Además no encontramos asociación de la TSH con MICS, esto podría atribuirse a que, en las enfermedades críticas en su fase aguda puede estar normal y en fase crónica puede no mostrar cambios o mostrarse disminuida e indicar recuperación23. Por otro lado encontramos una correlación positiva de TSH con edad, PCR, IL-6, ferritina y asociación negativa con creatinina, a diferencia de otros autores15.
Al comparar las concentraciones séricas de las hormonas tiroideas entre hombres y mujeres no se encontraron diferencias, ni correlación del IMC, ni hemoglobina con el perfil tiroideo y marcadores de inflamación (datos no mostrados).
El MICS se asocia negativamente con T3 y T3L, debido a que la T3 es la forma biológica activa de las hormonas tiroideas y sus concentraciones séricas en enfermedades críticas ya sea en fase aguda o crónica reflejan un mecanismo de adaptación ante la severidad de la enfermedad24.
La correlación T3L con MIS resultó significativa en este estudio, siendo menor a lo reportado por Yavuz et al. (r=-0,671, p<0,001)24. Mientras que se encontraron resultados similares respecto a la asociación de T3L con edad y albúmina; sin embargo en nuestro estudio no encontramos asociación entre T3L con PCR e IL-6 contrario a lo reportado por otros autores14,15, pero sí con albúmina aunque con una rho menor.
Por otro lado a diferencia de lo reportado por Fernández Reyes et al.8, no encontramos asociación de T3L con transferrina, pero sí encontramos asociación de la T3L baja con PCR, esto puede ser influenciado entre el estudio actual y el referenciado por la diferencias de edad (45,05±17,01 frente 71±11,7 años) y el IMC (23,96±4,98 vs. 26,3±4,8 kg/m2) y también puede explicar parcialmente las diferencias encontradas en la prevalencia de T3L baja.
Además encontramos relación inversa en T3L baja con albúmina, PCR, ferritina y edad, siendo similar a lo reportado por otros autores14,19. Esta alteración frecuente en sepsis, cáncer, enfermedades crónicas, síndrome de inmunodeficiencia humana, infarto del miocardio e inanición25, y recientemente fue propuesta como un marcador de inflamación en pacientes en HD24.
Se reconoce que a pesar de una baja en las concentraciones de T4 en la fase crónica de las enfermedades críticas, la concentración de T4L puede permanecer en el rango normal, a menos que la enfermedad sea severa y prolongada, donde se esperaría una disminución de TSH, así como de T4 y T4L, lo cual es predictor de mal pronóstico23. A diferencia de lo encontrado en nuestro estudio donde existen niveles más altos de T4L en pacientes con diagnóstico de MICS.
La literatura reporta que ciertos fármacos compiten con la unión a globulina (salicilatos, fenitoina, carbamazepina, furosemida, heparina) y esto eleva las concentraciones T4L disminuyendo la de T423, en nuestros pacientes 20 de ellos utilizaban furosemida (9 de ellos en el grupo de MICS) y un paciente utilizaba carbamazepina; al eliminar a estos pacientes, la asociación positiva persiste (rho=0,271 y p=0,005). Si bien la mayoría de los pacientes utilizaban heparina durante las sesiones de hemodiálisis, este factor no influyó en nuestros resultados dado que las muestras sanguíneas fueron tomadas antes de la HD y 48 h después desde la última sesión.
Otros autores comentan que los niveles de ácidos grasos libres insaturados están involucrados en el incremento en la concentración sérica de T4L en la enfermedad no tiroidea en ERC, especialmente cuando las concentraciones de albúmina son bajas,26 esto es por competencia en los sitios de unión a proteínas; siendo frecuente en enfermedades sistémicas graves y desnutrición; sin bien en nuestros pacientes no se midieron los ácidos grasos insaturados que pudieran explicar los niveles de T4L, la concentración media de albúmina en el grupo MICS fue de 3,7g/dl, siendo aceptable este resultado.
La T4L fue mayor en el grupo MICS y además correlacionó positivamente con inflamación, contrario a lo reportado por Carrero et al.15, surgiendo la hipótesis de que T4L elevada pueda ser un reflejo del estado nutricional e inflamación, lo cual fue evidente con las asociaciones de T4L con otros reactantes de fase aguda (PCR, IL-6, ferritina y albúmina). En este estudio lo esperado era que T4L estuviera normal o baja, como ocurre en pacientes con enfermedad no tiroidea en ERC27, siendo esta elevación asociada a un mal pronóstico,23 probablemente por incremento en el catabolismo.
Por otro lado encontramos un 11,7% de pacientes con T3 baja, lo cual contrasta con el 53,1% reportado por Fernández-Reyes et al.8, haciendo énfasis en que en nuestro estudio, esta alteración fue más frecuente en pacientes con MICS, esto se ha asociado a causas con: ayuno, acidosis metabólica crónica, la desnutrición proteica crónica que afectan la desyodación de yodotironina, así como las proteínas de unión de T3, reduciendo la conversión periférica de T4 a T3 y su unión a proteínas, siendo esta T3 baja junto con inflamación asociada a un alto riesgo de mortalidad11,19,20,27.
Algunos autores afirman que las citoquinas inflamatorias tales como factor de necrosis tumoral alfa, interleucina 1 (IL-1) y la IL-6 inhiben la expresión de la enzima tipo 5 ‘-desyodasa, que es responsable de la conversión periférica de T4 a T3, y esto favorece la T3 baja11,27–29, sin embargo en nuestro estudio solo la PCR mostró diferencia entre la presencia o no de síndrome de T3 baja (p=0,044), no así IL-6 (p=0,758) como se esperaba.
El grupo con MICS muestra concentraciones más bajo de hemoglobina (Hb) lo cual puede atribuirse a la inflamación que se relaciona con la elevación de PCR, IL-6, ferritina, y con la utilización de mayor dosis de eritropoyetina así como con el índice de resistencia a eritropoyetina, lo cual fue similar a lo reportado por otros autores30,31, además se encontró asociación negativa de Hb con IL-6 (r=-0,285, p=0,001) y PCR (rho=-0,314, p=0,005).
Finalmente reconocemos algunas limitaciones en este estudio ya que al ser transversal no podemos establecer una causalidad ni secuencia de eventos, así como por otro lado no pudimos determinar iodo, selenio y ácidos grasos libres; sin embargo consideramos que los resultados permiten obtener conclusiones válidas.
Las aportaciones de este estudio van encaminadas al médico clínico ante la necesidad de realizar tamizaje y determinación del estado nutricional-inflamación y de las hormonas tiroideas en pacientes con nefropatía, ya que están íntimamente relacionadas y contribuyen al incremento en la morbimortalidad.
ConclusionesLas alteraciones tiroideas y el síndrome MICS son frecuentes en diálisis, aproximadamente una octava parte de estos pacientes mostraron síndrome de T3L baja lo cual se correlacionó con inflamación y desnutrición. Los pacientes con MICS presentaron concentraciones séricas elevadas T4L y concentraciones séricas disminuidas de T3 y T3L; lo cual podría impactar en la sobrevida, por lo que estas alteraciones deben buscarse intencionadamente en pacientes en hemodiálisis.
Será necesario realizar nuevos estudios prospectivos para evaluar la sobrevida en aquellos pacientes que presenten esta asociación entre MICS con las alteraciones tiroideas para buscar opciones terapéuticas y determinar la importancia de medir las hormonas tiroideas como marcadores nutricionales y de pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el financiamiento otorgado por el Fondo de Investigación en Salud del IMSS (FIS) número FIS/IMSS/PROT/MD16/1559.