La hipertensión arterial (HTA) resistente en un problema frecuente en pacientes con enfermedad renal crónica (ERC). El descenso del filtrado glomerular (FGe) y el incremento en la albuminuria se asocian a HTA resistente, sin embargo, hay pocos estudios publicados sobre la prevalencia de esta entidad en los pacientes con ERC.
ObjetivoEstimar la prevalencia de la HTA resistente en pacientes con diferentes grados de enfermedad renal y analizar sus características.
MétodosSe incluyó a 618 pacientes con HTA y ERC estadios i-iv, de los cuales 82 (13,3%) cumplían criterios de HTA resistente.
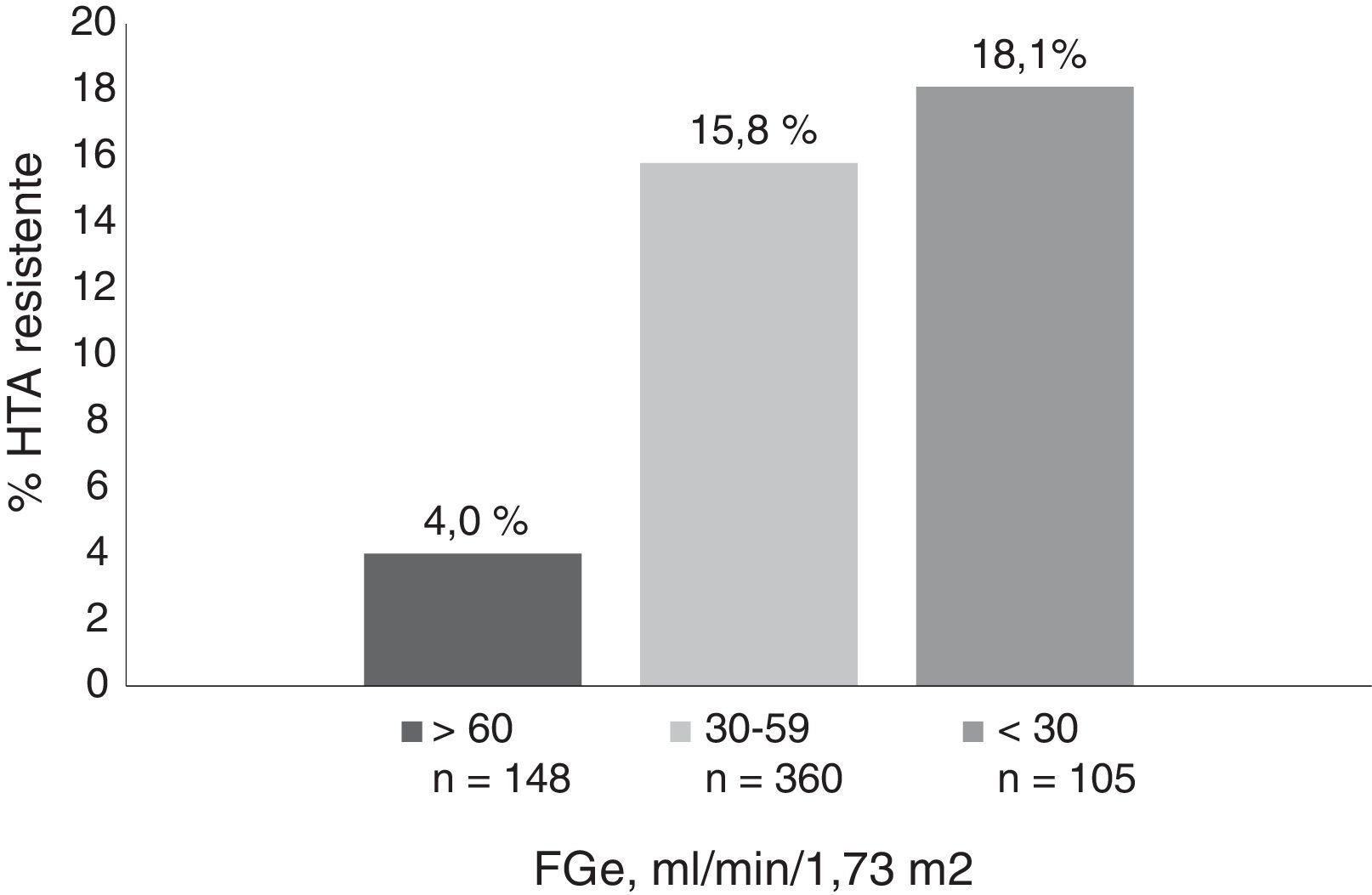
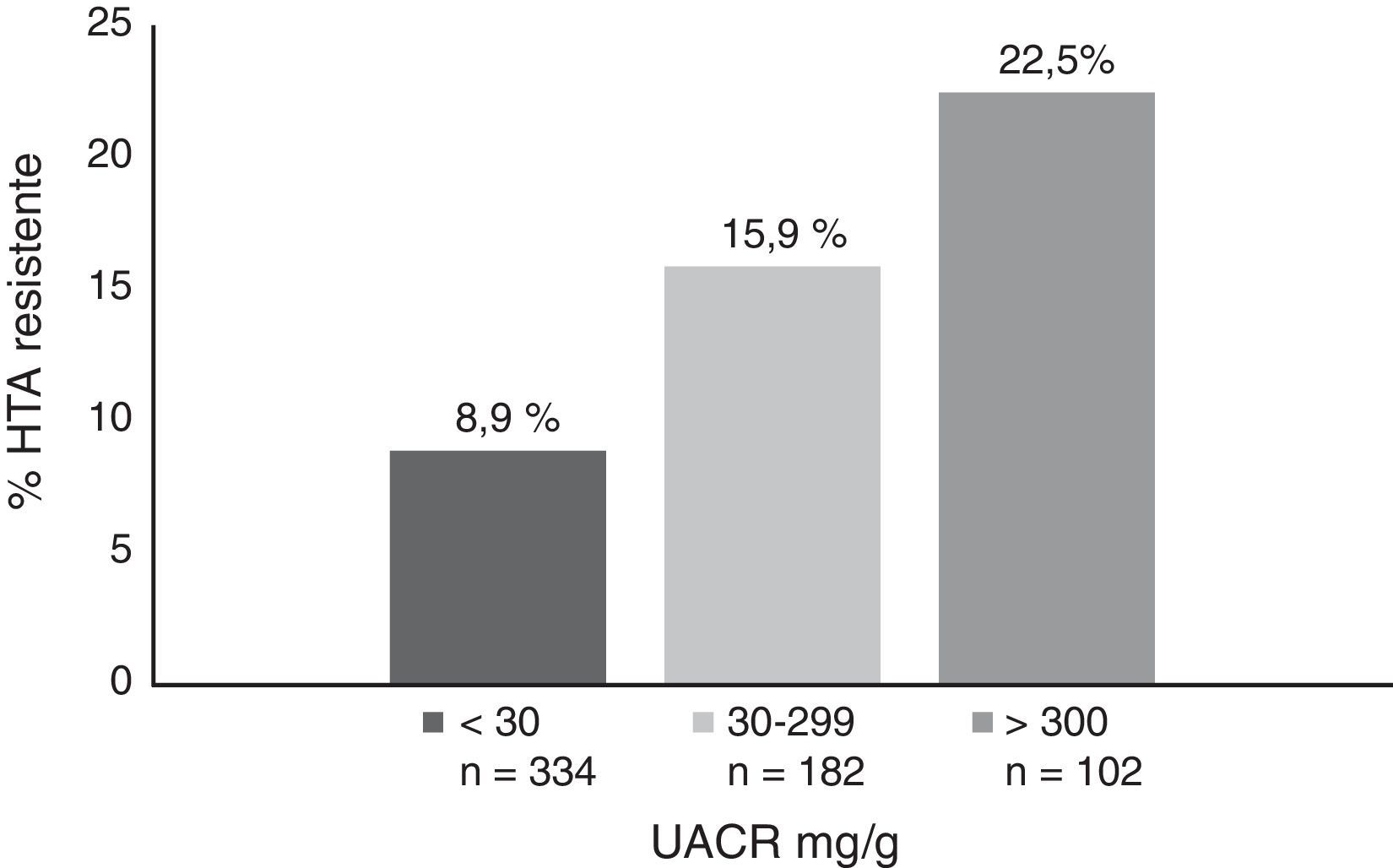
ResultadosLa prevalencia de HTA resistente se incrementó de forma significativa con la edad, el grado de ERC y la albuminuria. La prevalencia de HTA resistente fue del 3,2% en pacientes menores de 50 años, del 13,8% entre 50 y 79 años, y alcanzó el 17,8% en mayores de 80 años. En relación con la función renal, la prevalencia fue del 4, del 15,8 y del 18,1%, en pacientes con filtrado glomerular estimado (FGe) de>60, de 30-59 y de <30ml/min/1,73 m2, respectivamente y de 8,9, 15,9 y 22,5% para índice albúmina/creatinina urinario (UACR)<30, 30-299 y>300mg/g, respectivamente. En un modelo de regresión logística las características que se asociaron con la HTA resistente fueron la edad, el antecedente de enfermedad cardiovascular, el FGe, la albuminuria y la diabetes mellitus. El 47,5% de los pacientes con HTA resistente tenían la PA controlada (<140/90mmHg) con 4 o más fármacos antihipertensivos. Estos pacientes eran más jóvenes, con mejor función renal, menos albuminuria y recibían con más frecuencia antagonistas de la aldosterona.
ConclusiónLa prevalencia de HTA resistente aumenta con la edad, el grado de ERC y la albuminuria. Estrategias como el tratamiento con antagonistas de receptores de aldosterona se asocian con un mejor control tensional en este grupo de pacientes y disminuyen su prevalencia.
Resistant hypertension (RH) is a common problem in patients with chronic kidney disease (CKD). A decline in the glomerular filtration rate (GFR) and increased albuminuria are associated with RH; however, there are few published studies about the prevalence of this entity in patients with CKD.
ObjectiveTo estimate the prevalence of RH in patients with different degrees of kidney disease and analyse the characteristics of this group of patients.
MethodsA total of 618 patients with hypertension and CKD stages i-iv were enrolled, of which 82 (13.3%) met the criteria for RH.
ResultsRH prevalence increased significantly with age, the degree of CKD and albuminuria. The prevalence of RH was 3.2% in patients under 50 years, 13.8% between 50-79 years and peaked at 17.8% in patients older than 80 years. Renal function prevalence was 4, 15.8 and 18.1% in patients with an estimated glomerular filtration rate (GFR) of > 60, 30-59 and < 30ml/min/1.73 m2, respectively, and 8.9, 15.9 and 22.5% for a urine albumin to creatinine ratio (UACR) < 30, 30-299 and > 300mg/g respectively. In a logistic regression model, the characteristics associated with resistant hypertension were age, history of cardiovascular disease, GFR, albuminuria and diabetes mellitus. A total of 47.5% of patients with resistant hypertension had controlled BP (<140/90mmHg) with 4 or more antihypertensive drugs. These patients were younger, with better renal function, less albuminuria and received more aldosterone antagonists.
ConclusionRH prevalence increases with age, the degree of CKD and albuminuria. Strategies such as treatment with aldosterone receptor antagonists are associated with better blood pressure control in this group of patients, leading to reduced prevalence.
La hipertensión arterial (HTA) resistente definida como la falta de control de la presión arterial (PA)>140/90mmHg a pesar del tratamiento con 3 o más fármacos antihipertensivos, incluido un diurético, o PA controlada pero usando 4 o más fármacos1, es un problema frecuente en pacientes con enfermedad renal crónica (ERC). Los estudios realizados en población general estiman la prevalencia de la HTA refractaria en un amplio intervalo entre el 10 y el 30% del total de los pacientes con HTA. El registro (2005-2008) de National Health and Nutrition Examination Survey (NHANES) estima que la HTA resistente afecta al 12,3% de los pacientes con HTA2 y según el estudio Registro español de monitorización ambulatoria de la presión arterial, la prevalencia es del 12,2%3. Los estudios poblacionales como el Framingham Heart4 o el NHANES han identificado la raza, la edad, la diabetes mellitus, la enfermedad cardiovascular y la ERC como factores asociados a la refractariedad en el control de la PA.
En el estudio de Tanner et al. realizado con los datos de los pacientes incluidos en el Reasons for Geographic and Racial Differences in Stroke (REGARDS), el filtrado glomerular estimado (FGe)<60ml/min/1,73 m2 y el índice albúmina/creatinina (UACR)>300mg/g se asociaron de forma muy significativa con la presencia de HTA resistente5. A pesar de que tanto la ERC como la proteinuria se han asociado con la HTA refractaria, hay pocos trabajos realizados en este grupo de pacientes y no hay ningún estudio de prevalencia de HTA resistente en pacientes con ERC en población española.
El objetivo de nuestro estudio fue estimar la prevalencia de la HTA resistente en una cohorte de pacientes seguidos en consultas externas de Nefrología con diferentes grados de ERC, analizar las características de estos pacientes con ERC e HTA resistente, así como estudiar los factores asociados a la refractariedad y mejor control de la PA en este grupo poblacional.
Pacientes y métodosDiseño del estudioEstudio de cohortes observacional retrospectivo, en el que se incluyó a 618 pacientes estables y consecutivos con HTA y ERC estadios i-iv seguidos en la consultas externas de Nefrología desde el 1 de enero de 2012 hasta el 31 de diciembre de 2012.
Los criterios de inclusión fueron: edad ≥ 18 años, ERC estadios i-iv e HTA. Los criterios de exclusión fueron el ingreso hospitalario los 4 meses previos a la inclusión o rechazar la participación en el estudio.
La ERC se definió según las guías KDOQI6 y la HTA según el Eighth Report of the Joint National Committee7 como PA>140/90mmHg en este grupo de pacientes con ERC o recibir tratamiento con fármacos antihipertensivos. Se definió HTA controlada cuando los pacientes mantenían cifras de PA<140/90mmHg en consulta.
Se seleccionó a los pacientes, que cumplían criterios de HTA resistente según la guía de la American Heart Association de 2008, con PA > 140/90mmHg, a pesar del uso conjunto de 3 fármacos antihipertensivos de diferentes clases terapéuticas a dosis máximas, incluido un diurético, o a pacientes en tratamiento con 4 o más fármacos antihipertensivos, con independencia de las cifras de PA arterial.
En la consulta de Nefrología se revisó toda la medicación con el paciente, repasando las dosis y el horario de las tomas con el fin de mejorar el cumplimiento terapéutico.
Los antialdosterónicos se utilizan en pacientes con FGe estable y que presentan niveles de potasio <4,5 meq/l.
Variables estudiadasSe recogieron datos demográficos y de la historia clínica de los pacientes como la edad, sexo, hábito tabáquico, PA en consulta, diabetes mellitus y antecedentes de enfermedad cardiovascular (insuficiencia cardiaca, cardiopatía isquémica, enfermedad vascular periférica y enfermedad cerebrovascular). La insuficiencia cardiaca se diagnosticó mediante radiografía de tórax (presencia de edema pulmonar) y ecocardiograma (disfunción del ventrículo izquierdo). Se consideró que los pacientes presentaban insuficiencia cardiaca cuando tenían síntomas o clase funcional ii a iv en la clasificación de la New York Association con fracción de eyección<45%. Se definió enfermedad cerebrovascular por historia de accidente cerebrovascular isquémico o hemorrágico, accidente isquémico transitorio o estenosis carotídea>70% (medida por ecodoppler). El diagnóstico de enfermedad vascular periférica se hizo en los pacientes con claudicación intermitente, estenosis de arterias principales de miembros inferiores en arteriografía o ecodoppler, presencia de úlceras causadas por enfermedad aterosclerótica, revascularización o amputaciones por isquemia.
La función renal se valoró mediante el FGe por la ecuación de 4-variable Modification of Diet in Renal Disease y separamos a los pacientes según el grado de enfermedad renal en 3 grupos: FGe>60, 30-59 y <30ml/min/1,73 m2. La albuminuria se midió con un método inmunonefelométrico. Utilizamos el índice albúmina/creatinina (UACR) y se dividió a los pacientes en 3 grupos: UACR 0-29, 30-299 y>300mg/g. Se recogieron parámetros nutricionales e inflamatorios a partir de muestras obtenidas en condiciones basales tras 8 h de ayuno: colesterol total, colesterol-LDL, colesterol-HDL, triglicéridos y la proteína C reactiva (PCR). Los parámetros bioquímicos se analizaron con autoanalizadores utilizando métodos estándares y la PCR plasmática se midió utilizando un inmunoanálisis turbidimétrico a base de látex en un analizador Hitachi (Sigma Chemical Co, St. Louis, Missouri, Estados Unidos).
Medimos la PA en consulta utilizando un esfigmógrafo electrónico y automático (Omron MX3, Omron Life Science, Kyoto, Japón). Se realizaron 3 medidas de PA, tras 10 min en reposo con el paciente sentado y esperando 2 min entre las distintas tomas, y se consideró como resultado final la media de la segunda y la tercera medidas.
Se recogieron los fármacos antihipertensivos y el tratamiento con estatinas.
Análisis estadísticoSe utilizaron estadísticas de tendencia central: media aritmética ± desviación estándar para las variables continuas y distribución de frecuencias para las variables discretas. Para la comparación de medias entre los distintos grupos se utilizó la prueba t de Student, para las variables independientes binarias y para la comparación de proporciones se aplicó la prueba de la chi2 de Pearson. Se realizó un modelo de regresión logística para identificar las variables asociadas de manera independiente a la HTA resistente. El análisis de regresión logística múltiple se llevó a cabo introduciendo en el modelo con el método ENTER todas las variables independientes que fueron estadísticamente significativas en el modelo univariable con un valor de p<0,05. Para el análisis estadístico de utilizó el programa SPSS para Windows versión 18 (SPSS Inc, Chicago, Illinois, Estados Unidos).
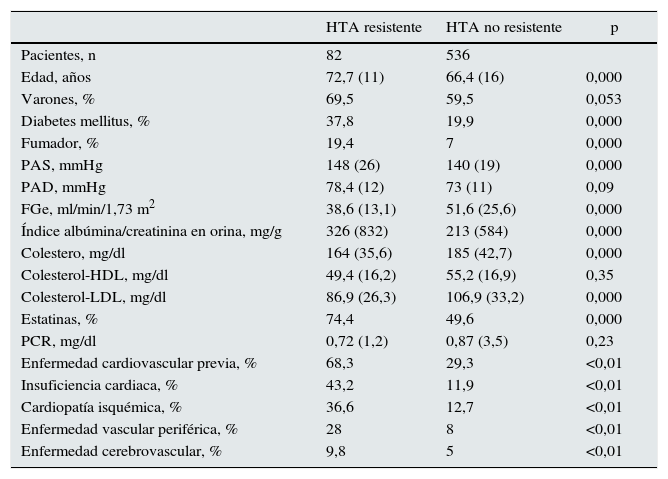
ResultadosSe incluyó a 618 pacientes con HTA y ERC estadios i-iv (24% estadios i y ii; 58,7% estadio iii y 17,3% estadio iv), de los cuales 82 pacientes (13,3%) cumplían criterios de HTA resistente. Los pacientes con HTA resistente comparados con el resto de los pacientes hipertensos eran mayores: 72,7±11 años vs. 66,4±16 años (p<0,01), con más frecuencia eran diabéticos (37,8 vs. 19,9%; p<0,01) y tenían enfermedad cardiovascular (68,3 vs. 29,3%; p<0,01). Los pacientes con HTA resistente recibían más estatinas, 74,4% frente a un 49,6% (p<0,01), y tenían LDL-colesterol menor (86,9±26,3 vs. 106,9±33,2mg/dl; p<0,01). Estos pacientes tenían una peor función renal (FGe 38,6±13,1 vs. 51,6±25,6ml/min/m2; p<0,01) y mayor albuminuria (UACR 326±832 vs. 231±584mg/g; p<0,01) (ver tabla 1). El peor control de la PA de los pacientes con HTA resistente es a expensas de un incremento de la PAS (148±26 vs. 140±19mmHg; p<0,01), ya que el 98% de estos pacientes presenta PAD controlada <90mmHg.
Características de los pacientes con y sin HTA resistente
| HTA resistente | HTA no resistente | p | |
|---|---|---|---|
| Pacientes, n | 82 | 536 | |
| Edad, años | 72,7 (11) | 66,4 (16) | 0,000 |
| Varones, % | 69,5 | 59,5 | 0,053 |
| Diabetes mellitus, % | 37,8 | 19,9 | 0,000 |
| Fumador, % | 19,4 | 7 | 0,000 |
| PAS, mmHg | 148 (26) | 140 (19) | 0,000 |
| PAD, mmHg | 78,4 (12) | 73 (11) | 0,09 |
| FGe, ml/min/1,73 m2 | 38,6 (13,1) | 51,6 (25,6) | 0,000 |
| Índice albúmina/creatinina en orina, mg/g | 326 (832) | 213 (584) | 0,000 |
| Colestero, mg/dl | 164 (35,6) | 185 (42,7) | 0,000 |
| Colesterol-HDL, mg/dl | 49,4 (16,2) | 55,2 (16,9) | 0,35 |
| Colesterol-LDL, mg/dl | 86,9 (26,3) | 106,9 (33,2) | 0,000 |
| Estatinas, % | 74,4 | 49,6 | 0,000 |
| PCR, mg/dl | 0,72 (1,2) | 0,87 (3,5) | 0,23 |
| Enfermedad cardiovascular previa, % | 68,3 | 29,3 | <0,01 |
| Insuficiencia cardiaca, % | 43,2 | 11,9 | <0,01 |
| Cardiopatía isquémica, % | 36,6 | 12,7 | <0,01 |
| Enfermedad vascular periférica, % | 28 | 8 | <0,01 |
| Enfermedad cerebrovascular, % | 9,8 | 5 | <0,01 |
FGe: filtrado glomerular estimado; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR, Proteína C reactiva.
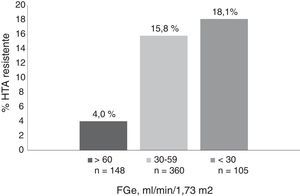
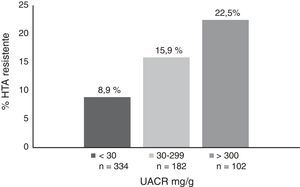
La prevalencia de HTA resistente se incrementó de forma significativa con la edad, el grado de ERC y la albuminuria. La prevalencia de HTA resistente fue del 3,2% en pacientes<50 años, del 13,8% en pacientes de entre 50 y 79 años, y alcanzó el 17,8% en pacientes>80 años. En relación con la función renal, la prevalencia fue del 4, del 15,8 y del 18,1% en pacientes con FGe de>60, de 30-59 y<30ml/min/1,73 m2, respectivamente (fig. 1) y de 8,9, 15,9 y 22,5% para UACR<30, de 30-299 y>300mg/g, respectivamente (fig. 2).
En cuanto al tratamiento antihipertensivo, los pacientes con HTA refractaria recibieron de media 4,2±0,5 fármacos/paciente frente a 1,6±0,9 fármacos/paciente en el resto (p<0,01). De los pacientes con HTA resistente, el 100% recibían tratamiento con uno o más diuréticos (el 69,5% diuréticos del ASA y el 39,1% tiazidas), el 91,4% un bloqueante del sistema renina-angiotensina-aldosterona, el 72% calcioantagonistas, el 61,2% betabloqueantes y el 18,8% antagonistas de la aldosterona. Un 29,5% de los pacientes recibía tratamiento con la asociación de 2 o más diuréticos.
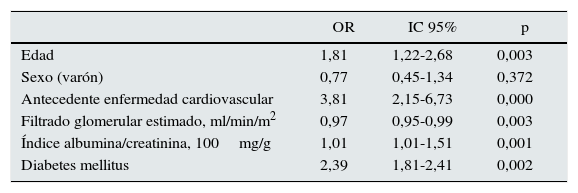
En un modelo de regresión logística, los factores que aumentaron el riesgo de HTA resistente fueron la edad (OR 1,81; IC 1,22-2,68), el antecedente de enfermedad cardiovascular (OR 3,81; IC 2,15-6,73), la albuminuria (OR 1,01; IC 1,21-1,51) y la diabetes mellitus (OR 2,39; IC 1,81-2,41). La mejor función renal redujo el riesgo de HTA resistente (OR 0,97; IC 0,95-0,99) (tabla 2).
Análisis de regresión logística múltiple con las características asociadas a la HTA resistente
| OR | IC 95% | p | |
|---|---|---|---|
| Edad | 1,81 | 1,22-2,68 | 0,003 |
| Sexo (varón) | 0,77 | 0,45-1,34 | 0,372 |
| Antecedente enfermedad cardiovascular | 3,81 | 2,15-6,73 | 0,000 |
| Filtrado glomerular estimado, ml/min/m2 | 0,97 | 0,95-0,99 | 0,003 |
| Índice albumina/creatinina, 100mg/g | 1,01 | 1,01-1,51 | 0,001 |
| Diabetes mellitus | 2,39 | 1,81-2,41 | 0,002 |
IC 95%: intervalo de confianza del 95%; OR: odds ratio.
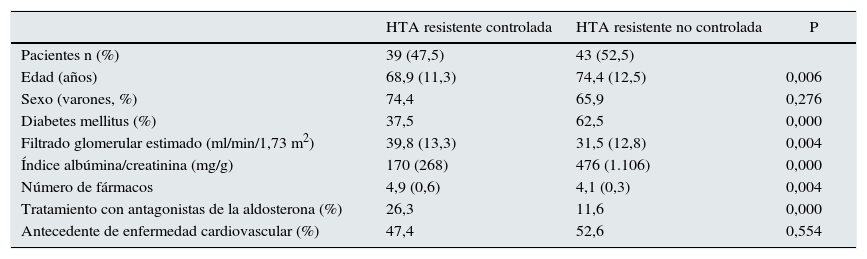
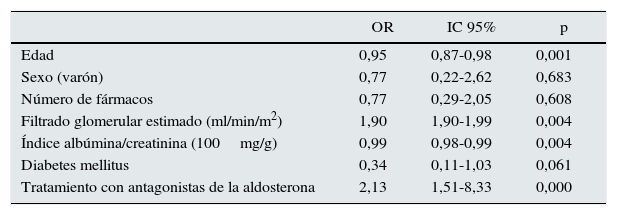
Un 47,5% de los pacientes con HTA resistente que recibían 4 o más fármacos antihipertensivos tenían la PA controlada. Comparando este grupo de pacientes con los pacientes con HTA refractaria no controlada, observamos que eran más jóvenes (68,9±11,3 vs. 74,4±12,5 años, p<0,01), había una menor proporción de diabéticos (37,5 vs. 62,5%), presentaban mejor función renal (FGe 39,8±13,3 vs. 31,5±12,8ml/min/1,73m2; p<0,01) y recibían más antagonistas de los receptores de aldosterona (26,3 vs. 11,6%; p<0,001) (tabla 3). Estos factores mantuvieron su poder predictivo en un modelo de regresión logística, menos la diabetes mellitus (tabla 4).
Características de los pacientes con HTA resistente y PA controlada <140/90mmHg y no controlada
| HTA resistente controlada | HTA resistente no controlada | P | |
|---|---|---|---|
| Pacientes n (%) | 39 (47,5) | 43 (52,5) | |
| Edad (años) | 68,9 (11,3) | 74,4 (12,5) | 0,006 |
| Sexo (varones, %) | 74,4 | 65,9 | 0,276 |
| Diabetes mellitus (%) | 37,5 | 62,5 | 0,000 |
| Filtrado glomerular estimado (ml/min/1,73 m2) | 39,8 (13,3) | 31,5 (12,8) | 0,004 |
| Índice albúmina/creatinina (mg/g) | 170 (268) | 476 (1.106) | 0,000 |
| Número de fármacos | 4,9 (0,6) | 4,1 (0,3) | 0,004 |
| Tratamiento con antagonistas de la aldosterona (%) | 26,3 | 11,6 | 0,000 |
| Antecedente de enfermedad cardiovascular (%) | 47,4 | 52,6 | 0,554 |
Variables asociadas al control de la PA<140/90mmHg en pacientes con HTA resistente
| OR | IC 95% | p | |
|---|---|---|---|
| Edad | 0,95 | 0,87-0,98 | 0,001 |
| Sexo (varón) | 0,77 | 0,22-2,62 | 0,683 |
| Número de fármacos | 0,77 | 0,29-2,05 | 0,608 |
| Filtrado glomerular estimado (ml/min/m2) | 1,90 | 1,90-1,99 | 0,004 |
| Índice albúmina/creatinina (100mg/g) | 0,99 | 0,98-0,99 | 0,004 |
| Diabetes mellitus | 0,34 | 0,11-1,03 | 0,061 |
| Tratamiento con antagonistas de la aldosterona | 2,13 | 1,51-8,33 | 0,000 |
Los niveles de potasio fueron más elevados en pacientes en tratamiento con espironolactona (4,5±0,8 vs. 4,2±0,7 mmEq/l; p=0,48), pero no de forma significativa.
DiscusiónNuestro estudio muestra que la prevalencia de la HTA resistente aumenta en los pacientes con mayor grado de ERC y proteinuria. Aun así, la prevalencia de HTA resistente de nuestros pacientes fue mucho más baja que la descrita previamente en pacientes con ERC. Estrategias como el tratamiento con antagonistas de los receptores de aldosterona mejoran el grado de control de la PA en pacientes con HTA resistente.
La prevalencia de la HTA resistente en nuestro estudio, realizado en pacientes con ERC estadios i-iv, se sitúa en un 13,3%, similar a la prevalencia estimada en estudios realizados en población hipertensa sin ERC como el estudio NHANES1 (12,3%) o el Registro español de monitorización de la presión arterial ambulatoria publicado en 20112 (9,9% en pacientes HTA y 12,9% en hipertensos con tratamiento). La prevalencia de HTA refractaria en nuestra serie podemos considerarla baja, ya que es muy similar a la descrita en población general, pero mucho más baja que la descrita en pacientes con ERC.
Como ya se había demostrado, encontramos que existe una relación directa entre el grado de ERC, la albuminuria y la prevalencia de la HTA resistente. En el estudio4 observaron esta misma relación, con un incremento significativo y progresivo en la prevalencia de HTA resistente a medida que avanza la ERC de 15,8, de 24,9 y de 33,4% para un FGe>60, de 45-69 y<45ml/min/1,73 m2, respectivamente. El incremento de albuminuria también se asoció con un aumento de la HTA refractaria, con una prevalencia de 12,1, de 20,8, de 27,7 y de 48,3% para un índice albúmina/creatinina en orina <10, de 10a 29, de 30 a 299 y>300mg/g, respectivamente. En nuestro estudio la prevalencia es mucho más baja en todos los estadios y en todos los grupos (ver figs. 1 y 2). Este hecho está en probable relación con un mejor cumplimiento terapéutico de los pacientes que acuden a una consulta especializada8 y con el desarrollo de estrategias terapéuticas que mejoran el control de la PA en pacientes con HTA resistente, como la optimización del tratamiento diurético, el descenso de consumo de sal o el tratamiento con bloqueantes de la aldosterona, como ya se señala en una revisión reciente publicada por Rossignol et al.9: son puntos claves a la hora de bajar las cifras de PA en pacientes con HTA resistente y ERC.
En un trabajo previo realizado por nuestro grupo, demostramos que la intensificación del tratamiento diurético guiado con bioimpedancia mejoraba el control de la PA de pacientes con HTA resistente y ERC10. Además, el 18,8% de nuestros pacientes recibían tratamiento con espironolactona, cifra muy superior al 3% de los pacientes incluidos en el registro americano NHANES1 o al 9% del registro español de pacientes hipertensos en atención primaria11. El tratamiento con antagonistas de la aldosterona es el fármaco de elección para control de PA y proteinuria en pacientes con HTA refractaria, hecho que se ha demostrado en varios estudios12,13. Así, en estudios más recientes como el Symplicity III14, realizado en pacientes altamente seleccionados con HTA refractaria, para valorar la eficacia de la denervación simpática renal, la cuarta parte de los pacientes incluidos recibía dicho tratamiento. En pacientes con ERC es necesario monitorizar estrechamente los niveles de potasio en los que toman espironolactona, pero se ha demostrado que este tratamiento reduce de forma significativa la TA y la proteinuria15,16. En nuestros pacientes los niveles de potasio fueron más elevados en los que estaban en tratamiento con espironolactona (4,5±0,8 vs. 4,2±0,7 mmEq/l; p=0,48), pero está diferencia no era significativa, y no hubo ningún caso de hiperpotasemia tóxica. Probablemente el consejo dietético reiterado y el uso de resinas de intercambio iónico, así como un seguimiento muy estrecho, haya condicionado que no haya diferencias en las cifras de potasio.
Otros factores que se asocian con mayor prevalencia de HTA resistente fueron la edad, diabetes mellitus, tratamiento con estatinas y mayor riesgo cardiovascular. La edad más avanzada se asoció con un peor control de la PA, sobre todo a expensas de un peor control de las cifras de PAS. La asociación entre edad y peor control de PAS es ampliamente conocida17. La PA aumenta de forma progresiva con la edad, debido a un incremento de la rigidez arterial, la disfunción de los barorreceptores, la disfunción endotelial y el estrés oxidativo. En estudios como el ALLHAT18, la DM también se asoció a un peor control de la PA. El síndrome metabólico se ha puesto en relación en diversos estudios con la presencia de HTA refractaria, asociado en muchas ocasiones a una elevación en los niveles de aldosterona19. En nuestro trabajo los pacientes con HTA resistente recibían más tratamiento con estatinas, un 74,4% frente al 49,6% de los pacientes con HTA y, por lo tanto, tenían niveles más bajos de colesterol-LDL. Probablemente este hecho se deba a que son pacientes con mayor riesgo cardiovascular y con indicaciones de tratamiento con estatinas independientemente de los niveles de colesterol-LDL. El 69% de los pacientes con criterios de HTA resistente habían tenido al menos un evento cardiovascular previo (enfermedad coronaria, episodios de insuficiencia cardiaca, enfermedad cerebrovascular y enfermedad vascular periférica).
La definición de HTA resistente de las guías de la Sociedad Americana del Corazón publicadas en 2008 incluyen a los pacientes con PA controlada <140/90mmHg que están en tratamiento con 4 o más fármacos antihipertensivos. En nuestro estudio aproximadamente la mitad de los pacientes con HTA resistente presentaban un adecuado control de las cifras de PA, cifra muy superior al 19,2% del registro realizado en atención primaria en 6.292 pacientes hipertensos, o en el subestudio del Registro NHANES, en el que solo el 27% de los pacientes con ERC tenía una PA controlada <140/90mmHg20. Este hecho se puede deber, de nuevo, al mejor cumplimiento terapéutico y al mayor uso de antagonistas de los receptores de aldosterona en una consulta especializada. La falta de cumplimiento terapéutico, la sobrecarga de volumen y la activación del sistema renina-angiotensina-aldosterona21 son las causas fundamentales de HTA resistente en pacientes con ERC. En algunos estudios ya se ha mostrado que el tratamiento con espironolactona disminuye la PA independientemente de los niveles de aldosterona y de la actividad de renina plasmática22. Además, el control de la PA se asoció con una menor edad, una mejor función renal y una albuminuria menor.
El estudio no carece de limitaciones. En primer lugar, es un estudio transversal, observacional y prospectivo con el sesgo que esto conlleva, ya que los datos se refieren a una sola toma de PA en la consulta y a una única determinación analítica, aunque se excluyó a los pacientes inestables con un ingreso o evento cardiovascular en los 4 meses anteriores. En segundo lugar, no realizamos un registro de monitorización ambulatoria de PA ni en el domicilio del paciente con AMPA ni con una MAPA en la consulta, por lo que la prevalencia de HTA resistente puede estar sobrevalorada, teniendo en cuenta variables importantes como la HTA de bata blanca o el mal cumplimiento terapéutico de algunos enfermos. Otra limitación del estudio es el pequeño tamaño muestral y que se haya obtenido de un solo centro hospitalario, lo que supone un sesgo en la selección de pacientes.
A pesar de que la resistencia al tratamiento antihipertensivo se ha asociado estrechamente con el descenso del filtrado glomerular, hay pocos estudios sobre la prevalencia y epidemiología de la HTA refractaria en pacientes con ERC. En estos pacientes la HTA es a la vez causa y consecuencia de la ERC23.
Presentamos el primer estudio de prevalencia de HTA resistente en población con ERC realizado en España, donde se confirma la asociación entre HTA refractaria, proteinuria y grado de ERC. Los pacientes con HTA resistente son más mayores, tiene una elevada comorbilidad cardiovascular y más lesión de órgano diana, por lo que es muy importante un adecuado diagnóstico precoz y tratamiento. La atención en una consulta especializada y el desarrollo de estrategias terapéuticas como el tratamiento cuidadoso con espironolactona se asocian a una menor prevalencia de HTA refractaria y a un mejor control de la PA. El uso de bloqueantes de la aldosterona se debe valorar en pacientes con HTA resistente no controlada, con ERC moderada, siempre con dosis bajas y monitorizando los niveles de potasio. Este estudio abre opciones a realizar nuevos estudios en pacientes con ERC e HTA resistente, con un mejor diseño (prospectivos, multicéntricos y que incluyan un mayor número de pacientes).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.