La enfermedad poliquística renal es un trastorno tanto clínico como genéticamente heterogéneo. La variante autosómica recesiva (ARPKD, autosomal-recessive polycystic kidney disease) es menos frecuente que la variante autosómica dominante (ADPKD). Su tasa de incidencia es de aproximadamente 1 por cada 20.000 nacimientos. El gen causal se denomina PKHD1 (polycystic kidney and hepatic disease 1). Codifica la proteína fibrocistina que juega un papel clave en la diferenciación de los túbulos renales y las vías biliares.
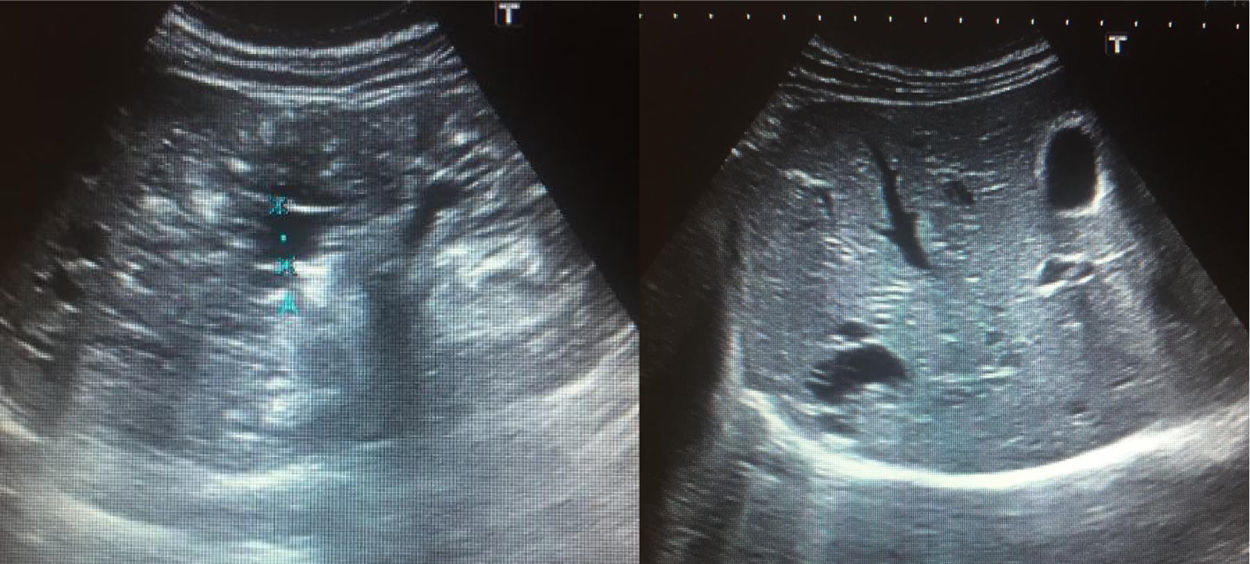
Hemos tenido la oportunidad de estudiar una familia con ARPKD con características poco habituales. El probando tiene 15 años en la actualidad; desde los dos meses de edad fue diagnosticado de enfermedad renal crónica y quistes hepáticos. Se observó un defecto en la capacidad de concentración desde los cuatro años de edad. El FGR actual es de 56,2 mL/min/1,73 m2. Tiene hipertensión arterial secundaria y afectación hepática con quistes en el segmento 6 (fig. 1). Su hermana de 12 años está asintomática y la ecografía renal y hepática es normal; la función renal está conservada (FGR 113 mL/min/1,73 m2). Ambos hermanos son portadores de dos mutaciones en heterocigosis compuesta en el gen PKHD1, p.Arg1624Trp y p.Ile2957Thr. La madre es portadora de la mutación p.Ile2957Thr y, el padre, de p.Arg1624Trp.
Como antecedentes heredofamiliares, en la rama paterna, el abuelo fue diagnosticado de quistes renales sin aparente alteración en el filtrado glomerular, la abuela finada por aneurisma cerebral sin más estudios a comentar y un tío abuelo con una enfermedad quística renal. En la rama materna sólo se mencionan dos tías con infecciones de orina de repetición, una de ellas con hipercalciuria. Se niega consanguinidad.
En los estudios realizados en el gen PKHD1 en pacientes con ARPKD, se ha observado que la mutación p.Arg1624Trp es una de las cuatro más frecuentemente halladas. Los pacientes portadores de la misma tienen manifestaciones clínicas desde el periodo neonatal1,2 y muestran enfermedad renal crónica, hipodisplasia renal y afectación hepática3.
La segunda mutación p.Ile2957Thr, se ha descrito en familias consanguíneas. Asimismo, también se ha catalogado como patológica a edades tempranas en razas caucásicas4,5.
Existen estudios genómicos en los que se han comunicado variantes génicas en las que los pacientes se encuentran asintomáticos6. Sin embargo, consisten en cambios exónicos silentes que no alteran la secuencia de aminoácidos. Ninguna de esas variantes se corresponde con las halladas en la familia que hemos estudiado.
Explicar la variabilidad fenotípica en ambos hermanos es complejo. El probando no debutó en el periodo prenatal o postnatal inmediato, como está descrito en la mayoría de los casos de ARPKD. En la actualidad está ubicado en el estadio G3 KDIGO, a una edad en la que la mayoría de los pacientes que han sobrevivido precisan tratamiento sustitutivo de la función renal7. Obviamente, podrían aparecer signos de la enfermedad de forma tardía en su hermana por lo que debe seguir siendo controlada. Cabe la posibilidad de que en esta familia está activo un proceso de metilación del ADN como está descrito en la variante autosómica dominante8.