El paricalcitol, un activador selectivo del receptor de la vitamina D, se utiliza en el tratamiento del hiperparatiroidismo secundario en el receptor de trasplante renal. Estudios tanto clínicos como experimentales realizados en pacientes renales no trasplantados muestran propiedades antiinflamatorias para esta molécula. En este estudio exploratorio, hemos evaluado el perfil antiinflamatorio del paricalcitol en receptores de trasplante renal.
MétodosTreinta y un pacientes trasplantados con hiperparatiroidismo secundario completaron 3 meses de terapia con paricalcitol oral (1μg/día). Se determinaron las concentraciones séricas y los niveles de expresión génica de citocinas inflamatorias en células mononucleares de sangre periférica al inicio y al final del estudio.
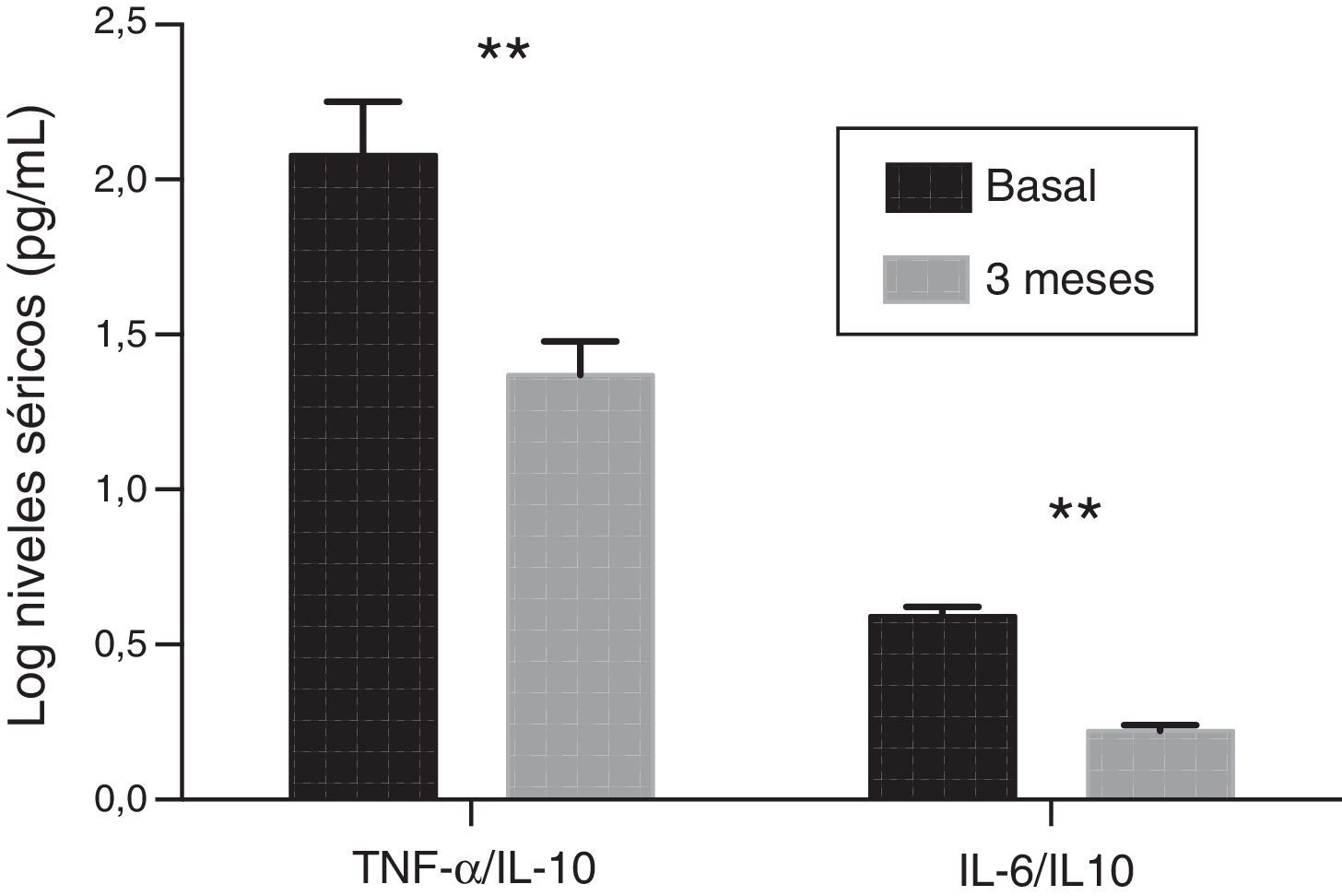
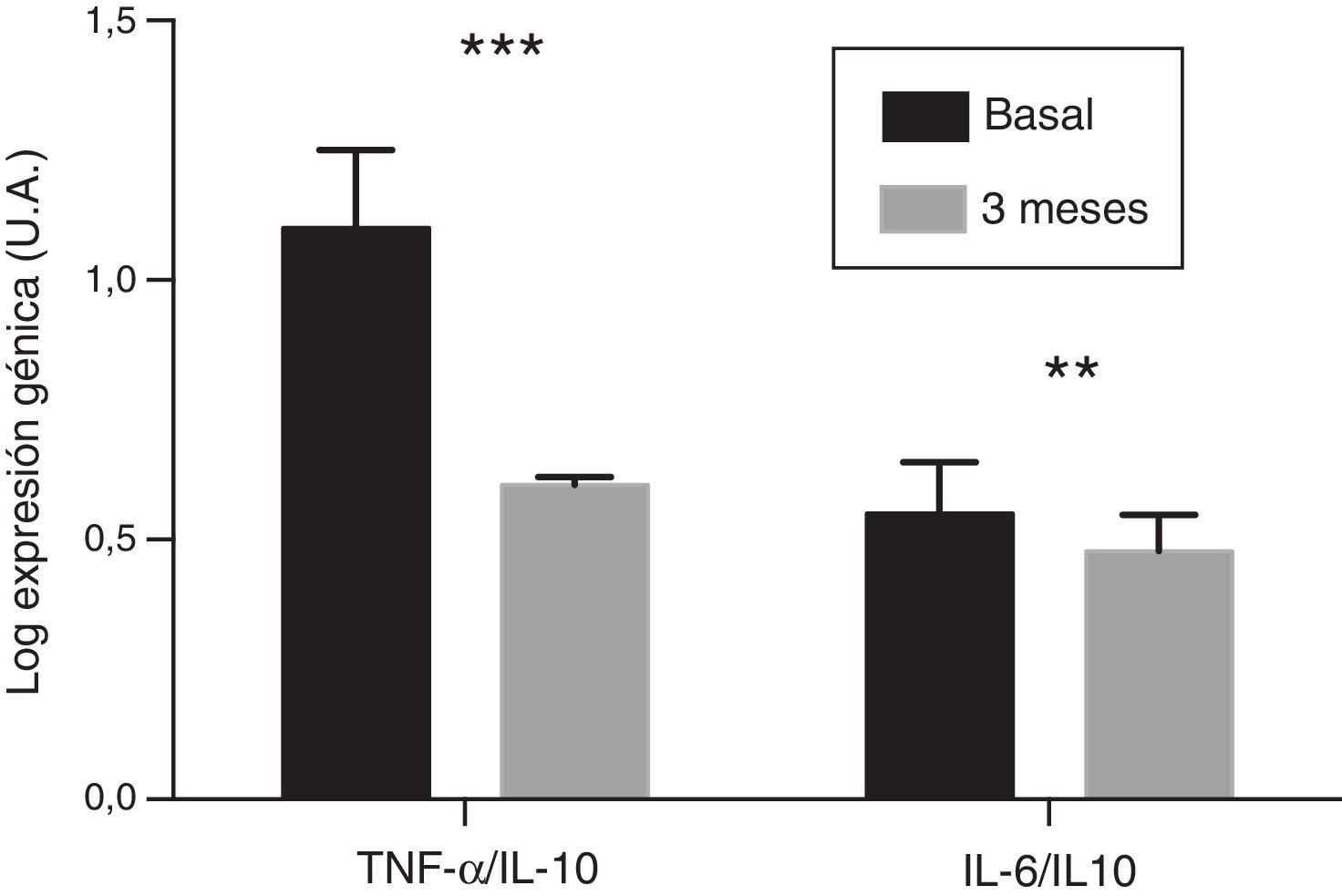
ResultadosEl paricalcitol provocó una disminución significativa en los niveles de hormona paratiroidea, sin cambios en los de calcio y fósforo. Además, indujo una reducción en las concentraciones séricas de la interleucina (IL)-6 y del factor de necrosis tumoral alfa (TNF-α), con reducciones porcentuales respecto al estado basal de un 29% (p<0,05) y de un 9,5% (p<0,05), respectivamente. Los niveles de expresión génica de la IL-6 y del TNF-α en células mononucleares de sangre periférica experimentaron un descenso de un 14,1% (p<0,001) y de un 34,1% (p<0,001), respectivamente. La proporción entre las citocinas proinflamatorias (TNF-α e IL-6) y la antiinflamatoria IL-10, tanto para los niveles séricos como para los de expresión génica, también disminuyó significativamente.
ConclusionesLa administración del paricalcitol a receptores de trasplante renal se asocia con efectos beneficiosos sobre su estado inflamatorio, lo que podría asociarse a un potencial beneficio clínico.
Paricalcitol, a selective vitamin D receptor activator, is used to treat secondary hyperparathyroidism in kidney transplant patients. Experimental and clinical studies in non-transplant kidney disease patients have found this molecule to have anti-inflammatory properties. In this exploratory study, we evaluated the anti-inflammatory profile of paricalcitol in kidney-transplant recipients.
MethodsThirty one kidney transplant recipients with secondary hyperparathyroidism completed 3 months of treatment with oral paricalcitol (1μg/day). Serum concentrations and gene expression levels of inflammatory cytokines in peripheral blood mononuclear cells were analysed at the beginning and end of the study.
ResultsParicalcitol significantly decreased parathyroid hormone levels with no changes in calcium and phosphorous. It also reduced serum concentrations of interleukin (IL)-6 and tumour necrosis factor-alpha (TNF-α) by 29% (P<0.05) and 9.5% (P<0.05) compared to baseline, respectively. Furthermore, gene expression levels of IL-6 and TNF-α in peripheral blood mononuclear cells decreased by 14.1% (P<0.001) and 34.1% (P<0.001), respectively. The ratios between pro-inflammatory cytokines (TNF-α and IL-6) and anti-inflammatory cytokines (IL-10), both regarding serum concentrations and gene expression, also experienced a significant reduction.
ConclusionsParicalcitol administration to kidney transplant recipients has been found to have beneficial effects on inflammation, which may be associated with potential clinical benefits.
Aunque el trasplante renal consigue corregir muchos de los desajustes metabólicos derivados de la uremia, el hiperparatiroidismo secundario (HPTS) continúa estando presente en un alto porcentaje de estos pacientes1.
El paricalcitol es un activador selectivo del receptor de la vitamina D (RVD) empleado para la prevención y tratamiento del HPTS. Dos ensayos clínicos prospectivos y aleatorizados realizados recientemente muestran, para receptores de trasplante renal, un pronunciado descenso en las concentraciones de hormona paratiroidea intacta (PTHi) en aquellos pacientes que recibieron paricalcitol2,3, junto con un descenso en la frecuencia de HPTS postrasplante de más de la mitad tras un año de seguimiento2 y una atenuación de los procesos de remodelado óseo y de pérdida mineral3. Además, se produce una reducción en la excreción urinaria de proteínas lo que, junto con todo lo anterior, señala la existencia de efectos pleiotrópicos del paricalcitol en esta población.
En la enfermedad renal crónica (ERC), el estado inflamatorio se asocia con diversas complicaciones, incluyendo anemia, hipertrofia ventricular izquierda, calcificación vascular y aterosclerosis, y es un predictor independiente de mortalidad1-3. En este escenario, las alteraciones en las citocinas reguladoras del proceso inflamatorio suponen un factor clave con implicaciones relevantes en el desarrollo de complicaciones y en el incremento de la morbimortalidad4-8. En el caso de los pacientes receptores de trasplante renal, la inflamación se ha relacionado con consecuencias deletéreas, tales como el rechazo agudo, aparición de complicaciones a largo plazo, desarrollo de calcificación coronaria, hipertensión arterial, así como un incremento de la aparición de eventos cardiovasculares y de mortalidad9-13.
Estudios experimentales tanto in vitro como in vivo han mostrado efectos antiinflamatorios del paricalcitol, incluyendo la atenuación de la expresión de citocinas inflamatorias, la inhibición de la inflamación renal mediante el secuestro del NF-kB, la inhibición de la vía Wnt, y el bloqueo de la transcripción génica mediada por β-catenina14-18. Sin embargo, los estudios que señalan la existencia de efectos antiinflamatorios del paricalcitol en el entorno clínico son escasos y ninguno de ellos se ha llevado a cabo en receptores de trasplante renal.
Este estudio preliminar se ha llevado a cabo en pacientes receptores de trasplante renal para determinar el efecto de la administración del paricalcitol oral sobre las concentraciones séricas y el perfil de expresión génica en células mononucleares de sangre periférica (CMSP) de citocinas inflamatorias.
MétodosDiseño del estudioEstudio prospectivo, abierto, no aleatorizado, que ha incluido a pacientes portadores de trasplante renal, realizado en condiciones de práctica clínica habitual. Los criterios de inclusión fueron: pacientes mayores de 18 años; función renal estable durante los 3 meses previos al inicio del estudio (estabilidad definida como una variabilidad de los valores de creatinina sérica menores del 20% con respecto al último control); niveles séricos de calcio y fósforo dentro del rango de normalidad; filtrado glomerular estimado mayor de 30mL/min/1,73 m2; sin modificaciones de la terapia inmunosupresora en los 3meses previos y capacidad para dar consentimiento informado. Los criterios de exclusión fueron: concentración de PTHi inferior a 100pg/mL; existencia de episodios previos de rechazo agudo; enfermedad inmunológica conocida; episodios inflamatorios agudos en los 3 meses previos; positividad para hepatitis B, C o HIV; tratamiento previo con calcimiméticos, con vitamina D o con compuestos con vitamina D activa y hábitos de tabaquismo, alcoholismo o abuso de drogas.
Los pacientes finalmente incluidos en el estudio y que tuvieran una concentración sérica de PTHi mayor de 100pg/mL recibieron tratamiento con paricalcitol por vía oral a una dosis de 1μg/día durante 3 meses. Una vez finalizados los 3 meses de tratamiento, se determinó la variación en los niveles séricos de las citocinas inflamatorias interleucina (IL)-6, IL-10 y del factor de necrosis tumoral (TNF)-α, así como la variación en la expresión de sus genes codificantes en CMSP. El estudio recibió la aprobación del Comité de Ética Institucional del centro y se llevó a cabo de acuerdo con la Declaración de Helsinki, con la Directiva para los Ensayos Clínicos de la Unión Europea (2001/20/EC) y siguiendo las normas de buena práctica clínica. Todos los participantes firmaron un consentimiento informado previamente a la inclusión.
Determinaciones bioquímicasTodas las determinaciones se realizaron por personal que desconocía las características de los pacientes y el grupo al que fueron asignados. Las extracciones de sangre se realizaron tras un periodo de ayuno de 8h. Las alícuotas de suero se mantuvieron congeladas a –80°C hasta su utilización. Los parámetros bioquímicos rutinarios se determinaron mediante métodos estándar. La creatinina se midió mediante un método enzimático estandarizado (CREA Plus, Roche Diagnostic, Mannheim, Alemania). Los coeficientes de variación (intra- e interensayo) fueron menores de 1,5%. La concentración de PTHi sérica se determinó mediante el ensayo Roche modular intact PTH assay (Roche Diagnostics Corp., Indianapolis, IN, EE. UU.) (rango normal de referencia, 15-65pg/mL).
Los niveles séricos de proteína C reactiva de alta sensibilidad (PCRhs) se midieron mediante ensayo inmunoturbidimétrico (Roche Diagnostics GmbH, Mannheim, Alemania) de forma automatizada; la sensibilidad era de 0,3mg/l y los coeficientes de variabilidad intra- e interensayo de 1,6 y 8,4%, respectivamente. Se determinaron las concentraciones de TNF-α, de IL-6 y de IL-10 mediante ELISA de alta sensibilidad ELISA (Quantikine Human, R&D Systems, Minneapolis, EE. UU.) utilizando para ello un procesador de placas ELISA DSXTM 4 (Vitro SA, España). Las concentraciones mínimas detectables fueron 0,10; 0,70 y 0,50pg/mL, respectivamente. Los coeficientes de variación intra- e interensayo fueron inferiores al 10,8%. A todos los participantes se les solicitó una muestra de orina de 24 h para la determinación del valor de aclaramiento en creatinina y de la excreción urinaria de albúmina. Se instruyó previamente a los pacientes sobre cómo recoger dichas muestras de orina y se les entregaron las instrucciones por escrito. El contenedor con la orina se llevó al laboratorio el mismo día en que finalizó el periodo de recolección. La excreción urinaria de albúmina se cuantificó mediante inmunoturbidometría (Tina-quant Albumin Assay, Roche Diagnostic, Mannheim, Alemania). Respecto a la sensibilidad y especificidad analíticas, el límite del blanco fue de 2mg/dL y el límite de detección de 3mg/dL. Los coeficientes de variación intra- e interensayo fueron inferiores al 4%.
Expresión génica en células mononucleares de sangre periféricaA todos los pacientes se les extrajo una muestra de sangre total (2,5mL) al inicio y a la finalización del estudio utilizando para ello tubos PAXgene Blood RNA tubes (BD, Franklin Lakes, NJ, EE. UU.). Esta extracción se realizó al mismo tiempo que la empleada para recuperar el suero. Se empleó el kit PAXgene Blood RNA Kit (Qiagen, Valencia, CA, EE. UU.) para extraer el ARN total siguiendo las instrucciones del fabricante, para posteriormente conservarlo a −80°C. El ADNc se sintetizó utilizando el kit High Capacity RNA-to-cDNA kit (Applied Biosystems, Foster City, CA, EE. UU.).
Mediante el uso de sonda TaqMan y la PCR cuantitativa a tiempo real (qRT-PCR) se determinó las expresión de los transcritos codificantes para TNF-α, IL-6, IL-10 y para la gliceraldehído 3-fosfato deshidrogenasa (GApDH). La mezcla de reacción comercial empleada fue TaqMan Fast Universal PCR Master Mix (Applied Biosystems) y las sondas TaqMan seleccionadas para cada transcrito fueron: Hs00174128_ml [TNFα], Hs00985639_ml [IL-6], Hs0961622_m1 [IL-10] y Hs99999905_m1 [GApDH]). La amplificación se realizó en un termociclador 7500 Fast Real-Time PCR System (Applied Biosystems). Los niveles de ARNm para cada uno de los genes estudiados se calcularon mediante cuantificación relativa usando para ello el método comparativo 2-ΔΔCt mediante normalización con respecto a la expresión de GApDH. Las determinaciones de cada transcrito se hicieron por triplicado y se utilizaron muestras sin transcripción reversa como controles negativos frente a la posible contaminación por ADN.
Análisis estadísticoDada la naturaleza exploratoria del estudio, no se realizó cálculo del tamaño muestral. Los datos categóricos se presentan como valores absolutos y porcentajes. Las variables continuas se señalan con los valores de media±desviación estándar. Se empleó el test W de Shapiro-Wilk para determinar la normalidad. Las comparaciones basales se realizaron mediante una prueba t de Student para muestras independientes si los datos seguían una distribución normal, o mediante un test U de Mann-Whitney cuando los datos aparecieron altamente sesgados. Para comparar los valores finales y los basales, se emplearon las pruebas Mann-Whitney y Wilcoxon para datos pareados, según correspondía. Tanto los valores séricos como los de expresión génica que no presentaron una distribución normal fueron transformados a valores logarítmicos para la realización de los cálculos. Los niveles de expresión de los genes en estudio se calcularon utilizando el programa Data AssistTM v3.0 Software (Applied Biosystems). El resto de los cálculos se realizó mediante el programa Graphpad InStat (GraphPad Software, San Diego, CA, EE. UU.). Todos los tests fueron de 2colas y se consideró como estadísticamente significativo un valor de p<0,05.
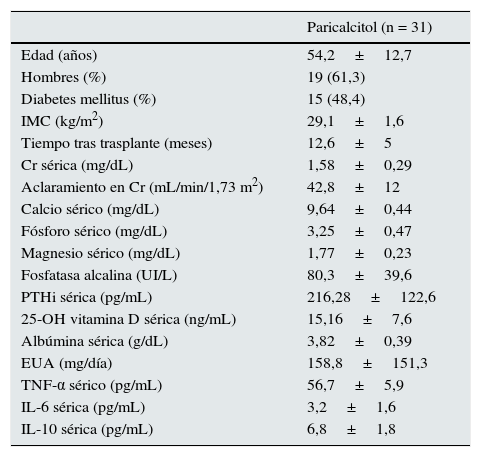
ResultadosCaracterísticas demográficas y parámetros bioquímicosAl inicio del estudio se consideró a un total 74 pacientes, de los cuales 43 no fueron incluidos por las siguientes razones: 8 tenían una concentración de PTHi menor de 100pg/mL, 12 tuvieron un episodio infeccioso agudo, 5 tenían antecedente de rechazo agudo, 5 pacientes recibían tratamiento con vitamina D nutricional y 4 con análogos activos, 4 pacientes presentaron una variación de la concentración sérica de creatinina>20% respecto al control previo y en 5 pacientes se modificó la terapia inmunosupresora. Finalmente, se incluyeron 31 pacientes según los criterios de inclusión (19 hombres; edad media 54,2±12,7 años) que recibieron tratamiento con paricalcitol (1μg/día durante 3 meses).
El tratamiento con paricalcitol fue bien tolerado, de forma que todos los pacientes completaron el estudio, y en ningún caso fue necesario retirar, ni siquiera de forma temporal, el tratamiento.
Respecto a la terapia inmunosupresora, todos los pacientes recibieron terapia con esteroides y con mofetil micofelonato. Veintiséis pacientes recibieron tacrolimus y 5 un inhibidor de la vía del mTOR (mammalian target of rapamycin). Finalmente, 15 pacientes (48%) recibieron tratamiento con bloqueadores del sistema renina-angiotensina. La tabla 1 recoge las características clínicas basales de los participantes.
Características clínicas basales de los pacientes incluidos en el estudio
| Paricalcitol (n = 31) | |
|---|---|
| Edad (años) | 54,2±12,7 |
| Hombres (%) | 19 (61,3) |
| Diabetes mellitus (%) | 15 (48,4) |
| IMC (kg/m2) | 29,1±1,6 |
| Tiempo tras trasplante (meses) | 12,6±5 |
| Cr sérica (mg/dL) | 1,58±0,29 |
| Aclaramiento en Cr (mL/min/1,73 m2) | 42,8±12 |
| Calcio sérico (mg/dL) | 9,64±0,44 |
| Fósforo sérico (mg/dL) | 3,25±0,47 |
| Magnesio sérico (mg/dL) | 1,77±0,23 |
| Fosfatasa alcalina (UI/L) | 80,3±39,6 |
| PTHi sérica (pg/mL) | 216,28±122,6 |
| 25-OH vitamina D sérica (ng/mL) | 15,16±7,6 |
| Albúmina sérica (g/dL) | 3,82±0,39 |
| EUA (mg/día) | 158,8±151,3 |
| TNF-α sérico (pg/mL) | 56,7±5,9 |
| IL-6 sérica (pg/mL) | 3,2±1,6 |
| IL-10 sérica (pg/mL) | 6,8±1,8 |
Cr: creatinina; EUA: excreción urinaria de albúmina; IL: interleucina; IMC: índice de masa corporal; NS: no significativo; PTHi: hormona paratiroidea intacta; TNF-α: factor de necrosis tumoral-alfa; UI: unidades internacionales.
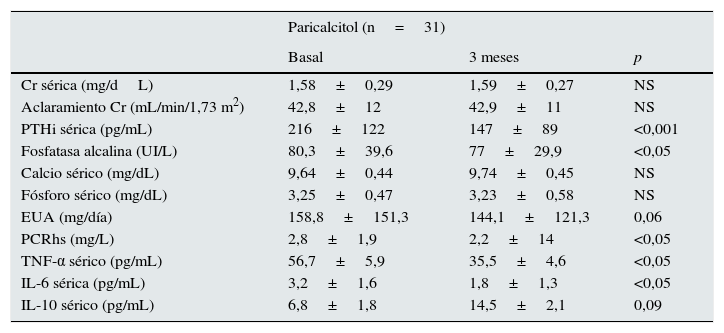
Tras 3meses de administración de paricalcitol, no se observaron cambios significativos ni en la función renal (valores de creatinina sérica y de aclaramiento en creatinina) ni en los parámetros de metabolismo mineral (fósforo y calcio séricos y producto calcio-fósforo) excepto para los valores de HPTi (tabla 2). Así, las concentraciones séricas de PTHi experimentaron un descenso significativo desde los 216,3±122,6pg/mL basales hasta los 147±89pg/mL a la finalización del estudio (p<0,001), lo que representa un descenso porcentual medio de un 31,9% respecto a los valores basales. De forma similar, también disminuyeron los niveles séricos de fosfatasa alcalina en los sujetos que recibieron paricalcitol. No hubo episodios de hipercalcemia ni de hiperfosfatemia durante el estudio.
Características bioquímicas de los pacientes al comienzo y al final del estudio
| Paricalcitol (n=31) | |||
|---|---|---|---|
| Basal | 3 meses | p | |
| Cr sérica (mg/dL) | 1,58±0,29 | 1,59±0,27 | NS |
| Aclaramiento Cr (mL/min/1,73 m2) | 42,8±12 | 42,9±11 | NS |
| PTHi sérica (pg/mL) | 216±122 | 147±89 | <0,001 |
| Fosfatasa alcalina (UI/L) | 80,3±39,6 | 77±29,9 | <0,05 |
| Calcio sérico (mg/dL) | 9,64±0,44 | 9,74±0,45 | NS |
| Fósforo sérico (mg/dL) | 3,25±0,47 | 3,23±0,58 | NS |
| EUA (mg/día) | 158,8±151,3 | 144,1±121,3 | 0,06 |
| PCRhs (mg/L) | 2,8±1,9 | 2,2±14 | <0,05 |
| TNF-α sérico (pg/mL) | 56,7±5,9 | 35,5±4,6 | <0,05 |
| IL-6 sérica (pg/mL) | 3,2±1,6 | 1,8±1,3 | <0,05 |
| IL-10 sérico (pg/mL) | 6,8±1,8 | 14,5±2,1 | 0,09 |
Cr: creatinina; EUA: excreción urinaria de albúmina; IL: interleucina; NS: no significativo; PCRhs: proteína C reactiva de alta sensibilidad; PTHi: hormona paratiroidea intacta; TNF-α: factor de necrosis tumoral alfa; UI: unidades internacionales.
En cuanto a la excreción urinaria de albúmina, no se produjeron cambios significativos en este parámetro, aunque se observó un descenso de un 9,3% respecto a los valores basales (p=0,057).
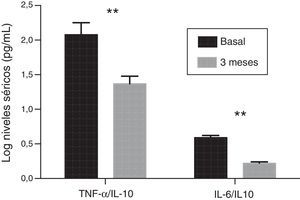
Perfil inflamatorioLa concentración de PCRhs experimentó un descenso significativo después del tratamiento con paricalcitol (2,8±1,9 vs. 2,2±1,4; p<0,05). Los niveles séricos de IL-10 tras el tratamiento con paricalcitol mostraron una tendencia al alza (p=0,09), mientras que los valores tanto de la IL-6 como del TNF-α disminuyeron significativamente (tabla 2). Así, respecto a los valores basales, los descensos porcentuales medios de la IL-6 y del TNF-α fueron respectivamente: 29,08 y 9,58% (p<0,05, en ambos casos). Estos cambios no estuvieron relacionados ni con las variaciones en los niveles séricos de PTHi ni con el cambio en la excreción urinaria de albúmina. Se evaluó también el cambio en el balance entre fuerzas pro- y antiinflamatorias mediante la evolución de los cocientes del TNF-α y de la IL-6 con respecto a la citocina antiinflamatoria IL-10. Así, y respecto a los valores basales, se observaron reducciones significativas tanto del cociente TNF-α/IL-10 como del cociente IL-6/IL-10, con valores porcentuales de disminución del 33 y del 36,9%, respectivamente (p=0,01) (fig. 1).
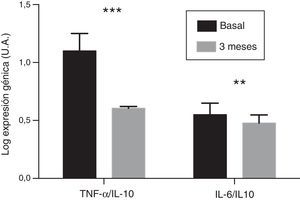
En las CMSP provenientes se analizó la evolución de los niveles de expresión génica de las citocinas proinflamatorias IL-6 y TNF-α. Tras 3 meses de administración de paricalcitol oral, los niveles de ARNm de estas citocinas mostraron un descenso significativo, con un valor porcentual medio de 14,13 y de 34,17%, respectivamente (p<0,001). Por su parte, el nivel de expresión de la IL-10 no mostró variaciones significativas. Tampoco se observó que hubiera correlación entre el cambio en los niveles de expresión de IL-6 y de TNF-α y las variaciones observadas en las concentraciones séricas de estas citocinas. Finalmente, los cocientes de los niveles de expresión del TNF-α y de la IL-6 con respecto a los de la IL-10 experimentaron una reducción significativa de un 45,6% y de un 13,4%, respectivamente, tras el tratamiento (p<0,01 y p<0,001, respectivamente) (fig. 2).
DiscusiónEn este trabajo hemos evaluado los efectos del paricalcitol sobre el perfil inflamatorio de pacientes receptores de trasplante renal que presentan HPTS persistente. Estudios recientes en este campo muestran que el tratamiento con este compuesto tiene un impacto positivo que redunda en un descenso mayor en las concentraciones de PTHi y en una reducción en la frecuencia de HPTS postrasplante2,3. Además, provoca una atenuación de los procesos de remodelado óseo y de pérdida mineral, así como una reducción de la excreción urinaria de proteína, lo que señala la existencia de efectos pleiotrópicos beneficiosos derivados de la activación del RVD3. Nuestros resultados aportan nuevos datos en este sentido y apuntan un efecto modulador del perfil inflamatorio del paciente trasplantado renal por parte del paricalcitol. Concretamente, la administración de este activador selectivo del RVD provoca un descenso significativo de los niveles séricos de las citocinas proinflamatorias IL-6 y TNF-α, así como una reducción en los niveles de expresión de los genes IL-6 y TNF-α en las CMSP.
De acuerdo con estudios observacionales previos y diversos ensayos clínicos2,3,19, los niveles séricos de PTHi mostraron una reducción rápida tras 3meses de tratamiento con paricalcitol, con un descenso porcentual medio y significativo de un 31,9% respecto a los valores basales, sin ningún cambio en los valores de calcio y fósforo. Además, se observó una reducción significativa en la concentración sérica de fosfatasa alcalina, lo cual ha sido observado previamente20,21. Este descenso se ha relacionado con un descenso concomitante de PTHi así como con un efecto supresor del paricalcitol sobre los osteoblastos21.
El incremento en la excreción urinaria de albúmina es frecuente en los pacientes receptores de trasplante renal, con más de un 45% de los sujetos que presentan proteinuria al año del trasplante22. En la mayoría de los casos, el grado de proteinuria está por debajo de 500mg/día, pero incluso a bajos niveles —que van desde 150 hasta 500mg/día— es un potente predictor de reducción de la supervivencia a largo plazo del injerto renal23,24. En nuestro estudio, hemos analizado la evolución de la albuminuria y hemos observado que tiene una tendencia a la disminución al finalizar el tratamiento que no llega a ser estadísticamente significativa. Un estudio retrospectivo previo muestra también un descenso ligero, aunque significativo, de la proteinuria en 58 pacientes renales trasplantados, tras 3 meses de administración de paricalcitol19. De igual modo, nuestros resultados coinciden con los de un ensayo clínico reciente de Trillini et al.3 donde, de nuevo, se observa una tendencia a reducir la proteinuria tras 3 meses de terapia con paricalcitol. Dicho descenso alcanza significado estadístico a los 6 meses de seguimiento. Algunos trabajos experimentales también señalan esta asociación entre el uso de paricalcitol y los efectos antiproteinúricos, y apuntan a diversos mecanismos que incluyen la regulación a la baja del sistema renina-angiotensina, la atenuación de la fibrosis renal, la estimulación de la síntesis de nefrina y el efecto antiinflamatorio15,16,25,26.
La activación del RVD, más allá de sus efectos clásicos sobre el metabolismo mineral, está asociada con importantes capacidades pleiotrópicas que incluyen la regulación de funciones inmunes y la modulación del estrés oxidativo y de la inflamación27,28. Aunque los estudios experimentales han aportado una sólida evidencia de los efectos antiinflamatorios del paricalcitol como activador selectivo del RVD15,29,30, los trabajos clínicos son escasos y los que existen se han llevado a cabo con pacientes con ERC o en diálisis31-34. El presente estudio, enfocado como prueba de concepto, supone el primer trabajo diseñado específicamente para evaluar los potenciales efectos de considerar la activación selectiva del RVD como objetivo a la hora de modular el perfil inflamatorio de los pacientes con trasplante renal. Nuestros resultados muestran que el tratamiento con paricalcitol está asociado con una reducción significativa en las concentraciones séricas de las citocinas proinflamatorias TNF-α e IL-6, así como con un descenso de los cocientes TNF-α/IL-10 e IL-6/IL-10. Hasta donde sabemos, solamente un estudio previo ha analizado estos efectos en pacientes con trasplante renal19. En dicho estudio, se evaluó de forma retrospectiva la evolución de 58 pacientes y el estado inflamatorio de los pacientes se determinó únicamente midiendo los niveles séricos de la proteína C reactiva, valor que fue considerado como un resultado terciario. Los resultados al final del estudio mostraron un descenso en los niveles de proteína C reactiva tras 3 meses de tratamiento con paricalcitol, reducción que permaneció siendo significativa tras 24 meses de tratamiento. Sin embargo, no se consideraron los niveles séricos de las citocinas inflamatorias ni sus niveles de expresión génica.
Nuestro estudio demuestra que, además de su efecto sobre las concentraciones séricas, el paricalcitol es capaz de actuar en las CMSP modulando la transcripción de genes que codifican citocinas inflamatorias. En un estudio in vitro previo se observó que el paricalcitol era capaz de reducir la producción del TNF-α y de la IL-8 basales y la inducida por lipopolisacáridos en CMSP de sujetos sanos35. De forma más reciente, se ha comprobado que, al cultivar CMSP aisladas de pacientes con ERC y estimularlas con fitohemaglutinina A, se provoca un incremento en la producción de citocinas inflamatorias (IL-17, IL-6, IL-1β y TNF-α); sin embargo, si las células se obtienen de pacientes con ERC que recibieron paricalcitol, ocurre un descenso significativo en la producción de estas citocinas comparado con la de pacientes que no recibieron el tratamiento y que recuperan valores basales similares a los de células de sujetos sanos35. En nuestro estudio, comprobamos que los niveles de ARNm de IL-6 y de TNF-α en CMSp muestran reducciones significativas de un 14 y de un 34% respecto a los valores basales (p<0,001) tras el tratamiento con paricalcitol. Un efecto similar del paricalcitol sobre la expresión génica de citos inflamatorias en CMSP ha podido observarse en pacientes con ERC y en hemodiálisis33,34.
Hoy en día se considera a la aterosclerosis como a una enfermedad inflamatoria. A su vez, la inflamación se caracteriza por la activación en sangre periférica de células inmunocompetentes, que provocan la producción de citocinas inflamatorias. Además, la activación y la entrada de CMSP desde la circulación hacia la pared vascular es un paso crítico en la patogénesis de la aterosclerosis36,37 y, desde una perspectiva clínica, el incremento en la expresión de las citocinas inflamatorias en las CMSP se relaciona con la enfermedad cardiovascular38-40. Así, es posible especular que la capacidad antiinflamatoria del paricalcitol, un efecto pleiotrópico y extraesquelético, puede estar asociado con un impacto clínico positivo, similar al que se ha observado en pacientes en hemodiálisis41.
Aunque este trabajo presenta información novedosa, debemos reconocer ciertas limitaciones. Así, dada la naturaleza exploratoria de este estudio, no ha sido llevado a cabo siguiendo un diseño aleatorizado, el tamaño muestral ha sido pequeño, y también el periodo de seguimiento de los pacientes, lo cual puede haber determinado que algunos de los resultados no hayan alcanzado siginificación estadística y, por tanto, no nos ha permitido dibujar unas conclusiones definitivas. Además, los efectos de la terapia con paricalcitol no fueron comparados con los producidos por la vitamina D o con otro de sus metabolitos activos. Sin embargo, basándonos en la homogeneidad del estudio en términos de la atención general, del seguimiento y del abordaje terapéutico de los pacientes, que no variaron durante el estudio, podemos suponer que los resultados obtenidos se deben al tratamiento con paricalcitol.
En conclusión, los resultados del presente estudio muestran que la activación selectiva del RVD mediante paricalcitol en pacientes con trasplante renal se asocia con un efecto modulador y beneficioso sobre el perfil inflamatorio sérico y sobre la expresión génica de citocinas en CMSP, lo que resulta en un impacto favorable en el equilibrio entre las citocinas proinflamatorias (IL-6 y TNF-α) y la citocina antiinflamatoria IL-10. Estos hallazgos señalan que los beneficios de la terapia con paricalcitol observados previamente en pacientes con ERC y diálisis pueden extenderse a los trasplantados renales. Se necesitan ensayos prospectivos a largo plazo y adecuadamente impulsados para lograr una mejor evaluación del impacto potencial de este tratamiento y de la traducción de estos efectos pleiotrópicos beneficiosos sobre los resultados clínicos en trasplantados renales, incluida la supervivencia del injerto y la morbimortalidad del paciente.
FinanciaciónJDC, MMF, CMF y JFNG son miembros de RETIC/REDinREN/RD16/0009/0022, (ISCIII) y del GEENDIAB. La actividad investigadora de JDC, EMN y de JFNG está financiada por el ISCIII (CD16/00165, FI14/00033 y INT15/00004, respectivamente). Este estudio ha sido financiado parcialmente por Ayudas a la Investigación de la S.E.N. y ACINEF.
Autoría/colaboracionesLos autores JDN, EHP y EMN han contribuido por igual en la elaboración de este artículo.
Conflicto de interesesLos autores de este manuscrito no tienen conflictos de interés que declarar.
Referencias no citadas