La nefropatía por cianosis es un cuadro infrecuente y poco conocido, por lo que creemos de interés la descripción de un caso.
Varón de 49 años que acude a consultas por proteinuria. Fue diagnosticado de atresia tricuspídea en su primera infancia, tratada quirúrgicamente con intervención clásica de Glenn (anastomosis de la vena cava superior a la arteria pulmonar derecha) a los 20 meses de edad, y en un segundo tiempo mediante fístula sistémica pulmonar de Blalock-Taussig izquierda (injerto de prótesis de GORE-TEX® de la arteria subclavia a la arteria pulmonar homolateral), que posteriormente se debió reparar con un stent endovascular por estenosis. Presenta disfunción ventricular izquierda moderada con cianosis crónica, cifras de Hb habituales de 17g/dl y Hto del 60%. Trombocitopenia moderada y accidente isquémico transitorio 10 años antes a raíz del cual se sustituyó antiagregación con AAS por clopidogrel. Tratamiento habitual con clopidogrel, alopurinol y bosentán. Además, flebotomías periódicas hasta hace 2 años en que se suspendieron a criterio de sus cardiólogos. El paciente acude a consultas por presentar proteinuria de tiempo de evolución desconocido. Se muestra normotenso, con un IMC de 23kg/m2. En la analítica destaca Cr 0,78mg/dl con filtrado glomerular estimado por CKD- EPI por encima de 90ml/min/1,73m2; Hb 23,8g/dl; Hto del 80,8%; plaquetas 89.000/ml; ácido úrico 7,9mg/d; colesterol 257mg/dl; sistemático de orina con mínima microhematuria; MAu/Cru 3.371,4mg/g y proteinuria 6,21g/24h de carácter mixto. Serología vírica negativa. Inmunología negativa (complemento, ANA, ANCA, anti-DN, anticuerpos anti-fosfolipasa y anti-PLA2R). Inmunoglobulinas y proteinograma normal. Ecografía abdominal con riñones de tamaño conservado e hiperecogenicidad difusa bilateral como único hallazgo reseñable.
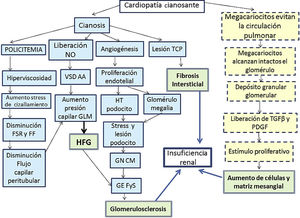
Desde 19601 se conoce que entre un 30-50% de cardiopatías cianosantes pueden desencadenar una glomerulopatía secundaria conocida como nefropatía por cianosis2. Es un correlato de síndrome cardiorrenal tipo 2. Se debe a distintos mecanismos (fig. 1)3–5 puestos en marcha por el síndrome de hiperviscosidad secundario a la policitemia extrema y a la cianosis, que provocan un aumento del stress de cizallamiento al pasar un elevado número de hematíes por una unidad de superficie capilar en el glomérulo. El descenso subsecuente del flujo sanguíneo renal y de la fracción de filtración inducen hipoxia, con una respuesta angiogénica mediada por la liberación de óxido nítrico, vasodilatación selectiva de la arteriola aferente y aumento de la presión del capilar lo que determina hiperfiltración glomerular. El descenso de flujo sanguíneo capilar peritubular también contribuye a aumentar la presión capilar. De forma paralela, la cianosis desencadena un estímulo angiogénico con aumento del número de capilares por glomérulo, glomerulomegalia por proliferación endotelial y aumento del área de superficie del capilar glomerular, el podocito se estira, se hipertrofia por estrés y se daña en lo que morfológicamente remeda a la glomerulonefritis por cambios mínimos y en un segundo tiempo a la glomerulosclerosis focal y segmentaria6.
Fisiopatología de la nefropatía por cianosis.
FF: fracción de filtración; FSR: flujo sanguíneo renal; GEFyS: glomerulosclerosis focal y segmentaria; GLM: glomérulo; GNCM: glomerulonefritis de cambios mínimos; HFG: hiperfiltración glomerular; HT: hipertrofia; PDGF: factor de crecimiento derivado de las plaquetas; TCP: túbulo contorneado proximal; TGFβ: factor de crecimiento tumoral β; VSD AA: vasodilatación arteriola aferente.
Línea continua: vía de daño vascular; línea quebrada: vía de daño proliferativo; doble cuadrícula: vía de daño final.
Se acepta que el daño inicial es tubular7–9, sobre todo en el túbulo proximal, lo que se refleja en un aumento de N-acetil glucosamina y α1-microglobulina urinarios que suele producirse en la primera década de la vida y continuarse en la siguiente década con un daño glomerular (albuminuria, proteinuria y descenso del filtrado glomerular). Conforme el mecanismo de hiperfiltración glomerular compensador se agota, se desarrolla una hialinosis glomerular con glomeruloesclerosis y una fibrosis intersticial que condicionará el pronóstico a medio plazo. De forma diferencial distinguimos un daño vascular resultado de la dilatación capilar, engrosamiento o destrucción endotelial, glomerulosclerosis y fibrosis periglomerular de un daño mediado por un mecanismo proliferativo no vascular, resultado del shunt en la circulación pulmonar. En condiciones normales, tras liberarse del bazo y médula ósea, una población de megacariocitos quedan retenidos en el intersticio y en la vasculatura pulmonar5,10,11. En la vasculatura pulmonar donde se disgregan formando plaquetas activas a razón de 106/h. Pero en condiciones de shunt derecha/izquierda se evita este paso y los megacariocitos pasan intactos a la circulación sistémica posibilitando que sus gránulos alfa, ricos en PDGF y en TGFβ lleguen al glomérulo renal y se liberen, derivándose 2 efectos. Una trombocitopenia periférica que indirectamente cuantifica el grado de shunt (a mayor trombocitopenia, mayor shunt) y un aumento de factores plaquetarios proliferativos que provocarán el aumento de células yuxtaglomerulares del mesangio, matriz mesangial y fibrosis intersticial focal.
El nivel de hematocrito, el tiempo de espera hasta la cirugía del shunt y un nivel de plaquetas menor de 250.000/ml son factores de riesgo para la aparición de la nefropatía3,12,13.
El tratamiento consiste en disminuir los tiempos de espera quirúrgicos, flebotomías periódicas e inhibición del eje renina-angiotensina-aldosterona con IECA14.
El pronóstico renal es desfavorable si no se resuelve la causa. En nuestro caso, iniciamos tratamiento con estatina e IECA, y se recomendaron de nuevo flebotomías periódicas sin disponer en el momento de esta redacción de un seguimiento suficiente para evaluar la respuesta.