La infección por el poliomavirus BK (PBK) es un problema emergente en el trasplante renal que contribuye a la pérdida crónica de los injertos renales, y en el que la inmunosupresión desempeña un papel decisivo en su aparición. El conocimiento de los factores de riesgo y la monitorización estrecha de marcadores urinarios y serológicos de la infección pueden mitigar los efectos indeseables de esta infección. En esta revisión se profundiza en los aspectos clínicos y epidemiológicos de la infección por PBK, así como en las medias profilácticas y terapéuticas disponibles para su control en pacientes con trasplante renal que reciben moderna inmunosupresión.
The infection by the BK Polyomavirus (BKV) is an emerging problem in kidney transplants that contributes to a chronic loss of kidney grafts, and in which immunosuppression plays a decisive role. Understanding its risk factors and strictly monitoring urine and serological markers of the infection could mitigate the undesirable effects of this disease. In this review, we investigate the clinical and epidemiological aspects of the BKV infection, as well as go over the available prophylactic and treatment methods currently available for controlling the infection in kidney transplant patients that receive modern immunosuppression.
INTRODUCCIÓN
Los virus son patógenos especialmente problemáticos en receptores de trasplante, debido a que el problema de la infección viral en trasplantes refleja un complejo equilibrio entre las diferentes infecciones virales presentes a lo largo de la vida, la función inmune antiviral del receptor y el nivel de inmunosupresión necesario para mantener el injerto funcionante.
La infección por el poliomavirus BK (PBK) es un problema emergente en el trasplante renal, interpretado como el precio a pagar por una inmunosupresión (IS) moderna y potente.
ASPECTOS BIOLÓGICOS DEL VIRUS
El poliomavirus, junto con el papilomavirus, pertenece a la familia de los papovavirus. El virus BK (VBK) pertenece a la familia de los poliomavirus junto con otros poliomavirus detectados en la especie humana, como el virus JC (VJC), el virus KI, el virus WU, el virus del carcinoma de células Merkel y el virus 40 Simial (SV40).
Son virus pequeños, desnudos, de 42 nm de diámetro, provistos de cápside de simetría icosaédrica que alberga en su interior un genoma con doble cadena circular de ADN con más de 5.000 pares de nucleótidos, compuesto de una región «temprana», altamente conservada, que codifica para el denominado «antígenoT/t» (AgT), implicado en la transformación, replicación viral, regulación y expresión génica; una región «tardía», que codifica para las tres proteínas de la cápside, denominadas VP1, VP2 y VP3, y para una proteína denominada «agnoproteína» una región reguladora «no codificante», situada entre las otras dos, en la que asientan los determinantes para el inicio de la replicación, la unión del AgT y los elementos reguladores transcripcionales.
El poliomavirus posee especificidad de adaptación a su huésped, de tal forma que su evolución probablemente esté asociada con la evolución de la especie hospedadora, de modo que la infección natural se circunscribe a una o a pocas especies relacionadas, pudiendo constituir un marcador para establecer las diferencias raciales en seres humanos.
Mediante el análisis de la secuencia genómica se han podido establecer diferentes genotipos: europeo, asiático y africano. El resto de los genotipos apuntarían a una recombinación de los anteriores y, aunque su origen es difícil de establecer, su estudio podría constituir una herramienta de apoyo al conocimiento de la evolución de las migraciones humanas.
El VBK se asocia con dos complicaciones en receptores de trasplante; la nefropatía asociada a poliomavirus BK (NAPBK) en trasplante renal y la cistitis hemorrágica en trasplante de médula ósea. En contraste con el VBK, aunque el VJC reside en el uroepitelio y normalmente se reactiva, rara vez produce nefropatía, y se asocia con cuadros de encefalitis y leucoencefalopatía multifocal. El SV40, procedente del simio, se introdujo en la población humana a través de de vacunas contaminadas para la polio y adenovirus, y aunque se ha detectado su presencia en biopsias de riñones trasplantados, su importancia en el trasplante renal no está bien definida.
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
La infección primaria ocurre de forma subclínica en la primera década de la vida, con una seroprevalencia en la población adulta superior al 80%.
La fuente de infección es exclusivamente humana, no está probado que un animal actúe como reservorio, y la vía de transmisión puede ser fecal-oral, respiratoria, transplacental y a través de tejidos donados. Durante la fase virémica, el virus infecta los tejidos, urotelio, tejido linfoide y cerebro, produciendo una infección lítica latente.
Después de la transmisión viral natural durante la infancia, el PBK permanece en el tracto urinario con reactivaciones intermitentes y niveles bajos de viruria (Vr) en 5-10% de los adultos inmunocompetentes1,2. En individuos inmunocomprometidos la frecuencia de VrBK aumenta al 20-60% y son frecuentes mayores virurias y la aparición de células decoy (células señuelo) en la orina3.
En el trasplante renal, la prevalencia de la nefropatía asociada con poliomavirus BK (NAPBK) oscila entre el 1 y el 10%4 en función del régimen inmunosupresor y de los métodos de aproximación al diagnóstico localmente utilizados, más que por verdaderas diferencias epidemiológicas.
En 2004 se incluyó en la base de datos americana el tratamiento de la infección por el VBK postrasplante renal, como variable de evolución postrasplante (TVBK); posteriormente se analizaron los datos, y se observó que de un total de >48.000 trasplantes, 1.474 fueron tratados dentro de los 24 meses. La incidencia acumulativa de TVBK aumentó con el tiempo, para pasar del 3,45% a los 24 meses hasta alcanzar un 6,6% en el 60 mes del trasplante.
La pérdida del injerto secundaria a NAPBK es del 50-100% a los 24 meses en centros sin cribado, lo que pone de relieve la importancia del diagnóstico precoz de la enfermedad5.
Diferentes protocolos de IS han sido identificados como factores de riesgo para el desarrollo de NAPBK, especialmente la triple terapia con fármacos anticalcineurínicos, MMF y esteroides5,6, pero casos de NAPBK también se han descrito con otros regímenes IS, lo que apunta a la intensidad de la IS más que a un fármaco específico como factor de riesgo, unido a factores determinantes del paciente (hombres >50 años, receptor seronegativo VBK), del injerto (donante seropositivo VBK, incompatibilidades HLA, lesión isquémica o inmunológica), y del virus (carga viral latente, serotipo de la cápside, capacidad replicativa)7.
DIAGNÓSTICO HISTOLÓGICO Y PROGRESIÓN DE LA NAPBK
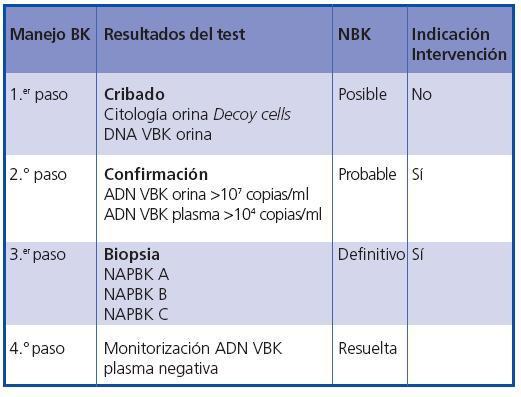
Las células decoy, viruria y viremia sólo indican replicación viral, no nefropatía, pero son herramientas clave para la prevención y monitorización de la enfermedad.
La única manifestación clínica de NAPBK es el deterioro de la función renal, y cuando esto ocurre ya es tarde para intervenir, porque se ha producido la lesión renal.
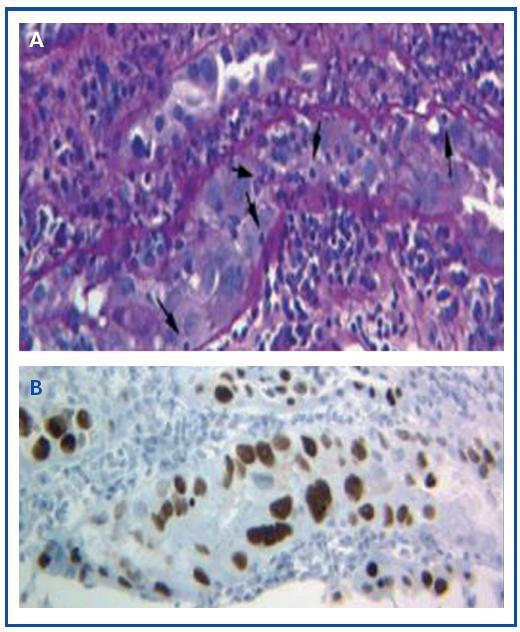
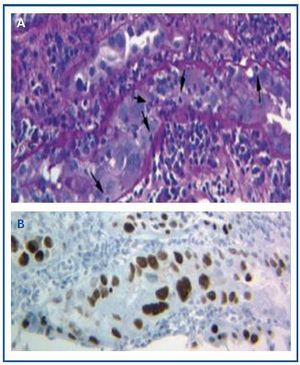
El diagnóstico de la enfermedad sólo puede hacerse mediante biopsia del injerto donde nos encontraremos las típicas inclusiones virales nucleares basofílicas en las células epiteliales (tubulares, cápsula de Bowman y/o urotelio), signos de inflamación con tubulitis (figura 1A), hallazgos similares a los que aparecen el rechazo agudo mediados por células T. Sólo mediante la técnica de inmunohistoquímica para el SV-40 AgLT podremos apreciar la tinción positiva nuclear e identificar al poliomavirus (BK, JC) como responsable de la inflamación, descartar el diagnóstico de rechazo agudo mediado por células T (figura 1B), y confirmar el diagnóstico de NAPBK.
Las lesiones histológicas de la NAPBK son focales y heterogéneas, por lo que una biopsia negativa no excluye el diagnóstico. Por tanto, está indicado repetirla si la carga viral en sangre permanece elevada de forma persistente.
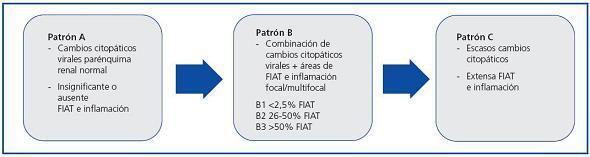
Los patrones histológicos de la NAPBK2,8,9 se basan en la identificación y extensión del infiltrado inflamatorio y de la fibrosis asociada a la infección viral, lo que permite establecer tres patrones histológicos (figura 2).
CURSO CLÍNICO Y OPORTUNIDADES PARA LA PREVENCIÓN Y EL DIAGNÓSTICO PRECOZ
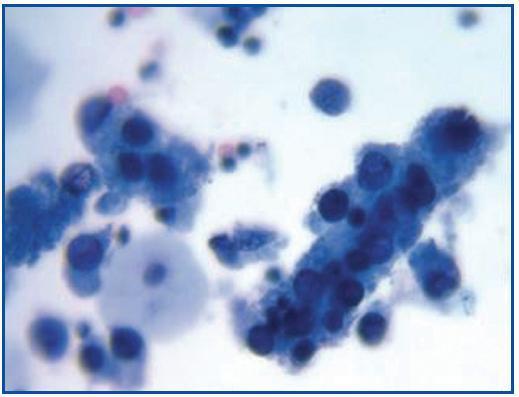
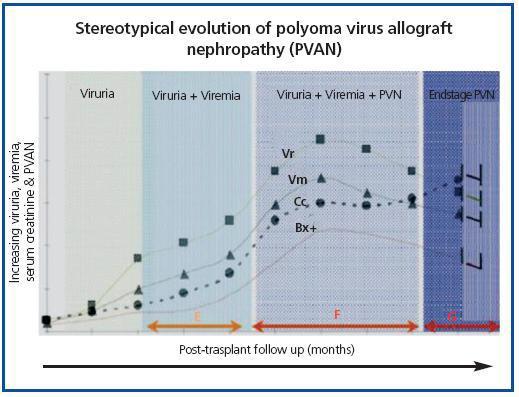
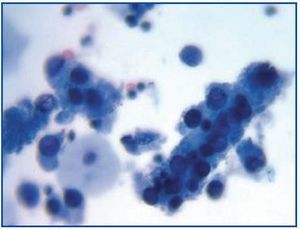
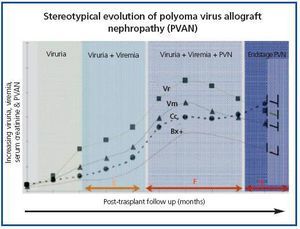
El curso clínico típico de la NAPBK9 representado en la figura 3, muestra cómo el desarrollo de la enfermedad se encuentra precedido por la aparición de viruria BK (Vr BK), reflejo de la reactivación viral y de la replicación en el tracto urinario, con la aparición de las típicas células decoy (células señuelo)(figura 4), fáciles de identificar mediante estudios rutinarios de citología de orina, aunque la cuantificación de la Vr mediante técnica de PCR es más sensible que la citología y permite distinguir entre infección por VBK y VJC.
Cuando la viruria es >105 copias/ml y persistente; semanas o meses después es seguida por el desarrollo de viremia (Vm) >107 copias/ml y, finalmente, NAPBK. La Vr BK no es diagnóstica de afectación del parénquima renal, sin embargo la aparición simultánea de Vm y Vr es patognomónica de afectación parenquimatosa renal (NAPBK), pero, además, la Vm mantenida o más típicamente que aumenta en semanas, es un factor predictivo del deterioro de la función renal y se correlaciona con la presencia y la gravedad de las lesiones histológicas. En pacientes con función renal normal o moderada disfunción renal, la probabilidad de encontrarnos con hallazgos histológicos de NAPBK es directamente proporcional a la duración y nivel de viremia. Viremias elevadas y mantenidas identifican a aquellos pacientes con replicación viral no controlada que conduce al daño renal.
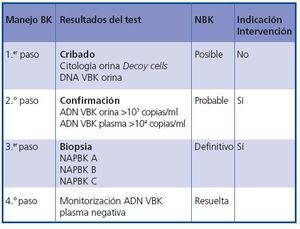
En conclusión, el diagnóstico e intervención precoz minimiza la lesión del injerto. Basándonos en los trabajos publicados una propuesta de algoritmo diagnóstico4,9 sería el de la figura 5.
TRATAMIENTO DE LA NAPBK
El mejor tratamiento de la NAPBK es el diagnóstico precoz de la enfermedad para intervenir antes de que se produzca la lesión renal.
Por este motivo, las Guías KDIGO10 sugieren la realización de cribado en todos los trasplantes renales mediante Vm mensual durante los primeros 3 meses (2D), trimestral hasta finalizar el primer año (2D), siempre que se produzca disfunción renal sin causa justificada (2D) y después del tratamiento de un episodio de rechazo agudo (2D). También sugieren reducción de la IS, cuando la Vm supera de forma persistente las 107 copias/ml (2D).
En lo que concierne a la pauta de reducción de IS, el primer paso consistiría en implementar el protocolo estándar (no mantener niveles del ACN ni antiproliferativo por encima del rango terapéutico), seguido por la determinación de viremia cada 4 semanas, descenso del ACN del 15-20%, descenso del MMF del 50% y/o supresión del MMF, y/o sustitución del TAC por CsA o un ISP11 (figura 6).
Respecto al tratamiento antiviral, cidofovir, leflunomida, quinolonas e inmunoglobulina i.v. han sido utilizados de forma empírica y su eficacia en la actualidad es difícil de determinar por haber sido administrados en combinación con reducción de IS y por la falta de estudios prospectivos controlados y aleatorizados.
Para finalizar, comentar el retrasplante renal en pacientes que han perdido un injerto por NAPBK. La recurrencia de la enfermedad en pequeñas series es del 12%. Las recomendaciones que deben tenerse en cuenta en esta situación son las siguientes: 1) informar al paciente del mayor riesgo potencial de recurrencia de la NAPBK; 2) confirmación pretrasplante de ausencia de replicación viral (PCR en sangre y orina en el momento de la inclusión en lista de espera y una vez incluido cada 6 meses), el paciente debe ser trasplantado con PCR en sangre negativa, y 3) adaptar la IS a esta patología12-14.
PUNTOS CLAVE
1. La potente y moderna inmunosupresión puede ser la responsable de la creciente prevalencia de esta infección.
2. La infección por virus BK en pacientes inmunocomprometidos puede afectar a la función y supervivencia del injerto renal.
3. El diagnóstico precoz mediante la monitorización estrecha del recuento de células señuelo en orina y/o viruria y viremia es crucial para evitar el impacto negativo de esta complicación.
4. No existen evidencias de un tratamiento específico efectivo de esta infección. Sólo la reducción de la inmunosupresión minimiza la virulencia de la misma.
Figura 1. Inclusiones virales nucleares basofílicas en las células epiteliales y tubulitis en la nefropatía por poliomavirus BK (A) e inmunohistoquímica para el antígeno SV-40 AgLT (B).
Figura 2. Patrones histológicos de la nefropatía por poliomavirus BK.
Figura 3. Células señuelo dispersas y cilindros celulares conteniendo células señuelo compactadas. Estos cilindros cuando aparecen son patognomónicos de afectación renal.
Figura 4. Fases evolutivas de la nefropatía por poliomavirus BK.
Figura 5. Algoritmo diagnóstico NAPBK.
Figura 6. Algoritmo terapéutico NAPBK.