Durante siglos, el riñón se ha considerado principalmente un órgano de eliminación y un regulador de la sal y del equilibrio iónico. A pesar de que una vez se pensó que era la causa estructural de la diabetes, y que en los últimos años ha sido ignorado como regulador de la homeostasis de la glucosa, actualmente es reconocido como un actor importante en el ámbito de la regulación del metabolismo glucídico. Durante el ayuno, el 55% de la glucosa proviene de la gluconeogénesis. Sólo 2 órganos tienen esta capacidad: el hígado y el riñón. Este último es responsable del 20% de la producción total de glucosa y del 40% de la producida por la gluconeogénesis. Hoy en día tenemos una mejor comprensión de la fisiología del transporte de glucosa renal a través de transportadores específicos, como el cotransportador sodio-glucosa tipo 2 (SGLT2 por sus siglas en inglés: Sodium Glucose Cotransporter). Un compuesto natural, floricina, se aisló a principios de 1800 y durante décadas desempeñó un papel importante en la diabetes y la investigación de la fisiología renal. Finalmente, en el nexo de estos descubrimientos antes mencionados, se reconoció el efecto de compuestos floricina-like en los transportadores de glucosa renal, lo que ha ofrecido un nuevo mecanismo para el tratamiento de la hiperglucemia. Esto ha llevado al desarrollo de varias modalidades terapéuticas potencialmente eficaces para el tratamiento de la diabetes.
For centuries, the kidney has been considered primarily an organ of elimination and a regulator of salt and ion balance. Although once thought that the kidney was the structural cause of diabetes, which in recent years has been ignored as a regulator of glucose homeostasis, is now recognized as a major player in the field of metabolic regulation carbohydrate. During fasting, 55% of the glucose comes from gluconeogenesis. Only 2 organs have this capability: the liver and kidney. The latter is responsible for 20% of total glucose production and 40% of that produced by gluconeogenesis. Today we have a better understanding of the physiology of renal glucose transport via specific transporters, such as type 2 sodium-glucose cotransporter (SGLT2). A natural compound, phlorizin, was isolated in early 1800 and for decades played an important role in diabetes and renal physiology research. Finally, at the nexus of these findings mentioned above, recognized the effect of phlorizin-like compounds in the renal glucose transporter, which has offered a new mechanism to treat hyperglycemia. This has led to the development of several potentially effective treatment modalities for the treatment of diabetes.
INTRODUCCIÓN
En el año 2009, De Fronzo1 describía la rápida evolución del conocimiento de las diversas vías fisiopatológicas relacionadas con el desarrollo de la diabetes.
Este hecho lo resumía explicando que se había pasado del triunvirato al octeto ominoso, haciendo referencia al papel relevante que parecían tener en la alteración hidrocarbonada el riñón2-4 (por aumento de la reabsorción de glucosa), el intestino delgado y las células alfa (por disminución del efecto incretina y el aumento de la producción de glucagón) y la disfunción de neurotransmisores en el sistema nervioso central, asociado a los componentes clásicos de la insulinorresistencia (disminución de la producción de insulina, aumento de la producción hepática de glucosa, disminución de la captación de glucosa por el músculo esquelético y aumento de la lipólisis).
EL RIÑÓN Y LA HOMEOSTASIS DE LA GLUCOSA
El riñón, históricamente, no ha sido considerado como uno de los principales órganos responsables de la homeostasis de la glucosa. Sin embargo, ahora entendemos que desempeña un papel importante en la homeostasis de la glucosa de dos formas: 1) la gluconeogénesis, y 2) la filtración glomerular y la reabsorción de la glucosa en los túbulos contorneados proximales.
Con una mayor comprensión de los mecanismos renales responsables de la homeostasis de la glucosa y con las probabilidades de manipular ese sistema, el riñón desempeña un papel clave en el tratamiento de la hiperglucemia.
La filtración y la reabsorción de la glucosa
Los glomérulos de un adulto sano filtran aproximadamente 180 g de glucosa cada día5. En circunstancias normales, casi toda esta glucosa se reabsorbe y <1% se excreta en la orina6. La reabsorción de glucosa a partir de los túbulos es un proceso de múltiples pasos con participación de varios mecanismos de transporte. La glucosa, una vez filtrada en el túbulo, deberá ser transportada fuera del mismo, a través de las células epiteliales tubulares, y después, a través de la membrana basolateral, hacia el capilar peritubular. Bajo condiciones óptimas, cuando la carga de glucosa tubular es de aproximadamente 120 mg/min o menos, no se pierde la glucosa en la orina. Sin embargo, cuando la carga de glucosa excede aproximadamente los 220 mg/min (el denominado «umbral de glucosa»), la glucosa comienza a aparecer en la orina.
El valor de glucosa en sangre necesario para proporcionar dicha carga tubular no es un valor establecido en los seres humanos, sino que es un rango. Un estudio de evaluación de este proceso comunicó que la concentración de glucosa en sangre necesaria para superar el umbral de la glucosa tubular osciló entre 130 y 300 mg/dl7. Además, el estudio encontró una relación entre la edad y un aumento en los niveles del umbral.
El 90% de la glucosa filtrada se reabsorbe por la alta capacidad del transportador SGLT2 en el segmento contorneado del túbulo proximal, y el 10% restante de la glucosa filtrada se reabsorbe por el transportador SGLT1 en el segmento recto del túbulo proximal descendente2. El resultado es que no aparece glucosa en la orina.
En modelos animales de diabetes tipo 1 y diabetes tipo 2, la capacidad renal máxima de reabsorción tubular (Tm) de la glucosa es mayor8. En personas con diabetes tipo 1, Mogensen et al.9 han demostrado que la Tm de la glucosa está incrementada. En los pacientes con diabetes tipo 2 se han publicado resultados contradictorios.
Clínicamente, la causa más frecuente de glucosuria es la diabetes. Por tanto, los pacientes no excretan glucosa en la orina hasta que su concentración de glucosa en la sangre es superior a 180 mg/dl, lo que no ocurre normalmente en los individuos sin diabetes.
Papel del transportador SGLT2
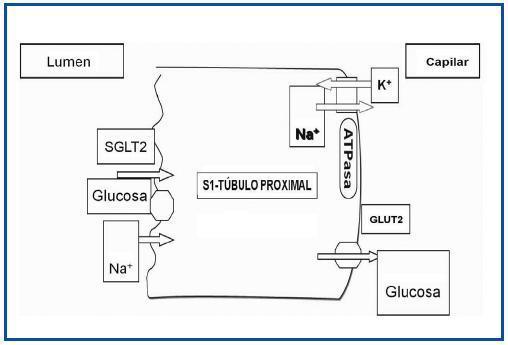
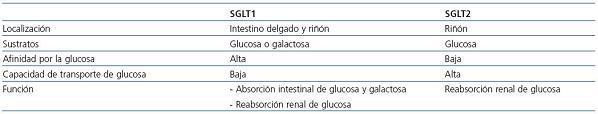
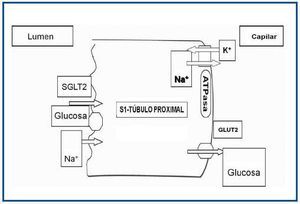
El primer paso en la reabsorción de la glucosa de la orina implica el transporte de glucosa desde los túbulos a los capilares peritubulares a través de las células epiteliales tubulares10. Esto se logra con la familia de cotransportadores sodio-glucosa (SGLT) (figura 1). Los SGLT incluyen una gran variedad de proteínas de membrana que actúan en el transporte de glucosa, aminoácidos, vitaminas, iones y osmolitos a través de la membrana del borde «en cepillo» de los túbulos renales proximales, así como el epitelio intestinal11. SGLT1 es un transportador de baja capacidad y de alta afinidad. Se encuentra principalmente en el tracto gastrointestinal, pero también se puede encontrar en el segmento S3 del túbulo proximal renal. Aunque SGLT1 es el transportador clave de la absorción de glucosa en el tracto gastrointestinal, su impacto en el riñón es menos importante; representa alrededor del 10% de la reabsorción de la glucosa.
Esto ha sido de algún interés farmacológico porque el bloqueo de este transportador, teóricamente, atenúa la absorción gastrointestinal de glucosa y podría ofrecer un método para inducir la pérdida de peso o reducir la hiperglucemia posprandial.
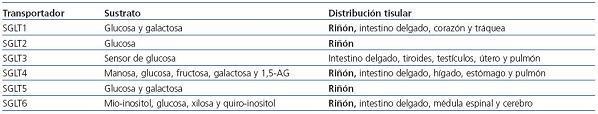
Por el contrario, SGLT2 es un transportador de gran capacidad y de baja afinidad, y se encuentra principalmente en el riñón. En la tabla 1 se comparan los transportadores SGLT1 y SGLT2.
Un tercer miembro de esta familia, SGLT3, se encuentra ampliamente en el músculo esquelético y el sistema nervioso. Se cree que SGLT3 no es un transportador de glucosa, sino que actúa como sensor12.
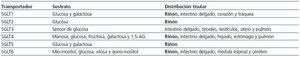
Aunque se han identificado otros miembros de esta familia (SGLT4, SGLT5 y SGLT6), su función en humanos se desconoce en estos momentos (tabla 2). El SGLT de mayor prevalencia e importancia funcional en el riñón es SGLT2. Esto explica por qué este transportador, que se encarga del 90% de la reabsorción de la glucosa en el riñón, se ha convertido en centro de gran interés en el ámbito de la diabetes.
Este transportador se encuentra en una densidad relativamente alta en el segmento S1 (el segmento inicial) del túbulo proximal. SGLT2 transporta glucosa aprovechando el gradiente de energía de la reabsorción de sodio en el filtrado tubular. Este proceso recibe el nombre de transporte activo secundario y es impulsado por el gradiente electroquímico de sodio en el filtrado tubular.
GLUCOSURIA RENAL FAMILIAR: MODELO DE INHIBICIÓN DEL TRANSPORTADOR SGLT2
La glucosuria renal familiar es una condición genética que ha servido de modelo para observar los efectos de la inhibición del transportador SGLT2. Los pacientes con esta condición están asintomáticos, a pesar de presentar en la mayoría de los casos mutación del gen SLC5A2 (por las siglas en inglés de solute carrier family 5A), encargado de la codificación de la proteína transportadora SGLT2. Se han comunicado patrones de herencia autosómica dominante y recesiva. Como resultado de esta mutación, los pacientes con glucosuria renal familiar excretan más de 100 g de glucosa en orina de 24 horas.
Santer et al.13 realizaron un estudio genético en 23 familias con diagnóstico de glucosuria renal familiar, encontrado 21 mutaciones diferentes del gen SLC5A2; 14 de las 21 familias eran homocigotas y presentaban glucosurias comprendidas entre 15 y 200 g/día. Los heterocigotos presentaban glucosurias menores de 4,4 g/día, e incluso algunos no las presentaban.
En dos familias con diagnóstico de glucosuria renal familiar no se encontró mutación del gen SLC5A, aunque podrían presentar mutaciones de los genes que codifican GLUT2 (transportador de glucosa tipo 2), HNF-1α (factor hepático nuclear 1 alfa) que regula la transcripción de SGLT2, o de los genes relacionados con SGLT1 o SGLT3.
Salvo la glucosuria, no se observan otras patologías asociadas. La glucosa plasmática puede estar alta o baja, y el volumen sanguíneo permanece esencialmente normal debido a la reabsorción de sodio a través de otros canales transportadores. La función renal y vesical continúa siendo normal, y este grupo de pacientes no presenta incremento en la incidencia de diabetes, enfermedad renal o infecciones del tracto urinario, en comparación con la población general14.
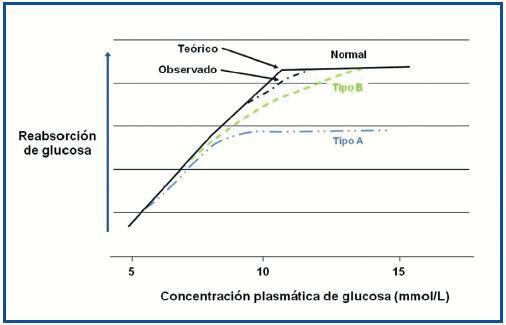
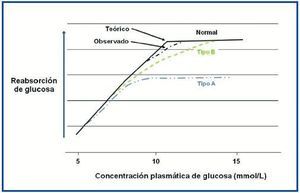
En la figura 2 se expone un esquema de la reabsorción de glucosa en individuos normales y en pacientes con glucosuria renal familiar. Como se ha mencionado previamente, la capacidad renal máxima de reabsorción tubular (Tm) de glucosa es un rango variable, aunque para estudios fisiológicos (teórico, línea negra continua) se sitúa en torno a 198 mg/dl (11 mmol/l), y el Tm de glucosa observado suele estar por debajo de esta cifra (línea negra discontinua), y se satura con concentraciones de glucosa cercanas a 180 mg/dl (10 mmol/l)15.
La glucosuria renal familiar puede clasificarse en dos tipos13. La tipo A, en la que la Tm de glucosa es menor que los individuos normales (línea azul). Estos pacientes presnetan una disminución de la actividad del transportador SGLT2, así como una glucosuria más importante.
En la glucosuria renal familiar tipo B, el transportador SGLT2 no tiene afinidad por la glucosa, lo que resulta en una disminución de la tasa de reabsorción de glucosa, aunque con una Tm de glucosa normal (línea verde).
DIABETES MELLITUS TIPO 2 Y EL TRANSPORTADOR SGLT2
La diabetes mellitus tipo 2 se asocia con incremento de la expresión y actividad de SGLT2.
En un estudio16 realizado para analizar el transportador SGLT2 se utilizaron células epiteliales tubulares proximales humanas exfoliadas (HEPTC, por sus siglas en inglés: Human exfoliated proximal tubular epithelial cells), que se obtuvieron de muestras de orina. Se aislaron HEPTC de individuos sanos y de pacientes diabéticos, y fueron cultivadas en un ambiente hiperglucémico.
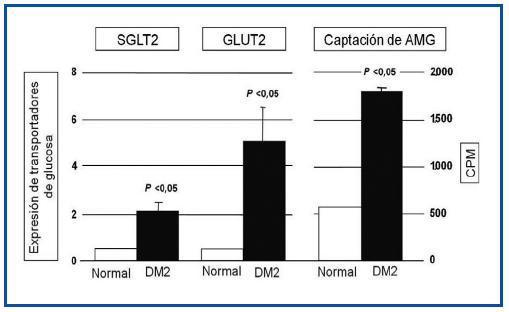
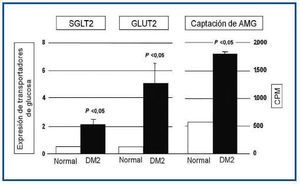
Como se observa en la figura 3, las HEPTC de pacientes diabéticos presentaron mayor expresión de SGLT2 y GLUT2 en comparación con los individuos no diabéticos, siendo esta diferencia estadísticamente significativa. También determinaron la captación renal de glucosa utilizando metil-α-D-[U14C]-glucopiranosido (AMG), que es un análogo de glucosa. También se observó una mayor captación de glucosa en las HEPTC de pacientes diabéticos que en individuos sin diabetes.
Estos hallazgos indican que el sistema renal es una parte importante en el balance energético corporal mediante la regulación de la absorción de glucosa, y que en los pacientes diabéticos parece existir una mala adaptación a este mecanismo. En la diabetes, la reabsorción de glucosa puede estar aumentada en términos absolutos por un incremento de la Tm de glucosa.
INHIBIDORES DEL TRANSPORTADOR SGLT2 PARA EL TRATAMIENTO DE LA DIABETES MELLITUS TIPO 2
En 1835, químicos franceses aislaron una sustancia, la florizina, de las raíces de los manzanos. Aunque se creyó que la florizina era un compuesto para tratar la fiebre, las enfermedades infecciosas y la malaria, no fue hasta 50 años después de su descubrimiento que se encontró que altas dosis de florizina causaban glucosuria17.
Durante varias décadas, la florizina fue utilizada para la valoración de la fisiología renal. Fue en 1970 cuando se descubrió que la glucosuria inducida por la florizina se debía a que inhibía un sistema activo de transporte responsable de la reabsorción tubular de glucosa. Entre 1980 y 1990 se identifica el transportador SGLT2, y se comienza a perfilar la inhibición de este transportador como tratamiento de la diabetes mellitus tipo 2. Por tanto, la florizina ha sido el primer inhibidor conocido de SGLT2.
Sin embargo, la florizina no pudo utilizarse como tratamiento de la diabetes mellitus tipo 2 por varias razones. En primer lugar, porque la absorción intestinal es muy pobre, y en segundo, porque no es un inhibidor selectivo de SGLT2, ya que también es capaz de inhibir SGLT1, causando en la mayoría de los casos diarrea osmótica.
La inhibición de SGLT2 puede reducir los niveles de glucosa plasmática al disminuir el Tm de la glucosa, lo que se traduce en aumento de la excreción urinaria de glucosa.
En animales no diabéticos, la inhibición de SGLT2 no posee efecto en la glucemia plasmática, porque se incrementa la producción hepática de glucosa para compensar la glucosuria. Sin embargo, en animales diabéticos la administración de inhibidores de SGLT2 produce glucosuria dosis-dependiente y una significativa reducción de la glucosa plasmática.
En esencia, la inhibición de SGLT2 «resetea» la mala adaptación del riñón diabético, al disminuir la afinidad del transportador y aumentar la glucosuria, lo que disminuye la glucemia y, por tanto, la glucotoxicidad18.
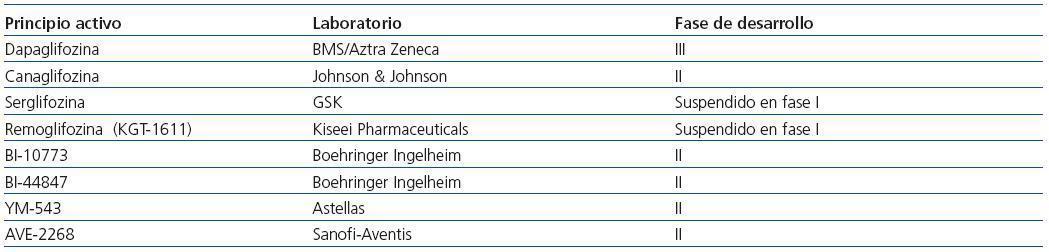
Actualmente se han desarrollado fármacos análogos de florizina que son selectivos para SGLT2 y con una mejor absorción intestinal. En la tabla 3 se exponen algunos fármacos de este grupo, que incluye a dapaglifozina y a canaglifozina, que actualmente se encuentran en ensayos clínicos de fase III.
Además, al menos un laboratorio está desarrollando una molécula para reducir la expresión de SGLT2, y se encuentra en ensayos clínicos de fase 119. Esta molécula es ISIS-388626. Este compuesto es un oligonucleótido que disminuye la transcripción del gen que codifica el transportador SGLT2. En modelos murinos y caninos, el tratamiento con ISIS-388626 reduce el ARNm (ácido ribonucleico mensajero) de SGLT2 en un 80%, sin demostrar alteración de SGLT1, por lo que es altamente selectivo. Se observó una importante reducción de la glucemia en ayunas, de la glucemia posprandial y de la HbA1c (hemoglobina glicada) en modelos animales, sin que se hayan observado cambios en las concentraciones de electrólitos plasmáticos y urinarios20.
De los inhibidores de SGLT2, el más desarrollado es dapaglifozina.
La dapaglifozina se absorbe rápidamente después de la administración oral en pacientes con diabetes mellitus tipo 2, en un tiempo promedio de 1 hora (0,5-4,0 h). Un estudio de fase I en voluntarios sanos sugirió que la absorción es más lenta cuando se administra junto con comidas, aunque esta diferencia fue mínima21. La vida media de dapaglifozina es de aproximadamente 16 horas. La glucosuria es dosis-dependiente.
El aclaramiento renal de dapaglifozina es mínimo (3-6 ml/min) y su excreción renal es baja (menos de 2,5% en orina de 24 h). Estudios in vitro han sugerido que dapaglifozina se metaboliza por inactivación metabólica por la vía de la enzima glucuroniltransferasa22.
Dapaglifozina ha demostrado tener un efecto hipoglucemiante a dosis de 2,5, 5, 10, 20 y 50 mg diarios en ensayos clínicos de fase II. La mayoría de los ensayos clínicos en fase III que están en curso evalúan los efectos de dosis diarias de 2,5, 5 y 10 mg.
El diseño del estudio de fase II para dapaglifozina fue aleatorizado, doble ciego, controlado con placebo, para valorar los efectos dosis-dependientes de dapaglifozina en pacientes con diabetes mellitus tipo 2. Un total de 389 pacientes diabéticos tipo 2 sin tratamiento y con HbA1c mayor del7% fueron aleatoriamente asignados a un grupo tratado con placebo o a un grupo tratado con dosis crecientes de dapaglifozina, durante 12 semanas23. Metformina XR (fórmula de liberación prolongada) fue el comparador activo, aunque no se realizaron comparaciones estadísticas. Se valoraron: glucemias en ayunas, glucemia posprandial utilizando la sobrecarga oral de glucosa prolongada (3 h) y HbA1c.
Los valores basales de HbA1c estuvieron comprendidos entre el 7,7% y 8,0% en todos los grupos. En el grupo con dapaglifozina la reducción de HbA1c estuvo en torno a –0,8%, mientras que en el grupo con placebo fue de –0,2 % (p <0,01). Los pacientes con dapaglifozina presentaron glucosurias comprendidas entre 52 y 85 g/día, con una reducción en la glucemia en ayunas entre 16 y 30 mg/dl. También se observó pérdida de peso en el grupo tratado con dapaglifozina de 2,2 a 3,2 kg, que significó una pérdida de peso promedio entre el 2,5 y el 3,4%. También se detectó un incremento del volumen urinario de 107 a 470 ml/día.
En cuanto a efectos adversos, se observó un discreto aumento en la incidencia de infecciones del tracto urinario, aunque esta diferencia no fue estadísticamente significativa. No hubo diferencias en la frecuencia de episodios de hipoglucemias e hipotensión entre los grupos del estudio.
La dapaglifozina está actualmente en fases avanzadas de desarrollo para uso en monoterapia o en combinación con otros agentes hipoglucemiantes. El fármaco ha sido bien tolerado en fases iniciales, siendo los efectos adversos más frecuentes: infecciones del tracto urinario, mareos, cefalea, fatiga, lumbalgia y nasofaringitis24. Los estudios de fase III de dapaglifozina incluyen: monoterapia en pacientes con diabetes mellitus tipo 2 que no se controlan con dieta y ejercicio, así como tratamiento combinado con metformina, sulfonilureas, tiazolidindionas o insulina25-29.
Los inhibidores de SGLT2 son un grupo novedoso de fármacos que parecen aportar varias ventajas en el tratamiento de la diabetes mellitus tipo 2:
1. Peso. Los inhibidores de SGLT2 promueven la pérdida de peso al incrementar la glucosuria (1 g de glucosa equivale a 4 kcal), lo que disminuye los niveles plasmáticos de glucosa y estimula la lipólisis.
2. Corrige un mecanismo alterado en la diabetes mellitus tipo 2. En los pacientes diabéticos se ha demostrado que existe un aumento en la reabsorción tubular de glucosa.
3. Efectos adversos. La hipoglucemia habitualmente es una barrera a la hora de plantear estrategias de control glucémico óptimo. Como la inhibición de SGLT2 es completamente independiente de la secreción de insulina, no hay aumento del riesgo de hipoglucemia.
4. Tratamiento de la hiperglucemia. El mecanismo único de los inhibidores de SGLT2 hace que probablemente sean un complemento de otras terapias hipoglucemiantes.
Las mayores preocupaciones sobre la inhibición de SGLT2 son el riesgo de infecciones del tracto urinario, la depleción del volumen intravascular secundario a la diuresis osmótica, el desequilibrio hidroelectrolítico, la nefrotoxicidad debido a la acumulación de productos finales de la glucosilación avanzada, la nicturia y la interacción farmacológica. Se requieren estudios a largo plazo que respondan a estas consideraciones, aunque con la evidencia obtenida hasta este momento existen datos suficientes para considerar a los inhibidores de SGLT2 como fármacos seguros.
Los inhibidores de SGLT2 podrían no ser efectivos en pacientes con insuficiencia renal debido a la reducción de la tasa de filtración glomerular, aunque actualmente está en investigación. Se están realizando estudios para identificar el punto de corte de la tasa de filtración glomerular en el que los inhibidores de SGLT2 pueden estar contraindicados.
CONCLUSIÓN
La inhibición del transportador de glucosa SGLT2 supone un nuevo abordaje terapéutico de la diabetes mellitus tipo 2. Estudios en modelos experimentales de diabetes han demostrado que la inducción de glucosuria revierte la glucotoxicidad, restaura la normoglucemia, y mejora el funcionamiento de la célula beta y la sensibilidad a la insulina.
El hecho de que existan mutaciones genéticas del transportador de glucosa SGLT2, como ocurre en la glucosuria renal familiar, apoya la seguridad a largo plazo de la inhibición de este transportador en humanos. Resultados preliminares con dapaglifozina aportan evidencias en cuanto a la eficacia de los inhibidores de SGLT2 en la reducción de la glucemia en ayunas y de la glucemia posprandial, así como del descenso de HbA1c en pacientes diabéticos.
La comprensión de la fisiopatología de la diabetes tipo 2 es un proceso dinámico. Cuando surgen nuevos conceptos fisiopatológicos, también surgen potenciales herramientas terapéuticas. El tratamiento óptimo de la diabetes mellitus tipo 2 requiere un abordaje múltiple de los distintos defectos en la homeostasis de la glucosa.
CONCEPTOS CLAVE
1. El 55% de la producción de glucosa proviene de la gluconeogénesis. El riñón es responsable del 40% de la glucosa producida a través de la gluconeogénesis, lo que equivale al 20% de la producción total de glucosa.
2. En el riñón, el transportador principal de la reabsorción tubular de glucosa es SGLT2.
3. En la glucosuria renal familiar existe una mutación del gen SCL5A2, que codifica a SGLT2. En estos pacientes no hay incremento en la incidencia de diabetes o de enfermedad renal. El único hallazgo es glucosuria asintomática en la mayoría de los casos.
4. En los pacientes diabéticos se ha observado un incremento en la actividad transportadora de SGLT2, lo que se traduce en un aumento de la reabsorción tubular de glucosa.
5. Los inhibidores de SGLT2 se perfilan como tratamiento de la diabetes mellitus tipo 2, al inducir glucosuria y, por tanto, la disminución de la glucemia plasmática y de la glucotoxicidad.
Figura 1. Mecanismo de acción de SGLT2.
Figura 2. Comparación de la capacidad máxima de reabsorción tubular (Tm) de glucosa.
Figura 3. Comparación de transportadores tubulares de glucosa en diabéticos y no diabéticos.
Tabla 1. Comparación de los transportadores SGLT1 y SGLT2
Tabla 2. Familia de cotransportadores sodio-glucosa
Tabla 3. Fármacos inhibidores del transportador SGLT2 y fase de desarrollo