La nefritis lúpica (NL) es una de las manifestaciones más frecuentes del lupus eritematoso sistémico (LES) y afecta aproximadamente al 40% de los pacientes. La afectación renal representa un importante factor de riesgo de morbilidad y mortalidad, y el 10% de los pacientes con NL desarrollarán una enfermedad renal crónica (ERC) avanzada durante su seguimiento1. Durante las últimas décadas hemos vivido la dualidad del tratamiento en la terapia secuencial entre la ciclofosfamida intravenosa y el micofenolato acompañado de glucocorticoides2. Sin embargo, la fotografía final con esta estrategia terapéutica era unas tasas de remisión completa entre un 20-30%, un 20-35% de recidivas entre los tres a cinco años, un elevado porcentaje de efectos secundarios a los fármacos empleados originando una gran carga de daño acumulado que se traducía en una gran morbilidad y una disminución de la calidad de vida de los pacientes3. Durante los últimos años, la llegada de nuevos fármacos dirigidos a diversas dianas terapéuticas específicas junto a la aparición de diferentes guías americanas y europeas en el manejo del lupus y de la NL han supuesto una gran revolución alcanzando un mayor porcentaje de remisión, disminuyendo la dosis de glucocorticoides empleadas y mejorando la calidad de vida de los pacientes4–7.
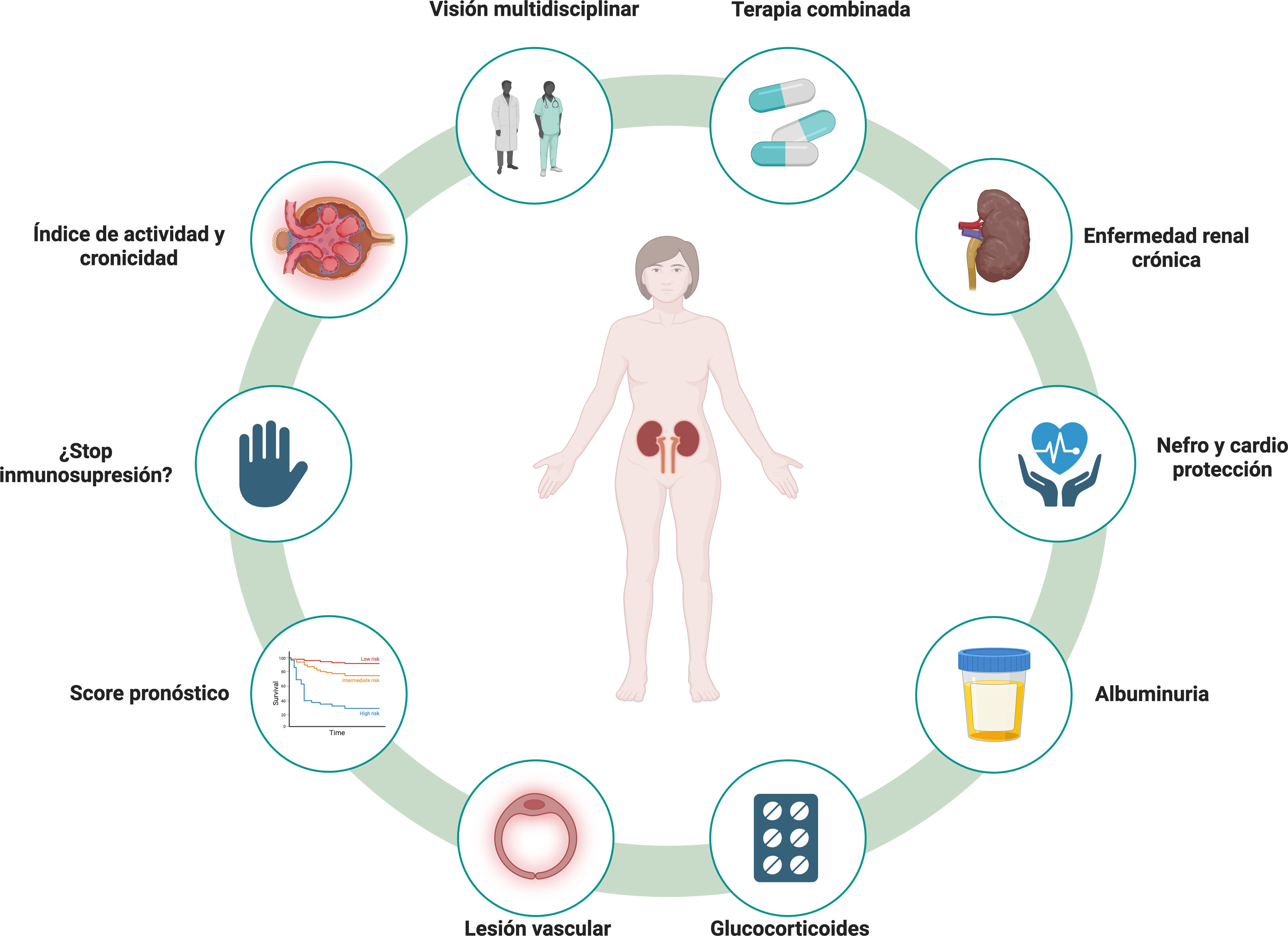
Sin embargo, esta nueva perspectiva del lupus y de la NL ha generado nuevas cuestiones pendientes de resolver y que merecen una especial atención (fig. 1):
- 1)
Una visión multidisciplinar del lupus: rompiendo barreras entre especialidades
En estos últimos años ha dado un gran paso la visión integral del paciente con lupus. Esta nueva situación ha supuesto que diferentes especialistas consideren al paciente con lupus dentro de un proceso asistencial con diferentes manifestaciones y al que se debe dar una respuesta homogénea en el planteamiento diagnóstico y la decisión terapéutica8. Esta visión holística de la enfermedad supone que el planteamiento ante el paciente lúpico sea claramente distinto buscando objetivos específicos como prevenir el daño acumulado, evitar las recidivas, cuestionarse las diferentes comorbilidades (enfermedad cardiovascular, osteoporosis, prevención de infecciones, screening de neoplasias, etc.), manejar las posibles complicaciones del embarazo. Para conseguir todos estos objetivos, necesitamos intensificar estrategias enfocadas a un estilo de vida más saludable y seleccionar tratamientos inmunosupresores más personalizados con un menor número de efectos secundarios dentro de una estrategia importada del mundo reumatológico conocida como «treat to target»9.
- 2)
De terapias secuenciales a terapias combinadas
Continuamos utilizando una nomenclatura importada del mundo de la Oncología, y hablamos de tratamiento de inducción y de mantenimiento para las enfermedades autoinmunes. Siempre nos ha llamado la atención, el uso de un mismo fármaco inmunosupresor (ciclofosfamida según la pauta del National Institutes of Health (NIH) o micofenolato mofetil o derivados del ácido micofenólico) para el uso de estas terapias secuenciales (inicio y mantenimiento). Durante los últimos años, los diferentes ensayos clínicos en el mundo de la NL (BLISS-LN [Efficacy and Safety of Belimumab in Adult Patients with Active Lupus Nephritis], AURORA [Aurinia Renal Response in Active Lupus With Voclosporin] y NOBILITY [A Study to Evaluate the Safety and Efficacy of Obinutuzumab Compared With Placebo in Participants With Lupus Nephritis]) nos han demostrado que desde el inicio la combinación de varios fármacos con diferentes dianas de acción nos permitiría hablar de una «terapia multitarget» según las características clínicas, inmunológicas e histológicas del paciente con NL10–12.
En este sentido quizás sería más recomendable hablar de terapias combinadas como aproximación a nuestra estrategia terapéutica y por fin podamos desterrar este tipo de nomenclatura que pueden conducir al error en el cumplimiento de los objetivos del tratamiento de la NL3.
- 3)
Enfermedad renal crónica: la gran olvidada
Parece que seguimos enfocando nuestro pensamiento en que la presencia de ERC está ligada exclusivamente a la cuantía del filtrado glomerular renal (filtrado glomerular renal [FGR] <60mL/min/1,73 m2). Sin embargo, los nefrólogos sabemos desde hace tiempo, que este es un concepto erróneo y queda reforzado por las recientes guías KDIGO (Kidney Disease: Improving Global Outcomes) sobre ERC13. La definición de ERC es obviamente más amplia. Debemos incluir en la definición de la ERC aquellos pacientes que presenten alguna de las siguientes opciones durante al menos tres meses: una cuantía de albuminuria superior a un cociente albúmina/creatinina>30mg/g, una hematuria persistente, lesiones descritas en la histología renal, y/o anormalidades estructurales detectadas por imagen. Creemos que en el caso del paciente con NL cumple sobradamente alguno de estos criterios, por lo que deberíamos empezar a decir que nuestros pacientes con NL tienen ERC y enfocar nuestras estrategias terapéuticas a la prevención y la nefro y cardio-protección. Rojas-Rivera et al., en un artículo muy evocador publicado recientemente, resaltan e insisten en este concepto de la NL como ERC, olvidado por las diferentes guías europeas y americanas, pero que tiene una gran repercusión en la salud cardiovascular de los pacientes con LES14.
- 4)
Remisión completa, pero ¿dónde dejamos la albuminuria?
Cuando nos referimos a la remisión completa en la NL hablamos de una cuantía de proteinuria ≤ 0,5g/24 horas o un cociente urinario proteína/creatinina ≤ 0,5g/g, un sedimento urinario inactivo (≤5 hematíes/campo), una albúmina sérica ≥3,5g/dL y un FGR normal o ≤ 10% inferior al existente antes del brote7. Sin embargo, nos surge una cuestión en el paciente con NL y en remisión clínica completa, ¿qué estrategia debemos plantear en un paciente con proteinuria <0,5g/24 horas, pero con una albuminuria patológica? Esta pregunta está pendiente de resolver en el mundo de las enfermedades autoinmunes. Todos tendríamos claro que un paciente diabético con una albuminuria patológica claramente es un factor que multiplica el riesgo cardiovascular en ese paciente y, por lo tanto, intensificaríamos el tratamiento nefroprotector13, sin embargo, en las diferentes guías de NL no se hace ninguna mención a este aspecto. Los pacientes con LES y más aún con una NL son pacientes con alto riesgo cardiovascular y con un presumible envejecimiento vascular acelerado, motivo por el cual, deberíamos replantearnos nuestra estrategia terapéutica en ellos y mirar a la cuantía de la albuminuria para intensificar nuestro tratamiento nefro y cardioprotector14,15.
- 5)
De las clases histológicas a los índices de actividad y cronicidad
Según las recientes guías y recomendaciones (EULAR [The European Alliance of Associations for Rheumatology], KDIGO, GLOSEN [Grupo de Enfermedades Glomerulares de la Sociedad Española de Nefrología]) continuamos enfocando nuestro tratamiento inmunosupresor según la clase histológica de la NL16. Sin embargo, hoy en día disponemos de una mayor y mejor descripción de la histología renal (índices de actividad y cronicidad) que pueden orientar nuestro tratamiento. Este tipo de índices pueden permitirnos dirigir nuestra estrategia terapéutica, seleccionando una inmunosupresión específica o enfocarlo más hacia la nefroprotección. Una reciente publicación, nos hace pensar en esta posibilidad de enfocar nuestro tratamiento personalizado en la NL en la que podamos combinar el índice de actividad (IA) y el índice de cronicidad (IC) junto a la cuantía de la proteinuria, y la actividad inmunológica del paciente con LES. Esta opción, nos permitiría tener una visión integral del paciente y elegir entre nuestras opciones terapéuticas17.
- 6)
¿Dónde quedó la lesión vascular en las biopsias renales?
Está claro que hemos mejorado en la descripción de las biopsias renales después de la nueva clasificación del 2018, pero todavía existen áreas grises pendientes de aclarar, y una de ellas es la lesión vascular18. Ya hace más de una década, un grupo asiático demostraba que la lesión vascular era relativamente frecuente en las biopsias de pacientes con NL y su tipología guardaba una estrecha relación con la evolución de la función renal19. Nuestra experiencia con rebiopsias renales en pacientes con NL, la lesión vascular, más que el cambio de clase histológica era uno de los factores de riesgo más importantes para el desarrollo de la ERC20. En otras patologías sistémicas, como la diabetes mellitus, el daño vascular supone un factor de riesgo en el desarrollo de la ERC tan importante como la lesión glomerular21. Por esta razón, debemos solicitar la inclusión en el informe de las biopsias renales, de descripción de las lesiones vasculares. Este tipo de lesión es la carta de presentación de la futura evolución de la función renal y de los posibles eventos cardiovasculares de nuestros pacientes con NL y su envejecimiento vascular prematuro. Un aspecto crucial es la investigación enfocada a los diferentes mecanismos celulares y moleculares implicados en la senescencia acelerada que se observa en pacientes con ERC. Ampliar nuestro conocimiento en el papel de los factores y moléculas implicados en la senescencia acelerada nos permitirá un mejorar los métodos diagnósticos y de seguimiento y nos servirá para identificar posibles dianas terapéuticas asociadas a este proceso22.
- 7)
Ausencia de un score pronóstico en la NL
En la actualidad, no disponemos de nuevos biomarcadores que establezcan el pronóstico renal de los pacientes con NL. En la mayoría de los estudios se utilizan marcadores clínicos, renales e histológicos clásicos. Revisiones sistemáticas destacan la gran heterogeneidad de los estudios en la definición de los resultados renales, lo que complica la estratificación del riesgo en estos pacientes23. Necesitamos, en los próximos años, desarrollar índices pronósticos de la evolución de la función renal que combinen factores demográficos, clínicos, analíticos e histológicos fáciles de aplicar en la práctica clínica habitual y que se conviertan en una herramienta diagnóstica y de personalización del tratamiento24. Por otro lado, por qué no plantear un sistema de puntuación en la clasificación histológica similar al de la nefropatía IgA (NIgA) que permitiera pronosticar la evolución de la función renal en los pacientes con NL. Aunque no estaría exenta de importantes limitaciones y sesgos, debido a que la NL es una enfermedad más agresiva que la NIgA, y cualquier estudio de resultados basado en los hallazgos iniciales de la biopsia se vería necesariamente influido por el tratamiento, podría ser una forma original de mirar los resultados histológicos25.
- 8)
Suspensión de glucocorticoides, mito o realidad
Aunque con ciertas reticencias parece que estamos preparados para un mundo de enfermedades autoinmunes sin esteroides. Existen pocas experiencias en la suspensión de glucocorticoides en pacientes con LES y/o NL. Un estudio reciente de un grupo francés con importantes limitaciones metodológicas (estudio unicéntrico, ningún fármaco biológico entre los inmunosupresores empleados), concluyó que el mantenimiento con 5mg de prednisona prevenía de la recidiva en el paciente con LES26. Sin embargo, en este mismo estudio cabe destacar que el 63% de los pacientes no presentaron recidivas y permanecieron libres de glucocorticoides. Creemos que estamos en un momento idóneo para plantearnos reducciones rápidas de los glucocorticoides y en un porcentaje elevado y seleccionado poder interrumpirlos, debido a los tratamientos que disponemos hoy en día (belimumab, rituximab, anifrolumab o inhibidores de la calcineurina). Esta nueva perspectiva nos permitiría disminuir claramente el daño orgánico acumulado consecuencia de la dosis de glucocorticoides.
- 9)
Inmunosupresión, ¿hasta cuándo?
Es un tema controvertido y complejo por la naturaleza de la propia enfermedad y en el que las guías dejan siempre un halo de incertidumbre (tres a cinco años, después de 12 meses en remisión). Sin embargo, esta idea se diluye cuando nos acercamos al mundo real. Estudios como el MANTAIN (Mycophenolate Mofetil Versus Azathioprine for Maintenance Therapy of Lupus Nephritis), análisis a los 10 años, presentó que más del 50% de los pacientes mantenían algún tipo de inmunosupresión27. En este punto, podríamos resumir las dos posturas más distantes, por un lado, los que apuestan por mantener la inmunosupresión durante toda la vida, apoyándose en que se trata de una enfermedad autoinmune que cursa con brotes y bajar la guardia de la inmunosupresión podría suponer recidivas con lo que deterioraría la situación general del paciente. Por otro lado, los que consideran que después de un tiempo prudencial de inmunosupresión (tres a cinco años, después de 12 meses en remisión), y en pacientes con afectación exclusivamente renal, se podría valorar retirar la inmunosupresión, apoyándose en la realización de una biopsia renal para decidir según el grado de actividad continuar o no con la inmunosupresión28. Recientemente se ha publicado un estudio francés, en el que se randomizó a los pacientes con NL después de dos a tres años de tratamiento inmunosupresor con micofenolato o azatioprina en remisión completa o parcial, a suspender o mantener la inmunosupresión29. Después de 24 meses de seguimiento, no se demostró la no inferioridad de la interrupción del tratamiento inmunosupresor de mantenimiento para la recidiva renal (27,3 vs. 12,5%, el grupo que se suspendió vs. el que se mantuvo la inmunosupresión). La interrupción de la inmunosupresión se asoció a un mayor riesgo de reagudizaciones graves del LES. Lo cierto es que después de los resultados de este estudio se abren más preguntas que las evidencias aportadas. Para arrojar algo más de luz en este punto, Frangou et al., han propuesto un algoritmo respecto a este dilema, mantener o reducir gradualmente hasta suspender la inmunosupresión en pacientes con NL en remisión clínica completa o parcial, después de la realización de una biopsia renal30. En este punto, deberíamos personalizar esta decisión y colocar en ambos platos de la balanza, aspectos como la edad, raza, grado de afectación del LES (manifestaciones renales y extrarrenales), recidivas, efectos secundarios de los fármacos, etc.31, ante la espera de nuevos ensayos clínicos que nos arrojen mayor luz a este aspecto.
- 10)
Fármacos nefro-cardioprotectores y NL, un binomio que queda excluido de todos los ensayos clínicos
Es conocido por todos que los pacientes con enfermedades autoinmunes quedan excluidos de todos los estudios con los nuevos fármacos nefroprotectores32. Esta situación supone que no dispongamos hasta la fecha, de ningún tipo de ensayo clínico randomizado y aleatorizado con patologías autoinmunes y fármacos nefro y cardioprotectores. Esta situación, hace que los clínicos dedicados a la NL acaben extrapolando los efectos beneficiosos de estos fármacos en los pacientes con LES y NL33. Recientemente, hemos publicado nuestra experiencia con inhibidores del cotransportador de sodio y glucosa tipo 2 (SGLT2) en pacientes con NL, su utilización supuso una reducción de un 50% de la proteinuria después de ocho semanas de tratamiento34. El uso de estos fármacos, unido a los hallazgos histológicos del paciente, sin duda evitó el uso de una mayor cantidad de inmunosupresión y permitió conseguir el efecto beneficioso de estos fármacos. Por otro lado, cada vez disponemos de más fármacos con un gran potencial nefroprotector (agonistas de los receptores del péptido similar al glucagón tipo 1 [GLP1], antagonistas de los receptores de los mineralocorticoides o los antagonistas de la endotelina) que necesitaremos explorar en nuestros pacientes con NL para mejorar la elevada comorbilidad cardiovascular de nuestros pacientes.
En conclusión, necesitamos durante los próximos años ir dando una respuesta más contundente a todas estas cuestiones, para conseguir un mejor control de la enfermedad, una menor incidencia de efectos secundarios y de daño orgánico acumulado y mejorar la calidad de vida de nuestros pacientes con LES. Es tiempo para pensar.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.