El parvovirus B19 (PB19) es un virus DNA de cadena simple para el que el 90% de la población presenta anticuerpos, dado que la primoinfección suele darse durante la infancia. Si bien esta infección suele ser banal en la población general1, en el paciente inmunosuprimido se puede presentar en forma de aplasia pura de células rojas o pancitopenia (por el tropismo del virus hacia el antígenoP de la superficie de los eritroblastos)2-4. Asimismo, es una causa de microangiopatía trombótica (MAT) independientemente del grado de inmunosupresión. A continuación presentamos un caso de pancitopenia secundaria a PB19 en un paciente trasplantado renal, complicada con una MAT tras la retirada de la inmunosupresión.
Se trata de un varón de 48años con antecedente de enfermedad renal crónica secundaria a nefropatía intersticial crónica en el contexto de infecciones urinarias de repetición y malformaciones de la vía urinaria, portador de su primer trasplante renal desde 2014 abocado a urostomía, con inmunosupresión con prednisona, tacrolimus y ácido micofenólico.
A lo largo del seguimiento se evidenció un deterioro progresivo de la función renal hasta creatininas basales en torno a 4mg/dl en relación con un rechazo crónico mediado por anticuerpos en julio de 2020 e infecciones urinarias de repetición secundarias a las malformaciones descritas previamente.
El paciente ingresa en octubre de 2020 por astenia y febrícula. Analíticamente, destacaba un deterioro de la función renal hasta una creatinina de 8,36mg/dl, acidosis metabólica, hemoglobina de 3,8g/dl, 98.000 plaquetas/μl y 3.200 leucocitos/μl. Con estos hallazgos, se administran tres concentrados de hematíes y se reinicia hemodiálisis crónica a través de un catéter venoso central.
En el estudio posterior de la anemia se objetivó anemia microcítica e hiporregenerativa, sin esquistocitos en el frotis. No obstante, se evidenció una haptoglobina suprimida y una LDH de 511U/l. Ante estos datos, se realizó un cultivo de células endoteliales que fue negativo. El test de Coombs, la electroforesis en suero, las serologías de Leishmania y PB19 y las cargas virales de citomegalovirus, virus BK y virus de Epstein-Barr fueron negativas.
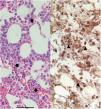
Ante la ausencia de mejoría tras diez días de ingreso, se realizó una biopsia de médula ósea que mostró una médula hipocelular, con hiperplasia eritroide, presencia de lantern cells e inclusiones virales positivas para anticuerpos anti PB19 (fig. 1). Ante ello, se suspende el tacrolimus y el ácido micofenólico y se inician inmunoglobulinas intravenosas (IgIV) a dosis de 400mg/kg/día durante 5días.
Tras finalizar el tratamiento, se observa una profundización de la anemia y de la trombocitopenia, junto con desarrollo de hipertensión arterial (HTA) de difícil control y aumento de LDH hasta 655mg/dl. Asimismo, se objetivó un 6,3% de reticulocitos (compatible con anemia hiperregenerativa) y 3 esquistocitos por campo en el frotis de sangre periférica. Se realizó una determinación de anticuerpos donante-específico que fue negativa y se descartaron otras causas de HTA mediante doppler renal.
Ante la relación temporal con la retirada de la inmunosupresión y la imposibilidad para la realización de biopsia renal por alto riesgo de sangrado, se administran de forma empírica 900mg de eculizumab semanales durante 3semanas, consiguiéndose una resolución de los parámetros hematológicos y de la hipertensión arterial (tabla 1). No obstante, no se objetivó una recuperación de la función renal, probablemente al encontrarse ya el paciente en situación de enfermedad renal crónica avanzada. Por ello, al alta, el paciente permaneció dependiente de hemodiálisis crónica.
Evolución de los parámetros clínicos y bioquímicos del paciente al ingreso, tras la retirada de la inmunosupresión, tras las 3 dosis de eculizumab y en el seguimiento posterior
| Hallazgos analíticos | Al ingreso | Tras la retirada de la inmunosupresión | Tras 3 dosis de eculizumaba | Tras 1 mes de seguimientoa | Tras 3 meses de seguimiento a |
|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 3,8 | 7,0 | 8,5 | 10,0 | 11,1 |
| Plaquetas (× 109/l) | 98 | 71 | 133 | 146 | 183 |
| Esquistocitos en sangre periférica (por campo de gran aumento) | <1 | 3 | <1 | <1 | <1 |
| Haptoglobina (mg/dl) | <5,83 | <5,83 | 10,30 | 17,60 | 27,50 |
| Índice de producción reticulocitaria (%) | 0,1 | 6,3 | 6,8 | 3,8 | 4,2 |
| LDH (U/l) | 511 | 655 | 286 | 217 | 256 |
| Presión arterial sistólica (mmHg) | 133 | 199 | 125 | 146 | 144 |
| Presión arterial diastólica (mmHg) | 64 | 107 | 80 | 85 | 91 |
LDH: lactato deshidrogenasa.
La serología al alta de PB19 fue positiva y el estudio posterior de mutaciones de proteínas reguladoras de la vía alterna del complemento fue negativo.
La infección por PB19 se produce habitualmente en el primer año tras el trasplante2 y se ha de sospechar en el caso de anemia resistente a eritropoyetina2,4,5. De cara al diagnóstico, las guías recomiendan determinar la carga viral, ya que la serología es poco sensible en el paciente inmunosuprimido2. En este caso, fue necesario realizar una biopsia de médula ósea dada la baja sospecha inicial ante esta infección por el tiempo transcurrido desde el trasplante. Los hallazgos más frecuentes en la biopsia de médula ósea son la presencia de pronormoblastos gigantes con inclusiones intranucleares (lantern cells) (fig. 1).
El tratamiento recomendado2 consiste en IgIV a dosis de 0,4g/kg/día durante 5días. Este tratamiento permite en la mayor parte de los casos independencia transfusional a los 12meses de seguimiento6.
Tras el inicio del tratamiento, el paciente desarrolló una MAT. La MAT asociada a PB19 se ha descrito normalmente en el postrasplante inmediato7. Se han propuesto dos mecanismos como posible explicación del desarrollo de MAT por PB19: por invasión directa del endotelio a través del antígenoP7,8 o por la formación de inmunocomplejos. En ambos casos, el daño endotelial favorecería la activación de la vía alterna del complemento, lo que explicaría la buena respuesta a una pauta corta de eculizumab9.
En conclusión, el PB19 puede desencadenar una aplasia medular en el postrasplante tardío y es una causa infrecuente de MAT que, en este caso, presentó una mejoría importante a eculizumab.
Conflicto de interesesLos autores declaran no tener conflicto de intereses relacionados con la publicación de este artículo.