La COVID-19 ha demostrado ser especialmente agresiva con los pacientes con enfermedad renal crónica (ERC). La menor tasa de respuesta inmunológica y la mayor facilidad para la progresión a formas graves de enfermedad ha propiciado este hecho, que se ha mantenido en la era posvacunal de la pandemia. Paradójicamente, la ERC ha sido excluida de la mayoría de los ensayos clínicos de las principales herramientas terapéuticas desarrolladas frente a SARS-CoV-2. Sin embargo, se ha ido reuniendo experiencia de uso de estos fármacos en distintos estadios de la ERC que avala su uso con garantías de eficacia y seguridad.
El objetivo de esta revisión es reunir todas las indicaciones de tratamiento frente a la COVID-19 en los distintos estadios de la enfermedad adaptadas a la ERC en sus distintas fases, incluyendo el tratamiento sustitutivo renal.
COVID-19 has proven to be particularly aggressive in patients with chronic kidney disease (CKD). The lower immune response rate and the greater susceptibility to progress to severe forms of the disease have contributed to this phenomenon, which has persisted in the post-vaccination era of the pandemic. Paradoxically, CKD has been excluded from most clinical trials of the main therapeutic tools developed against SARS-CoV-2. However, experience in the use of these drugs has been accumulating in different stages of CKD, supporting their use with guarantees of efficacy and safety.
The objective of this review is to gather all treatment indications for COVID-19 in the different phases of the disease, tailored to CKD in its various stages, including renal replacement therapy.
La gravedad de la COVID-19 asociada a enfermedad renal crónica (ERC) ha sido especialmente patente en dos grupos de pacientes: los pacientes en tratamiento sustitutivo renal (TRS) en sus dos modalidades (diálisis y trasplante renal) y los pacientes con ERC en cualquier estadio y tratamiento inmunosupresor. En el caso de los pacientes con ERC y TRS, el registro COVID-19 de la Sociedad Española de Nefrología (SEN) demostró una alta tasa de contagio con una elevada necesidad de ingreso hospitalario (hasta el 85%) y una tasa de mortalidad que llegaba al 25% en la era pre-vacunal1. Estos hallazgos se han replicado en series procedentes de otros países, como Francia y Gran Bretaña, donde se confirma que el aumento del riesgo de progresión a enfermedad grave y muerte por COVID-19 asociado a ERC se ha mantenido claramente aumentado respecto al de la población general en la era posvacunal2,3.
Los pacientes con enfermedad glomerular también han demostrado tener peor pronóstico que la población general en relación con la COVID-19, con aumento de la tasa de mortalidad y de desarrollo de fracaso renal agudo independiente del uso de tratamiento inmunosupresor en el momento de la infección por SARS-CoV-24.
A pesar de las bajas tasas de respuesta a la vacunación, tanto la gravedad como la mortalidad asociada a SARS-CoV-2 parecen haber mejorado sustancialmente en sucesivas olas5. Sin embargo, la ERC y la inmunosupresión siguen siendo un factor de riesgo para la progresión a formas graves de enfermedad (tablas 1 y 2).
Grupos de riesgo para priorizar el uso de fármacos anti-SARS-CoV-2a,b
| Personas con inmunosupresión grave | No se espera una respuesta inmune adecuada a la vacunación |
| Personas no vacunadas | Con más de 80 años o con más de 65 y factores de riesgo de progresión a formas graves (tabla 2) |
| Personas vacunadas (pasados más de 6 meses tras la última dosis) | Con más de 65 años y al menos un factor de riesgo para progresión a formas graves |
Factores de riesgo de progresión a formas gravesa
| • Enfermedad renal crónica (FG <45 ml/min) |
| • Enfermedad hepática crónica (Child-Pugh clase B o C) |
| • Enfermedad neurológica crónica (esclerosis múltiple, ELA, miastenia gravis o enfermedad de Huntington) |
| • Enfermedad cardiovascular (IAM, ACV, AIT, IC, angina de pecho con prescripción de nitroglicerina, injertos de revascularización coronaria, intervención coronaria percutánea, endarterectomía carotídea y derivación aórtica) |
| • Enfermedad pulmonar crónica (EPOC de alto riesgo con FEV1 <50% o 2 o más exacerbaciones año o un ingreso, asma con requerimiento de tratamiento diario), diabetes mellitus con afectación de órgano diana |
| • Obesidad (IMC ≥ 35) |
| • Bajo peso (IMC ≤ 18,5) |
Recomendaciones SEIMC para el manejo clínico de pacientes con COVID-19 – SEIMC – COVID-19.
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; ELA: esclerosis lateral amiotrófica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; IMC: índice de masa corporal.
Desde los primeros casos de COVID-19 hasta la fecha actual se han desarrollado múltiples estrategias para combatir la enfermedad. Lamentablemente, la ERC ha sido causa de exclusión de los principales ensayos clínicos que han sustentado las indicaciones de estas terapias, y la ERC con filtrado glomerular estimado (FGe) <30ml/min/1,73m2 esté ausente en la mayor parte de las fichas técnicas de anticuerpos monoclonales y antivirales activos frente a SARS-CoV-2. Sin embargo, en este periodo se han reportado experiencias de su uso en pacientes con ERC avanzada y/o trasplante renal que apoyan el uso de estos fármacos en nuestros pacientes.
El objetivo de este documento es recoger las indicaciones y la experiencia de uso de distintas herramientas frente a la infección por SARS-CoV-2 en la ERC con el objetivo de facilitar el acceso homogéneo al tratamiento eficaz en esta población.
En las tablas 1-4 se recogen las definiciones y la estratificación del riesgo considerada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) para priorizar el acceso a fármacos anti-SARS-CoV-2.
Definición de los contextos clínicos de la COVID-19
| • Infección asintomática o presintomática: individuos que presentan una PDIA positiva pero no presentan síntomas compatibles con COVID-19 |
| • COVID-19 leve: individuos con signos y síntomas de COVID-19 pero sin falta de aire, disnea, o alteraciones radiográficas |
| • COVID-19 moderada: individuos con evidencia de afectación de tracto respiratorio inferior en la exploración (presencia de crepitantes) o radiográfica y con saturación de oxígeno (SatO2) ≥ 94% basal |
| • COVID-19 grave: individuos con SatO2 <94% basal, cociente de la presión arterial parcial de oxígeno entre la fracción de oxígeno inspirado (PaO2/FiO2) <300mgHg, frecuencia respiratoria >30rpm o infiltrados pulmonares >50% |
| • COVID-19 crítico: individuos con fracaso respiratorio, shock séptico y/o fallo multiorgánico |
PDIA: prueba de detección de infección activa (test de antígeno o PCR); SatO2: saturación de oxígeno.
Pacientes con inmunosupresión grave
| • Receptores de trasplante de órgano sólido, progenitores hematopoyéticos o células CAR-T en los dos primeros años tras el trasplante o en tratamiento inmunosupresor para evitar rechazo |
| • Hemodiálisis y diálisis peritoneal |
| • Inmunodeficiencias primarias combinadas y con ausencia de respuesta vacunal |
| • Pacientes con enfermedad oncológica o hematológica con tratamiento activo con quimioterapia mielotóxica o con neutropenia (< 500 neutrófilos/μl) o linfopenia (<1.000 linfocitos/μl) |
| • Pacientes con infección por VIH con recuento de linfocitosT CD4 <200 células/mm3 |
| • Pacientes con fibrosis quística |
| • Pacientes con síndrome de Down a partir de 40 años de edad |
| • Tratamiento con corticoides orales a dosis altas y durante un tiempo prolongado |
| • Tratamiento con ciertos inmunomoduladores no biológicos en los 3 meses previos: metotrexato, leflunomida, 6 mercaptopurina, azatioprina, ciclosporina, micofenolato, tacrolimus y sirolimus |
| • Tratamiento con inmunomoduladores biológicos en los 3 meses previos: inhibidores de la proliferación de célulasB, proteínas de fusión supresoras de linfocitosT, inhibidores de la interleucina, anticuerpos monoclonales anti-CD 52, moduladores de la esfingosina 1 fosfato, inhibidores de la proteincinasa o inhibidores de la familia JAK o de la BK |
| • Tratamiento con anticuerpos monoclonales anti-CD20 en los seis meses previos |
BK: Bruton's kinase; CAR-T: chimeric antigen receptor; JAK: Janus Kinase; VIH: virus de la inmunodeficiencia humana.
El rápido desarrollo y comercialización de las vacunas frente a SARS-CoV-2 claramente ha modificado el curso de la enfermedad en aquellos países con altas tasas de vacunación. Sin embargo, existe controversia sobre la tasa de respuesta vacunal en el paciente con ERC y/o TRS6. En marzo de 2022 se publicaron los datos del estudio prospectivo SENCOVAC, que valoraba la respuesta humoral inmediata y la seguridad de las vacunas frente a SARS-CoV-2 en pacientes con ERC7. En este registro se incluían pacientes en TRS (hemodiálisis, diálisis peritoneal y trasplante renal) y también ERC de cualquier etiología y estadio que recibieron en su mayoría vacunas ARN mensajero (ARNm). La tasa de generación de anticuerpos (Ac) frente a la proteínaS fue prácticamente del 100% a los 28 días posvacuna salvo en la población con trasplante renal, donde no llegó al 80%. La determinación de Ac anti-proteínaS se repitió a los 3 y 6meses. En la mayoría, la caída de Ac observada entre los meses 3 y 6 se recuperó tras la tercera dosis, exceptuando a la población con trasplante renal, donde nuevamente la tasa de seroconversión no llegó al 80%8. La cuarta dosis de vacuna ha mantenido un perfil de eficacia similar, de tal modo que los pacientes sin respuesta serológica han mantenido una tasa subóptima tras la misma9. Sin embargo, la estrategia vacunal actual ha demostrado capacidad para reducir la gravedad y la mortalidad asociada a la COVID-19 en todos los pacientes con ERC incluyendo los trasplantados renales, debido probablemente a un papel relevante de la inmunidad celular adquirida gracias a la vacunación10,11.
Una de las principales barreras para la adherencia a las pautas vacunales recomendadas ha sido el miedo a los efectos adversos. La revisión Cochrane realizada sobre los datos de 41 ensayos clínicos aleatorizados incluyendo a más de 43.000 sujetos demuestra que la tasa de efectos secundarios de las principales vacunas administradas —ARNm y ChAdOx1 (Oxford-AstraZeneca)/SII-ChAdOx1 (Serum Institute of India)— es muy baja y sin diferencia con la del placebo12, dato que se ha confirmado en población con ERC en el estudio SENCOVAC9.
Dada la escasa aparición de efectos adversos graves y a largo plazo, en la actualidad no existe contraindicación ni excepciones específicas para las personas con ERC y se considera que los pacientes con ERC deben seguir las pautas de vacunación propuestas para la población general y ajustadas a su estratificación de riesgo (tabla 4).
Tratamiento pre-exposiciónSe han desarrollado varios Ac neutralizantes frente a SARS-CoV-2, pero solo Evusheld® (Tixagevimab 150mg + Cilgavimab 150mg) obtuvo autorización para su uso como profilaxis pre-exposición.
Evusheld® es una combinación de dos anticuerpos monoclonales inmunoglobulina tipo G1k (IgG1k) de acción prolongada, cilgavimab y tixagevimab, derivados de célulasB de pacientes convalecientes con infección por SARS-CoV-2. Se unen simultáneamente a regiones no superpuestas del dominio de unión al receptor RBD de la proteínaS del SARS-CoV-2, que impide la unión del RBD (del inglés Receptor Binding Domain) al receptor humano de la enzima de conversión de la angiotensina2, y así la entrada del virus en las células13.
El ensayo clínico PROVENT ha testado la eficacia y la seguridad de Evusheld® en profilaxis pre-exposición de enfermedad sintomática COVID-19 en adultos, no vacunados, sin infección previa por SARS-CoV-2, seronegativos y con mayor riesgo de respuesta inadecuada a la vacunación. De los 5.197 participantes, solo el 10% padecían ERC (5% en el grupo tratado y 5% en el grupo placebo). Se demostró una reducción del riesgo relativo de enfermedad sintomática positiva por RT-PCR (del inglés reverse transcription PCR) para el SARS-CoV-2 del 77% (IC95%: 46-90%, p<0,001)). Se estima que la duración del efecto protector tras una sola dosis es de al menos 6 meses13.
En cuanto a la seguridad, la mayor parte de los efectos adversos fueron leves, en forma de cefalea, fatiga y tos.
Indicaciones: El 22/2/2023 el Consejo interterritorial del SNS emitió un comunicado de no-recomendación de Evusheld® como profilaxis pre-exposición de COVID-19 debido a la ausencia de actividad neutralizante in vitro frente a las variantes circulantes predominantes en España. No obstante, esta indicación se revisará en función de las variantes circulantes futuras de SARS-CoV-2.
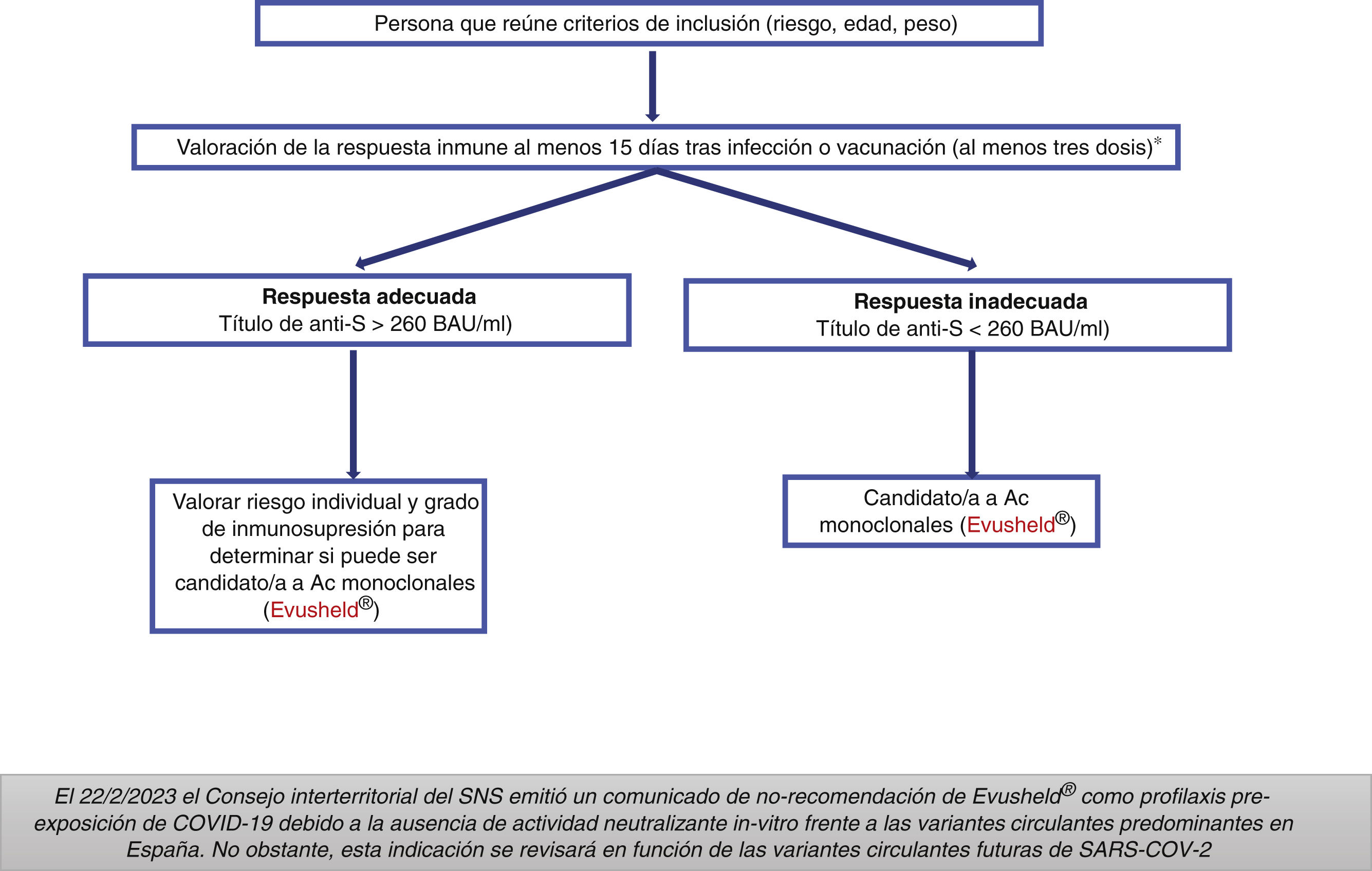
Grupos previamente considerados candidatos a tratamiento con Evusheld®Adultos y adolescentes a partir de 12 años con un peso >40kg y alto grado de inmunosupresión (tabla 4), que no responden adecuadamente a la vacunación o que no puedan completar la pauta de vacunación.
La AEMPS ha considerado requisito indispensable para su administración haber recibido al menos tres dosis de la vacuna (salvo reacción alérgica grave o reacción adversa grave relacionada con la administración de alguna de las vacunas frente a COVID-19) y tener una respuesta serológica inadecuada al menos 15días después de la última dosis de la vacuna (fig. 1)14.
Posología. 150mg de tixagevimab y 150mg de cilgavimab, administrados como dos inyecciones intramusculares secuenciales separadas. No requiere ajuste a función renal.
Interacciones farmacocinéticas. No se han descrito. No presenta metabolismo hepático ni eliminación renal.
Efectos adversos. Reacciones en la zona de inyección y de hipersensibilidad (erupción y urticaria)15.
Tratamiento de la infección por SARS-CoV-2El pasado 23 de febrero de 2023 se publicó en www.aemps.gob.es el siguiente informe: «Actualmente la situación epidemiológica es menos compleja y existe disponibilidad de diferentes tratamientos frente a la COVID-19 que ya están comercializados y, en algunos casos, incluso se han adquirido a través de compras centralizadas europeas. Por ello, la intervención y priorización de tratamientos por parte de la AEMPS ya no es necesaria. Corresponde al médico, dentro de la práctica clínica habitual, decidir la opción más adecuada atendiendo a las características y especificidades de su paciente, de acuerdo a la ficha técnica o las instrucciones de los distintos comités sanitarios a nivel autonómico u hospitalario»16.
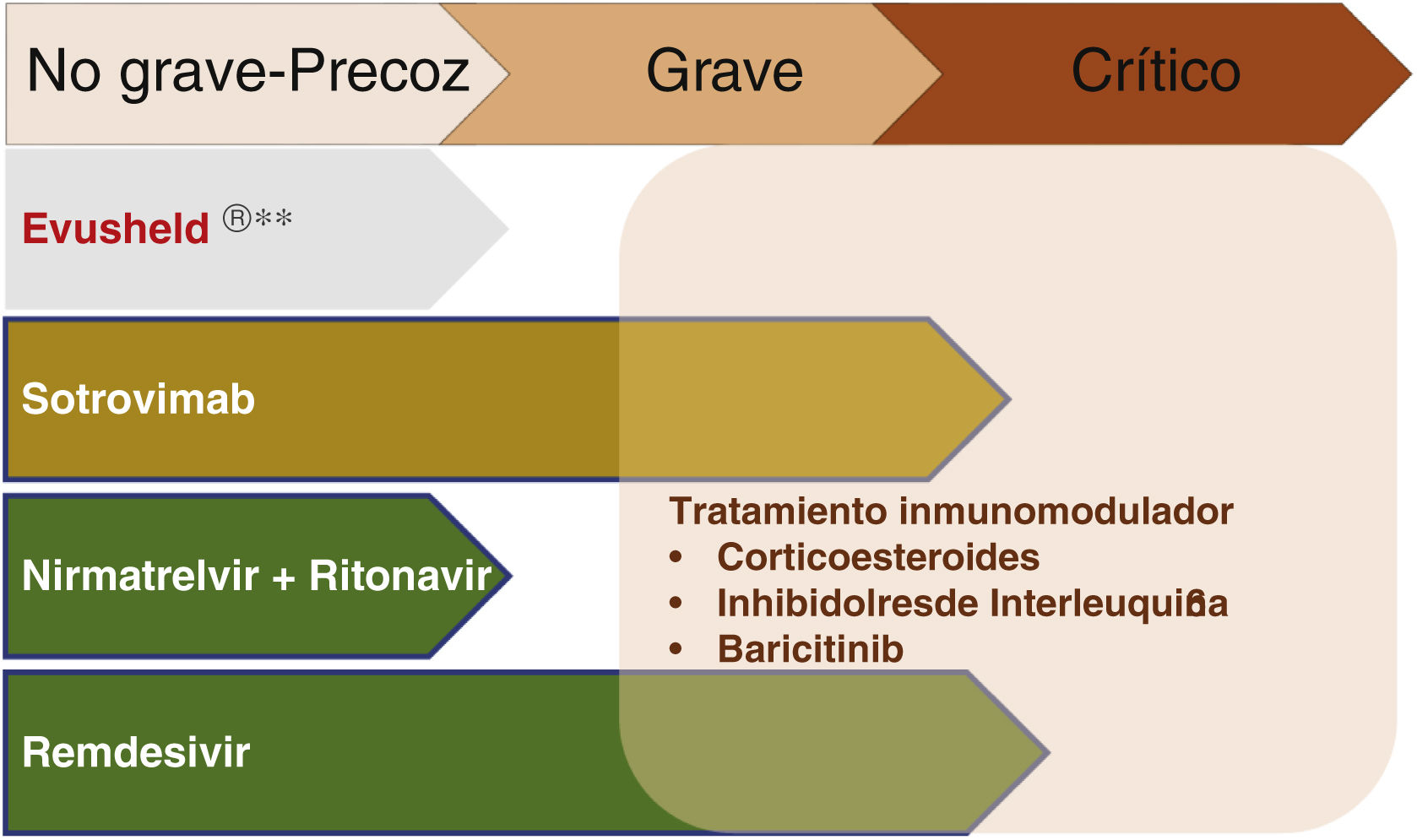
Tratamieno de la COVID precozEl objetivo en esta fase es evitar la progresión a formas graves, la hospitalización y la muerte, tanto con antivirales como con anticuerpos neutralizantes. En la figura 2) se resumen las indicaciones actuales en pacientes con ERC.
AntiviralesNirmatrelvir-ritonavir (Paxlovid®)Nirmatrelvir inhibe la principal proteasa de SARS-CoV-2, Mpro o 3CLpro, fundamental para la replicación viral. Se combina con ritonavir, un potente inhibidor del citocromo P450 (CYP)-3A4, que prolonga la vida media del fármaco permitiendo una dosificación cada 12h.
La eficacia de este fármaco se testó en un ensayo clínico fase 2-3 aleatorizado doble-ciego frente a placebo en pacientes sintomáticos, no vacunados, con alto riesgo de progresión a formas graves de COVID-19, demostrando una disminución del riesgo de progresión a formas graves del 89% comparado con el grupo placebo17.
La eliminación de nirmatrelvir es fundamentalmente renal, y la de ritonavir es hepática.
Indicaciones. Adultos con COVID-19 leve-moderada que presenten un riesgo alto de progresar a COVID-19 grave, con una duración de síntomas ≤5 días y con test de antígeno positivo18.
Posología. Debe iniciarse en los primeros cinco días tras el inicio de síntomas.
- •
Dosis general:
- ∘
Nirmatrelvir 300mg + ritonavir 100mg v.o. dos veces al día.
- ∘
Duración: 5 días.
- ∘
- •
Dosis en insuficiencia renal:
- ∘
FGe ≥ 60ml/min/1,73 m2 no precisa ajuste.
- ∘
FGe 30- 60ml/min/1,73 m2: nirmatrelvir 150mg + ritonavir 100mg v.o. dos veces al día.
- ∘
FGe <30ml/min/1,73 m2: en ficha técnica figura como no indicado. No obstante, se ha descrito el uso de 300mg nirmatrelvir + 100mg ritonavir el día 1 seguido de 150mg nirmatrelvir + 100mg ritonavir una vez al día durante 4 días con buen perfil de eficacia (inhibición de la Mpro) y de seguridad18-20.
- ∘
Pacientes en diálisis: misma dosis que para FGe <30ml/min/1,73 m2. No hay datos en diálisis peritoneal y tampoco en técnicas de reemplazo continuas.
- ∘
Trasplante renal: debido a la interacción con la eliminación hepática (ver a continuación), los inhibidores de la calcineurina se deben suspender durante el tratamiento con nirmatrelvir/ritonavir y reiniciar 48-72h tras la finalización del tratamiento a dosis inferior a la previa y monitorizando niveles18.
- ∘
- •
No se recomienda en insuficiencia hepática grave
Interacciones farmacológicas. Son muy frecuentes, por lo que se recomienda revisar cuidosamente la lista de estas. Para ello se puede acceder a algunas de las herramientas digitales desarrolladas, como por ejemplo https://www.covid19-druginteractions.org/21. Entre las más comunes están los anticoagulantes de acción directa y warfarina, estatinas, antagonistas alfa-adrenérgicos, trazodona e hidromorfona, antagonistas de los canales del calcio, anticonvulsivantes e inhibidores de la calcineurina22.
Efectos adversos:
- •
Trastornos del sistema nervioso: disgeusia, cefalea (frecuentes).
- •
Trastornos gastrointestinales: vómitos, náuseas (frecuentes), dolor abdominal (poco frecuente).
- •
Trastornos generales: malestar general (raro).
- •
Elevación de transaminasas hepáticas, hepatitis clínica e ictericia (muy raro).
- •
Riesgo de desarrollo de resistencia a VIH-1. (El tratamiento en monoterapia con ritonavir de un paciente con infección por VIH-1 no controlada o no diagnosticada puede desarrollar una resistencia a los inhibidores de la proteasa del VIH).
Remdesivir (Veklury®) es un análogo nucleósido que inhibe la polimerasa dependiente de ARN con eficacia in vitro para inhibir la replicación de MERS-CoV (del inglés Middel East respiratory syndrome), SARS-CoV-1 y SARS-CoV-2 en las células del epitelio respiratorio. En modelos experimentales animales ha demostrado ser eficaz en uso pre-exposición (12h) y post-exposición precoz. La eficacia de remdesivir fue inicialmente probada en el ensayo clínico fase3, aleatorizado y doble ciego comparado con placebo, ACTT-1 (Adaptive Covid-19 Treatment Trial), en pacientes adultos hospitalizados con COVID-19, demostrando una disminución del tiempo de hospitalización de 10días en el grupo de remdesivir vs 15días en el grupo placebo (riesgo relativo [RR]: 1,29; IC95%: 1,12-1,49; p<0,001) en el conjunto de los pacientes, y de la mortalidad en el grupo de pacientes con necesidad de oxígeno de bajo flujo (RR: 0,30; IC95%: 0,14-0,64)23. Con posterioridad, el ensayo clínico fase3 PINE-TREE24 ha demostrado de forma concluyente disminución de la mortalidad asociada al uso del fármaco en los 7 primeros días desde el inicio de los síntomas, en pacientes con factores de riesgo para progresión. Además, el ensayo clínico adaptativo llevado a cabo por la Organización Mundial de la Salud, Solidarity fase3, ha demostrado una reducción de la progresión y de la mortalidad en los pacientes hospitalizados por COVID-19 con necesidad de oxigenoterapia, excepto para aquellos con ventilación mecánica25. El estudio REDPINE evaluó la eficacia y la seguridad de remdesivir en pacientes con FGe <30ml/min/1,73m2 (tanto ERC como fracaso renal agudo con deterioro sostenido de función renal), incluyendo pacientes en diálisis con buen perfil de seguridad26.
Indicaciones27:
- •
COVID-19 leve-moderado que presente algún criterio de alto riesgo de progresión y ≤7días de síntomas e infección confirmada.
- •
COVID-19 grave.
- •
No está indicado en COVID-19 crítica con necesidad de ventilación mecánica, aunque si el paciente está en tratamiento con el fármaco antes de la ventilación, debe mantenerse.
Posología:
- •
COVID-19 leve-moderada que presente algún criterio de alto riesgo de progresión y ≤7días de síntomas o test de antígeno positivo: día1: 200mg en perfusión i.v., día 2 y siguientes: 100mg/24 horas i.v. en perfusión. Duración 3 días.
- •
COVID-19 grave: misma dosis, duración 5-10días (incluso más en el caso de paciente inmunodeprimido y persistencia de replicación viral sintomática).
Dosis en insuficiencia renal. No requiere ajuste, incluido pacientes en diálisis. Se recomienda administrar dosis después de la sesión16,18. No existen datos sobre ajuste de dosis en diálisis peritoneal ni en técnicas continuas.
Interacciones. Con fosfato de cloroquina o sulfato de hidroxicloroquina (antagonizan in vitro la actividad antiviral). Remdesivir es un inhibidor de CYP 3A4, pero debido a su rápida eliminación tras la administración i.v. es poco probable que tenga efecto significativo sobre la exposición a fármacos que sean sustrato de esta enzima. No obstante, se ha descrito aumento de los niveles de inhibidoras de calcineurina a partir del tercer día de tratamiento28.
Efectos adversos. Los más frecuentes son la elevación de transaminasas y de los tiempos de protrombina, seguidos de náuseas y vómitos, cefalea, erupción cutánea (exantema maculopapular). El sulfobutileter-beta-ciclodextrina es un excipiente de Veklury® de eliminación renal que puede acumularse en pacientes con enfermedad renal grave y asociarse a nefrotoxicidad. Sin embargo, en diferentes estudios que evaluaron la toxicidad de remdesivir en pacientes con insuficiencia renal grave (FG <30ml/min/1,73m2) no se observó empeoramiento del FG en tratamientos de 5días de duración o menos.
Anticuerpos monoclonalesTanto el suero hiperinmune como el uso de Ac monoclonales han sido testados como prevención de desarrollo de la COVID-19 o al menos de sus formas graves tras exposición a SARS-CoV-2. En el caso de los Ac monoclonales frente a SARS-CoV-2, estos derivan de un clon de célulasB dirigidos frente a la proteínaS y pueden actuar por dos mecanismos:
- •
Neutralización del patógeno.
- •
Función efectora, que incluye la citotoxicidad celular dependiente de anticuerpos (ADCC), la fagocitosis celular dependiente de Ac, la citotoxicidad dependiente del complemento y la opsonización a través del fragmento cristalizable (región Fc)29.
Se recomienda revisar la capacidad neutralizante de los diferentes Ac monoclonales en relación con las variantes circulantes en cada momento para valorar la indicación de tratamiento29. En el caso de presentar una capacidad neutralizante disminuida, priorizar el tratamiento con antivirales (nirmatrelvir o remdesivir) y/o valorar el uso combinado con alguno de ellos.
SotrovimabEs un anticuerpo monoclonal obtenido de un conjunto de Ac monoclonales neutralizantes humanos procedente de un individuo infectado con SARS-CoV en 2003, que inhibía de forma potente tanto a los aislados de SARS-CoV humanos como los zoonóticos. Su zona de anclaje en la proteínaS se encuentra distante al dominio RBM (zona de anclaje común de los Ac neutralizantes), afectándose menos por la variabilidad de esa zona, mitigando el escape viral.
El ensayo clínico COMET-ICE, fase3, aleatorizado, doble ciego, controlado con placebo, que incluyó a pacientes con diagnóstico de COVID-19 leve o moderado con menos o igual de 5días desde el inicio de los síntomas y factores de riesgo de progresión a formas graves, demostró una disminución de la mortalidad o de la hospitalización por cualquier causa en los pacientes tratados con sotrovimab con una reducción del RR del 79%; IC (50%-91%); p<0,00117.
Existe evidencia del uso de sotrovimab en ERC: un estudio observacional de cohortes realizado en el Reino Unido, que incluyó 2.367 pacientes en TRS (70% con trasplante y 30% en diálisis), observó que el tratamiento con sotrovimab supuso una reducción del riesgo de hospitalización y/o muerte por COVID-19 en comparación con el tratamiento con molnupiravir (hazard ratio: 0,35; IC [0,17-0,71])18. Además, en el metaanálisis que analizó los resultados clínicos del uso de sotrovimab en pacientes con TOS, donde se incluyó el trasplante renal, sotrovimab redujo, de forma significativa, el riesgo de hospitalización, de necesidad de ingreso en la UCI y de mortalidad19.
Indicaciones. Dentro de los 5 días de inicio de los síntomas de COVID-19.
- •
Indicado para el tratamiento de la COVID-19 en adultos y adolescentes (12 años o mayores y que pesen al menos 40kg) que no requieren oxígeno suplementario y que tienen un mayor riesgo de progresar a COVID-19 grave.
- •
También hay experiencia de uso en pacientes con COVID-19 moderada-grave inmunodeprimidos con serología negativa o con bajo nivel de protección para SARS-CoV-2.
Posología:
- •
Dosis única de perfusión diluida de 500mg por vía intravenosa. Se recomienda vigilancia en la primera hora posterior.
- •
Insuficiencia renal. No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Interacciones. No se han realizado estudios de interacciones. Sotrovimab no se elimina por vía renal ni se metaboliza mediante las enzimas del CYP.
Efectos adversos. Diarrea (2%), reacciones de hipersensibilidad (2%), reacciones relacionadas con la perfusión (1%), anafilaxia (0,05%)20.
Tratamiento de la COVID-19 graveEl desarrollo de herramientas terapéuticas que frenan la proliferación del SARS-CoV-2 ha disminuido la frecuencia de progresión a enfermedad grave. No obstante, aún hay conceptos que conviene destacar para el manejo de aquellos pacientes que presenten formas graves.
El uso de fármacos inmunomoduladores debe restringirse a la fase inflamatoria, evitando su uso en las fases iniciales de la enfermedad, donde pueden favorecer la replicación viral.
Han demostrado eficacia en el control de la fase inflamatoria de la COVID-19, solos o en combinación21:
- •
Corticosteroides.
- •
Antagonistas de los receptores de interleucina 6 (tocilizumab).
- •
Baricitinib.
El uso de antivirales en esta fase está limitado a remdesivir, y solo en paciente grave no crítico. En pacientes con ventilación mecánica, remdesivir no modificó la evolución de la enfermedad respecto a no-tratamiento22. En el caso de que el paciente estuviera recibiendo remdesivir antes de la instauración de ventilación mecánica, se continuará con el tratamiento hasta completarlo.
El uso de anticuerpos monoclonales en esta fase ha demostrado disminuir la mortalidad en pacientes seronegativos, tal y como demostró el estudio RECOVERY23, con disminución de la mortalidad en pacientes seronegativos hospitalizados con necesidad de oxígeno. Este ensayo utilizó casirivimab-indevimab, una combinación de Ac monoclonales que no son eficaces frente a las variantes actuales y, por lo tanto, no se usan. En base a estos resultados, en la actualidad se utilizan en esta indicación los Ac monoclonales que mantienen actividad frente a las variantes circulantes en cada momento.
En trasplantados renales se recomienda suspender el anti-metabolito y mantener el inhibidor de la calcineurina y/o los inhibidores de mTOR tanto en la fase viral como en la inflamatoria, dado su potencial efecto inmunomodulador en esta fase de la enfermedad24.
En la figura 3 se resume el uso de fármacos en las distintas fases de la COVID-19.
Tratamiento farmacológico en las distintas fases de la COVID-19.
** No recomendado en la actualidad por el Consejo Interterritorial del Sistema Nacional de Salud en base a la ausencia de efecto neutralizante sobre las cepas circulantes en España. Susceptible de modificación en función de evolución de las variantes de SARS-CoV-2.
La ERC es un factor de riesgo para el desarrollo de formas graves de la COVID-19. La inmunización obtenida por las sucesivas pautas vacunales ha demostrado ser efectiva en los pacientes con ERC, incluidos aquellos con menor tasa de respuesta serológica inicial, en la disminución del riesgo de formas graves de COVID-19. Existen distintas herramientas farmacológicas para el control de la enfermedad precoz leve o moderada, que pueden ser utilizadas con eficacia y seguridad en la ERC avanzada. En el caso de pacientes trasplantados o con tratamiento inmunosupresor, el ajuste del mismo puede ser de utilidad para mitigar la progresión a formas graves.
- •
La enfermedad renal crónica (ERC) es un factor de riesgo para alcanzar una respuesta serológica subóptima con las estrategias vacunales frente a SARS-CoV-2 y para el desarrollo de complicaciones derivadas de la COVID-19.
- •
Los ensayos clínicos de los principales fármacos frente a SARS-CoV-2 han excluido a los pacientes con ERC avanzada. No obstante, en este periodo se han publicado estudios de cohortes y de experiencia en vida real en distintos grupos de pacientes con ERC.
- •
La vacunación ha demostrado ser eficaz previniendo el desarrollo de formas graves de infección con un buen perfil de seguridad, y las sucesivas dosis de recuerdo han mejorado la tasa de respuesta serológica incluso en los pacientes con peor respuesta, como los trasplantados renales. Por ello, la vacunación está indicada en todo el espectro de la enfermedad renal, incluyendo aquellos en diálisis y portadores de un injerto renal.
- •
Existen varios tratamientos dirigidos a la fase precoz de la enfermedad para evitar la progresión a formas graves en pacientes con alto riesgo de progresión, que pueden ser utilizadas en pacientes con ERC. Tanto el uso de anticuerpos monoclonales como el uso de antivirales en los estadios precoces de la COVID-19 se pueden utilizar con garantías incluso en pacientes con tratamiento renal sustitutivo.
- •
El uso de fármacos dirigidos a controlar la fase inflamatoria está también indicado en la ERC. En el caso del trasplante renal, la suspensión del anti-metabolito manteniendo el tratamiento con inhibidores de calcineurina y/o inhibidores de mTOR (mammalian Target Of Rapamycin) puede ser útil para el control de ambas fases, viral e inflamatoria, de la COVID-19.
Los autores declaran no tener ningún conflicto de intereses.