A pesar de la frecuencia con que la anemia está presente en los pacientes con enfermedad renal crónica (ERC), su relación con lesiones gastrointestinales no ha sido estudiada.
MétodoEstudio observacional analítico transversal de un año de reclutamiento para determinar la prevalencia de lesiones gastrointestinales endoscópicas y los factores de riesgo asociados en pacientes asintomáticos con ERC estadios 1-5 y anemia que presentaban un test inmunoquímico cualitativo de sangre oculta en heces positivo.
ResultadosSe analizaron 9.658 pacientes con ERC, de los que 286 (2,9%) presentaban anemia; 198 tuvieron un test de sangre oculta en heces positivo (47% varones, 71,1±11,8 años). El estudio endoscópico reveló 255 lesiones, con al menos una lesión en el 68,2%, siendo las más prevalentes: pólipos colorrectales adenomatosos (39,6%), lesiones agudas de la mucosa gástrica (22,6%), lesiones neoplásicas (15,1%), angiodisplasias (14,4%), esofagitis (8,4%), enfermedad inflamatoria intestinal (4,8%) y colitis isquémica (3,1%). La uremia y el ácido acetilsalicílico fueron identificados como factores de riesgo de lesiones agudas de la mucosa gástrica. Las angiodisplasias se relacionaron con el enolismo, el mayor estadio de ERC, la anemia y la ausencia de respuesta a agentes estimulantes de la eritropoyesis. La edad y la anemia refractaria constituyeron factores de riesgo de pólipos adenomatosos y cáncer colorrectal.
ConclusiónLos pacientes renales con anemia podrían beneficiarse de un estudio endoscópico debido a la alta prevalencia de lesiones gastrointestinales que presentan, particularmente pólipos adenomatosos y cáncer colorrectal, más frecuentes en los mayores de 50 años con ERC estadios 3-5.
Despite the frequency with which anaemia is present in patients with chronic kidney disease (CKD), its relationship with gastrointestinal lesions has not been studied.
MethodA cross-sectional, analytical, observational study involving one year of recruitment was carried out to determine the prevalence of endoscopic gastrointestinal lesions and associated risk factors in asymptomatic patients with chronic kidney disease stages 1-5 and anaemia who had a positive qualitative immunochemical faecal occult blood test.
ResultsA total of 9,658 patients with CKD were analysed, of which 286 (2.9%) had anaemia; 198 had a positive faecal occult blood test (47% male, 71.1±11.8 years). The endoscopic study revealed 255 lesions, with at least one lesion in 68.2% of patients, with the most prevalent being: adenomatous colorectal polyps (39.6%), acute lesions of the gastric mucosa (22.6%), neoplastic lesions 15.1%), angiodysplasia (14.4%), oesophagitis (8.4%), inflammatory bowel disease (4.8%) and ischaemic colitis (3.1%). Uraemia and acetylsalicylic acid were identified as risk factors for acute gastric mucosal lesions. Angiodysplasia was associated with alcoholism, a more advanced stage of chronic kidney disease, anaemia, and lack of response to erythropoiesis-stimulating agents. Age and refractory anaemia were risk factors for adenomatous polyps and colorectal cancer.
ConclusionRenal patients with anaemia could benefit from an endoscopic study due to their high prevalence of gastrointestinal lesions, particularly adenomatous polyps and colorectal cancer, which are more common in those over 50 years of age with CKD stages 3-5.
La anemia es una complicación frecuente de la enfermedad renal crónica (ERC), y su gravedad guarda una relación inversa con el grado de la función renal1. A medida que avanza la enfermedad, disminuye la producción de eritropoyetina, con la consecuente reducción en la formación de glóbulos rojos en la médula ósea. Sin embargo, en el paciente con ERC puede existir más de una causa responsable de la aparición de anemia, como el déficit de hierro, de ácido fólico o de vitamina B12, la hemólisis, las pérdidas digestivas y los síndromes mielodisplásicos. Asimismo, existen factores que disminuyen la respuesta a la eritropoyetina.
Por otro lado, la uremia produce alteraciones a distintos niveles del aparato digestivo y, aunque su patogenia no se conoce, se ha demostrado una mayor prevalencia de lesiones gastrointestinales en los individuos con ERC2. Se han estimado alteraciones endoscópicas en el 40-90% de los pacientes con ERC3. Entre ellas, las enfermedades digestivas más prevalentes son las lesiones agudas de la mucosa gástrica (LAMG)4–6, las angiodisplasias7, la diverticulosis8, la poliposis colónica y el cáncer colorrectal9,10. La enfermedad gastrointestinal más frecuentemente descrita es la angiodisplasia, pero la más grave por su alteración en la modificación del pronóstico en términos de calidad de vida y supervivencia es el cáncer colorrectal. Se ha sugerido que la asociación entre ERC y cáncer tiene su origen en alteraciones inmunitarias ocasionadas por la uremia11,12.
Según la International Agency for Research on Cancer de la Organización Mundial de la Salud13,14, el cáncer colorrectal es el tercer cáncer más común en el mundo (tras el de pulmón y el de mama), con cerca de 1,4 millones de nuevos casos diagnosticados en 2012. Alrededor del 54% de los casos de cáncer colorrectal se producen en los países más desarrollados. La mayor incidencia de cáncer colorrectal se encuentra en Oceanía y Europa, y la menor incidencia en África y Asia. La mortalidad en el primer año es del 8,5%, con las tasas estimadas más altas en Europa Central y del Este (14,9 por 100.000 para ambos sexos), y las más bajas en África Occidental (3,3 por 100.000).
La edad de presentación habitual del cáncer colorrectal esporádico es entre la sexta y la octava décadas de la vida, a diferencia de las formas hereditarias, en las que el diagnóstico suele ser antes de los 50 años15. La forma de presentación varía en función de la localización del tumor. Dentro del diagnóstico diferencial del cáncer colorrectal deben incluirse otras neoplasias digestivas y otras entidades como la enfermedad inflamatoria intestinal, angiodisplasias, diverticulitis, colitis actínica, isquémica o infecciosa y tuberculosis intestinal. Ante la sospecha de cáncer colorrectal es imperativo practicar una colonoscopia que, además de confirmar la neoformación, permite la toma de biopsias para su diagnóstico histológico15. La endoscopia permite además la identificación de potenciales lesiones sincrónicas. En cuanto al cribado de cáncer colorrectal, se ha demostrado que en los individuos mayores de 50 años sin factores de riesgo adicional dependientes de su historia personal o familiar, la realización de un test de sangre oculta en heces (TSOH) anual o bienal, sigmoidoscopia cada 5 años o colonoscopia cada 10 años disminuye la incidencia y la mortalidad por cáncer colorrectal16.
Los TSOH inmunoquímicos se basan en la detección de hemoglobina humana mediante anticuerpos específicos y tienen una sensibilidad del 66-90% y una especificidad superior al 90%17,18. El TSOH es una técnica barata, sencilla, no invasiva y bien aceptada por el paciente, que no se ve afectada por la ingesta de sangre roja, alimentos con actividad peroxidasa o fármacos19.
Las guías KDIGO recomiendan la realización de un estudio endoscópico en aquellos pacientes que presenten hiporrespuesta al tratamiento con agentes estimulantes de la eritropoyesis (AEE)20. En función de que en todo paciente con ERC y anemia es prioritario realizar un estudio para filiar el origen de la anemia, descartar factores contribuyentes y optimizar la respuesta al tratamiento21–23, el objetivo de este estudio fue determinar la prevalencia de lesiones gastrointestinales endoscópicas en los pacientes con ERC y anemia que habían obtenido un TSOH positivo, así como analizar los factores de riesgo asociados.
MétodoSe realizó un estudio observacional, analítico, transversal, de un año de reclutamiento, en el Complejo Hospitalario La Mancha-Centro, Alcázar de San Juan, Ciudad Real, España.
Se incluyeron todos los pacientes mayores de 18 años con ERC y anemia de las consultas externas del servicio de nefrología. Fueron excluidos los pacientes con sintomatología digestiva, tomadores de antiinflamatorios no esteroideos, los sometidos a estudio endoscópico en los últimos 5 años y los que presentaban uno o más factores de hiporrespuesta a los AEE: infección activa, parathormona sérica mayor de 500pg/ml, intoxicación por aluminio, neoplasia, tratamiento con quimioterapia o radioterapia, tratamiento concomitante con fármacos inmunosupresores o datos de hemólisis.
La tasa de filtrado glomerular estimado (TFGe) fue calculada por la fórmula de Modification on Diet on Renal Disease de 6 variables (MDRD-6) y los estadios de ERC fueron definidos según la National Kidney Foundation24. Se definió anemia, según las guías KDIGO25 y NICE26, como la presencia de una hemoglobina sérica inferior a 11g/dl y/o un índice de saturación de transferrina inferior al 20%.
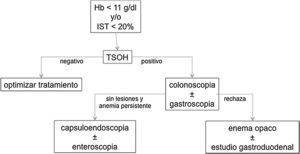
Se realizó a los pacientes un TSOH inmunoquímico cualitativo (DIMA®; 94,6% de sensibilidad; 99,3% de especificidad). Aquellos con un resultado positivo fueron derivados al servicio de aparato digestivo para someterse a una colonoscopia y, en caso de no hallarse lesiones, a una gastroscopia en el mismo acto; el estudio se amplió con capsuloendoscopia y/o enteroscopia en caso de anemia persistente con estudio endoscópico inicial negativo. A los pacientes que rechazaron el estudio endoscópico se les solicitó un enema opaco y, si no se observaban lesiones, un estudio gastroduodenal baritado (fig. 1). Se recogieron datos sociodemográficos y antropométricos, parámetros analíticos (hemograma, bioquímica, proteinograma, vitamina B12 y ácido fólico), tratamiento farmacológico concomitante y hallazgos endoscópicos.
Los procedimientos se llevaron a cabo dentro de las Normas de Buenas Prácticas Clínicas y todos los pacientes proporcionaron consentimiento informado para participar en el estudio.
Análisis estadísticoSe realizó un análisis descriptivo de las variables incluidas en el estudio. Las variables cuantitativas se resumieron mediante medidas de tendencia central (media o mediana, según la distribución de los datos) y de dispersión (desviación estándar o intervalo intercuartílico, respectivamente). Las variables cualitativas se expresaron con frecuencias absolutas y relativas (porcentaje).
La comparación entre grupos con TSOH positivos y negativos se determinó mediante la prueba Chi-cuadrad (o el test exacto de Fisher cuando fue necesario) para las variables cualitativas o la prueba t de Student para las variables cuantitativas. El contraste entre las diferentes lesiones y los posibles factores de riesgo asociados fue realizado mediante la prueba Chi-cuadrado (o el test exacto de Fisher cuando fue necesario). También se realizó el calculó de la odds ratio (OR).
El análisis estadístico fue realizado con el programa SPSS® versión 18. En todos los test, se consideró como estadísticamente significativa la probabilidad de una p<0,05.
ResultadosDe los 9.658 pacientes con ERC atendidos durante el año de reclutamiento, 286 (2,9%) presentaban anemia. De estos, 6 rechazaron la realización de un TSOH y 198 (69,2%) tuvieron un resultado positivo, de los cuales el 47% eran varones, con una edad media de 71,1±11,8 años, y fueron derivados al servicio de aparato digestivo para estudio endoscópico. Las características basales de los pacientes con anemia y realización de un TSOH, tanto negativo como positivo, se resumen en la tabla 1.
Características basales de los pacientes con anemia y un TSOH
| Características basales | TSOH negativo (n=82) | TSOH positivo (n=198) | Valor de p |
|---|---|---|---|
| Varones, n (%) | 47 (57,3) | 93 (47) | 0,115 |
| Edad (años) | 67,2±14,5 | 71,1±11,8 | 0,180 |
| Fumadores, n (%) | 19 (24,7) | 44 (23) | 0,278 |
| Enolismo, n (%) | 1 (1,3) | 15 (7,9) | 0,046 |
| Obesidad (IMC>30kg/m2), n (%) | 36 (52,9) | 88 (51,2) | 0,804 |
| Hipertensión arterial, n (%) | 73 (89) | 178 (89,9) | 0,827 |
| Diabetes mellitus, n (%) | 40 (48,8) | 86 (43,4) | 0,413 |
| Eventos isquémicos, n (%) | 22 (26,8) | 59 (29,8) | 0,618 |
| Enfermedad renal crónica | 0,014 | ||
| Estadios 1-2, n (%) | 27 (32,9) | 34 (17,2) | |
| Estadio 3, n (%) | 27 (32,9) | 83 (41,9) | |
| Estadios 4-5, n (%) | 28 (34,1) | 81 (40,9) | |
| Creatinina, mg/dl | 1,8±1,1 | 1,9±0,9 | 0,397 |
| Urea, mg/dl | 78,9±40,6 | 83,9±42,9 | 0,365 |
| TFGe-MDRD-6, ml/min/1,73m2 | 46,6±27,7 | 38,6±20,5 | 0,020 |
| Etiología, n (%) | 0,244 | ||
| No filiada | 6 (7,3) | 5 (2,5) | |
| Multifactorial | 22 (26,8) | 51 (25,8) | |
| Vascular | 23 (28) | 67 (33,8) | |
| Nefropatía diabética | 13 (15,9) | 22 (11,1) | |
| Glomerular | 4 (4,9) | 17 (8,6) | |
| Nefropatía tubulointersticial crónica | 6 (7,3) | 24 (12,1) | |
| Poliquistosis renal hereditaria | 4 (4,9) | 8 (4,0) | |
| Otra | 4 (4,9) | 4 (2,0) | |
| Tratamiento, n (%) | |||
| Aspirina | 31 (37,8) | 86 (43,4) | 0,385 |
| Clopidogrel | 13 (15,9) | 20 (10,1) | 0,174 |
| Anticoagulantes orales | 10 (12,2) | 22 (11,1) | 0,795 |
| Corticoides | 2 (2,4) | 5 (2,5) | 0,999 |
| Hierro | 32 (39) | 110 (55,6) | 0,012 |
| AEE | 9 (11) | 53 (26,8) | 0,004 |
| Inhibidores de la bomba de protones | 45 (54,9) | 135 (68,2) | 0,034 |
| Estudio de anemia | |||
| Hemoglobina, g/dl | 12,9±1,9 | 12,3±1,8 | 0,007 |
| Volumen corpuscular medio, fl | 87,3±6,2 | 88,7±6,7 | 0,111 |
| Ferritina, ng/ml | 137,3±195,9 | 117,2±124,6 | 0,308 |
| Transferrina, mg/dl | 261,7±57,6 | 255,9±55,8 | 0,440 |
| Índice de saturación de transferrina, % | 15,1±4,5 | 15,4±6,3 | 0,648 |
| Déficit de ácido fólico, n (%) | 0 (0) | 9 (4,5) | 0,062 |
| Déficit de vitamina B12, n (%) | 1 (1,2) | 1 (0,5) | 0,501 |
| Displasias sanguíneas, n (%) | 0 (0) | 4 (2,0) | 0,325 |
AEE: agentes estimulantes de la eritropoyesis; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; TFGe: tasa de filtrado glomerular estimado; TSOH: test de sangre oculta en heces.
La presencia de un TSOH positivo se asoció significativamente con el hábito enólico, la TFGe, la hemoglobina sérica y el tratamiento con suplementos de hierro, AEE e inhibidores de la bomba de protones.
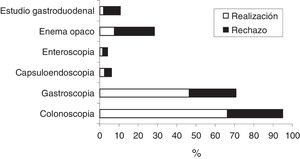
El 20,6% de los pacientes rechazó la colonoscopia que les fue indicada, siendo este porcentaje del 17,5% en el caso de la gastroscopia. La figura 2 muestra la tasa de indicación (expresada como la suma total de cada barra del histograma), aceptación y rechazo de las pruebas de estudio de sangrado digestivo para los pacientes con un TSOH positivo.
Prevalencia de lesiones gastrointestinalesDe los 198 pacientes con un TSOH positivo, el 68,2% presentó alguna lesión en las pruebas complementarias realizadas, con un total de 255 lesiones. La prevalencia de lesiones gastrointestinales en los pacientes con un TSOH positivo se detalla en la tabla 2. Las lesiones endoscópicas más prevalentes fueron la gastritis crónica (50%), las lesiones preneoplásicas (43,9%), las LAMG (22,6%), la diverticulosis (21,5%) y las angiodisplasias (14,4%). Los pólipos colónicos adenomatosos constituyeron la lesión preneoplásica digestiva más frecuente, con un 39,6% de pacientes renales afectados. La úlcera gástrica y duodenal se encontró en un 17,7% de los casos.
Prevalencia de lesiones gastrointestinales
| Lesiones gastrointestinales | Total (n=255) |
|---|---|
| Esofagitis, n (%) | 8 (8,4) |
| Lesiones agudas de la mucosa gástrica, n (%) | 21 (22,6) |
| Gastritis aguda | 0 (0) |
| Bulboduodenitis | 6 (6,4) |
| Úlcera gástrica y duodenal | 17 (17,7) |
| Gastritis crónica, n (%) | 39 (50,6) |
| Pólipos, n (%) | 22 (19,9) |
| Gástricos de glándulas fúndicas o hiperplásicos | 10 (10,6) |
| Colónicos hiperplásicos | 12 (9,3) |
| Angiodisplasias, n (%) | 19 (14,4) |
| Colitis isquémica, n (%) | 4 (3,1) |
| Enfermedad inflamatoria intestinal, n (%) | 4 (4,8) |
| Diverticulosis, n (%) | 28 (21,5) |
| Hemorroides, n (%) | 36 (27,5) |
| Inactivas | 32 (24,4) |
| Congestivas | 4 (3,1) |
| Lesiones preneoplásicas, n (%) | 55 (43,9) |
| Esófago de Barrett | 3 (3,2) |
| Pólipos gástricos adenomatosos | 1 (1,1) |
| Pólipos colónicos adenomatosos | 51 (39,6) |
| ≤2 adenomatosos <1 cm | 34 (26,4) |
| ≥1 adenomatosos ≥1 cm | 5 (3,9) |
| ≥3 adenomatosos <1 cm | 12 (9,3) |
| Lesiones neoplásicas, n (%) | 19 (15,1) |
| Cáncer gástrico | 1 (0,9) |
| Cáncer colorrectal | 18 (14,3) |
Las tablas 3-6 describen los factores de riesgo asociados a las lesiones gastrointestinales causantes de anemia: LAMG, angiodisplasias, lesiones preneoplásicas y cáncer colorrectal.
Factores de riesgo asociados a las lesiones agudas de la mucosa gástrica
| LAMG | |||
|---|---|---|---|
| Factor de riesgo | No (%) | Sí (%) | Valor de p |
| Tabaquismo | 22,4 | 18,2 | 0,633 |
| Tratamiento con AAS | 15,5 | 34,3 | 0,036 |
| Uremia>50mg/dl | 4,8 | 27,8 | 0,035 |
| Diabetes mellitus | 25,5 | 19,6 | 0,491 |
| Estadios de ERC | 0,183 | ||
| 1-2 | — | 15,8 | |
| 3 | — | 30 | |
| 4-5 | — | 17,5 | |
| Hemoglobina<11g/dl | 23,5 | 20 | 0,718 |
| Hiporrespuesta a AEE | 29,4 | 9,1 | 0,355 |
AAS: ácido acetilsalicílico; ERC: enfermedad renal crónica; LAMG: lesiones agudas de la mucosa gástrica.
Factores de riesgo asociados a las angiodisplasias
| Angiodisplasias | |||
|---|---|---|---|
| Factor de riesgo | No (%) | Sí (%) | Valor de p |
| Enolismo | 11,3 | 50 | 0,003 |
| Estadios de ERC | 0,015 | ||
| 1-2 | — | 0 | |
| 3 | — | 10,9 | |
| 4-5 | — | 26,9 | |
| Hemoglobina<11g/dl | 10,4 | 25 | 0,034 |
| Hiporrespuesta a AEE | 9,1 | 50 | 0,014 |
| Uremia>50mg/dl | 6,5 | 16,8 | 0,241 |
| Ferritina<100 ng/ml | 17,3 | 13,3 | 0,537 |
AEE: agentes estimulantes de la rritropoyesis; ERC: enfermedad renal crónica.
Factores de riesgo asociados a las lesiones preneoplásicas colónicas
| Pólipos colónicos adenomatosos | |||
|---|---|---|---|
| Factor de riesgo | No (%) | Sí (%) | Valor de p |
| Edad (años) | 0,421 | ||
| <50 | — | 23,1 | |
| 50-80 | — | 40,7 | |
| >80 | — | 44 | |
| Tratamiento con AEE | 45,7 | 22,9 | 0,018 |
| Hiporrespuesta a AEE | 18,2 | 40 | 0,258 |
| Ferritina<100ng/ml | 40 | 39,2 | 0,928 |
| Hemoglobina<11g/dl | 41,9 | 33,3 | 0,370 |
| Estadios de ERC | 0,609 | ||
| 1-2 | — | 50 | |
| 3 | — | 35,9 | |
| 4-5 | — | 40,4 | |
| Uremia>50 mg/dl | 37 | 40,2 | 0,765 |
AEE: agentes estimulantes de la eritropoyesis; ERC: enfermedad renal crónica.
Para el cáncer colorrectal constituyeron factores de riesgo la hiporrespuesta a AEE (OR: 1,6 [1,1-2,4]) y la edad mayor a 80 años (OR: 3,52 [1,6-7,9]).
Factores de riesgo asociados al cáncer colorrectal
| Cáncer colorrectal | ||||
|---|---|---|---|---|
| Factor de riesgo | No (%) | Sí (%) | Valor de p | |
| Edad (años) | 0,002 | |||
| <50 | — | 0 | ||
| 50-80 | — | 10,2 | ||
| >80 | — | 36 | ||
| Tabaquismo | 11 | 19,1 | 0,209 | |
| Enolismo | 13,9 | 16,7 | 0,678 | |
| IMC>30kg/m2 | 14,5 | 16,7 | 0,760 | |
| Diabetes | 17,8 | 9,4 | 0,185 | |
| Tratamiento con AEE | 14,1 | 14,7 | >0,999 | |
| Hiporrespuesta a AEE | 0 | 37,5 | 0,005 | |
| Ferritina<100 ng/ml | 16,7 | 12,3 | 0,502 | |
| Hemoglobina<11g/dl | 12,1 | 20 | 0,256 | |
| Estadios de ERC | 0,997 | |||
| 1-2 | — | 13,6 | ||
| 3 | — | 16,1 | ||
| 4-5 | — | 13,7 | ||
| Uremia>50 mg/dl | 21,4 | 12,2 | 0,230 | |
AEE: agentes estimulantes de la eritropoyesis; ERC: enfermedad renal crónica; IMC: índice de masa corporal.
El riesgo de padecer LAMG en pacientes en tratamiento con ácido acetilsalicílico (AAS) era 2,8 veces superior (1,0-7,7) y se multiplicaba por 7,7 en los casos con uremia superior a 50mg/dl (1,2-61,2).
El enolismo aumentaba el riesgo de angiodisplasias en 7,8 veces (2,2-27,9). El riesgo de padecer estas lesiones fue 2,4 veces superior (1,1-6,7) en los pacientes con ERC estadios 4-5 respecto al estadio 3. Niveles de hemoglobina inferiores a 11g/dl aumentaban el riesgo de desarrollar dichas lesiones en 2,9 veces (1,05-7,8) y la hiporrespuesta al tratamiento con AEE, en 10 veces (1,7-59,9).
Los pólipos colónicos adenomatosos se asociaron de manera significativa al tratamiento con AEE (p=0,015). Fueron más frecuentes a mayor edad, aunque no se obtuvo significación estadística, que sí se halló en los pacientes con cáncer colorrectal (78,50±5,98 vs. 67,78±12,06 años; p<0,001). El tratamiento con AEE se asoció a la presencia de pólipos adenomatososos y la hiporrespuesta a dicho fármaco se correlacionó con el cáncer colorrectal.
Aunque no se halló significación estadística, la esofagitis fue más prevalente en los pacientes con hábito enólico (28,6 vs. 7%; p =0,11) y en los fumadores (14,3 vs. 5,2%; p =0,15); el 15,6% de los pacientes con pólipos gástricos estaba en tratamiento con IBP frente al 3,3% (p =0,165). La prevalencia de hemorroides fue mayor en los estadios más avanzados de ERC (13,6% en los estadios 1-2, 31,2% en el estadio 3 y 25,9% en los estadios 4-5; p=0,206). La gastritis crónica, la enfermedad inflamatoria intestinal y la diverticulosis no se correlacionaron con ningún factor.
No se encontró ninguna correlación entre la etiología de la ERC y las lesiones halladas en este estudio. En ningún caso se detectaron diferencias entre sexos.
Los modelos de regresión logística multivariante observaron una asociación entre la esofagitis, el tratamiento con AAS y la uremia mayor de 50mg/dl, aunque sin significación estadística (p=0,78 y 0,73, respectivamente). También se observó una asociación entre las angiodisplasias y el enolismo y entre dichas lesiones y los estadios de ERC (p=0,01 y 0,04, respectivamente).
DiscusiónEste trabajo muestra una alta prevalencia de lesiones digestivas en los pacientes con ERC y anemia.
Los datos de este estudio no pueden compararse con otros, dado que la literatura carece de estudios que analicen las lesiones digestivas en pacientes con ERC y anemia a partir de un TSOH inmunoquímico positivo.
Launoy et al.27 estudiaron la presencia de pólipos colónicos adenomatosos y cáncer colorrectal en una población no renal de 7.421 individuos de 50-74 años, de los que 434 (5,8%) tuvieron un TSOH inmunoquímico positivo, una cifra mayor que en el presente trabajo, en el que los pacientes no fueron seleccionados por su edad sino por criterios de anemia. La prevalencia de pólipos adenomatosos fue del 49,5%, algo superior a la nuestra (39,6%), mientras que la de cáncer colorrectal resultó inferior (6 vs. 14,3%).
Existen estudios en pacientes renales realizados con un TSOH de guayaco. El más importante es el realizado por Bini et al.28, que formularon la hipótesis de que el valor predictivo de un TSOH de guayaco disminuiría de forma decreciente con respecto al grado de insuficiencia renal, en función de a la presencia de sangrado intestinal a partir de lesiones mucosas triviales. Identificaron prospectivamente a 1.225 individuos asintomáticos con riesgo medio para cáncer colorrectal, que habían sido derivados para la realización de una colonoscopia a raíz de un TSOH positivo. Se encontraron lesiones clínicamente importantes en el 23,9% de los pacientes con ERC estadio 1, 32,8% de los pacientes con ERC estadios 2 y 3, y 42,6% de los pacientes con ERC estadios 4 y 5. Las lesiones halladas aumentaban con el grado de insuficiencia renal: adenomas de 1cm o mayores (15,1, 20,1 y 22,8%), carcinomas (5,1, 10,1 y 13,2%) y ectasias vasculares (1,7, 2,4 y 6,1%). Comparado con los pacientes sin insuficiencia renal o ERC estadio 1, el riesgo de tener una lesión clínicamente importante se estimó en 1,61 en los sujetos con ERC estadios 2 y 3 y en 2,33 en la ERC estadios 4 y 5. Se concluyó que el valor predictivo de un TSOH positivo para lesiones clínicamente significativas aumentaba de acuerdo al grado de ERC. Estos hallazgos concuerdan con los del estudio presente, en el que las LAMG son mayores con el grado de uremia (27,8 vs. 4,8%; p=0,035) y aumenta la prevalencia de las angiodisplasias con el grado de insuficiencia renal (0% en estadios 1-2 vs. 17,6% en estadios 3-5; p=0,024).
La prevalencia de lesiones de los pacientes del presente estudio es en general mayor que la observada en estudios pretrasplante renal, como el de Al-Mueilo et al.10 (gastritis crónica 50,6 vs. 37%; úlcera 17,7 vs. 11,1%; bulboduodenitis 6,4 vs. 14,8%), Khedmat et al.9 (úlcera en el 17,7 vs. 16,1% en pacientes con ERC, 13,7% en hemodiálisis y 13,7% en trasplantados) y Sotoudehmanesh et al.3 (esofagitis en el 5,8 vs. 8,4%, úlcera en el 17,7 vs. 73%, angiodisplasia en el 14,4 vs. 4,4%, pólipos gástricos inflamatorios en el 10,6 vs. 1,5%). Este hallazgo puede deberse a la selección de los pacientes bajo criterios de anemia. Sotoudehmanesh et al no correlacionaron las lesiones con la edad, el tiempo en diálisis, la causa de la ERC, la sintomatología ni los niveles de hemoglobina sérica, aunque las lesiones más importantes eran observadas con más frecuencia en hombres. Lee et al.29 compararon la colonoscopia de 57 candidatos a trasplante renal con 60 sujetos sin insuficiencia renal, sometidos a colonoscopia como parte de un cribado de cáncer colorrectal. Se encontraron pólipos en el 37% de los candidatos a trasplante y en el 22% de los controles, lo que ya sugirió que las guías de cribado de cáncer colorrectal deben adecuarse a los candidatos potenciales a trasplante renal.
Zuckerman et al.30 mostraron que la angiodisplasia era el hallazgo más frecuente como causa de hemorragia digestiva alta, al igual que los sangrados recurrentes en pacientes con ERC. No se puede establecer comparación con el nuestro trabajo, ya que en nuestro caso se trata de una población de pacientes estables, cuyo motivo de consulta es la revisión de su ERC.
Las angiodisplasias se han relacionado frecuentemente con la ERC. Sin embargo, aunque este estudio muestra que constituyen un grupo importante de lesiones gastrointestinales relacionadas con el grado de función renal, no son las únicas ni las más prevalentes. Su asociación con valores de hemoglobina inferiores a 11g/dl y la hiporrespuesta a AEE son datos útiles que sugieren el planteamiento de un estudio endoscópico previo a la prescripción de AEE en los pacientes con ERC.
Conviene destacar que todos los pacientes eran ambulatorios y no habían manifestado síntomas que hubieran orientado a la solicitud de un estudio endoscópico. Por ello, resulta llamativo el hallazgo de úlcera gastroduodenal en el 17,7% y de colitis isquémica en el 3,1% de los casos.
Aunque los pacientes del estudio han sido seleccionados por la existencia de anemia y un TSOH positivo, se encontraron lesiones relacionadas específicamente con una hemoglobina sérica inferior a 11g/dl o una hiporrespuesta al uso de AEE; fue el caso de las angiodisplasias, los pólipos colónicos adenomatosos y el cáncer colorrectal.
Se ha descrito que los pacientes con ERC tienen un riesgo más elevado de ciertos tipos de cáncer debido a la disfunción del sistema inmunitario, una inadecuada reparación del ADN, la reducción de la defensa antioxidante, el acúmulo de carcinógenos, las infecciones crónicas y la inflamación31. El problema al analizar los estudios al respecto es que los retrospectivos no ofrecen un número real de pacientes diagnosticados, por lo que los estudios de cribado serían más recomendables.
Wu et al.32 calcularon el riesgo de cáncer colorrectal en la población con ERC a partir de un estudio de cohortes que incluía 15.975 pacientes, con una incidencia anual del 0,34% en los pacientes renales no en diálisis.
Ito et al.33 realizaron un cribado de tumores gastrointestinales mediante ecografía abdominal, TSOH, gastroscopia y colonoscopia en 178 pacientes en hemodiálisis y diálisis peritoneal, de los cuales 10 de ellos presentaron malignidad (un cáncer esofágico, tres cánceres gástricos, 4 cánceres colorrectales y dos carcinomas hepatocelulares).
Este estudio también confirma que la prevalencia de lesiones neoplásicas en los pacientes con ERC (14,3% de cáncer colorrectal) es mucho mayor que la descrita en pacientes no renales34.
Este trabajo destaca por su importante tamaño muestral, la inclusión de pacientes diversos con un amplio rango de edad y TFGe, el diseño prospectivo, la recogida de datos demográficos y clínicos de manera detallada y el uso de gastroscopia y colonoscopia completa para evaluar los pacientes con un TSOH positivo. Este es el primer estudio que determina la prevalencia de lesiones gastrointestinales en pacientes con ERC (no diálisis) y anemia.
No obstante, existen algunas limitaciones que deberían considerarse a la hora de interpretar los resultados. Los pacientes con ERC avanzada y en diálisis tienen una alta prevalencia de inflamación mucosa y lesiones triviales en el tracto gastrointestinal superior, que pueden sangrar y ocasionar un TSOH positivo en ausencia de lesiones clínicamente importantes y llevar a un sobreuso de la colonoscopia. Sin embargo, este estudio pone de relieve la importancia de descartar el origen digestivo de la anemia en los pacientes con ERC, lo cual podría llevar a utilizar en menor cuantía los AEE, además de modificar el pronóstico a medio y largo plazo en términos de enfermedad neoplásica. El TSOH tiene una baja sensibilidad para detectar hemorragias ocultas del tracto gastrointestinal superior y colon derecho, por lo que serían necesarios estudios que utilizaran la colonoscopia como prueba de cribado de cáncer colorrectal. El hecho de que este trabajo se haya llevado a cabo en un único centro podría limitar la extrapolación de los resultados a otras poblaciones, especialmente en el caso del cáncer colorrectal, que ha demostrado asociarse a factores medioambientales y nutricionales.
ConclusionesLa prevalencia de lesiones gastrointestinales endoscópicas en los pacientes con ERC y anemia es alta, incluidas las preneoplásicas y neoplásicas, lo que lleva a sugerir su diagnóstico en la práctica clínica habitual mediante gastroscopia y colonoscopia. Un subgrupo de pacientes que se beneficiarían en especial de un cribado lo constituyen los mayores de 50 años con ERC estadios 3-5, que se encuentran expuestos a un mayor riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.