Los inhibidores de check-point (ICP) son una revolución en el tratamiento oncológico. Actúan inhibiendo receptores de los linfocitos T (LT), antígeno 4 del linfocito T citotóxico (CTLA4) o de muerte celular programada 1 (PD1) o sus ligandos, desencadenan desregulación e hiperactivación de los LT, que causa efectos adversos inmunomediados (iRAEs). A nivel renal, la nefritis intersticial inmunomediada es el más frecuente observada, aunque también, glomerulonefritis pauci-inmune, podocitopatías y glomerulopatía C3, lo que empeora el pronóstico1–6. Presentamos un caso de glomerulonefritis pauci-inmune (GP) durante el tratamiento con durvalumab, antiPD-L1, en paciente con carcinoma epidermoide de pulmón.
Varón de 71 años, antecedentes de hipertensión, diabetes II, dislipemia y carcinoma epidermoide de pulmón (G2 pT3 pN1, PD-L1<1%) diagnosticado en 2018, tratamiento quirúrgico y quimioterapia con 4 ciclos de cisplatino y vinorelbina. Tratamiento de mantenimiento con durvalumab, 12 ciclos, hasta 14/11/2019, manteniéndose libre de enfermedad (figs. 1 y 2).
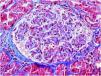
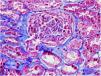
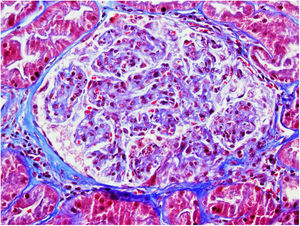
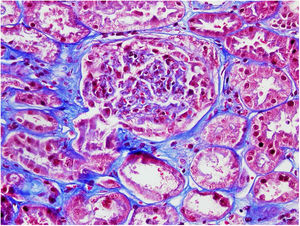
El 17/11/2019 ingresa por fracaso renal agudo, creatinina 4,5mg/dl, microhematuria (300hematíes/μl), síndrome nefrótico clínico y analítico (proteinuria 6g/día, albumina 2,2mg/dl). Estudio inmunológico normal/negativo; biopsia renal: 21 glomérulos, 6 esclerosis globales. Hipercelularidad inflamatoria en luces capilares, mononucleadas, neutrófilos focalmente, hematíes fragmentados y fenómeno de leucocitoclasia. Cuatro glomérulos con semilunas epiteliales. Fibrosis intersticial, atrofia tubular e inflamación crónica leve. Arterias y arteriolas sin alteraciones. Inmunofluorescencia directa no depósitos IgA, IgG, IgM, C3, C1q, kappa, lambda. Diagnóstico: glomerulonefritis pauci-inmune con extracapilaridad 27% de los glomérulos. Se inició tratamiento esteroides intravenosos (500mg×3 días) vía oral a dosis de 1mg/kg/día y ciclofosfamida intravenosa ajustada (500mg/m2).
Tras un mes, seguimiento ambulatorio con esteroides vía oral y ciclofosfamida, creatinina de 3-3,5mg/dl, CKD-EPI 16,5-18ml/min, proteinuria nefrótica y microhematuria.
Reingreso tras segundo bolo de ciclofosfamida, creatinina 7,14mg/dl, urea 319mg/dl y proteinuria 4,18g/24h sin síndrome nefrótico, hematuria intensa. Se inició tratamiento renal sustitutivo (TSR), hemodiálisis intermitente, manteniendo diuresis de 1.500-2.000cc/día. Posteriormente continua ciclofosfamida intravenosa y en programa de hemodiálisis periódica, con seguimiento estrecho. Se objetiva descenso de proteinuria a <1,5g/día, diuresis 2l y un ClCrea 12-18ml/min sin necesidad TSR hasta el momento actual y enfermedad oncológica en remisión completa.
Los check-point, son regulares de la respuesta inmunológica de LT. Su bloqueo con inmunoterapia promueve un estado de desregulación linfocitaria, que lleva a hiperestimulación de los LT y mejor control sobre las células tumorales. Sin embargo, su principal inconveniente son iRAEs, exacerbando enfermedades autoinmunes como GP. La GP, se caracteriza por la presencia de ANCA séricos positivos, en ocasiones como en nuestro paciente, resultan negativos, especulando que sean ANCA frente a otro epítopo u otros autoanticuerpos no detectados3.
La GP, se ha asociado a una expresión aberrante de PD1 en algunos sujetos y mayor hiperactividad de los LT, con mayor riesgo de desarrollar GP con tratamiento con inmunoterapia. En nuestro caso podríamos postular que existía esta expresión aberrante, que desencadenó la GP7 y la suspensión del tratamiento con inmunoterapia junto al tratamiento inmunosupresor, pudo controlar dicha hiperactividad de LT, lo que hizo la remisión de GP.
Por otro lado, se ha descrito la existencia polimorfismos de PDCD1 (gen que codifica PD1), que aumentan la susceptibilidad de desarrollar GP, por lo tanto, un análisis genético, podría ser útil para prevenir el desarrollo de GP en pacientes que requieran tratamiento con ICP y plantear otros tratamientos8,9.
La estrecha relación entre oncología y nefrología lleva a la realización de biopsia renal y valoración por nefrología precozmente, con diagnóstico precoz que aumenta la supervivencia renal y global.