La proteinuria postrasplante renal se asocia a una disminución en la supervivencia del injerto y del paciente. Para reducir la proteinuria y mejorar el pronóstico renal se recomienda asociar fármacos bloqueantes del sistema renina-angiotensina-aldosterona (RAA). Aunque en los pacientes no trasplantados se ha demostrado que la dieta rica en sal reduce el efecto antiproteinúrico de los IECA y ARA-II, este efecto no se ha estudiado en los trasplantados renales.
ObjetivoValorar la relación entre la ingesta de sodio y el efecto antiproteinúrico de los IECA/ARA-II en los trasplantados renales.
MétodosSeleccionamos a 103 trasplantados tratados con IECA/ARA-II más de 6 meses por proteinuria>1g/día. La proteinuria se analizó al inicio del tratamiento y a los 6 meses. La ingesta de sal se estimó con el cociente urinario sodio/creatinina (uNa/Cr).
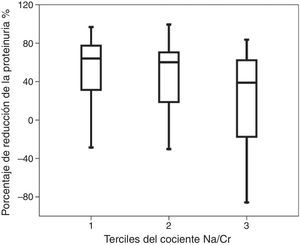
ResultadosEn 46 pacientes (44,7%) la proteinuria disminuyó<1g/día. Un uNa/Cr elevado se relaciona con un menor descenso de la proteinuria (r=−0,251; p=0,011). El porcentaje de reducción de la proteinuria fue significativamente menor en los pacientes en el tercil más alto de uNa/Cr [63,9% (RIC 47,1%); 60,1% (RIC 55,4%); 38,9% (RIC 85,5%); p=0,047]. Un uNa/Cr elevado se relaciona de forma independiente (OR 2,406 por 100 mEq/g; IC 95%: 1,008-5,745; p=0,048) a una respuesta antiproteinúrica<50% tras el bloqueo del eje RAA.
ConclusionesEn los trasplantados renales con proteinuria tratados con IECA/ARA-II una ingesta elevada de sal se asocia con un menor descenso de la proteinuria.
Post-transplant proteinuria is associated with lower graft and patient survival. Renin-angiotensin-aldosterone system blockers are used to reduce proteinuria and improve renal outcome. Although it is known that a high salt intake blunts the antiproteinuric effect of ACEI and ARB drugs in non-transplant patients, this effect has not been studied in kidney transplant recipients.
ObjectiveTo analyse the relationship between sodium intake and the antiproteinuric effect of ACEI/ARB drugs in kidney transplant recipients.
MethodsWe selected 103 kidney transplant recipients receiving ACEI/ARB drugs for more than 6 months due to proteinuria>1 g/day. Proteinuria was analysed at baseline and at 6 months after starting ACEI/ARB treatment. Salt intake was estimated by urinary sodium to creatinine ratio (uNa/Cr).
ResultsProteinuria fell to less than 1g/day in 46 patients (44.7%). High uNa/Cr was associated with a smaller proteinuria decrease (r=−0.251, P=.011). The percentage proteinuria reduction was significantly lower in patients in the highest uNa/Cr tertile [63.9% (IQR 47.1%), 60.1% (IQR 55.4%), 38.9% (IQR 85.5%), P=.047]. High uNa/Cr independently relates (OR 2.406 per 100 mEq/g, 95% CI: 1.008-5.745, P=.048) to an antiproteinuric response <50% after renin-angiotensin-aldosterone system blockade.
ConclusionsA high salt intake results in a smaller proteinuria decrease in kidney transplant recipients with proteinuria treated with ACEI/ARB drugs.
El desarrollo de proteinuria, incluso de pequeña cuantía, tras el trasplante renal se asocia a una reducción en la supervivencia del injerto y del paciente, por lo que su control tiene un gran interés1–3. Desafortunadamente, un elevado número de trasplantados renales desarrolla proteinuria. En un estudio de 613 trasplantes renales, hasta el 45% de ellos presentaba proteinuria por encima de 150mg/día, de los que un 65% estaba por debajo de 500mg/día. Las biopsias de estos pacientes con proteinuria presentaban mayoritariamente fibrosis intersticial y atrofia tubular o no tenían hallazgos específicos, salvo en los que tenían una proteinuria por encima de 1.500mg/día, en los que predominaba la afectación glomerular4. Entre los factores que influyen en la aparición de proteinuria se encuentran el trasplante de donante femenino a receptor masculino, la edad avanzada del donante, la función renal, la presión arterial, el rechazo celular y el rechazo mediado por anticuerpos, la recurrencia de la glomerulonefritis, la isquemia caliente y fría prolongada y el retraso en la función inicial del injerto, entre otros4–6.
Las medidas que se utilizan en la actualidad para reducir la proteinuria postrasplante son el control estricto de la presión arterial, el bloqueo del eje renina-angiotensina-aldosterona (RAA) con inhibidores de la enzima de conversión (IECA) o bloqueantes del receptor de angiotensina II (ARA-II), mejorar el control lipídico, suspender el hábito tabáquico y mantener un peso adecuado7. En concreto, las guías KDIGO recomiendan usar IECA o ARA-II en los pacientes con glomerulonefritis recurrente y proteinuria y en los pacientes hipertensos con proteinuria ≥ 1g/día8.
En la población general el bloqueo del eje RAA se ha demostrado eficaz para disminuir la proteinuria, controlar la hipertensión y la progresión de la enfermedad renal crónica (ERC) tanto en pacientes con nefropatía diabética como no diabética9,10. Por el contrario, aunque algunos estudios han demostrado la eficacia del efecto antiproteinúrico del bloqueo del eje RAA en el ámbito del trasplante renal11,12, no se dispone de información precisa sobre la eficacia del descenso de la proteinuria para preservar la función renal y mejorar la supervivencia del injerto y del paciente12–16.
En los pacientes con ERC no trasplantados se conocen diversos factores que pueden reducir el efecto antiproteinúrico del bloqueo del eje RAA17–22. Uno de estos factores es la ingesta de sal. En un metaanálisis que incluía 11 estudios se ha podido cuantificar que, por cada reducción en la ingesta de sodio de 92 mEq/día, se disminuía un 32,1% la albuminuria22. Ninguna de las cohortes incluidas en el metaanálisis incluía trasplantados renales. El objetivo de nuestro estudio es valorar la relación entre la ingesta de sodio y el efecto antiproteinúrico de los IECA y ARA-II en nuestra población de trasplantados renales.
MétodosPoblación y diseño del estudioDe la población de 1.423 trasplantados renales realizados en nuestro centro entre octubre de 1986 y mayo de 2012 seleccionamos a 137 pacientes: 1) con más de 3 meses de evolución postrasplante, 2) que presentaban proteinuria mayor de 1 g/día, 3) que hubieran recibido tratamiento con IECA o ARA-II durante más de 6 meses y 4) en los que se dispusiera de una determinación del cociente sodio/creatinina en orina antes de iniciar IECA o ARA-II. Se excluyó a 34 pacientes con variaciones de la creatinina plasmática mayores del 25% antes de iniciar IECA o ARA-II, y a aquellos en que se había modificado el tratamiento diurético en el mes previo al inicio de IECA o ARA-II o a lo largo de los 6 meses de seguimiento. En nuestra unidad todos los pacientes son entrenados para realizar una recogida precisa de orina de 24 h en cada visita de rutina y todos reciben consejo dietético específico para seguir una dieta pobre en grasas y sal. Un total de 40 pacientes (38,8%) estaban recibiendo tratamiento diurético. Las dosis de IECA y ARA-II fueron estandarizadas para una dosis equivalente de enalapril de acuerdo con guías farmacológicas y estudios previos sobre el efecto antiproteinúrico a dosis equivalentes23–25. El estudio se realizó cumpliendo los criterios de la Declaración de Helsinki.
Recogida de datosLas características de los pacientes y los datos analíticos se recogieron al inicio del bloqueo del eje RAA y a los 6 meses (tabla 1) y se extrajeron de la base de datos de trasplantados renales de nuestro centro alimentada de forma prospectiva. Las variables recogidas fueron la edad del donante y del receptor, el peso, la causa de la ERC, la causa de la proteinuria, los fármacos inmunosupresores, el tiempo desde el trasplante al inicio del bloqueo RAA y los datos analíticos. La proteinuria se determinó por el método del rojo de pirogalol-molibdato en orina de 24 h. La ingesta de sodio se estimó con la excreción de sodio en la orina de 24 h y se normalizó con la excreción de creatinina mediante el cociente sodio/creatinina para evitar posibles errores en la recogida. La presión arterial se midió 3 veces, separadas 5 min por un sistema automático y se utilizó la última lectura.
Características basales y a los 6 meses de los pacientes
| Basal | 6 meses | p | |
|---|---|---|---|
| Edad del receptor, años | 51 (13) | - | - |
| Sexo del receptor (varón), % | 80,6 | - | - |
| Peso, kg | 75 (14) | 75 (13) | 0,064 |
| Causa ERC, % | - | ||
| Diabetes | 9,7 | ||
| Glomerulonefritis | 44,7 | ||
| Vascular/nefroangiosclerosis | 12,6 | ||
| Edad del donante, años | 42 (17) | - | - |
| Creatinina sérica, mg/dl | 2,16 (0,76) | 2,42 (1,31) | 0,012 |
| Filtrado glomerular, ml/min/1,73m2 | 37 (14) | 35 (16) | 0,003 |
| Potasio, mEq/l | 4,2 (0,6) | 4,5 (0,6) | 0,000 |
| TA sistólica, mmHg | 141 (17) | 135 (16) | 0,000 |
| TA diastólica, mmHg | 83 (11) | 78 (9) | 0,000 |
| Excreción urinaria sodio/creatinina, mEq/g | 113 (48) | 113 (50) | 0,940 |
| Excreción urinaria creatinina, mg/día | 1.528 (650) | 1.469 (519) | 0,205 |
| Proteinuria, mg/día | 2.200 (RIC 3.378) | 1.284 (RIC 2.196) | 0,000 |
| Proteinuria menor de 1g, % | 0 | 44,7 | - |
| Causa de la proteinuria, % | - | - | |
| Afectación glomerular | 22,3 | ||
| FIAT | 65 | ||
| Inhibidores mTOR | 8,7 | ||
| No filiada | 3,9 | ||
| IECA/ARA-II, % | 44,6/55,4 | - | - |
| Inhibidores de la calcineurina, % | 85,4 | - | - |
| Azatioprina, % | 12,6 | - | - |
| Micofenolato, % | 61,2 | - | - |
| Inhibidores mTOR, % | 18,4 | - | - |
| Tiempo desde el trasplante al inicio de IECA/ARA-II, días | 1.097 (RIC 2.363) |
ARA-II; antagonistas del receptor de angiotensina; ERC: enfermedad renal crónica; FIAT: fibrosis intersticial y atrofia tubular; IECA: inhibidores de la enzima convertidora de angiotensina; mTOR: mammalian target of rapamycin; RIC: rango intercuartílico; TA: tensión arterial.
Entre paréntesis, se expresa la desviación estándar.
Las variables categóricas se expresaron como frecuencias relativas y las continuas como medias±desviación estándar, excepto aquellas que no tenían distribución normal que se reportaron como mediana y rango intercuartílico (RIC). Se establecieron los terciles del cociente sodio/creatinina urinario y se estimó su ingesta de sal (<87 mEq/g; entre 87 y 138 mEq/g; >138 mEq/g; los puntos de corte de 87 y 138 mEq/g son equivalentes a 6,4 y 9,4g de sal al día). La proteinuria, el cociente sodio/creatinina en orina, la excreción de creatinina en orina, la función renal y el potasio sérico se compararon en el momento basal y a los 6 meses mediante la prueba t para muestras pareadas. Se analizó la relación entre las variables cuantitativas mediante análisis de correlación. Se utilizó el test de Kruskal-Wallis para establecer la relación entre el porcentaje de descenso de la proteinuria y los terciles del cociente sodio/creatinina en orina. Se definió la respuesta antiproteinúrica inadecuada cuando el porcentaje de reducción de la proteinuria era menor del 50%. Los factores de riesgo de respuesta antiproteinúrica inadecuada se analizaron mediante el test t de Student, U de Mann-Whitney y Chi-cuadrado. Se llevó a cabo un análisis multivariante de regresión logística con todas las variables significativas. Se consideró un valor de p<5% como estadísticamente significativo. Para realizar los análisis se utilizó el programa estadístico SPSS, versión 15.0 (SPSS Inc, Chicago, IL, EE. UU.).
ResultadosLas características basales y a los 6 meses de los pacientes están reflejadas en la tabla 1. Un 55,4% de los pacientes recibieron IECA y un 44,6%, ARA-II. A los 6 meses de iniciar el bloqueo del eje RAA se elevó la creatinina sérica, aumentaron los niveles de potasio, se redujeron la TA sistólica y diastólica y se redujo la proteinuria de 24 h de forma significativa (tabla 1). Por el contrario, no hubo diferencias significativas a los 6 meses ni en la excreción urinaria de sodio ni de creatinina, ni tampoco en el cociente sodio/creatinina en orina (tabla 1). En 46 pacientes (44,7%) se redujo la proteinuria por debajo de un gramo tras 6 meses del bloqueo del eje RAA. No encontramos diferencias significativas en el cociente inicial sodio/creatinina entre los pacientes con y sin tratamiento diurético (p=0,083).
Un cociente sodio/creatinina urinario elevado se relacionaba con un menor descenso de la proteinuria a 6 meses (r=−0,251; p=0,011) y con un menor porcentaje de descenso de la proteinuria con respecto a la proteinuria basal (r=−0,211; p=0,033). De forma similar, el porcentaje de reducción de la proteinuria con respecto de la basal fue significativamente menor en los pacientes en el tercil más alto del cociente urinario sodio/creatinina [63,9% (RIC 47,1%); 60,1% (RIC 55,4%); 38,9% (RIC 85,5%); p=0,047] (fig. 1). El descenso de proteinuria en valor absoluto a los 6 meses fue menor para el tercil más alto, pero sin alcanzar significación estadística [1.161mg (RIC 2.406mg); 978mg (RIC 1.299mg); 696mg (RIC 1.422mg); p=0,056].
En la tabla 2 se muestran los factores relacionados con un porcentaje de descenso de la proteinuria menor del 50% (52 pacientes). El uso de inhibidores de mTOR y un menor cociente sodio/creatinina en orina se relacionan de forma significativa con una reducción en la proteinuria mayor de 50%. Ni la creatinina ni el filtrado glomerular se relacionaron con la disminución de la proteinuria en porcentaje (tabla 2) o en valor absoluto (datos no presentados). Tampoco las dosis de IECA y ARA-II estandarizadas para enalapril se relacionaron con la disminución de la proteinuria (p = 0,149). Mediante el análisis de regresión logística, incluyendo las variables significativas (uso de inhibidores de mTOR y cociente sodio/creatinina), el cociente urinario de sodio/creatinina fue el único factor relacionado de forma independiente (OR 2,406 por 100 mEq/g; IC95%: 1,008-5,745; p=0,048) a una respuesta no adecuada antiprotineinúrica tras el bloqueo del eje RAA en trasplantados renales.
Factores de riesgo relacionados con un porcentaje de descenso de la proteinuria mayor del 50%
| Porcentaje ≥ 50% | Porcentaje<50% | p | |
|---|---|---|---|
| (n=53) | (n=50) | ||
| Edad receptor, años | 48 (13) | 53 (13) | 0,068 |
| Sexo receptor (varón), % | 84,9 | 76,0 | 0,253 |
| Peso, kg | 76 (13) | 74 (14) | 0,367 |
| Edad donante, años | 40 (19) | 44 (15) | 0,237 |
| Creatinina, mg/dl | 2,22 (0,79) | 2,10 (0,74) | 0,425 |
| Filtrado glomerular, ml/min/1,73 m2 | 37 (15) | 38 (14) | 0,917 |
| TA sistólica basal, mmHg | 140 (19) | 142 (14) | 0,556 |
| TA diastólica basal, mmHg | 83 (10) | 82 (12) | 0,663 |
| TA sistólica 6 meses, mmHg | 132 (15) | 137 (17) | 0,219 |
| TA diastólica 6 meses, mmHg | 78 (7) | 78 (11) | 0,938 |
| Descenso de TA sistólica, mmHg | 8,9 (16,7) | 5,7 (17,2) | 0,415 |
| Descenso de TA diastólica, mmHg | 5,6 (9,1) | 4,2 (11,0) | 0,534 |
| Cociente urinario sodio/creatinina basal, mEq/g | 103 (43) | 124 (51) | 0,029 |
| Tercer tercil cociente urinario sodio/creatinina, % | 24,5 | 44,0 | 0,114 |
| Cociente urinario sodio/creatinina 6 meses, mEq/g | 103 (39) | 123 (58) | 0,045 |
| Causa de proteinuria, % | |||
| Afectación glomerular | 30,0 | 15,1 | 0,287 |
| FIAT | 60,0 | 69,8 | |
| Inhibidores mTOR | 6,0 | 11,3 | |
| No filiada | 4,0 | 3,8 | |
| Uso de inhibidores mTOR | 26,4 | 10,0 | 0,032 |
| Dosis normalizada a enalapril, % | 0,149 | ||
| 2,5mg | 4 (8) | 0 (0) | |
| 5mg | 24 (48) | 31 (58,5) | |
| 10mg | 18 (36) | 17 (32,1) | |
| 20mg | 2 (4) | 5 (9,4) | |
| 30mg | 1 (2) | 0 (0) | |
| 40mg | 1 (2) | 0 (0) | |
| Tiempo desde el trasplante al inicio de IECA/ARA-II, días | 1.097 (RIC 2.630) | 1.111 (RIC 1.874) | 0,444 |
ARA-II: antagonistas del receptor de angiotensina; FIAT: fibrosis intersticial y atrofia tubular; IECA: inhibidores de la enzima convertidora de angiotensina; mTOR: mammalian target of rapamycin; RIC: rango intercuartílico.
Entre paréntesis, se expresa la desviación estándar.
De manera similar a estudios previos realizados en pacientes trasplantados y no trasplantados9,26, en nuestro estudio observamos que los fármacos bloqueantes del eje RAA reducen de forma significativa la proteinuria. A los 6 meses de tratamiento se redujo la proteinuria media de 3,6 a 2,2g/día y en casi la mitad de los pacientes (44,7%) la proteinuria se redujo por debajo de 1g/día. Las ventajas del uso de IECA/ARA-II en el trasplante renal continúan siendo controvertidas, con estudios en los que no se observa mejoría histológica, ni de la supervivencia del injerto, ni del paciente, ni en el riesgo cardiovascular15,16,27, con otros en los que aumenta la supervivencia del paciente, pero no la del injerto28 y otros en los que mejoran ambas29. En este último trabajo, precisamente, el mayor beneficio sobre la evolución del injerto se observó en aquellos pacientes con valores de proteinuria más elevados29. Ya sea por un efecto específico del bloqueo RAS, o no, lo que está demostrado es que la reducción de la albuminuria a corto plazo ejerce un efecto nefroprotector a largo plazo.
En un metaanálisis de 21 ensayos clínicos que incluía a 78.342 pacientes, Heerspink et al. observaron que por cada reducción de albuminuria de un 30% bloqueando el sistema RAA disminuía el riesgo de ERC estadio 5 un 32% a largo plazo30. La reducción de aproximadamente un 39% en la proteinuria observada en nuestro estudio con bloqueantes RAA podría conducir a una reducción en la pérdida de injertos renales a largo plazo de más de 30%, aunque este efecto se debería comprobar en estudios a largo plazo. El hecho de que no se haya demostrado beneficio en la evolución renal al reducir la proteinuria con IECA/ARA-II en la población trasplantada renal, pero sí en la población general, puede deberse tanto a las características específicas de los pacientes trasplantados (específicamente el tratamiento inmunosupresor, sobre todo con anticalcineurínicos y el daño aloinmune) como a problemas metodológicos. Por ejemplo, en el metaanálisis de Heerspink et al., un tamaño muestral por debajo de 1.250 o la causa de la nefropatía influían en la capacidad de los estudios para demostrar beneficio del bloqueo del eje RAA30. En el trasplante renal es difícil llevar a cabo estudios a largo plazo y con gran número de pacientes que permitan corroborar el beneficio a largo plazo de IECA y ARA-II.
El efecto de la dieta sosa sobre la TA está reconocido tanto en población trasplantada como en la población general31. A pesar de ello, un elevado número de pacientes con ERC presenta una ingesta de sal por encima de las recomendaciones de la OMS (por debajo de 5g/día)32. Entre los trasplantados renales, hasta un 87% presentan una excreción urinaria de sodio que refleja una ingesta de sal por encima de 5 g. Además, la ingesta de sal se mantiene a lo largo del tiempo en cada paciente y en la población global, a pesar de las recomendaciones realizadas31,33,34. Todo ello refleja que, a pesar de su dificultad, disponemos de una oportunidad para mejorar la evolución de los receptores de trasplante renal intensificando las medidas dietéticas sin requerir tratamientos farmacológicos.
El hallazgo principal de nuestro estudio es que la dieta rica en sal limita el efecto antiproteinúrico de los IECA y ARA-II en la población trasplantada renal, de forma similar a lo anteriormente publicado en pacientes con ERC. En un estudio prospectivo de 500 pacientes no diabéticos con ERC, Vegter et al. demostraron que los pacientes en el tercil alto del cociente urinario sodio/creatinina presentaron un menor descenso de la proteinuria con ramipril (20%) que los pacientes con menor ingesta de sal (25 y 31%) lo que llevó a un mayor riesgo de desarrollar ERC estadio 517. En nuestra población de trasplantados renales el porcentaje de reducción en la proteinuria del tercil superior del cociente sodio/creatinina al inferior fue 16, 41 y 43%, respectivamente. La magnitud del efecto antiproteinúrico de la dieta sosa se ha demostrado que puede llegar a ser más eficaz, incluso, que el doble bloqueo del sistema RAA o tan eficaz como el tratamiento diurético18,20. Así, en un ensayo aleatorizado de 52 pacientes con nefropatía no diabética la reducción de la proteinuria al añadir dieta sosa al tratamiento con IECA fue significativamente mayor que la reducción de proteinuria al añadir ARA-II al IECA (51 vs. 21%; p<0,001)18. También en 34 pacientes con proteinuria sin diabetes en los que el tratamiento con losartan disminuía la proteinuria un 30%, la adición de hidroclorotiazida conseguía una reducción del 56% y, al añadir dieta sosa, del 55%20.
Por todo ello, parece recomendable insistir en que también el paciente trasplantado siga una dieta baja en sal, especialmente en los que presentan proteinuria que no ha respondido, o solo lo ha hecho parcialmente, al bloqueo del eje RAA. Dadas las diferencias entre el tercil superior de consumo de sal y los terciles medio e inferior en nuestro estudio, podemos recomendar al menos una disminución moderada en la ingesta de sodio para mejorar la respuesta antiproteinúrica al tratamiento con IECA/ARA-II, sin que sea precisa una restricción severa. Es previsible que, de forma paralela a lo observado en población ERC no trasplantada, una mayor reducción de la proteinuria contribuya a mejorar la supervivencia del injerto renal.
No se conocen completamente los mecanismos fisiopatológicos que contribuyen al efecto antiproteinúrico de asociar la restricción de sal. En condiciones normales la ingesta de sal se asocia con un aumento en el sodio sérico que activa el centro de la sed y estimula la secreción de hormona antidiurética. Todo ello conlleva un aumento del volumen circulante, de la presión arterial y del filtrado glomerular, que disminuye el estímulo activador de la renina, lo que hace menos eficaz el bloqueo del eje RAA para la hipertensión arterial y la proteinuria. Si disminuye el sodio sérico, se reduce el volumen circulante y la presión arterial, se activa el eje RAA y su bloqueo se vuelve más efectivo22. Por otro lado, el sodio parece jugar un papel en el endotelio. Verhave et al. demostraron que la ingesta de sal aumenta la albuminuria de forma independiente de la presión arterial35, un hecho que refleja el daño específico endotelial. Nosotros tampoco encontramos una relación entre los cambios en la presión arterial y la respuesta antiproteinúrica, un hallazgo previamente descrito por algunos autores y que apunta a que la reducción en la proteinuria inducida por la restricción de sal está influida tanto por la presión intraglomerular como por la TA sistémica17. Este daño endotelial podría estar mediado también por mecanismos inflamatorios: se ha observado incluso que la ingesta elevada de sal se asocia tanto con mayor albuminuria como con una PCR elevada en pacientes hipertensos22,36.
Al analizar los factores que se podrían relacionar con la respuesta antiproteinúrica, observamos que el uso de inhibidores de mTOR se asocia a una mayor respuesta antiproteinúrica con IECA/ARA-II, aunque este hallazgo no se confirmó en el análisis multivariante. El uso de IECA/ARA-II se ha demostrado eficaz en la literatura para tratar e, incluso, prevenir la proteinuria desarrollada tras la conversión desde anticalcineurínicos a inhibidores de mTOR37. Se han descrito varios mecanismos que contribuyen a la aparición de proteinuria con los inhibidores de mTOR. La mayoría de la veces la proteinuria aparece tras la conversión desde inhibidores de la calcineurina, probablemente en relación con la suspensión de su efecto vascoconstrictor38,39. Hay algunas hipótesis que apuntan a un posible daño tubular y glomerular directo y se han reportado casos de glomerulosclerosis segmentaria y focal39,40. No se dispone de estudios específicos que demuestren una mayor respuesta antiproteinúrica con IECA/ARA-II en pacientes tratados con inhibidores de mTOR. Para explicar nuestro hallazgo, podemos especular con 2 potenciales mecanismos; 1) IECA y ARA-II reducen la presión capilar glomerular que habría aumentado tras la retirada de los anticalcineurínicos y el inicio del inhibidor de mTOR y 2) tanto IECA como ARA-II revierten el daño mediado por angiotensina-II específicamente inducido por mTOR sobre la recaptación de albúmina en el túbulo proximal40.
La principal limitación de nuestro estudio está derivada de que es un estudio observacional en que los pacientes tienen fármacos y dosis diferentes de IECA y ARA-II. Sin embargo, sí refleja la práctica clínica habitual en que las dosis se ajustan en función de la evolución de la TA, del potasio y de la creatinina. No encontramos respuestas antiproteinúricas distintas normalizando a una dosis estándar de enalapril, lo que puede explicarse porque la mayoría de los pacientes estaban recibiendo 5mg de enalapril y se mantuvo la misma dosis durante todo el periodo de estudio (tabla 2). Como se comentó anteriormente, la ausencia de relación entre los cambios de TA y el efecto antiproteinúrico de la restricción de sal indica que la dieta sosa ejerce su efecto antiproteinúrico adicional a través de mecanismos parcialmente independientes del descenso de la TA y de la dosis de IECA/ARA-II utilizada. Una segunda limitación es que es un estudio de un solo centro, con un tamaño muestral limitado. A pesar de ello, la relación significativa entre el cociente urinario de sodio/creatinina y la respuesta antiproteinúrica apunta a que existe una asociación entre ambas. Son necesarios estudios más grandes, multicéntricos y prospectivos para confirmar el papel de la ingesta de sodio en la respuesta antiproteinúrica del bloqueo de eje RAA en los trasplantados renales.
Para concluir, nuestro estudio señala que, en los trasplantados renales con proteinuria tratados con IECA/ARA-II, una ingesta elevada de sal se asocia con un menor descenso de la proteinuria y, posiblemente, con una menor supervivencia del injerto. Evitar una ingesta excesiva de sal es una medida necesaria y efectiva que debe asociarse al bloqueo del eje RAA.
Conflicto de interesesLos autores no tienen conflictos de interés.