La disminución de hormonas tiroideas (HT) y el daño miocárdico son frecuentes en pacientes en diálisis y están asociados con la mortalidad. Sin embargo, poco se conoce de la importancia de las HT como factor de daño miocárdico, como se ha descrito en las enfermedades tiroideas primarias. El objetivo de este estudio fue explorar si existe interacción entre la disminución de triyodotironina total (tT3) y los marcadores de daño miocárdico y la relación de esta interacción entre ambos con la mortalidad, para establecer si el daño cardiovascular es el vínculo entre la disminución de HT y el riesgo de muerte en pacientes con ERC en diálisis.
Material y métodosSe estudiaron los niveles plasmáticos de HT, de marcadores de nutrición, inflamación y de daño al miocardio en 296 pacientes en diálisis peritoneal o en hemodiálisis, a los que se vigiló por 16 meses para conocer la asociación de las variables bioquímicas con la mortalidad.
ResultadosEn el 45% de los pacientes se encontró tT3 disminuida, lo cual tuvo correlación inversa con la proteína C reactiva (PCR) y con el NT-proBNP y directa con la albúmina y la transferrina. La diabetes, la PCR y la tT3 fueron factores de riesgo para la mortalidad por cualquier causa y la PCR, el NT-proBNP y la tT3 para mortalidad cardiovascular.
ConclusionesLos niveles bajos de tT3 son frecuentes en pacientes en diálisis, se asocian con inflamación, desnutrición y daño miocárdico: este último puede ser el vínculo entre la disminución de HT y la mortalidad por cualquier causa y la mortalidad cardiovascular.
Low thyroid hormone (TH) levels and myocardial damage are common in dialysis patients and are associated with mortality. However, little is known about the role of THs on myocardial damage as has been described in primary thyroid diseases. The aim of this study was to explore the potential relationship between low total triiodothyronine (total T3) and biomarkers of myocardial damage and the effect of their interaction on mortality, to ascertain if cardiovascular damage is the link between low THs and the risk of death in dialysis patients with CKD.
Material and methodsTH plasma levels, nutritional markers, inflammation and myocardial damage were studied in 296 patients undergoing peritoneal dialysis or haemodialysis, who were followed up for 16 months to ascertain the association between biochemical variables and mortality.
ResultsLow total T3 levels were found in 45% of patients, which was inversely correlated with C-reactive protein (CRP) and NT-proBNP, and directly correlated with albumin and transferrin. Diabetes, CRP and total T3 were risk factors for all-cause mortality, and CRP, NT-proBNP and total T3 for cardiovascular mortality.
ConclusionsLow total T3 levels are common in dialysis patients and are associated with inflammation, malnutrition and myocardial damage. The latter may be the link between low THs and all-cause and cardiovascular mortality.
Las alteraciones funcionales en el eje hipotálamo-hipófisis-tiroides y de la acción periférica de las hormonas tiroideas (HT) son frecuentes en pacientes con enfermedad renal crónica (ERC). El hallazgo más consistente es la reducción en los niveles plasmáticos de triyodotironina total (tT3) y libre (fT3). Es común aceptar que estos cambios son un componente del síndrome de la enfermedad no tiroidea, puesto que la hormona estimulante de la tiroides (TSH) en plasma está generalmente dentro de los límites normales. La enfermedad no tiroidea y los niveles disminuidos de T3 se han interpretado como una adaptación al proceso de desgaste en pacientes con enfermedad crónica, con el objetivo global de reducir el metabolismo corporal1-4.
La trascendencia de los cambios hormonales en los desenlaces clínicos de pacientes con ERC se ha estudiado solo en años recientes. En esos estudios se ha encontrado que la disminución en los niveles de T3, así como de tiroxina (T4) tiene valor predictivo independiente para la muerte por cualquier causa y, particularmente, para la de causa cardiovascular en pacientes con ERC en etapa de prediálisis, en pacientes en hemodiálisis (HD) o en diálisis peritoneal (PD)5-8.
La causa más frecuente de comorbimortalidad en los pacientes con ERC son las enfermedades cardiovasculares. Sin embargo, se conoce poco de la interacción entre la disminución de HT y las alteraciones cardiovasculares en pacientes renales, a pesar de que se ha demostrado que la disminución primaria de las HT tienen una amplia gama de efectos negativos sobre la función y estructura del miocardio. Entre otros efectos, se ha relacionado la disminución de HT con disfunción endotelial, así como con disfunción sistólica9-11 y diastólica, esta última como expresión de fibrosis del miocardio12.
El objetivo de este estudio fue explorar si existe asociación entre los niveles disminuidos de T3 y los marcadores de daño miocárdico —en este caso con el incremento de los niveles plasmáticos de la fracción N-terminal del propéptido natriurético cerebral (NT-proBNP)— y de esta interacción entre ambos con la mortalidad, para establecer si el daño cardiovascular es un vínculo entre la disminución de las HT y el riesgo de muerte en pacientes con ERC en diálisis.
Material y métodosDiseñoSe planteó el estudio de una cohorte prospectiva de pacientes prevalentes en tratamiento con diálisis en 6hospitales con programas de DP y HD crónica, todos atendidos en el Instituto Mexicano del Seguro Social (IMSS) en la Ciudad de México y la de Guadalajara. El protocolo fue aprobado por los comités de ética e investigación de cada uno de los centros participantes. Todos los pacientes firmaron una carta de consentimiento informado para participar en el estudio.
PacientesSe tomó una muestra al azar de pacientes prevalentes de DP y HD crónicas en cada centro. Todos los pacientes fueron adultos (≥18 años). No se aplicaron restricciones por su género, por etiología de la ERC ni por tiempo en la terapia. Desde un mes antes del reclutamiento todos los pacientes estaban clínicamente estables, libres de infecciones y complicaciones agudas. Fueron excluidos los pacientes seropositivos para VIH, hepatitis B o C, con cáncer o en tratamiento con inmunosupresores, así como pacientes con diagnóstico previo de enfermedades tiroideas, enfermedad vascular cerebral o periférica, insuficiencia cardiaca o cardiopatía isquémica actuales o anteriores. Se registró la prescripción de medicamentos con efecto conocido en la evaluación de la función tiroidea. El tamaño de la muestra fue calculado en 250 sujetos, considerando una proporción esperada de 0,40 (IC: 0,125) de pacientes con niveles bajos de HT.
ProcedimientosSe revisaron los expedientes clínicos y se extrajeron los datos demográficos y los datos relevantes de la enfermedad renal. Se hizo un análisis de composición corporal por bioimpedancia eléctrica (Biodynamics, Seattle, WA, EE. UU.). Se tomaron muestras de sangre venosa después de una noche de ayuno; de ellas, se separó el plasma en alícuotas, que se congelaron a −70°C hasta el momento de las pruebas bioquímicas. Todas las evaluaciones fueron hechas al inicio del seguimiento en un laboratorio centralizado. Para los pacientes en HD, se les tomó la muestra de sangre el día que no fueron dializados entre la primera y segunda sesión de la semana (media semana). Las visitas subsecuentes fueron programadas cada mes. El promedio del periodo de seguimiento fue de 16 meses. Los pacientes que sobrevivieron fueron seguidos al menos por 12 meses.
Pruebas de laboratorioLa glucosa, nitrógeno de urea sanguínea, creatinina, albúmina, colesterol total y triglicéridos fueron medidos por métodos convencionales en un equipo Hitachi 902 Automatic Analyzer (Roche Diagnostics GmbH, Mannheim, Alemania). La PCR fue medida con inmunoturbidimetría de alta sensibilidad (Tina-quant CRP-HS, Roche Diagnostics GmbH, Mannheim, Alemania). El NT-proBNP fue medido por inmunoanálisis (ECLIA Roche Diagnostics GmbH, Mannheim, Alemania) (los coeficientes de variación fueron 5,4 y 6,5% para intra- e interanálisis, respectivamente). La troponina i cardiaca (cTnI) se midió por RIA (Diagnostic Automation Inc., Calabasas, CA, EE. UU.) (los coeficientes de variabilidad fueron 6,1 y 6,7% para intra- e interanálisis). Las HT (fT3, tT3, fT4, tT4, y TSH) fueron medidas por RIA con kits estándares comerciales (CIS Bio International, Gif-sur Yvette, Francia). Los coeficientes de variación de las HT fueron fT3: 5,01; 5,42; tT3: 7,77; 8,17; fT4: 5,52; 8,85; tT4: 4,70; 8,00 y TSH: 2,80; 4,20%, para intra- e interanálisis, respectivamente.
Análisis estadísticoLos valores se muestran como frecuencias y porcentajes o como promedio±desviación estándar, según las características de las variables. Para las diferencias entre grupos, se aplicaron, de acuerdo con el tipo de variable, la prueba t de Student o la prueba de chi cuadrada. Se utilizó correlación múltiple (Pearson) para el análisis de correlación entre albúmina sérica, PCR, NT-proBNP, cTnI, y HT, controlándolas por género, estatus diabético, composición corporal y modalidad de diálisis. Los factores de riesgo para mortalidad se analizaron con el modelo de riesgo proporcional de Cox. Todos los cálculos estadísticos fueron hechos con SPSS, versión 17.0 (Chicago, IL, EE. UU.).
ResultadosLa población susceptible de estudio fue de 749 pacientes; de ellos, 400 fueron seleccionados al azar e invitados a participar. De ellos, 67 declinaron participar debido a problemas con el horario de toma de muestras, 21 pacientes fueron excluidos debido a problemas para asistir al hospital durante el periodo de seguimiento y 16 pacientes adicionales no acudieron a la toma de muestras para las pruebas bioquímicas iniciales.
Un total de 296 pacientes fueron incluidos en el estudio. La causa de la ERC fue nefropatía diabética en el 50,7% de los pacientes; causa desconocida en el 26,4%; hipertensión en el 6,4%; riñón poliquístico en el 6,1%; uropatía obstructiva en el 3,7%; pielonefritis crónica en el 2%; lupus en otro 2% y enfermedades diversas en el 2,8%. La medicación regular incluyó el tratamiento con eritropoyetina en el 26%. El 42% recibieron suplementos de hierro, principalmente por vía oral; el 87% recibieron carbonato de calcio como quelante de fosfato; el 5% recibieron calcitriol; el 67% recibieron al menos un antihipertensivo y el 44% recibieron 2o más antihipertensivos. Los más frecuentemente usados fueron los inhibidores de la enzima conversora de angiotensina. Entre los 296 pacientes, los tratados por HD (n=127) recibieron un plan de 3 sesiones por semana, 4 h por sesión; todos ellos fueron dializados usando filtros de polisulfona de alto flujo. Los pacientes de DP (DP continua ambulatoria y DP automatizada) (n=169) recibieron un plan con soluciones de glucosa.
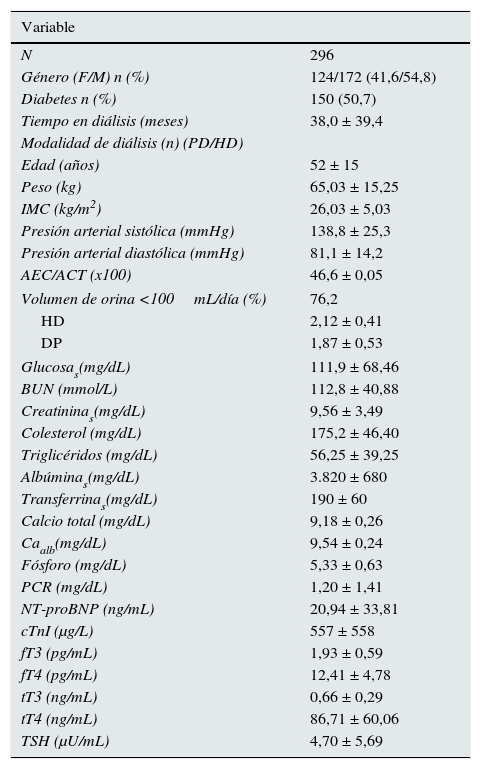
Los datos demográficos, clínicos y bioquímicos se muestran en la tabla 1. Ninguno de los sujetos tuvo antecedentes de enfermedad tiroidea primaria. La tabla 1 también muestra valores de las HT. Los niveles de tT3 estuvieron por debajo del límite normal (tT3 < 0,60ng/mL) en el 44,3% de los pacientes. Los valores bajos de fT3 (fT3 < 2,3pg/mL) fueron más frecuentes (52,8%). La TSH fue superior a 5,0μU/mL en 72 casos (25,7%). En 21 de estos pacientes (27,0%), fue superior a 10,0μU/mL. Los pacientes con diabetes tuvieron niveles menores de fT3 (1,87±0,66 vs. 2,01±0,52pg/mL; p<0,04) y tT3 (0,59±0,29 vs. 0,74±0,28ng/mL; p<0,001) comparados con los no diabéticos y la TSH fue superior a 5,0μU/mL en el 32,7% de los diabéticos y solo en el 18,5% de los no diabéticos (p<0,01). No hubo diferencia entre los niveles de las HT según las modalidades de diálisis.
Variables al inicio del estudio
| Variable | |
|---|---|
| N | 296 |
| Género (F/M) n (%) | 124/172 (41,6/54,8) |
| Diabetes n (%) | 150 (50,7) |
| Tiempo en diálisis (meses) | 38,0 ± 39,4 |
| Modalidad de diálisis (n) (PD/HD) | |
| Edad (años) | 52 ± 15 |
| Peso (kg) | 65,03 ± 15,25 |
| IMC (kg/m2) | 26,03 ± 5,03 |
| Presión arterial sistólica (mmHg) | 138,8 ± 25,3 |
| Presión arterial diastólica (mmHg) | 81,1 ± 14,2 |
| AEC/ACT (x100) | 46,6 ± 0,05 |
| Volumen de orina <100mL/día (%) | 76,2 |
| HD | 2,12 ± 0,41 |
| DP | 1,87 ± 0,53 |
| Glucosas(mg/dL) | 111,9 ± 68,46 |
| BUN (mmol/L) | 112,8 ± 40,88 |
| Creatininas(mg/dL) | 9,56 ± 3,49 |
| Colesterol (mg/dL) | 175,2 ± 46,40 |
| Triglicéridos (mg/dL) | 56,25 ± 39,25 |
| Albúminas(mg/dL) | 3.820 ± 680 |
| Transferrinas(mg/dL) | 190 ± 60 |
| Calcio total (mg/dL) | 9,18 ± 0,26 |
| Caalb(mg/dL) | 9,54 ± 0,24 |
| Fósforo (mg/dL) | 5,33 ± 0,63 |
| PCR (mg/dL) | 1,20 ± 1,41 |
| NT-proBNP (ng/mL) | 20,94 ± 33,81 |
| cTnI (μg/L) | 557 ± 558 |
| fT3 (pg/mL) | 1,93 ± 0,59 |
| fT4 (pg/mL) | 12,41 ± 4,78 |
| tT3 (ng/mL) | 0,66 ± 0,29 |
| tT4 (ng/mL) | 86,71 ± 60,06 |
| TSH (μU/mL) | 4,70 ± 5,69 |
Datos presentados como promedio±DE o mediana y rango a menos que se indique lo contrario.
AEC/ACT (×100): agua extracelular/agua corporal total (×100); Albúminas: albúmina sérica; BUN: nitrógeno de urea sanguínea; Caalb: calcio total sérico corregido por albúmina; cTnI: troponina I cardiaca; DP: diálisis peritoneal; fT3: triyodotironina libre; fT4: tiroxina libre; Glucosas: glucosa sérica; HD: hemodiálisis; IMC: índice de masa corporal; NT-proBNP: fracción N terminal del propéptido natriurético cerebral; PCR: proteína C-reactiva; TSH: hormona estimulante de la tiroides; tT3: triyodotironina total; tT4: tiroxina total.
Los límites normales de hormonas tiroideas son T3 total: 0,6-1,9ng/mL; T3 libre: 2,00-4,25pg/mL; T4 total: 45-110ng/mL; T4 libre: 7-18pg/mL y TSH: 0,25-4,00μU/mL.
Las variables relacionadas con composición corporal y nutrición estuvieron fuera de los rangos normales en un número importante de pacientes. El promedio del IMC estuvo en rango de sobrepeso. Cuando se evaluó el IMC por género, se encontraron con valores bajos solo el 2% de los pacientes, en rango normal el 46% y con sobrepeso u obesidad el 52%. El sobrepeso y la obesidad fueron más frecuentes en las mujeres (58%) que en los hombres (48%). El IMC y el contenido de grasa medido por bioimpedancia y expresado como porcentaje de peso corporal estuvieron estrechamente asociados (r = 0,47; p<0,01). El promedio del contenido de agua extracelular expresado como porcentaje del agua corporal total se encontró en rango de sobrehidratación y, cuando se evaluó tomando en cuenta el IMC y el género13, la sobrehidratación se encontró más frecuentemente en mujeres (99%) que en hombres (31%). La concentración plasmática de albúmina se encontró disminuida (<4g/dL) en el 30% de los pacientes y la transferrina sérica (<200mg/dL) en el 63%. Por otra parte, la PCR estuvo elevada (>3,0mg/L) en el 86% de los casos. Las concentraciones de NT-proBNP y cTnI estuvieron por arriba de los rangos normales en más del 50% de los pacientes.
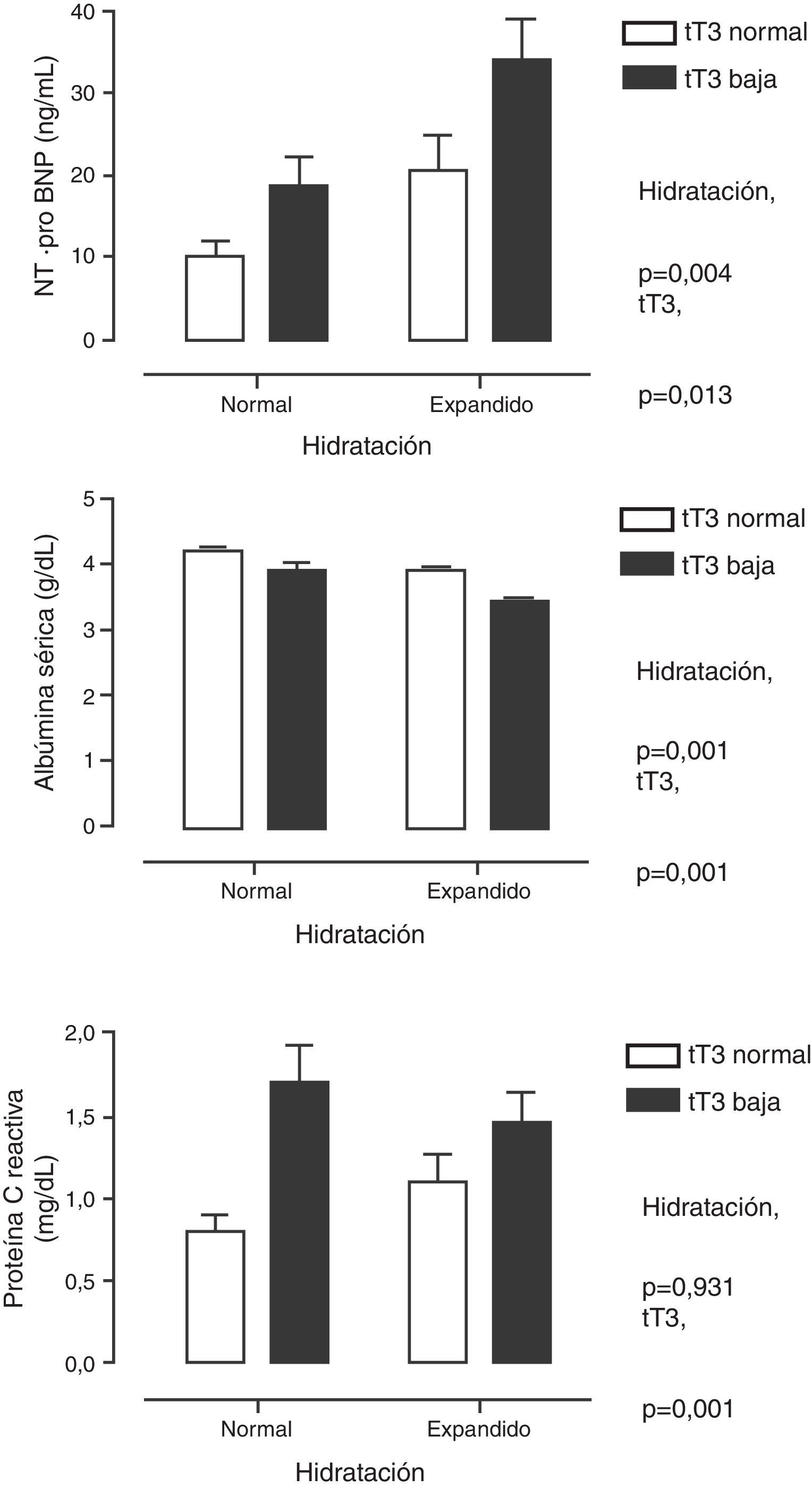
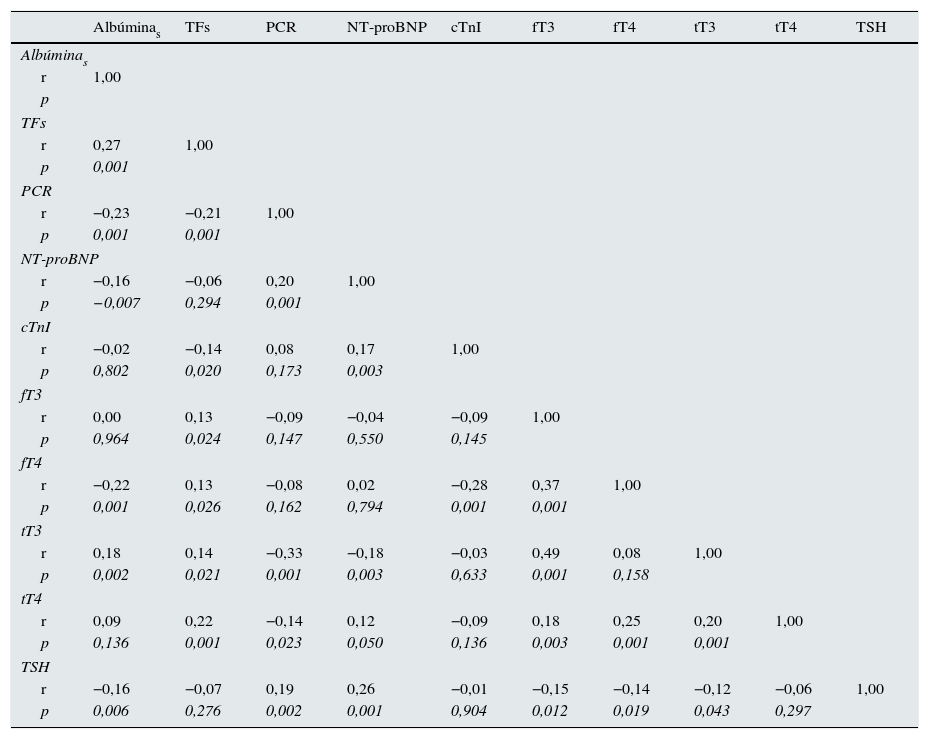
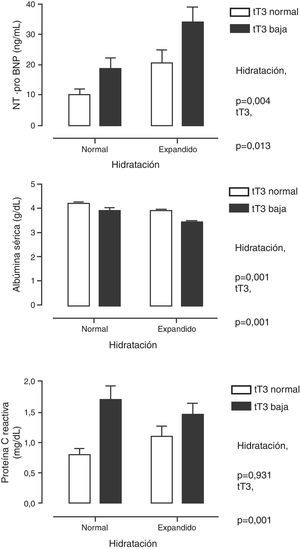
En la tabla 2 se muestra el análisis de correlación múltiple. Se encontraron asociaciones significativas entre las HT en sí mismas, así como con los parámetros bioquímicos de nutrición (albúmina, transferrina), de inflamación (PCR) y con los marcadores de daño miocárdico (cTnI y NT-proBNP). Debido a que varios de estos parámetros están bajo la influencia de la acción de las HT pero también se ven afectados por el estado de hidratación, se analizaron las diferencias clasificando a los pacientes de acuerdo con los valores bajos de tT3 y si estaban o no sobrehidratados. En la figura 1 se muestran estas diferencias. Se puede apreciar que el NT-proBNP estuvo más elevado en los pacientes con sobrehidratación que en los que tuvieron hidratación normal, pero dentro de cada una de estas categorías, los que tuvieron tT3 por debajo de los límites normales tuvieron el NT-proBNP aún más elevado. En el caso de la albúmina sérica, el patrón se encontró invertido: los pacientes sobrehidratados tuvieron albúminas más bajas que los que mostraron hidratación normal, pero, dentro de estas categorías, en los que tuvieron tT3 baja la albúmina sérica fue aún menor. La PCR solamente se encontró influida por la tT3: los pacientes con tT3 baja tuvieron niveles más altos de PCR.
Coeficientes de correlaciones múltiples controladas por edad, género, IMC y AEC/ACT
| Albúminas | TFs | PCR | NT-proBNP | cTnI | fT3 | fT4 | tT3 | tT4 | TSH | |
|---|---|---|---|---|---|---|---|---|---|---|
| Albúminas | ||||||||||
| r | 1,00 | |||||||||
| p | ||||||||||
| TFs | ||||||||||
| r | 0,27 | 1,00 | ||||||||
| p | 0,001 | |||||||||
| PCR | ||||||||||
| r | −0,23 | −0,21 | 1,00 | |||||||
| p | 0,001 | 0,001 | ||||||||
| NT-proBNP | ||||||||||
| r | −0,16 | −0,06 | 0,20 | 1,00 | ||||||
| p | −0,007 | 0,294 | 0,001 | |||||||
| cTnI | ||||||||||
| r | −0,02 | −0,14 | 0,08 | 0,17 | 1,00 | |||||
| p | 0,802 | 0,020 | 0,173 | 0,003 | ||||||
| fT3 | ||||||||||
| r | 0,00 | 0,13 | −0,09 | −0,04 | −0,09 | 1,00 | ||||
| p | 0,964 | 0,024 | 0,147 | 0,550 | 0,145 | |||||
| fT4 | ||||||||||
| r | −0,22 | 0,13 | −0,08 | 0,02 | −0,28 | 0,37 | 1,00 | |||
| p | 0,001 | 0,026 | 0,162 | 0,794 | 0,001 | 0,001 | ||||
| tT3 | ||||||||||
| r | 0,18 | 0,14 | −0,33 | −0,18 | −0,03 | 0,49 | 0,08 | 1,00 | ||
| p | 0,002 | 0,021 | 0,001 | 0,003 | 0,633 | 0,001 | 0,158 | |||
| tT4 | ||||||||||
| r | 0,09 | 0,22 | −0,14 | 0,12 | −0,09 | 0,18 | 0,25 | 0,20 | 1,00 | |
| p | 0,136 | 0,001 | 0,023 | 0,050 | 0,136 | 0,003 | 0,001 | 0,001 | ||
| TSH | ||||||||||
| r | −0,16 | −0,07 | 0,19 | 0,26 | −0,01 | −0,15 | −0,14 | −0,12 | −0,06 | 1,00 |
| p | 0,006 | 0,276 | 0,002 | 0,001 | 0,904 | 0,012 | 0,019 | 0,043 | 0,297 | |
AEC/ACT: agua extracelular/agua corporal total; Albúminas: albúmina sérica; cTnI: troponina cardiaca I; fT3: triyodotironina libre; fT4: tiroxina libre; IMC: índice de masa corporal; NT-proBNP: fracción N terminal del propéptido natriurético cerebral; p: significación; PCR: proteína C reactiva; r: coeficiente de correlación de Pearson; TFs: transferrina sérica; TSH: hormona estimulante de la tiroides; tT3: triyodotironina total; tT4: tiroxina total.
Niveles séricos de la fracción N-terminal del propéptido natriurético cerebral (panel superior), de la albúmina (panel medio) y de la proteína C reactiva (panel inferior) cuando se clasificó a los pacientes por el grado de hidratación y por la concentración de triyodotironina total (tT3). Se muestra como el efecto de tT3 es independiente del grado de hidratación.
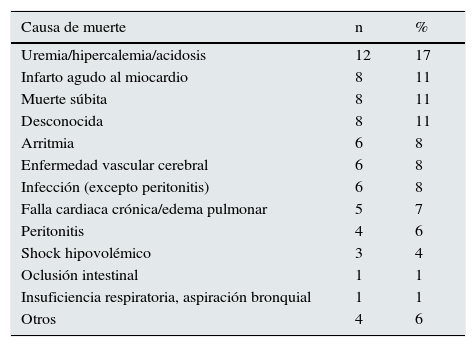
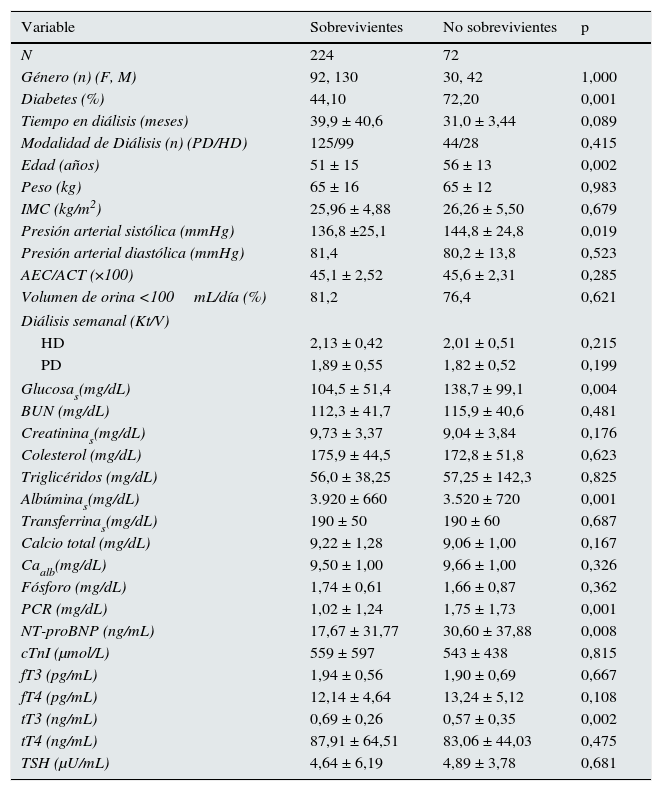
El periodo de seguimiento fue de 16,2±2,0 meses. Hubo 72 muertes. Las causas de muerte se muestran en la tabla 3; las muertes cardiovasculares (muerte súbita, infarto al miocardio, arritmia, falla cardiaca, enfermedad vascular cerebral) (n=33) contaron más del 45% del total de muertes. La tabla 4 muestra las diferencias en las variables relevantes entre los que sobrevivieron y los que no sobrevivieron. Además de las diferencias esperadas en edad, presión arterial y en la presencia de diabetes, hubo también diferencias significativas en variables relacionadas con la nutrición e inflamación (albúmina y PCR), así como también con variables asociadas a daño miocárdico (NT-proBNP). La diferencia entre los 2grupos en los valores de las HT fue solo significante para tT3. No hubo diferencia por la frecuencia ni el tipo de medicación, ni por la modalidad de diálisis.
Causa, número y porcentaje de muertes
| Causa de muerte | n | % |
|---|---|---|
| Uremia/hipercalemia/acidosis | 12 | 17 |
| Infarto agudo al miocardio | 8 | 11 |
| Muerte súbita | 8 | 11 |
| Desconocida | 8 | 11 |
| Arritmia | 6 | 8 |
| Enfermedad vascular cerebral | 6 | 8 |
| Infección (excepto peritonitis) | 6 | 8 |
| Falla cardiaca crónica/edema pulmonar | 5 | 7 |
| Peritonitis | 4 | 6 |
| Shock hipovolémico | 3 | 4 |
| Oclusión intestinal | 1 | 1 |
| Insuficiencia respiratoria, aspiración bronquial | 1 | 1 |
| Otros | 4 | 6 |
Comparaciones de diferentes variables entre sobrevivientes y no sobrevivientes
| Variable | Sobrevivientes | No sobrevivientes | p |
|---|---|---|---|
| N | 224 | 72 | |
| Género (n) (F, M) | 92, 130 | 30, 42 | 1,000 |
| Diabetes (%) | 44,10 | 72,20 | 0,001 |
| Tiempo en diálisis (meses) | 39,9 ± 40,6 | 31,0 ± 3,44 | 0,089 |
| Modalidad de Diálisis (n) (PD/HD) | 125/99 | 44/28 | 0,415 |
| Edad (años) | 51 ± 15 | 56 ± 13 | 0,002 |
| Peso (kg) | 65 ± 16 | 65 ± 12 | 0,983 |
| IMC (kg/m2) | 25,96 ± 4,88 | 26,26 ± 5,50 | 0,679 |
| Presión arterial sistólica (mmHg) | 136,8 ±25,1 | 144,8 ± 24,8 | 0,019 |
| Presión arterial diastólica (mmHg) | 81,4 | 80,2 ± 13,8 | 0,523 |
| AEC/ACT (×100) | 45,1 ± 2,52 | 45,6 ± 2,31 | 0,285 |
| Volumen de orina <100mL/día (%) | 81,2 | 76,4 | 0,621 |
| Diálisis semanal (Kt/V) | |||
| HD | 2,13 ± 0,42 | 2,01 ± 0,51 | 0,215 |
| PD | 1,89 ± 0,55 | 1,82 ± 0,52 | 0,199 |
| Glucosas(mg/dL) | 104,5 ± 51,4 | 138,7 ± 99,1 | 0,004 |
| BUN (mg/dL) | 112,3 ± 41,7 | 115,9 ± 40,6 | 0,481 |
| Creatininas(mg/dL) | 9,73 ± 3,37 | 9,04 ± 3,84 | 0,176 |
| Colesterol (mg/dL) | 175,9 ± 44,5 | 172,8 ± 51,8 | 0,623 |
| Triglicéridos (mg/dL) | 56,0 ± 38,25 | 57,25 ± 142,3 | 0,825 |
| Albúminas(mg/dL) | 3.920 ± 660 | 3.520 ± 720 | 0,001 |
| Transferrinas(mg/dL) | 190 ± 50 | 190 ± 60 | 0,687 |
| Calcio total (mg/dL) | 9,22 ± 1,28 | 9,06 ± 1,00 | 0,167 |
| Caalb(mg/dL) | 9,50 ± 1,00 | 9,66 ± 1,00 | 0,326 |
| Fósforo (mg/dL) | 1,74 ± 0,61 | 1,66 ± 0,87 | 0,362 |
| PCR (mg/dL) | 1,02 ± 1,24 | 1,75 ± 1,73 | 0,001 |
| NT-proBNP (ng/mL) | 17,67 ± 31,77 | 30,60 ± 37,88 | 0,008 |
| cTnI (μmol/L) | 559 ± 597 | 543 ± 438 | 0,815 |
| fT3 (pg/mL) | 1,94 ± 0,56 | 1,90 ± 0,69 | 0,667 |
| fT4 (pg/mL) | 12,14 ± 4,64 | 13,24 ± 5,12 | 0,108 |
| tT3 (ng/mL) | 0,69 ± 0,26 | 0,57 ± 0,35 | 0,002 |
| tT4 (ng/mL) | 87,91 ± 64,51 | 83,06 ± 44,03 | 0,475 |
| TSH (μU/mL) | 4,64 ± 6,19 | 4,89 ± 3,78 | 0,681 |
Datos presentados como promedio±DE o mediana (rango) a menos que se indique lo contrario. Las comparaciones fueron hechas por la prueba de t de student o la prueba de Chi cuadrada, según las características de las variables.
AEC/ACT: agua extracelular/agua corporal total; Albúminas: albúmina sérica; BUN: nitrógeno de urea sanguínea; Caalb calcio total sérico corregido por albúmina; cTnI: troponina cardiaca I; DP: diálisis peritoneal; fT3: triyodotironina libre; fT4: tiroxina libre; Glucosas: glucosa sérica; HD: hemodiálisis; IMC: índice de masa corporal; NT-proBNP: fracción N terminal del propéptido natriurético cerebral; PCR: proteína C reactiva; TSH: hormona estimulante de la tiroides; tT3: triyodotironina total; tT4: tiroxina total.
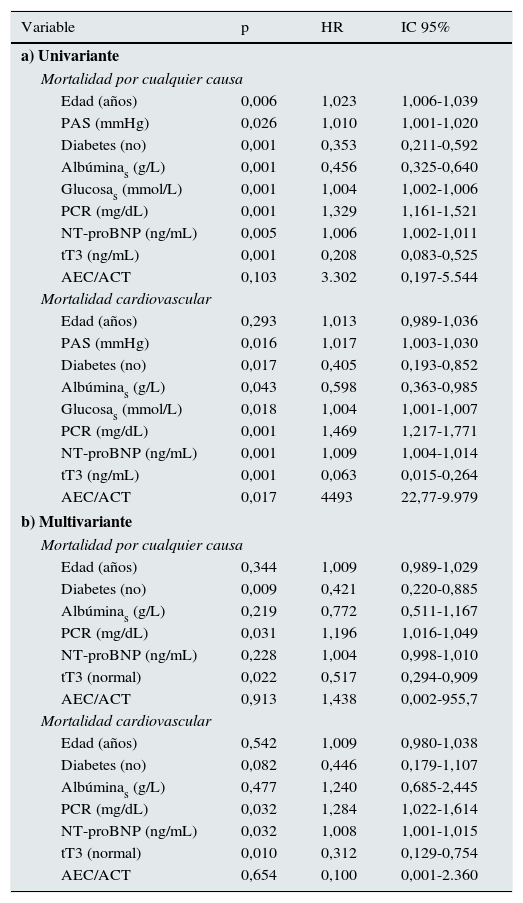
Aquellas variables diferentes entre los que sobrevivieron y los que no sobrevivieron fueron consideradas en el análisis de supervivencia. En el apartado a de la tabla 5 se muestra el análisis univariado. Los factores de riesgo para mortalidad por cualquier causa fueron: edad, presión arterial sistólica, diabetes, albúmina sérica, glucosa, PCR y NT-proBN; de las HT, solo tT3 fue un predictor significativo. En el análisis univariado de mortalidad cardiovascular, todas las variables antes mencionadas, con excepción de la edad, fueron predictores significativos.
Análisis de mortalidad
| Variable | p | HR | IC 95% |
|---|---|---|---|
| a) Univariante | |||
| Mortalidad por cualquier causa | |||
| Edad (años) | 0,006 | 1,023 | 1,006-1,039 |
| PAS (mmHg) | 0,026 | 1,010 | 1,001-1,020 |
| Diabetes (no) | 0,001 | 0,353 | 0,211-0,592 |
| Albúminas (g/L) | 0,001 | 0,456 | 0,325-0,640 |
| Glucosas (mmol/L) | 0,001 | 1,004 | 1,002-1,006 |
| PCR (mg/dL) | 0,001 | 1,329 | 1,161-1,521 |
| NT-proBNP (ng/mL) | 0,005 | 1,006 | 1,002-1,011 |
| tT3 (ng/mL) | 0,001 | 0,208 | 0,083-0,525 |
| AEC/ACT | 0,103 | 3.302 | 0,197-5.544 |
| Mortalidad cardiovascular | |||
| Edad (años) | 0,293 | 1,013 | 0,989-1,036 |
| PAS (mmHg) | 0,016 | 1,017 | 1,003-1,030 |
| Diabetes (no) | 0,017 | 0,405 | 0,193-0,852 |
| Albúminas (g/L) | 0,043 | 0,598 | 0,363-0,985 |
| Glucosas (mmol/L) | 0,018 | 1,004 | 1,001-1,007 |
| PCR (mg/dL) | 0,001 | 1,469 | 1,217-1,771 |
| NT-proBNP (ng/mL) | 0,001 | 1,009 | 1,004-1,014 |
| tT3 (ng/mL) | 0,001 | 0,063 | 0,015-0,264 |
| AEC/ACT | 0,017 | 4493 | 22,77-9.979 |
| b) Multivariante | |||
| Mortalidad por cualquier causa | |||
| Edad (años) | 0,344 | 1,009 | 0,989-1,029 |
| Diabetes (no) | 0,009 | 0,421 | 0,220-0,885 |
| Albúminas (g/L) | 0,219 | 0,772 | 0,511-1,167 |
| PCR (mg/dL) | 0,031 | 1,196 | 1,016-1,049 |
| NT-proBNP (ng/mL) | 0,228 | 1,004 | 0,998-1,010 |
| tT3 (normal) | 0,022 | 0,517 | 0,294-0,909 |
| AEC/ACT | 0,913 | 1,438 | 0,002-955,7 |
| Mortalidad cardiovascular | |||
| Edad (años) | 0,542 | 1,009 | 0,980-1,038 |
| Diabetes (no) | 0,082 | 0,446 | 0,179-1,107 |
| Albúminas (g/L) | 0,477 | 1,240 | 0,685-2,445 |
| PCR (mg/dL) | 0,032 | 1,284 | 1,022-1,614 |
| NT-proBNP (ng/mL) | 0,032 | 1,008 | 1,001-1,015 |
| tT3 (normal) | 0,010 | 0,312 | 0,129-0,754 |
| AEC/ACT | 0,654 | 0,100 | 0,001-2.360 |
AEC/ACT: agua extracelular/agua corporal total; Albúminas: albúmina sérica; Glucosas: glucosa sérica; HR: promedio al azar; IC 95%: intervalo de confianza del 95%; NT-proBNP: fracción N terminal del propéptido natriurético cerebral; p: significación; PAS: presión arterial sistólica; PCR: proteína C reactiva; tT3: triyodotironina total.
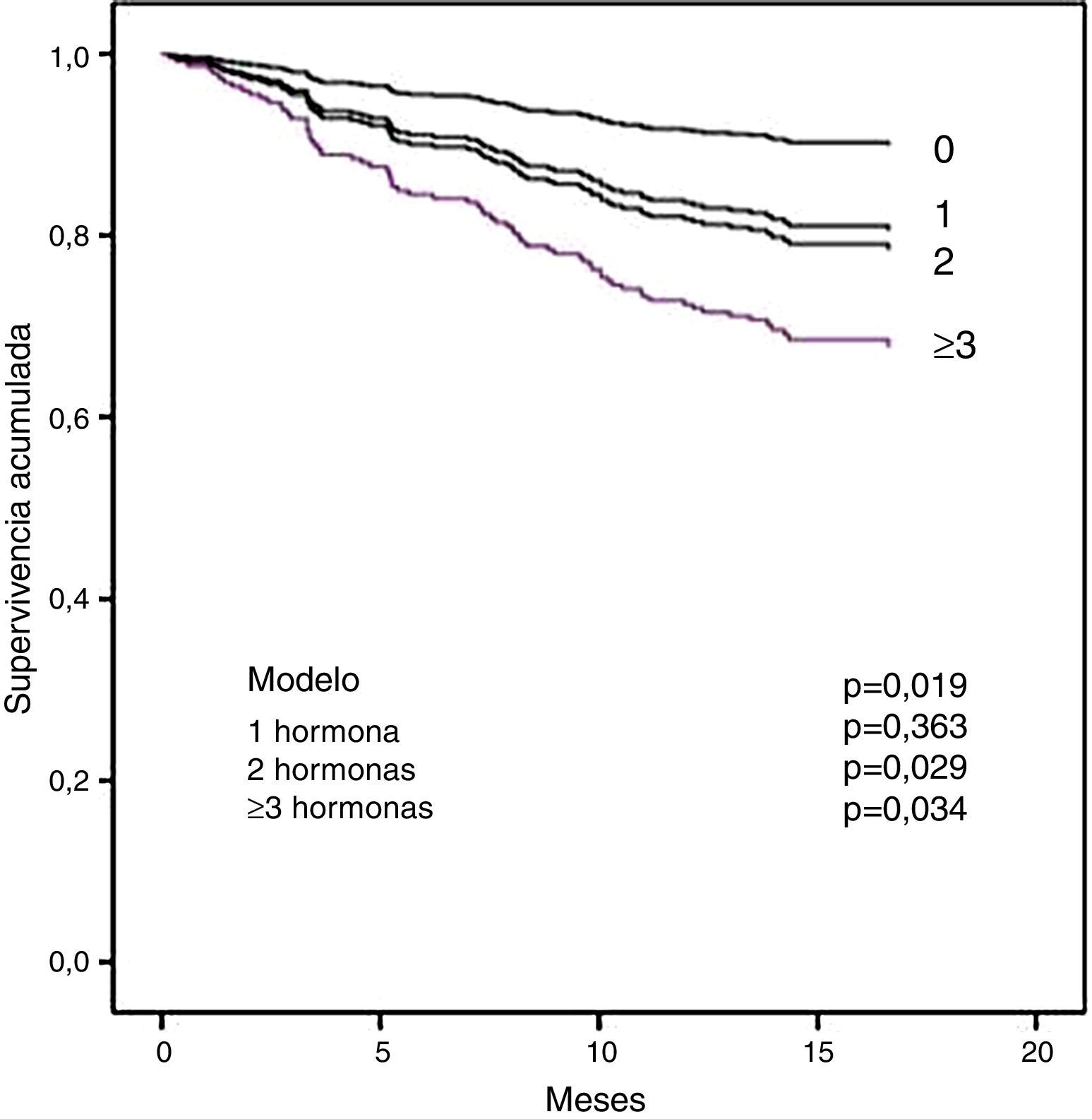
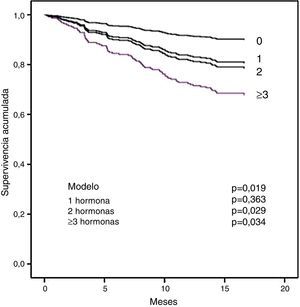
En el apartado b de la tabla 5 se muestra el análisis multivariado. La diabetes, la PCR y la tT3 fueron predictores significativos independientes de mortalidad por cualquier causa. Para la mortalidad cardiovascular, los factores significantes fueron PCR, NT-proBNP y tT3. Es importante notar que tT3 mantuvo su significación como un factor de riesgo independiente para muerte por cualquier causa y para mortalidad cardiovascular. Con el fin de explorar si la magnitud de los cambios en las HT afectó la supervivencia, se analizó el efecto del número de hormonas fuera de los límites normales sobre la mortalidad. En la figura 2 se muestra que los pacientes con 2o más hormonas consideradas en el rango de hipotiroidismo tuvieron una menor supervivencia.
DiscusiónLos hallazgos principales de este estudio se pueden resumir como sigue: 1) La concentración reducida de T3 en la sangre es frecuente en pacientes en diálisis. 2) La concentración de tT3 tuvo, como se esperaba, relación significativa con los marcadores bioquímicos de nutrición e inflamación. 3) Un nuevo hallazgo fue la relación inversa entre tT3 y NT-proBNP, un marcador de daño en el miocardio, lo cual indica que el daño cardiovascular puede ser el vínculo entre los niveles bajos de T3 y la mortalidad cardiovascular y, probablemente, también con la muerte por cualquier causa.
Los niveles disminuidos de tT3 y fT3 han sido reportados previamente tanto en pacientes con ERC en prediálisis como en pacientes en HD y DP, la frecuencia de esos cambios se ha encontrado entre el 10 y el 30% de los casos1,14. Los cambios en T4 y TSH son menos frecuentes. El mecanismo directo en la disminución de T3 es la reducción en la actividad enzimática de 5 monodeyodinasa, responsable de convertir T4 en T3, y un aumento en 5 monodeyodinasa, que convierte T4 a T3 reversa, que es inactiva en el tejido periférico15. La conversión de T4 a T3 está mucho mejor preservada en la glándula pituitaria: esto es porque T3 y TSH permanecen dentro de los niveles normales. Sin embargo, conforme el estado de salud de los pacientes decae, los cambios en T3 son más pronunciados y en etapas de mayor gravedad puede haber disminución progresiva en los niveles de T4 y cambios adicionales en TSH15. La proporción de pacientes con T3 baja encontrados en el actual estudio (44,3%) fue más alta que lo reportado en otros. Un número reducido de pacientes también mostró disminución en T4 y niveles aumentados de TSH. Es importante mencionar que los pacientes incluidos en este estudio no tuvieron antecedentes de enfermedad tiroidea. La elevación de TSH puede estar relacionada con mayor intensidad de la enfermedad no tiroidea o con cambios secundarios a la mejoría del paciente, como ha sido descrito en otros estudios16-18, y no necesariamente con hipotiroidismo primario, por esta razón se analizaron en conjunto. La magnitud y el número de hormonas afectadas estuvieron asociados con peores resultados clínicos, como se discute más adelante.
La proporción más alta de alteraciones de las HT en este estudio puede ser explicada por la mayor proporción de pacientes con datos bioquímicos de desnutrición e inflamación, como indica la correlación de T3 con la albúmina sérica y la PCR. La relación inversa entre niveles reducidos de T3 e inflamación ha sido consistente con lo encontrado en estudios previos19. Si bien la asociación entre esos factores es pobremente entendida, el efecto de las citocinas proinflamatorias es una posible explicación. La aplicación de interleucina-6 exógena en ratones y humanos ha mostrado que reduce la conversión de T4 a T3 en el tejido y acelera su metabolismo20,21. Por otra parte, en casos de desnutrición primaria, los niveles de T3 caen de forma significativa, probablemente como un mecanismo para reducir el gasto de energía en el organismo22,23. En los pacientes de este estudio es difícil separar el efecto de la inflamación del causado por la combinación desnutrición-desgaste metabólico, porque están estrechamente asociados24. La pérdida de las HT es otro factor que ha sido considerado para explicar los reducidos niveles de T3. En pacientes tratados con DP se puede perder en el dializado hasta el 10% de las HT producidas al día y cantidades variables de globulina transportadora de tiroxina. En pacientes con proteinuria hay, además, pérdida de HT a través de la orina25-27. En el estudio actual, no se encontraron diferencias en los niveles de las HT entre HD y DP, ni tampoco por el volumen de orina, lo que indica que la pérdida antes mencionada tuvo poco efecto en el contexto clínico.
La correlación inversa encontrada entre T3 y NT-proBNP señala que niveles bajos de T3 están involucrados en la remodelación del miocardio, pero este concepto requiere de un análisis más detallado. Por una parte, los pacientes hipotiroideos con un corazón sano tienen niveles normales o bajos de NT-proBNP o de BNP, y los pacientes con hipertiroidismo y corazón sano tienen niveles elevados de NT-proBNP o de BNP28,29. En pacientes con ERC, la interacción entre las HT y la función y el remodelamiento cardiacos ocurre bajo condiciones distintas: la glándula tiroides es esencialmente normal y el miocardio tiene importantes alteraciones funcionales y anatómicas. Dos artículos han reportado una fracción de eyección más baja y una masa ventricular más grande en pacientes en DP y HD que tienen T3 disminuida30,31 y en otro se encontró asociación entre la disminución de T3 y la disfunción diastólica12. Conviene señalar que en estas condiciones clínicas se ha encontrado NT-proBNP elevado y no disminuido, como se esperaría por la reducción de T3. A pesar de esta relación, los reportes concernientes a la relación entre HT y factores natriuréticos —un marcador ampliamente reconocido de daño miocárdico— son escasos en pacientes con ERC. Por otra parte, el remodelamiento anormal también influye en esta relación: en un paciente no urémico con miocardiopatía dilatada y reducción severa en las HT, contrariamente a lo esperado, se encontró aumentada la expresión del gen del péptido natriurético auricular en el miocardio; esta condición se corrigió más tarde a través de la terapia de remplazo con levotiroxina32. Esos datos juntos señalan que la interacción entre T3 y el corazón depende de qué órgano falla primero. En pacientes con ERC, la sobrecarga de volumen, la sobrecarga de presión y el remodelamiento del miocardio parecen preceder a las alteraciones tiroideas. A largo plazo, las disfunciones diastólicas y sistólicas unidas a inflamación y desnutrición conducen a alteraciones tiroideas más importantes, las cuales, a su vez, conducen a un daño al miocardio más grave, lo que inicia un círculo vicioso en el deterioro del paciente. La fibrosis del miocardio y la disfunción diastólica se presentan tempranamente en la ERC y se encuentran asociadas a la disminución de HT33-35 en forma similar a lo observado en hipotiroidismo subclínico y en el experimental9,36. El papel de otros marcadores de daño miocárdico como la cTnI puede estar enmascarado por la colinealidad con NT-proBNP, aunque debe mencionarse que su importancia en pacientes con ERC no es consistente37.
Mientras que la diabetes, los valores bajos de albúmina sérica, altos de PCR y altos de NT-proBNP son conocidos como factores importantes asociados a la mortalidad por cualquier causa y a la mortalidad cardiovascular38,39, el papel de los cambios en las HT como factores de riesgo han sido reconocidos solo recientemente en pacientes renales5-7. Sin embargo, el vínculo fisiopatológico entre HT y mortalidad permanece en debate. En algunos estudios, el nivel de fT3 estuvo implicado como un factor de riesgo de mortalidad5, pero en otros estudios, y de acuerdo con el presente, tT3 se encontró con mayor valor predictivo en un panel de pruebas de HT7. ¿Por qué tT3 sería un mejor predictor de mortalidad que fT3?, no se sabe. Se ha argumentado que tT3, así como fT3, disminuyen como consecuencia de la disminución en la conversión de T4 a T3, pero tT3 está adicionalmente afectada por la reducción de proteínas que se unen a las HT, reducción que es inducida por la inflamación. Esto significa que bajos niveles de tT3 representan un bajo nivel de hormonas mientras sirven también como un marcador de inflamación7. En este estudio, la disminución de tT3 tuvo la mayor influencia sobre la mortalidad, pero el número de HT en el rango compatible con hipotiroidismo también se asoció con la reducción progresiva de la supervivencia.
Una relación causal entre las HT y la mortalidad por cualquier causa y la mortalidad cardiovascular no puede ser establecida con la información actualmente disponible. La fuerte asociación de bajos niveles de T3 con marcadores de inflamación y desnutrición hace difícil ponderar la influencia individual de cada factor en la mortalidad. A pesar de esto, los niveles bajos de T3 y los niveles altos de PCR permanecen como factores de riesgo independientes para muerte por cualquier causa y muerte cardiovascular, lo que indica que ellos pudieran tener un efecto aditivo. Es también plausible que niveles bajos de T3 y elevados de los marcadores de inflamación actúen en paralelo y sigan otro factor casual. Los marcadores de inflamación en pacientes con ERC tienen varios orígenes posibles, alguno de los cuales puede ser también el factor disparador de la enfermedad no tiroidea.
Los datos reportados en este artículo muestran que los niveles bajos de T3 pueden ser un elemento adicional, que actúa junto con otros factores de riesgos tradicionales y no tradicionales, en la mortalidad. Para un mejor entendimiento de esta relación entre HT y remodelamiento del miocardio en pacientes con ERC, son necesarios estudios de intervención. Es importante comentar algunos avances en este sentido en pacientes con miocardiopatía dilatada: la suplementación aguda de T3 redujo significativamente los niveles circulantes de norepinefrina, de aldosterona y de NT-proBNP, así como aumentó el volumen diastólico final del ventrículo izquierdo, lo que indica que la suplementación con HT tiene un papel significativo en la función del miocardio en pacientes con enfermedades crónicas y alteraciones tiroideas secundarias34,40.
Como estudio descriptivo, el nuestro tiene limitaciones, puesto que no puede establecerse causalidad en las asociaciones encontradas. Por otra parte, la población estudiada tiene un número importante de variables confusoras (como la modalidad de tratamiento, la preponderancia de la diabetes y el tratarse de pacientes prevalentes) y aun la influencia de otros factores no identificados, así como de colinealidad entre las variables que fueron medidas, hacen que la falta de reproducibilidad de hallazgos reportados en otras publicaciones sea algo esperado. Solamente con estudios de intervención puede darse una respuesta adecuada a esta observación.
Con los resultados obtenidos podemos concluir que los niveles bajos de tT3 son frecuentes en pacientes en diálisis, que se asocian con inflamación, desnutrición y daño miocárdico. Este último puede ser el vínculo entre la disminución de HT y la mortalidad cardiovascular. Sin embargo, como han señalado algunos autores, se requieren estudios de intervención para atribuir a los cambios en HT una relación causa efecto con la remodelación del miocardio y con la mortalidad.
FinanciaciónLos autores expresan su agradecimiento a la Coordinación de Investigación en Salud del Instituto Mexicano del Seguro Social por el patrocinio de este trabajo (2008-785-041).
Conflicto de interesesLos autores declaran no tener conflicto de interés con la realización del presente trabajo.