La hemodiálisis (HD) progresiva es una modalidad de inicio del tratamiento renal sustitutivo adaptada a las necesidades individuales de cada paciente. Está condicionada fundamentalmente por la función renal residual (FRR). En ella, la frecuencia de sesiones con las que el paciente inicia HD (una o 2 sesiones por semana) es menor que en la HD convencional (3 por semana). Dicha frecuencia aumenta (de una a 2, y de 2 a 3) con el declinar de la FRR.
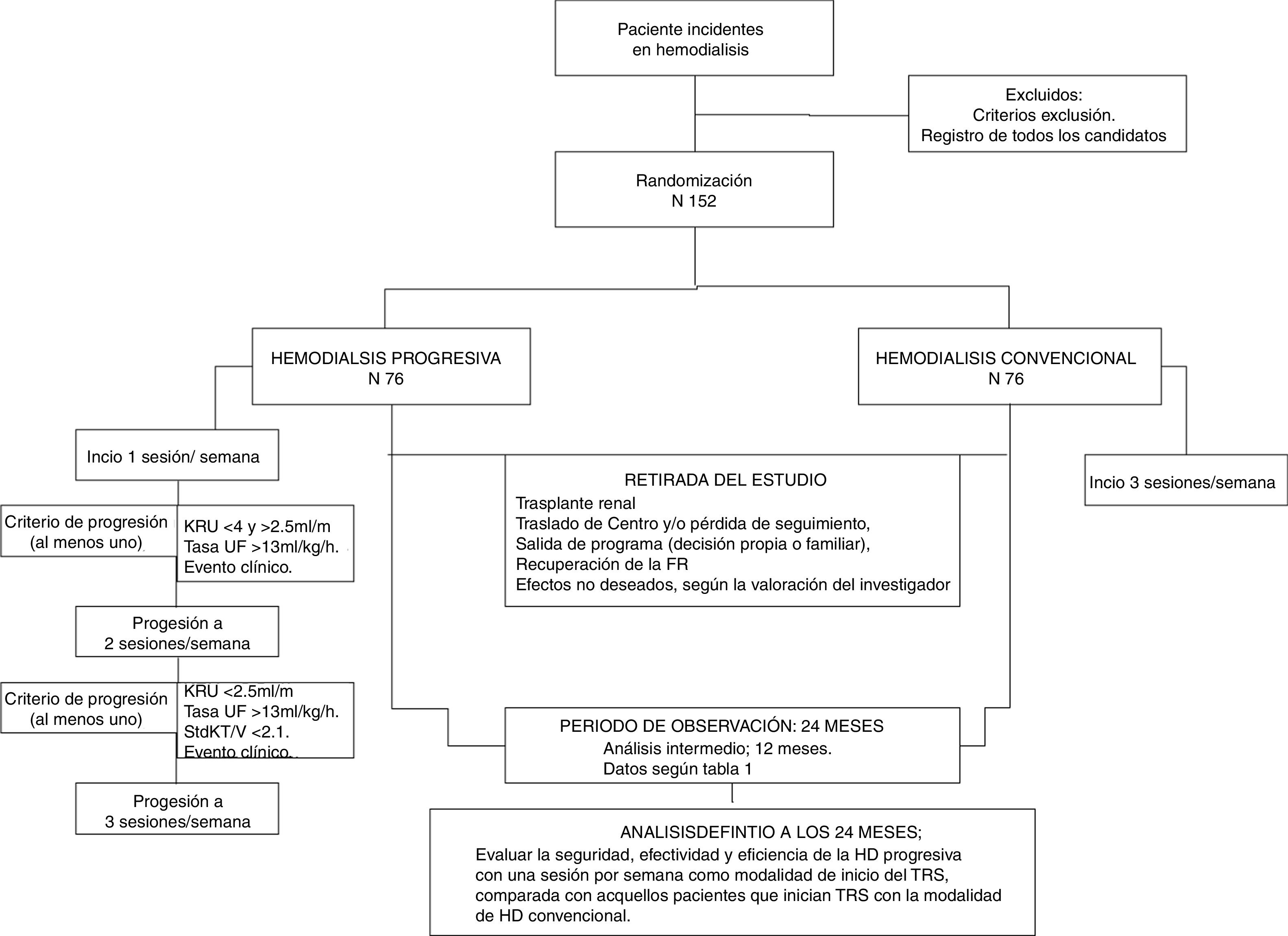
Metodología/diseñoDiPPI es un estudio abierto, multicéntrico, experimental, aleatorizado 1:1 y controlado con procedimiento de práctica clínica habitual, de bajo nivel de intervención y no comercial. Incluye 152 pacientes mayores de 18 años, con enfermedad renal crónica estadio 5, que inician HD como tratamiento renal sustitutivo; y la FRR, medida por aclaramiento renal de urea (KrU) es ≥4ml/min/1,73m2. El estudio se basa en un grupo de intervención con 76 pacientes que iniciarán HD con una sola sesión por semana (modalidad progresiva) y un grupo control con 76 pacientes que comenzarán con 3 sesiones por semana. El objetivo primario es evaluar la supervivencia y los objetivos secundarios son la morbilidad (hospitalizaciones), los parámetros clínicos habituales, la calidad de vida y la eficiencia.
DiscusiónEste estudio permitirá conocer, con la máxima evidencia científica, cuántas sesiones debe recibir un paciente al inicio del tratamiento con HD, dependiendo de su FRR.
RegistroRegistrado en U.S. National Institutes of Health, ClinicalTrials.gov con número NCT03239808.
Progressive haemodialysis (HD) is a starting regime for renal replacement therapy (RRT) adapted to each patient's necessities. It is mainly conditioned by the residual renal function (RRF). The frequency of sessions with which patients start HD (one or two sessions per week), is lower than that for conventional HD (three times per week). Such frequency is increased (from one to two sessions, and from two to three sessions) as the RRF declines.
Methodology/DesignIHDIP is a multicentre randomised experimental open trial. It is randomised in a 1:1 ratio and controlled through usual clinical practice, with a low intervention level and non-commercial. It includes 152 patients older than 18 years with chronic renal disease stage 5 and start HD as RRT, with an RRF of ≥4ml/min/1.73m2, measured by renal clearance of urea (KrU). The intervention group includes 76 patients who will start with one session of HD per week (progressive HD). The control group includes 76 patients who will start with three sessions per week (conventional HD). The primary purpose is assessing the survival rate, while the secondary purposes are the morbidity rate (hospital admissions), the clinical parameters, the quality of life and the efficiency.
DiscussionThis study will enable us to know, with the highest level of scientific evidence, the number of sessions a patient should receive when starting the HD treatment, depending on his/her RRF.
Trial registrationRegistered at the U.S. National Institutes of Health, ClinicalTrials.gov under the number NCT03239808.
La hemodiálisis (HD) convencional de 3 días por semana durante 3 a 5horas, realizada de forma ambulatoria en un centro sanitario, es la modalidad más utilizada de tratamiento renal sustitutivo (TRS)1; sin embargo tiene una mortalidad inaceptablemente alta (10-20% por año)2. En pacientes incidentes el tránsito a HD en el primer año conlleva unos resultados aún peores, existiendo factores ajenos al TRS que lo condicionan3. Para mejorar estos resultados se han propuesto nuevas técnicas y modalidades basadas en más dosis de HD y/o mayor número de sesiones2. No obstante, ensayos controlados y aleatorizados recientemente publicados han mostrado resultados controvertidos en términos de beneficio clínico4,5, junto con mayor tasa de complicaciones del acceso vascular6, y una menor preservación de la función renal residual (FRR)7.
Las guías 2015 de la National Kidney Foundation-Kidney Disease Outcomes Quality Initiative (KDOQI)1 permiten reducir la dosis semanal de diálisis en pacientes con un aclaramiento renal de urea (KrU) mayor de 3ml/min/1,73m2. En estos casos al aclaramiento dialítico (Kd) obtenido con 2 sesiones/semanales se añade el aclaramiento renal (Kr), consiguiendo una dosis de diálisis adecuada8,9. Sorprende que pocos centros sigan esta recomendación cuando más del 50% de los pacientes inician HD con un KrU>3ml/min10.
Autores como Kalantar-Zadeh et al.10,11, en EE. UU., o Teruel et al.12, en España, han publicado su experiencia con 2 sesiones de HD por semana en pacientes incidentes. Con esta modalidad consiguen preservar la FRR y tasas de supervivencia similares a las obtenidas con la HD convencional. Ello podría explicarse porque el Kr tuviera un peso clínico mayor que el Kd8, ya que la FRR, además del mantenimiento de la homeostasis del medio interno, contribuye a la producción de vitamina D y de eritropoyetina13,14, y a la depuración de toxinas urémicas ligadas a proteínas, las cuales son pobremente dializadas14,15. Podemos decir que la correlación entre la FRR y la supervivencia es fuerte y consistente, además de desempeñar un papel crucial en la adecuación de la diálisis1,9,16.
Actualmente se cuestiona el número de sesiones con las que un paciente debe iniciar la HD8,17–19. La HD progresiva es una opción de inicio de HD adaptada a la FRR, donde la frecuencia se incrementa conforme declina el volumen diario de diuresis8,17–19.
El estudio «Evaluación de la seguridad y efectividad de la hemoDiálisis Progresiva en Pacientes Incidentes» (DiPPI)20 pretende determinar si iniciar HD con una sesión por semana reduce la mortalidad en pacientes incidentes y su influencia en la morbilidad (hospitalizaciones), parámetros clínicos, calidad de vida y eficiencia comparada con aquellos pacientes que inician TRS con la modalidad de HD convencional.
Método y diseño del estudioDiseñoEstudio clínico prospectivo, multicéntrico, abierto, aleatorizado y controlado con la práctica clínica habitual, basada en iniciar HD con 3 sesiones por semana (grupo control).
IntervenciónConsiste en reducir la frecuencia o número de sesiones semanales con las que los pacientes inician la HD. El grupo experimental iniciará una sesión/semana para progresar a 2 y posteriormente a 3 sesiones/semana según criterios de progresión.
DiPPI no utiliza medicamentos ni placebos, y los procedimientos complementarios de diagnóstico o seguimiento no entrañan riesgo para la seguridad de los sujetos, al ser similares a los de la práctica clínica habitual. Por ello se considera un «ensayo clínico de bajo nivel de intervención». Además es una «investigación clínica sin ánimo comercial», pues ha sido diseñada directamente por los promotores e investigadores principales, sin ninguna aportación de la industria.
ParticipantesUnidades hospitalarias y centros de HD ambulatorios de distintos ámbitos. Incluirá solo a pacientes incidentes. Los pacientes ingresados por problemas intercurrentes permanecerán en el grupo asignado del estudio y serán evaluados de acuerdo con su aleatorización.
Criterios de inclusión- •
Mayores de 18 años, con enfermedad renal crónica (ERC) estadio 5 que hayan elegido HD como modalidad de tratamiento.
- •
FRR medida por KrU21≥4ml/min/1,73m2. En general se recomienda no comenzar HD con un KrU>7.
- •
Firma del consentimiento informado.
- •
Inicio urgente o no programado de HD. Se entiende como aquel que no permite la recogida de orina de 24horas previas a la primera sesión, o que no la tuviera recogida en los 30 días anteriores.
- •
Pacientes prevalentes en otras modalidades de TRS.
- •
Enfermedades asociadas: neoplasia activa, síndrome cardiorrenal o hepatorrenal, enfermedad inflamatoria activa, enfermedad cardiovascular definida como insuficiencia cardiaca clase iv de la HYHA, angina inestable, o cardiopatía isquémica con ingreso en los 3 meses anteriores.
Los pacientes en el grupo experimental aumentarán de una a 2 sesiones semanales, en caso de cumplir alguno de los siguientes criterios:
- •
Descenso del KrU21 (inferior a 4 y superior a 2,5ml/min/1.73m2). Este descenso deberá ser confirmado en la siguiente analítica obtenida en el mes siguiente. Ganancia de peso intersesión (semanal) que conlleve tasas de ultrafiltración superiores a 13ml/kg/hora, mantenido durante 3 semanas.
- •
Evento clínico que requiera sesiones no programadas (más de una) para su resolución.
Los pacientes con 2 sesiones por semana pasarán a HD convencional si:
- •
KrU21 menor de 2,5ml/min/1,73m2, y/o estándar Kt/V inferior a 2,1 semanal. Este descenso deberá ser confirmado en la siguiente analítica obtenida en el mes siguiente.
- •
Ganancia de peso intersesión que condiciona una tasa de ultrafiltración superior a 13ml/kg/hora, mantenido durante 3 sesiones.
- •
Evento clínico que requiera sesiones no programadas para su resolución
- •
Periodo de reclutamiento: 18 meses a partir de la inclusión del primer paciente. Los pacientes seleccionados como candidatos se registrarán en el formulario de pacientes (anexo 1). Si cumplen los criterios de elegibilidad y firman el consentimiento informado se procederá a su aleatorización.
- •
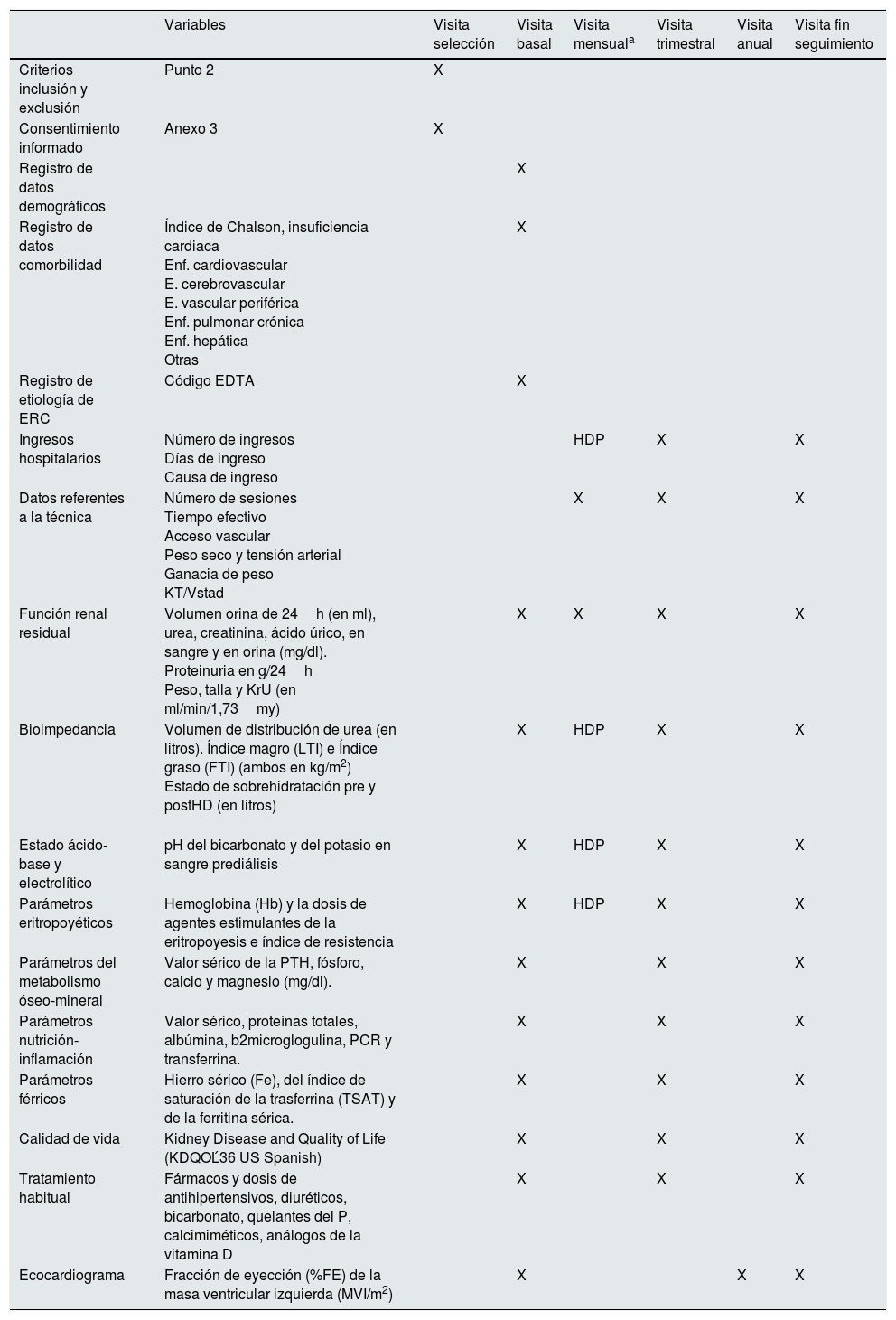
Periodo de seguimiento: 24 meses. En él se realizarán las determinaciones bioquímicas y las pruebas diagnósticas con la periodicidad que figura en el calendario de visitas (tabla 1). Los pacientes del grupo experimental, cuando progresen a 3 sesiones/semana, realizarán las mismas visitas que el grupo control. El esquema de trabajo queda definido en la tabla 1.
Tabla 1.Organigrama de visitas del estudio
Variables Visita selección Visita basal Visita mensuala Visita trimestral Visita anual Visita fin seguimiento Criterios inclusión y exclusión Punto 2 X Consentimiento informado Anexo 3 X Registro de datos demográficos X Registro de datos comorbilidad Índice de Chalson, insuficiencia cardiaca
Enf. cardiovascular
E. cerebrovascular
E. vascular periférica
Enf. pulmonar crónica
Enf. hepática
OtrasX Registro de etiología de ERC Código EDTA X Ingresos hospitalarios Número de ingresos
Días de ingreso
Causa de ingresoHDP X X Datos referentes a la técnica Número de sesiones
Tiempo efectivo
Acceso vascular
Peso seco y tensión arterial
Ganacia de peso
KT/VstadX X X Función renal residual Volumen orina de 24h (en ml), urea, creatinina, ácido úrico, en sangre y en orina (mg/dl). Proteinuria en g/24h
Peso, talla y KrU (en ml/min/1,73my)X X X X Bioimpedancia Volumen de distribución de urea (en litros). Índice magro (LTI) e Índice graso (FTI) (ambos en kg/m2)
Estado de sobrehidratación pre y postHD (en litros)
X HDP X X Estado ácido-base y electrolítico pH del bicarbonato y del potasio en sangre prediálisis X HDP X X Parámetros eritropoyéticos Hemoglobina (Hb) y la dosis de agentes estimulantes de la eritropoyesis e índice de resistencia X HDP X X Parámetros del metabolismo óseo-mineral Valor sérico de la PTH, fósforo, calcio y magnesio (mg/dl). X X X Parámetros nutrición-inflamación Valor sérico, proteínas totales, albúmina, b2microglogulina, PCR y transferrina. X X X Parámetros férricos Hierro sérico (Fe), del índice de saturación de la trasferrina (TSAT) y de la ferritina sérica. X X X Calidad de vida Kidney Disease and Quality of Life (KDQOĹ36 US Spanish) X X X Tratamiento habitual Fármacos y dosis de antihipertensivos, diuréticos, bicarbonato, quelantes del P, calcimiméticos, análogos de la vitamina D X X X Ecocardiograma Fracción de eyección (%FE) de la masa ventricular izquierda (MVI/m2) X X X En los datos referentes a la técnica, cuando existan varios parámetros (por ejemplo TA, ganancia de peso, etc.) se registrará solo el valor de la sesión en la que se obtengan las mediciones analíticas en dicha visita.
- •
Retirada del estudio: cualquier paciente será retirado por: recuperación de la FR, trasplante renal, pérdida de seguimiento, salida del programa y retirada del consentimiento. En estos casos se realizará la visita de fin de seguimiento y no se realizará ningún reemplazo.
- •
Supervivencia. Tiempo de estudio: 2 años.
- •
Hospitalizaciones por cualquier causa. Tiempo de estudio: 2 años.
- •
Preservación de la FRR. Tiempo de estudio: 2 años.
- ∘
Reducción del índice de filtrado glomerular (IFG) y de la función tubular.
- ∘
Volumen diurético medio y porcentaje de pacientes en anuria (volumen≤200ml/día) en 2 mediciones consecutivas.
- •
Parámetros de adecuación. Tiempo de estudio: 3, 6, 12 meses y 2 años.
- ∘
Control de la anemia. Pacientes con niveles de hemoglobina en rango terapéutico (en %) y niveles medios del índice de resistencia a la eritropoyetina (IRE en UI/kg/semana).
- ∘
Control del metabolismo óseo-mineral. Niveles medios de calcio, fósforo y de hormona paratiroidea intacta y porcentaje de pacientes con niveles en rango terapéutico.
- •
Control de la cardiopatía específica. Tiempo de estudio: 12 y 24 meses. Fracción de eyección del ventrículo izquierdo (FEVI). Porcentaje de pacientes con un índice de masa ventricular izquierda (IMVI) ajustado a superficie corporal ≥125g/my, o con derrame pericárdico.
- •
Control de la calidad de vida. Puntuación obtenida en la encuesta validada Kidney Disease and Quality of Life (KDQOĹ36 SF).
- •
Coste efectividad de la intervención: expresado como incremento del coste por año adicional ganado, ajustado a la calidad de vida.
Fue calculado para detectar diferencias en el contraste de la hipótesis nula H0: la ratio entre las medianas del tiempo de supervivencia es no inferior al límite de no inferioridad, mediante una prueba log-rank para 2 muestras independientes (de no inferioridad en una función de supervivencia exponencial). Para ello es necesario incluir en el estudio 152 pacientes, con una aleatorización 1:1, es decir 76 pacientes en cada grupo, asumiendo los siguientes parámetros:
- -
Período de inclusión de 18 meses.
- -
Duración máxima del período de seguimiento de 24 meses.
- -
Mediana de supervivencia en el grupo de HD convencional de 74 meses.
- -
Mediana del tiempo hasta la censura de 12 meses.
- -
Límite de no-inferioridad de 4 meses.
- -
Error tipo i 5% (significación).
- -
Error tipo ii 20% (potencia).
Se ha diseñado una lista única centralizada. Cuenta con 152 códigos de aleatorización (tamaño muestral) y 24 adicionales por si se incluyeran más pacientes. Tiene 2 estratos: según la edad (>o<75 años), y según el KrU basal (≥o<5,5ml/min/1,73m2). Esta aleatorización está balanceada cada 6 participantes.
El investigador responsable de cada centro solicitará formalmente la aleatorización a la oficina de investigación clínica (C.R.O. Delos Clinical) mediante el anexo 1.
Prescripción centralizada de la dosis de diálisisCada paciente recibirá una «prescripción centralizada» de la dosis. Se basará en el eKt/V necesario de acuerdo con la KrU de cada paciente, para obtener un EKRU de 12-KrUml/min/1,73m2 en una HD semanal y una stdKt/V de 2,3volúmenes semanales para 2 veces, según lo publicado por Casino y Basile22. Todos los cálculos relacionados con el modelo cinético de urea (UKM) se basan en la herramienta de prescripción23 y el software Solute-Solver24. El grupo control recibirá una dosis de spKt/V de 1,4 por sesión, descuidando la FRR1.
Nota: las KDOQI1 sugieren un stdKt/V=2,3 volúmenes semanales para programas de HD diferentes a 3 veces por semana HD. Pero ellos no mencionaron el horario de una vez a la semana. Por lo tanto, adoptamos el objetivo variable sugerido recientemente para EKRU como una guía para el programa de una semana, que parece estar de acuerdo con nuestra experiencia empírica.
VariablesLos datos se obtendrán de la historia clínica del paciente. Los investigadores rellenarán el cuaderno de recogida de datos electrónico (CRDe) en los periodos previstos.
Datos demográficos, clínicos y pruebas realizadas. Las determinaciones bioquímicas, las pruebas diagnósticas y su periodicidad figuran en la tabla 1, y son las recomendadas habitualmente en las guías para estos pacientes.
Supervivencia. Se determinará el tiempo de seguimiento en días. Será la diferencia desde la fecha del fin de seguimiento y la fecha de la visita basal. Los eventos se contabilizarán como fallecimientos (seguimiento inferior a 24 meses) o como fin de seguimiento (24 meses).
Hospitalizaciones. Se registrará su número y días en cada uno de ellos. Se consideran motivos de ingreso: las infecciones, las relacionadas con el acceso vascular (realización, reparación, sustitución, trombosis o sangrados), por enfermedad cardíaca, sangrado gastrointestinal u otras.
Preservación de la FRR. El IFG (en ml/min) se calculará por la semisuma del aclaramiento de urea y de creatinina, y la función tubular por medio de la excreción fraccionada de fósforo, ácido úrico y potasio.
Control de la anemia. Se medirá la hemoglobina (en g/dl) y dosis de agentes estimulantes de la eritropoyesis (en UI).
Control del metabolismo óseo-mineral. Se medirá el calcio, el fósforo (ambos en mg/dl) y la PTH intacta (en pg/dl).
Control de la cardiopatía específica. Se medirá la FEVI (en %), el IMVI (en g/my) y la existencia de derrame pericárdico.
Calidad de vida. Se medirán los ítems de la encuesta KDQOL’36 SF.
Coste efectividad de la intervención. A cada paciente se le calculará los costes durante el seguimiento. Se contabilizarán como costes: las sesiones realizadas, a razón de 201€ cada una, el trasporte sanitario, a 20€ por sesión, y los ingresos hospitalarios a 498€ por día de ingreso25. Estas tarifas no reflejarán los costes, ni los precios que se pagan por cada prestación. Tampoco serán representativas de todos los hospitales participantes. Sin embargo, utilizados como ratios permitirán calcular qué modalidad de inicio de HD es menos costosa, y por ello más eficiente.
Tiempos de permanencia (Tp) en HD progresiva. Cada paciente en modalidad de HD progresiva será registrado y se medirá el tiempo desde el inicio en el estudio y su progresión a 2 sesiones por semana (Tp en una sesión HD/semana en días) y el tiempo desde que pasa a 2 sesiones hasta su pase a HD convencional o fin del estudio (Tp en 2 sesiones HD/semana en días). Así mismo se registrará y medirá el tiempo desde el inicio hasta su pase a HD convencional o fin del estudio (Tp en HD progresiva en días).
Métodos estadísticosPoblación a analizarTodos los pacientes incluidos en el estudio, independientemente de su periodo de seguimiento, es decir, la población del estudio es por intención de tratar.
Análisis intermedioSe analizarán todos los objetivos a todos los pacientes cuando alcancen los 12 meses de seguimiento. En este análisis, metodología y variables serán igual que el análisis de resultados realizado al completar el fin de seguimiento (fig. 1).
Análisis descriptivoSe evaluarán todas las variables recogidas en la visita basal. Las cualitativas se expresarán en porcentajes y para valorar sus diferencias se realizará la prueba de Ji-cuadrado o el test estadístico de Pearson, si no se cumple la distribución de frecuencias observadas. Las variables cuantitativas se expresarán con la media, mediana, desviación estándar y recorrido intercuartílico, y para valorar sus diferencias se realizará la «t» de Student o el test de Mann-Whitney si no se cumple la distribución normal. Tendrán un nivel de significación del 5% y una potencia del 80% para la consecución de los objetivos.
Objetivo primarioAnálisis de la supervivencia. Se medirá mediante un análisis bivariante o test de Kaplan-Meier. La diferencia entre la media y la mediana del tiempo de supervivencia, entre ambas ramas del estudio, se analizará mediante test de log-rank. Se realizará un análisis multivariante o regresión multivariante de Cox para valorar la contribución real de la intervención (HD progresiva) y/o de cualquier variable que afecte a la supervivencia.
Objetivos secundariosAnálisis de los ingresos hospitalarios. En cada grupo se calculará el valor medio del número y días de ingresos. La diferencia entre las medias se evaluará mediante la «t» de Student o su alternativa no paramétrica de Mann-Whitney.
Análisis de la FRR. La evolución del IFG, de la función tubular y del volumen de orina/24horas durante el seguimiento respecto al basal se comparará mediante la prueba de Wilconxon. El tiempo de mantenimiento de la FRR (volumen≥200ml/día) se evaluará mediante técnica de Kaplan-Meier. Para valorar las diferencias entre la media y la mediana se realizará el test de log-rank. Para comparar la tasa de pacientes (en %) con un volumen ≤200ml/día al final del seguimiento se realizará la prueba Ji-cuadrado o el test estadístico de Pearson, según las distribución de proporciones observadas.
Otros parámetros analíticos. Para comparar el porcentaje de pacientes con hemoglobina <10,5g/dl, o de calcio, fósforo y de la PTH en rango terapéutico (en cada rama del estudio) se realizará la prueba de Ji-cuadrado o el test de Pearson, si no se cumple la distribución de frecuencias. Las diferencias entre niveles medios del índice de resistencia a la eritropoyetina, de calcio, fósforo y de la PTH intacta se evaluarán mediante la «t» de Student o su alternativa no paramétrica de Mann-Whitney.
Datos funcionales. Las diferencias en la FEVI, en el IMVI, en los ítems del cuestionario de calidad de vida y en el cálculo de la eficiencia (en cada rama del estudio) se evaluarán mediante la «t» de Student o su alternativa no paramétrica de Mann-Whitney. Para valorar la diferencia en la existencia de derrame pericárdico se realizará la prueba de Ji-cuadrado o el test de Pearson, si no se cumple la distribución de frecuencias observadas.
Controles de seguridadDurante el seguimiento, y especialmente en el grupo experimental, se prestará atención a la sobrecarga de volumen, a la hiperpotasemia y a la acidosis metabólica, tal y como aconseja la práctica clínica habitual. La bioimpedancia mensual en los pacientes en HD progresiva, y trimestral en el grupo control, ayudará al cálculo del peso seco y a descartar la sobrehidratación. Para el control del potasio y de la acidosis metabólica los investigadores pueden realizar un control de ambos parámetros en el periodo intermensual.
El ensayo se realizará de acuerdo con su protocolo22, con las Guías de buena práctica clínica y con los requerimientos legales aplicables en cada país con centros participantes. La confidencialidad de los datos se llevará a cabo de acuerdo con la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal y el Real Decreto 1720/2007.
DiscusiónEl tránsito desde el estadio 5 no dependiente de diálisis al TRS es un momento crucial, tanto para el paciente como para el nefrólogo. Se debe elegir, entre otras, 3 cosas: cuándo y cómo iniciar el TRS y la cuantía de depuración extrarrenal que debemos aportar. A pesar de no existir estudios controlados que lo avalen, ha habido una tendencia al inicio precoz del TRS1. Así, en EE. UU. más del 50% de los pacientes en la actualidad comienzan con un KrU>3ml/min/1,73m2, sin que esto haya reducido la morbimortalidad10.
Un inicio de diálisis progresivo, definido como el aumento gradual de la dosis a medida que disminuye la FRR, tiene como objetivo mantener constante el aclaramiento total de solutos (Kr y Kd). En peritoneal ya se propuso en sus primeras directrices sobre adecuación26, y en la actualidad está fuertemente implementada. Así, en algunos países el 30% de pacientes inician con uno o 2 intercambios/día, o con 3 o 4 sesiones/semana de DP automatizada27, y esto sucede a pesar de que los estudios sobre DP incremental son limitados, con escaso número de pacientes, monocéntricos y no aleatorizados27.
La HD progresiva o incremental también ha adquirido cierta importancia en los últimos años. Realizada sin fines económicos, ha mostrado resultados esperanzadores en el mantenimiento de la FRR, y con supervivencia similares a la HD convencional10–13. De hecho, la guía 3.2 de las KDOQI1 permite reducir la dosis semanal en pacientes con un KrU mayor de 3ml/min/1,73m2. En estos casos se establece como objetivo un aclaramiento continuo de 2,3 volúmenes semanales, expresados en términos stdKt/v, o un EKRU de 12-KrUml/min, corregidos ambos para un volumen de 35l2,22. Estas recomendaciones se basan en la fuerte correlación existente entre la FRR y la supervivencia9, y en su contribución al control del volumen y a la eliminación de solutos unidos a proteínas por secreción tubular28,29. Conviene recordar que estas últimas son escasamente dializadas con las técnicas actuales, aunque aumentemos la frecuencia29,30.
Los estudios publicados sobre la HD incremental sin embargo son observacionales, y sus resultados deben tomarse con cautela. La pauta de inicio en la mayoría de ellos ha sido de 2 sesiones10–12. Podríamos concluir que hoy por hoy no existe evidencia suficiente que indique qué pauta, dosis o frecuencia deben recibir los pacientes incidentes en HD con FRR.
Basándonos en experiencias previas22,31, y de acuerdo con algunos autores19,21 en DiPPI, hemos planteado comenzar con una sola sesión semanal y aumentar a 2 y de 2 a 3 al disminuir la FRR. Aunque parece atrevido, es más lógico transitar de forma gradual desde el estadio 5 noD al estadio 5HD. Esperamos obtener la misma supervivencia e igual tasa de complicaciones a los 2 años. De corroborarse esta modalidad de inicio como eficaz y segura, permitirá reducir a muchos pacientes incidentes su número de sesiones. Así, si uno de cada 4 pacientes incidentes en HD en España lo hiciera de forma progresiva se «evitarían» 76.000 sesiones, con sus respectivos desplazamientos, y los costes disminuirían en más de 21 millones de euros anuales.
El diseño metodológico fue cuidadosamente considerado. En principio se optó por un diseño observacional de cohortes, controlando el sesgo de selección mediante un pareamiento por puntuación de propensión (propensity score mach en inglés). Este método debe contar con variables suficientes para evitar sesgos, lo que implica un grupo control numeroso para poder encontrar pacientes pareados. Pero con ello no se eliminan los «factores de confusión residual», amenaza en cualquier estudio observacional. Un estudio aleatorizado y controlado tiene un mínimo sesgo y aporta el mayor nivel de evidencia, aunque presenta dificultades notables: menor potencia, selección de pacientes que produce la aleatorización (puede que no sea representativa de la población en HD), o desajustes entre ambos grupos en alguna variable clave. Creemos que el cálculo muestral y la aleatorización por bloques han minimizado estos inconvenientes y permitirán responder a la hipótesis planteada. No tiene enmascaramiento por la dificultad obvia que supone enmascarar las sesiones.
Posiblemente DiPPI sea igual de necesario que estudios como HEMO32, IDEAL33 o los derivados del FHN4–6, y sus resultados tendrán la misma trascendencia. Pero al tratase de un estudio no comercial no existe financiación para la inclusión de pacientes. Evitar la infradiálisis es un objetivo tan importante como sobredializar, y este ensayo clínico tratará de demostrar si hay diferencia entre la HD progresiva y la HD a dosis fija 3 veces por semana en pacientes incidentes. Los beneficios potenciales y el ahorro económico hacen que las razones para llevar a cabo un esfuerzo por parte de todos sean evidentes. Si estás interesado en este tema o valoras la posibilidad de participar en el estudio, te facilitaremos toda la información necesaria.
AbreviaturasCRDe: cuaderno de recogida de datos electrónico; DiPPI: diálisis incremental en pacientes incidentes (acrónimo del estudio); ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; FRR: función renal residual; HD: hemodiálisis; IFG: índice de filtrado glomerular; IMVI: índice de masa ventricular izquierda; IRE: índice de resistencia a la eritropoyetina, Kd: aclaramiento dialítico; KDOQI: Kidney Disease Outcomes Quality Initiative; KDQOĹ36: Kidney Disease and Quality of Life; Kr: aclaramiento renal; KrU: aclaramiento renal de urea; stdKt/v: estándar Kt/v; TRS: tratamiento renal sustitutivo.
Comité ético y avalesDictamen favorable del Comité Ético y de Investigación del Complejo Hospitalario de Cáceres. Avalado por la Consejería de Sanidad y Políticas Sociales de la Junta de Extremadura y por la Sociedad Española de Nefrología. Esponsorizado por la Fundación para la Formación e Investigación de los Profesionales de la Salud de Extremadura (FundeSalud), dependiente de la Consejería de Sanidad de la Junta de Extremadura.
Contribución de los autoresTodos los autores han contribuido de forma activa en el diseño del estudio, en su metodología y en la escritura del manuscrito.
FinanciaciónEn la actualidad el proyecto cuenta con una ayuda proporcionada por Fundación Liberbank de 10.000 euros netos, vehiculados a través de FundeSalud.
Conflicto de interesesNinguno de los autores manifiesta tener conflicto de intereses.
A los doctores J.L. Teruel y F. Maduell por su inestimable colaboración en la metodología y el diseño del estudio.