Los captores de fósforo son una de las herramientas consideradas básicas en el tratamiento integral del complejo Chronic Kidney Disease- Mineral and Bone Disorder1. Desde hace décadas es bien conocido que la retención de fósforo (por mecanismos directos e indirectos) contribuye a la aparición y progresión del hiperparatiroidismo secundario y la osteodistrofia renal en la enfermedad renal crónica (ERC)1,2. De hecho, la retención de fósforo bloquea todos los mecanismos hormonales contrarreguladores, aumenta la resistencia esquelética a la parathormona (PTH) y es considerado un elemento central en la fisiopatología de otras alteraciones endocrinas y sistémicas, como la disminución de calcitriol, el aumento del factor de crecimiento fibroblástico-23 (FGF-23), las calcificaciones cardiovasculares, el envejecimiento prematuro y la elevada morbimortalidad de estos pacientes2,3. Por todo ello, el fósforo ha sido considerado como «el asesino silencioso» de los pacientes con ERC4.
Como consecuencia, especialmente en los pacientes en diálisis, las recientes guías KDIGO subrayan la importancia de la restricción del fósforo en la dieta, una adecuada dosis de diálisis y el uso de captores del fósforo2. La evidencia sobre el efecto positivo de la dieta es limitada y de baja calidad5, y una restricción agresiva no solo es difícil, sino que además podría comprometer el estado nutricional del paciente, contrabalanceando el beneficio de controlar el fósforo6. De hecho, el uso de captores de fósforo permitiría una dieta más liberal y disminuir el riesgo de malnutrición6.
Aunque, por definición, todos los captores del fósforo disminuyen los niveles plasmáticos, sus características (con calcio, sin calcio; con metales como magnesio, hierro o aluminio; polímeros), en monoterapia o combinación, parecen condicionar efectos diferenciales sobre distintos aspectos del complejo Chronic Kidney Disease- Mineral and Bone Disorder (i.e. calcificación arterial, FGF-23) o sobre la supervivencia de los pacientes en diálisis7,8. Las nuevas guías KDIGO 2017 han aumentado el grado de evidencia sobre la necesidad de restringir el uso de captores del fósforo basados en calcio en todos los pacientes con ERC (evidencia 2B)2, y no solo en aquellos con hipercalcemia, calcificación arterial, enfermedad ósea adinámica o pacientes con PTH persistentemente disminuida, como se sugería en las guías anteriores. Asimismo, se continúa considerando razonable valorar la presencia de calcificaciones vasculares/valvulares en pacientes con ERC para guiar el manejo farmacológico2,9.
Captores: adherencia e interacciones farmacológicasLos nefrólogos son en general conscientes de que los pacientes con ERC, especialmente en tratamiento renal sustitutivo, toman muchos fármacos, y que una parte importante de esta sobrecarga la constituye el elevado número de comprimidos/cápsulas/sobres diarios de captores10. La administración simultánea de varios medicamentos al mismo paciente es algo muy frecuente. Aunque esta situación pueda resultar beneficiosa para mejorar la adherencia terapéutica, esta no está exenta de inconvenientes como la posibilidad de interacciones farmacológicas, especialmente en pacientes de edad avanzada o con enfermedades crónicas. A pesar de ello, un aspecto a menudo olvidado por nefrólogos es el de que los captores de fósforo, por sus distintas propiedades bioquímicas, pueden influir de modo diferencial y potencialmente importante sobre la absorción y eficacia de muchos fármacos. De hecho, su uso simultáneo con otros fármacos es frecuente y sus posibles implicaciones clínicas pasan con frecuencia desapercibidas. Por ello creemos que es importante mejorar esta práctica y revisar las interacciones farmacológicas descritas sobre los distintos captores de fósforo.
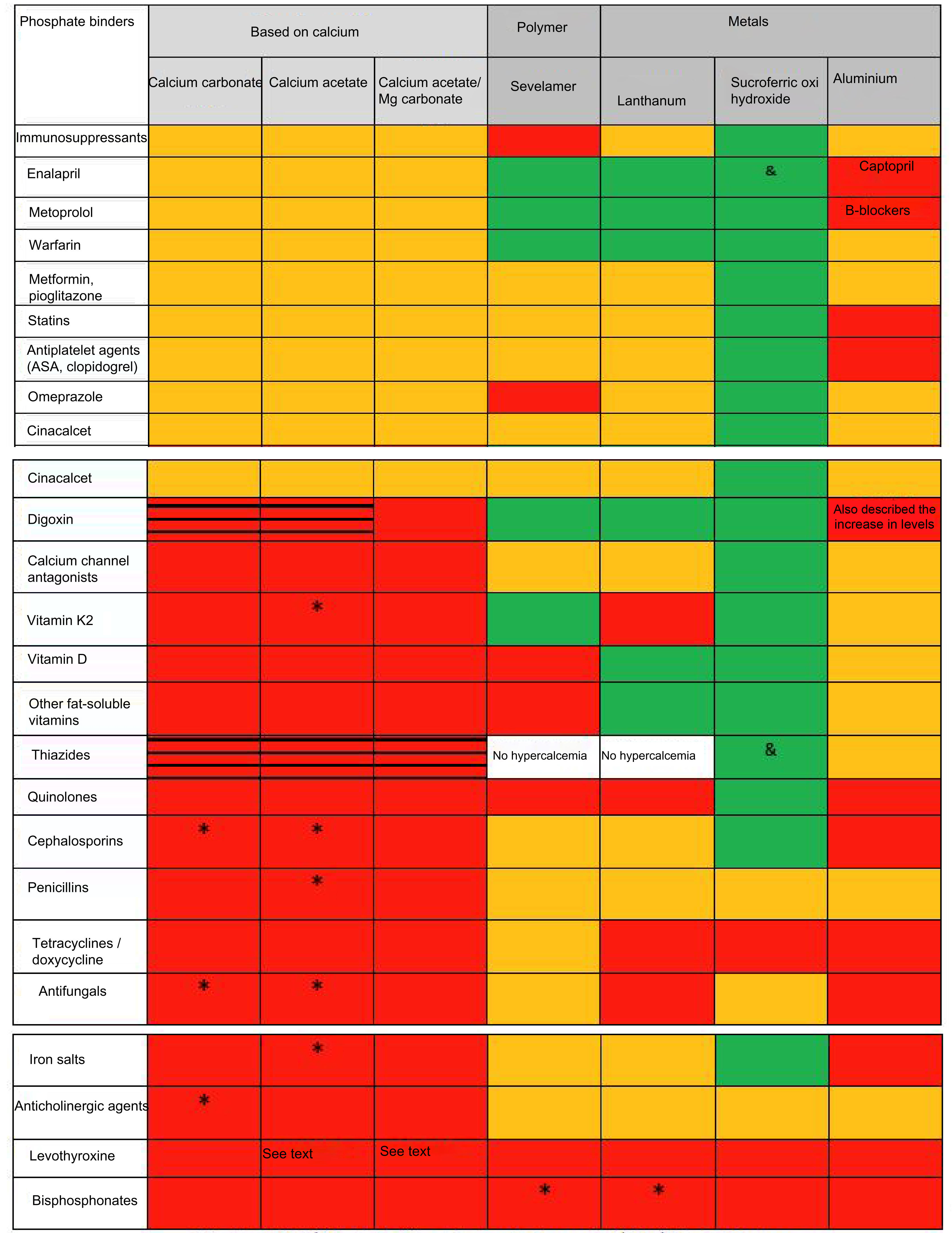
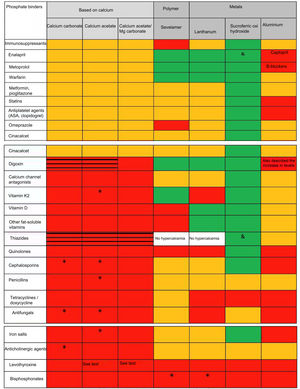
Interacciones farmacológicasEl distinto efecto de los captores de fósforo sobre la absorción de fármacos supone una interacción farmacocinética (afecta generalmente su proceso de absorción) a diferencia de las interacciones farmacodinámicas (afectan la unión a receptores o mecanismos de transducción de señales). Aunque son múltiples las revisiones y tablas que incluyen efectos distintivos entre los captores (dosis, número de comprimidos, efectos secundarios, niveles de calcio, fósforo, PTH, FGF-23 e incluso sobre progresión de calcificación vascular y/o supervivencia/mortalidad)9 para nuestro conocimiento ninguna ha analizado y comparado hasta ahora diferencias en las posibles interacciones farmacológicas y que resumimos en la figura 1. Como se aprecia, las interacciones farmacológicas más numerosas son las descritas para los captores con calcio y aluminio.
Interacciones farmacológicas de significado nefrológico más importantes de los distintos captores disponibles en España
aVer texto. El hidróxido de aluminio puede aumentar la concentración de ácido valproico (aunque su significado clínico no está establecido) y se han descrito intoxicaciones por quinidina y digoxina. Además de los mostrados, reduce la absorción o disminuye niveles de alopurinol y sucralfato, AINE, carbenoxolona, clorpromazina, epoetina, ketoconazol, etambutol, gabapentina, isoniazida, metronidazol, penicilamina, ranitidina, cloroquina, ciclinas, diflunisal, fluoruro de sodio, glucocorticoides, kayexalato, lincosamidas, fenotiazinas y neurolépticos, cefpodoxima, isoniacida y nitrofurantoína. A destacar también la disminución de la absorción de corticoides, aunque con repercusión clínica dudosa si se vigila la respuesta al fármaco. Es conocido el aumento de su toxicidad por citrato sódico y vitamina C. Aumenta la excreción de ácido acetil salicílico y puede alterar la distribución del pertecnetato de sodio en pruebas de radioimagen.
b
Demostrada ausencia de interacción también con furosemida y losartán.c
No descrita pero con potencial efecto de clase. Interacción no especificada. No interacción (demostrada en estudios in vitro o in vivo) Disminuye la absorción/eficacia reducida Aumenta el riesgo de hipercalcemia y toxicidad farmacológica secundaria (i.e. digitálicos).En las celdas en las que no se indica nada, ni sevelámero ni lantano han sido estudiados con diuréticos, pero la hipercalcemia no es un efecto secundario.
El carbonato cálcico puede modificar la absorción de diversos fármacos, por lo que deberían administrarse al menos 2horas antes o de 4 a 6horas después del captor. Además de los mostrados destacamos otros antibióticos como neomicina, cloranfenicol y fosfomicina, corticoides sistémicos, fenitoína y barbitúricos, antiácidos que contienen sales de aluminio, colestiramina, cinc, fluoruros y sales de hierro11,12. Esta última interacción es importante para evitar combinaciones de captores de calcio (práctica nefrológica común)8 con captores férricos. Al igual que ocurre con los otros captores es importante recordar que la eficacia de la levotiroxina puede verse reducida por el uso concurrente de calcio, por lo que la administración de carbonato cálcico y levotiroxina debe separarse al menos 4horas13.
Otra interacción a tener en cuenta, esta de carácter farmacodinámico, es que la hipercalcemia puede aumentar la toxicidad de los digitálicos (digoxina) y que los diuréticos tiazídicos reducen la excreción urinaria de calcio, por lo que existe un aumento de riesgo de hipercalcemia cuando se coadministran con captores cálcicos. Del mismo modo, el tratamiento concomitante con derivados de la vitamina D y/o medicamentos o nutrientes que contienen calcio (leche) puede favorecer la aparición de hipercalcemia y síndrome de leche-alcalinos. Además, la ingesta de altas cantidades de calcio puede causar una precipitación de los ácidos grasos y biliares en forma de jabones, que podrían alterar la absorción de ácido ursodesoxicólico y quenodesoxicólico, así como de grasas y vitaminas liposolubles12,13.
Acetato cálcico (Royen®, acetato de calcio RenaCare®)Como se ha comentado para el carbonato de calcio, la toma de acetato cálcico con algunos medicamentos puede alterar su absorción o favorecer su toxicidad por hipercalcemia. Además del contenido de la figura 1, destacamos la poco conocida disminución del efecto de los antagonistas del calcio14. A pesar de que en un estudio farmacoepidemiológico retrospectivo se había referido la escasa o nula interferencia del acetato cálcico con la absorción de levotiroxina15, datos recientes sugieren que los pacientes hipotiroideos deberían ser advertidos de tomar la dosis de levotiroxina claramente separada de cualquier formulación con calcio16.
Acetato cálcico/carbonato de magnesio (Osvaren®)El acetato cálcico/carbonato de magnesio puede alterar la absorción de algunos medicamentos incluidos en la figura 1, por lo que no deberían tomarse entre las 2horas anteriores y las 3horas posteriores a la administración del captor17. Además de la disminución de absorción de cefuroxima, cefpodoxima o nitrofurantoína, está descrita también la interacción con la absorción de cinc, fluoruros y el antipáludico halofantrina17. Asimismo, la ingestión simultánea de magnesio puede influir sobre la absorción de hierro, un complemento habitual de la polimedicación del paciente con ERC. El acetato cálcico/carbonato de magnesio puede producir también hipermagnesemia, por lo que se deben evitar los antiácidos que contengan no solo sales de calcio, sino también magnesio. Las sales de magnesio pueden adsorber digoxina en el tracto gastrointestinal, disminuyendo su biodisponibilidad, además de poder provocar un aumento de su potencial toxicidad por hipercalcemia. Solo en la ficha técnica de esta combinación se menciona la posibilidad de que el uso concomitante con estrógenos puede aumentar los niveles de calcio17.Curiosamente, a diferencia de los demás captores, se menciona que se puede producir un aumento de la absorción de levotiroxina en combinación con hidróxido de aluminio17,18; sin embargo, ya hemos mencionado que datos recientes sugieren que la administración de levotiroxina debe ser claramente separada de la toma de cualquier formulación con calcio16 y otros captores.
Captores no basados en calcio: polímeros y metalesComo muestra la figura 1 el número de interacciones farmacológicas descritas con los captores de estructura polimérica (sevelámero) o metales (lantano, hierro) es menor que la de los captores de fósforo con calcio. Sin embargo, existe una mayor información referida a interacciones medicamentosas sobre ellos al tratarse de fármacos de incorporación más reciente al arsenal terapéutico, y por las exigencias al respecto de las agencias en ensayos clínicos. Destacamos que en estos los pacientes que tomaban medicamentos antiarrítmicos o anticonvulsivos fueron específicamente excluidos, pero en general sería también recomendable evitar su coadministración probablemente con todo tipo de captor.
Sevelámero (Renagel®, Renvela®, sevelámero genérico)Sevelámero es un polímero cruzado no absorbible. Los medicamentos que tengan su biodisponibilidad reducida por sevelámero se deben administrar al menos una hora antes o 3horas después19. Subrayamos que en estudios de interacciones en voluntarios sanos el hidrocloruro de sevelámero redujo la biodisponibilidad de ciprofloxacino en aproximadamente un 50%20. Es muy importante conocer que sevelámero puede reducir los niveles plasmáticos de ciclosporina, tacrolimus y micofenolato mofetilo en pacientes trasplantados, aunque sin ninguna consecuencia clínica aparente (por ejemplo, rechazo del injerto). Aun así, se recomienda monitorizar sus niveles plasmáticos durante el uso de la combinación y tras su retirada, al igual que los niveles de TSH en pacientes que reciben levotiroxina (como con todo captor). Sevelámero puede disminuir la absorción de vitaminas liposolubles D, E, K y ácido fólico, con discutible repercusión clínica19. Por el contrario, en voluntarios sanos el sevelámero no tuvo ningún efecto en la biodisponibilidad de fármacos tan importantes como la digoxina, la warfarina, el enalapril o el metoprolol21. Sin embargo, la coadministración de inhibidores de la bomba de protones con sevelámero puede aumentar, raramente, los niveles de fósforo21.
Carbonato de lantano (Fosrenol®)El carbonato de lantano puede aumentar el pH gástrico (al igual que los captores cálcicos, a menudo usados en combinaciones de antiácidos) y disminuir la absorción oral de fármacos básicos débiles. Se recomienda no tomar estos compuestos 2horas antes o después de la administración de carbonato de lantano (i.e. antimaláricos como cloroquina e hidroxicloroquina, el antifúngico ketoconazol o los bisfosfonatos)22. La biodisponibilidad del ciprofloxacino oral disminuyó también en aproximadamente un 50% al administrarse conjuntamente con carbonato de lantano en un estudio en voluntarios sanos23. Por el contrario, el carbonato de lantano no afectó las concentraciones séricas de las vitaminas liposolubles A, D, E y K24, aunque recientemente se han descrito interacciones in vitro con la vitamina K225. Es también importante resaltar que, en voluntarios sanos, la administración de carbonato de lantano no modificó el perfil farmacocinético de digoxina, warfarina, metoprolol, fenitoína o enalapril22.
Oxihidróxido sucroférrico (OHSVelphoro®)A diferencia de otros captores existe múltiple información en estudios sobre la ausencia de interacciones del oxihidróxido sucroférrico (OHS) con otros fármacos (fig. 1). Además, se ha descrito la ausencia de interacción relevante in vitro con cefalexina, nifedipino y quinidina, entre otros (fig. 1)26, o la ausencia de interacciones relevantes con losartán, furosemida, omeprazol, digoxina o warfarina en voluntarios sanos27. Tampoco interactúa con estatinas (atorvastatina y simvastatina) en pacientes en diálisis, a pesar de datos preliminares in vitro que sugerían esa posibilidad de interacción. A diferencia de sevelámero, el OHS no afecta la actividad reductora sobre la PTH de la vitamina D oral28 y, a diferencia de lantano, no parece tener interacción con la vitamina K225. A destacar solamente la posibilidad de una menor absorción oral de fármacos que interaccionan con el hierro (como el alendronato y la doxiciclina) o, como los otros captores, con la levotiroxina29.
Captores basados en aluminioAunque las guías KDIGO recomiendan (evidencia 1C) evitar el uso prolongado de captores de fósforo basados en aluminio2, presentamos en la figura 1 las múltiples posibilidades de interacciones por la potencial prescripción fuera de nuestro ámbito o como fórmula magistral30. Debemos destacar asimismo la posibilidad de interacciones desconocidas con inmunosupresores o fármacos de desarrollo reciente.
ConclusionesAparte de los potenciales efectos negativos descritos de los captores con calcio, deberíamos tener también en cuenta la mayor frecuencia de posibles interacciones farmacológicas, muchas con fármacos de uso rutinario en nuestros pacientes polimedicados. En general, otros captores como sevelámero, lantano y OHS han probado la ausencia de interacciones significativas sobre fármacos para los que no consta información con captores más antiguos. Asimismo, debemos tener presente que aquellos captores que precisen un menor número de tomas en monoterapia no solo mejorarán la adherencia al tratamiento, sino que disminuirán directamente el riesgo de posibles interacciones indeseables. En cualquier caso, aunque el potencial de interacciones parece bajo para algunos captores, especialmente OHS, su uso con fármacos con un margen terapéutico estrecho aconsejaría de todos modos separar las dosis y controlar el efecto clínico y las reacciones adversas, tanto al inicio del tratamiento como tras posteriores ajustes de dosis.
Conflicto de interesesJ.B. ha recibido honorarios por conferencias de Abbvie, Amgen, Genzyme y Shire, así como por consultorías de Abbvie, Amgen, Vifor/Fresenius-Renal Pharma, Chugai, Medice y Genzyme/Sanofi. J.F.N.G. ha recibido honorarios por conferencias y/o consultorías de Abbvie, Amgen, Astra-Zeneca, Boehringer-Ingelheim, Esteve, Genzyme, Sanofi, Servier, Shire y Vifor/Fresenius-Renal Pharma. M.D.A. ha recibido honorarios por charlas y consultorías de Shire, Fresenius, Abbvie y Amgen. E.G.P. ha recibido honorarios por consultorías de Sanofi, Vifor/Fresenius-Renal Pharma, Amgen, Abbvie y Shire. A.L.M.F. ha recibido honorarios por conferencias de General Electric y Astra Zeneca y por consultorías de Vifor/Fresenius-Renal Pharma. E.S. ha recibido honorarios por conferencias de Abbvie, Sanofi, Shire, Vifor/Fresenius-Renal Pharma. A.M.M. ha recibido honorarios por conferencias de Abbvie, Amgen, Shire, Bellco, Fresenius-Medical Care. M.J.L. ha recibido honorarios por conferencias de Sanofi y Abbvie, así como por consultorías de Vifor/Fresenius-Renal Pharma. P.M.V. ha recibido honorarios por conferencias de Amgen, Sanofi y Vifor/Fresenius-Renal Pharma, así como por consultorías de Vifor/Fresenius-Renal Pharma. M.A.B. ha recibido honorarios por conferencias de Vifor/Fresenius-Renal Pharma. I.D. ha recibido honorarios por colaboración científica con Vifor/Fresenius-Renal Pharma.