La calcifilaxis, también denominada arteriolopatía urémica calcificante, es un síndrome raro que causa típicamente necrosis cutánea y que afecta principalmente a los pacientes en diálisis. La patogénesis es multifactorial y depende de la suma de todos los factores que producen calcificaciones ectópicas en el paciente con enfermedad renal crónica, como las alteraciones del metabolismo calcio-fósforo, el hiper o el hipoparatiroidismo, la diabetes, la obesidad, la inflamación sistémica y el uso de inhibidores de vitamina K, entre otros. Desde un punto de vista clínico, la calcifilaxis puede evolucionar desde una púrpura dolorosa hasta extensas áreas de necrosis cutánea que pueden sobreinfectarse y llegar a causar el fallecimiento del paciente por sepsis. El tratamiento se basa fundamentalmente en el manejo de las heridas, la eliminación de todos los elementos que puedan precipitar la calcificación ectópica y el uso de agentes inhibidores del proceso de calcificación.
Calciphylaxis, also known as calcific uraemic arteriolopathy, is a rare syndrome that typically causes skin necrosis and usually affects dialysis patients. Its pathogenesis is multifactorial and is the consequence of many factors causing ectopic calcifications in patients with chronic kidney disease, such as calcium-phosphate metabolism disorders, hyper- or hypo-parathyroidism, diabetes, obesity, systemic inflammation and the use of vitamin K antagonists, among others. From a clinical point of view, calciphylaxis may progress from painful purpura to extensive areas of skin necrosis that can potentially lead to superinfection and the death of the patient due to sepsis. Treatment is primarily based on managing the wounds, eliminating all the possible precipitating factors of ectopic calcification and administering agents which are capable of inhibiting the process of calcification.
La calcifilaxis, también denominada arteriolopatía urémica calcificante (CUA), es un síndrome clínico caracterizado por la ulceración necrótica de la piel debida a la calcificación de la media más fibrosis de la íntima arteriolar y posterior isquemia cutánea por trombosis.
Suele manifestarse en pacientes en terapia sustitutiva renal o con filtrado glomerular bajo, cuya alteración del metabolismo fosfocálcico parece representar la principal causa de esta dolencia. Sin embargo, otros factores de riesgo concurren en su patogénesis, por lo que puede también manifestarse en pacientes con filtrado glomerular normal o trasplantados, sobre todo con el progresivo aumento en la edad media y de la enfermedad cardiovascular de estos pacientes1–3.
Se trata de una afección rara, cuya incidencia real es desconocida, aunque parece que va en aumento, si bien esto podría simplemente reflejar un mejor conocimiento de la enfermedad, puesto que existen muchos casos no diagnosticados, y además no todos están adecuadamente recogidos4. Los datos extrapolados por el registro americano United States Renal Data System estiman que su incidencia anual se sitúa entre el 0,01 y el 0,05% de los pacientes en hemodiálisis5. Más recientemente, un estudio de las unidades de diálisis del Fresenius Medical Care North America reportó una incidencia anual del 0,34%6, mientras que el registro alemán refleja una incidencia anual del 0,04%7. La incidencia en pacientes en diálisis peritoneal es menos conocida, si bien un estudio centrado en este colectivo muestra una incidencia anual del 0,9%8. Por otro lado, todavía se dispone de menor información sobre la incidencia específica en pacientes con enfermedad renal crónica (ERC) que no están en diálisis.
Se asocia a una morbimortalidad elevada. La morbilidad se debe sobre todo al intenso dolor que provocan las lesiones y los requerimientos de hospitalización. La mortalidad se encuentra entre el 30 y el 80%, dependiendo de las comorbilidades y del patrón de afectación cutáneo. En los últimos años parece haber descendido la mortalidad, sobre todo desde que se conoce mejor la enfermedad, se actúa más rápidamente y se dispone de algunas alternativas de tratamiento. Un reciente estudio muestra una mortalidad a los 6 meses del 50% y al año del 58%, siendo la septicemia la primera causa de ella9.
Patogénesis y factores de riesgoLa isquemia y la consiguiente necrosis se producen por oclusión trombótica de las arteriolas cutáneas que han desarrollado un engrosamiento de su pared debido a la calcificación progresiva de la túnica media. Mientras el proceso de trombosis es un evento agudo y coincide con el desarrollo clínico de la enfermedad, el proceso de calcificación lleva un tiempo mucho más largo, en el cual muchos factores de calcificación ectópica se suman para producir dicho engrosamiento de la media a lo largo del tiempo. Estos factores suelen coexistir en el paciente en terapia sustitutiva renal y prácticamente son los mismos que causan la calcificación de las arterias de gran calibre.
Podríamos agruparlos como factores difícilmente modificables y factores modificables (tabla 1). Entre los factores difícilmente modificables se incluyen: tiempo en terapia sustitutiva renal, sexo femenino (posmenopausia), raza caucásica, diabetes e inflamación sistémica7,9,10. Entre los factores modificables más relevantes cabe incluir: obesidad, malnutrición, hiperfosforemia y elevado producto calcio-fósforo, uso de dosis elevadas de captores de fósforo de base cálcica, tratamiento con análogos de la vitamina D, hiperparatiroidismo o hipoparatiroidismo, anticoagulación con antagonistas de la vitamina K y estados de hipercoagulabilidad11.
Factores de riesgo asociados al desarrollo de arteriolopatía urémica calcificante en el paciente con enfermedad renal crónica
| Factores difícilmente modificables | Factores modificables |
|---|---|
| Tiempo en terapia sustitutiva renal | Obesidad/malnutrición |
| Sexo femenino (posmenopausia) | Hiperfosforemia. Calcio-fósforo elevado |
| Raza caucásica | Dosis elevadas captores de fósforo de base cálcica |
| Diabetes | Dosis elevadas análogos vitamina D |
| Inflamación | Hiperparatiroidismo/hipoparatiroidismo |
| Hipercoagulabilidad (déficit de proteína C o S) | |
| Antagonistas vitamina K |
El sexo femenino, considerado como factor de riesgo, podría indicar que las mujeres, sobre todo en la posmenopausia, por razones genéticas u hormonales (déficit de estrógenos), presentan una cierta predisposición a un patrón de calcificación ectópica que involucra los vasos más pequeños.
Los análogos de la vitamina D, a dosis elevadas, pueden acelerar la calcificación vascular, por un lado, al facilitar la diferenciación osteogénica de las células musculares lisas vasculares, pero, fundamentalmente, por la elevación de la fosfatemia y la calcemia que provocan. Análogos como el paricalcitol o el maxacalcitol parecen ser menos inductores de calcificación12.
Si bien tradicionalmente el hiperparatiroidismo se ha considerado como un importante factor de riesgo de CUA, también el hipoparatiroidismo se ha asociado más recientemente con el desarrollo de calcifilaxis; de hecho, la enfermedad de hueso adinámico se ha relacionado con una mayor severidad de calcificaciones vasculares13. En el registro alemán de calcifilaxis, el 47% de los pacientes reportados tenían niveles de PTH inferiores al rango aconsejado por las guías KDIGO7.
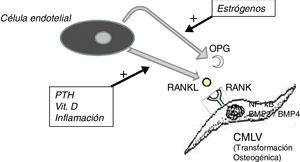
No hay que olvidar que el proceso de calcificación de la túnica media no consiste solamente en el depósito pasivo de cristales de calcio, sino que procede del cambio de fenotipo de las células mesenquimales de la pared arterial que se transforman en células de estirpe osteoblástica, las cuales producen y depositan tejido óseo dentro de la túnica media exactamente como si esta fuera hueso. Este es un proceso finamente regulado en el que todos los factores antedichos actúan en contra de los mecanismos que inhiben la calcificación ectópica, como la osteoprotegerina (OPG) y la matriz de proteína Gla (MGP).
La OPG es una proteína soluble, sintetizada, al igual que el ligando del receptor activador del factor nuclear kB (RANKL), fundamentalmente por los osteoblastos, aunque también por células estromales y células endoteliales. Actúa como un receptor señuelo impidiendo la unión del RANKL con su receptor natural el RANK, inhibiendo así la activación mediada por RANK del factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-kB), un factor de transcripción fundamental para la producción de factores de crecimiento, mediadores de inflamación y citocinas y que juega también un papel esencial para el desarrollo y el recambio fisiológico del tejido óseo. Su inhibición se asocia al desarrollo de hueso hipermineralizado (osteopetrosis), mientras que su hiperactividad se asocia a pérdida de tejido óseo y a depósito ectópico de mineral. De hecho, en modelos animales con déficit de OPG, se observa una extensa calcificación vascular debida a la hiperactividad del eje RANKL-RANK-NF-kB14, que también promueve la activación de las proteínas morfogénicas óseas 2 y 4, favoreciendo la transición osteogénica de las células musculares lisas (fig. 1). En el paciente con ERC, muchos factores actúan sobre este eje; por ejemplo, la PTH, la vitamina D y la inflamación sistémica activan RANKL y NF-kB15. La disminución de los niveles séricos de estrógenos se asocia también a una disminuida expresión de OPG16, lo que podría explicar la referida mayor incidencia de calcifilaxis en las mujeres posmenopáusicas. El denosumab, un anticuerpo monoclonal frente al RANKL, se ha mostrado a nivel experimental capaz de prevenir la calcificación vascular17, aunque este efecto beneficioso todavía no se ha podido confirmar en la clínica18.
Esquema del eje OPG-RANKL-RANK y calcificación vascular.
BMP: proteína morfogénica ósea; CMLV: célula de músculo liso vascular; NF-kB: factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas; OPG: osteoprotegerina; PTH: parathormona; RANK: receptor activador de NF-kB; RANKL: ligando del receptor activador de NF-kB.
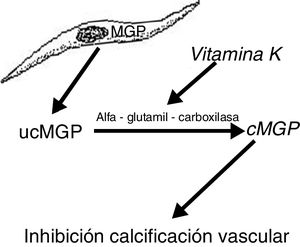
Por otro lado, la MGP, proteína producida por las células musculares lisas de la pared vascular, previene su transdiferenciación en células de estirpe osteoblástica y además interactúa con los cristales de hidroxiapatita previniendo la calcificación19,20. Esta proteína se activa con un mecanismo de carboxilación (gamma-glutamil carboxilasa) dependiente de la vitamina K. La vitamina K previene la calcificación vascular al servir como cofactor de la carboxilación de la proteína MGP, un proceso que convierte la MGP descarboxilada en MGP carboxilada (fig. 2). Esto explica por qué los antagonistas de la vitamina K, tales como los anticoagulantes orales (acenocumarol, warfarina), favorecen la calcificación ectópica, algo que parece confirmarse en la clínica. Así, un estudio de casos y controles mostró una fuerte asociación entre el uso de warfarina y el desarrollo de calcifilaxis, con una odds ratio de 11,421, y en otro estudio de casos y controles, el déficit de vitamina K conllevaba una disminución de los valores séricos relativos de MGP carboxilada que eran significativamente bajos en los pacientes que presentaron calcifilaxis. En este último estudio, cada reducción de 0,1 unidades en la concentración relativa de MGP carboxilada se asociaba con un incremento de más de 2 veces del riesgo de calcifilaxis22.
Se ha planteado que la trombosis del vaso estenosado, que conlleva la aparición aguda del síndrome clínico, puede ser también, a su vez, consecuencia de un estado de hipercoagulabilidad, que puede estar provocado por la deficiencia de proteína C o S o incluso anticoagulante lúpico23,24, o también por episodios hipotensivos, como, por ejemplo, durante una sesión de hemodiálisis.
En algunos casos, los pacientes refieren traumatismos previos en las zonas de necrosis o, en el caso de los diabéticos, las repetidas inyecciones de insulina en el abdomen o la parte alta de los muslos6. Esto significa que factores puntuales pueden precipitar el cuadro agudo de necrosis cutánea, causando la trombosis de las arteriolas previamente estenosadas a lo largo del tiempo como consecuencia de todos los mecanismos ya mencionados.
Manifestaciones clínicas y diagnósticoGeneralmente, la CUA suele manifestarse en 2 fases: la primera se presenta con eritemas laminares cutáneos y prurito; la segunda, con ulceración y necrosis cutánea muy dolorosa (dolor desproporcionado respecto a la lesión cutánea), aunque ambos tipos de lesiones pueden presentarse simultáneamente. Mientras que el primer tipo de lesión se asocia a una mortalidad del 30%, el segundo conlleva una mortalidad mucho más alta, aproximadamente del 80%25.
La distribución de las lesiones cutáneas tampoco es homogénea, pudiéndose distinguir 2 patrones clásicos de enfermedad (tabla 2). En el primer patrón, distal, que se presenta en aproximadamente el 90% de los casos, las lesiones aparecen en las extremidades inferiores, especialmente entre el tobillo y la pantorrilla, aunque también se han descrito casos en dedos, manos e incluso genitales. El segundo tipo de patrón, proximal, es menos frecuente y afecta áreas con mayor tejido adiposo, como el tronco, el interior de los muslos, las nalgas y, en alguna ocasión, las mamas. En general, se considera que este patrón tiene un peor pronóstico que el distal. Sin embargo, hay series que reportan tasas de mortalidad similares (distal 70%, proximal 76%)26.
Manifestaciones clínicas de la arteriolopatía urémica calcificante
| Dos fasesa |
| 1) Eritemas laminares cutáneos+prurito (mortalidad aproximada 30%) |
| 2) Ulceración y necrosis cutánea muy dolorosa (mortalidad aproximada 80%) |
| Dos patrones de distribución |
| Distal (sobre todo en las extremidades inferiores; mortalidad 20-25%) |
| Proximal (tronco, interior muslos, nalgas; mortalidad 60-65%) |
En el diagnóstico diferencial hay que tener en cuenta las enfermedades que pueden presentarse con un cuadro cutáneo similar11. En la tabla 3 se agrupan las manifestaciones dermatológicas de las afecciones que en un momento dado pudieran presentar algún tipo de confusión; no obstante, la mayoría de ellas se podrán descartar por las diferencias en cuanto a los antecedentes, la historia clínica, el patrón biológico sanguíneo o, en última instancia, la histología.
Diagnóstico diferencial de las lesiones de arteriolopatía urémica calcificante
| Enfermedades | Lesiones dérmicas |
|---|---|
| Purpura fulminans (CID, PTT) | Inicio distal, progresa proximalmente |
| Aterotrombosis/Enfermedad arterial periférica | Úlceras secas en extremidades. Hipoperfusión |
| Síndrome antifosfolípido | Necrosis extensa. Muy excepcional |
| Vasculitis | Afectación multisistémica |
| Crioglobulinemia | Afectación petequial y equimosis distal o lateromedial del muslo |
| Esclerodermia | Abultamiento y alteración de la pigmentación |
| Embolismo de colesterol | Livedo reticularis de aparición súbita y bilateral Se suele asociar gangrena y cianosis |
| Fascitis necrosante | Eritema y decoloración púrpura Frecuentes flictenas |
| Celulitis | Eritema extenso. Caliente. Frecuente hidropesia |
| Necrosis cutánea por heparina | En el lugar de inyección, máculas eritematosas o hemorrágicas. Necrosis posterior |
| Necrosis cutánea por warfarina | Área eritematosa. Petequias y equimosis Aparición precoz tras inicio de warfarina Posterior gangrena |
| Úlceras de estasis | Irregulares, húmedas. No livedo |
| Úlceras traumáticas | Borde irregular. No livedo |
| Úlceras neuropáticas | En puntos de presión. Lesión necrótica Suele tener un callo circundante |
La biopsia cutánea nos ayudará a confirmar el diagnóstico de calcifilaxis. La muestra debería tomarse en los bordes de la lesión para evitar que presente tejido necrótico, ya que esto perjudicaría el diagnóstico, pero por otro lado tampoco muy alejado, pues en este caso nos podría dar falsos negativos. Cuando se realiza la biopsia es importante tomar la muestra con una profundidad de al menos 4-5mm para incluir también la grasa subcutánea en el análisis, de este modo se incluirán más fácilmente las arteriolas afectadas para hacer el diagnóstico. Se ha descrito que, en ocasiones, la biopsia cutánea puede complicarse con sobreinfección o aumento de la zona de necrosis, por tanto, los riesgos y los beneficios de realizarla han de valorarse en cada paciente, especialmente en los que tienen un cuadro clínico muy llamativo que pueda hacerla innecesaria. El patrón anatomopatológico clásico consiste en la calcificación de la túnica media de las arteriolas cutáneas o de la grasa subcutánea, asociada a un importante engrosamiento fibrointimal que disminuye la luz del vaso, objetivándose en algunos vasos la trombosis de la luz residual. La calcificación de la túnica se puede demostrar con la tinción de Von Kossa en inmunohistoquímica27 o puede mostrar un patrón violeta en la coloración con hematoxilina y eosina.
Recientemente se han propuesto unos criterios diagnósticos que si bien presentan algunas limitaciones, son los únicos que existen. Según estos criterios, el diagnóstico de calcifilaxis puede hacerse si se cumplen los 3 criterios clínicos de: 1) paciente en hemodiálisis o con filtrado glomerular<15ml/min/1,73m2; 2) más de 2 úlceras dolorosas y no curables con púrpura dolorosa asociada, y 3) presentes en el tronco, las extremidades o el pene. En caso de que se cumplan solamente 2 de los criterios anteriormente mencionados, el diagnóstico hay que confirmarlo si hay una biopsia con los signos histológicos de calcifilaxis27.
Las pruebas de imagen también pueden contribuir al diagnóstico de calcifilaxis. Una radiografía simple de la zona afectada puede demostrar la presencia de calcificaciones de los vasos de medio-pequeño calibre. En un estudio multicéntrico retrospectivo sobre 29 pacientes, la presencia de calcificaciones en forma de red (net-like pattern) en los tejidos blandos presentó una especificidad muy elevada, de alrededor del 90%28. La gammagrafía ósea también ha mostrado cierta utilidad, acumulándose el trazador de forma difusa en las áreas correspondientes a los hallazgos clínicos. También se podría aprovechar para monitorizar el efecto del tratamiento29. Una radiografía con técnica de mamografía, debida a su mejor definición gráfica, puede también evidenciar calcificaciones de los pequeños vasos cutáneos y puede ser muy útil en el diagnóstico diferencial de las lesiones30. La ecografía, siendo una herramienta barata, fácilmente disponible y segura, puede contribuir al diagnóstico en los pacientes con alta sospecha clínica. En estos casos, la ecografía de las zonas afectadas puede demostrar calcificaciones vasculares en los tejidos subcutáneos como depósitos hiperecogénicos con relativos conos de sombra30. Hay también casos donde se ha demostrado con TC de alta resolución la presencia de vasos calcificados de pequeño y medio calibre. Sin embargo, considerando el riesgo para el paciente, el coste y la mayor sensibilidad de la radiografía simple o con técnica de mamografía, no se puede aconsejar su uso rutinario31.
En definitiva, a día de hoy no hay ninguna prueba de imagen con suficiente especificidad/sensibilidad, aunque quizá la radiografía simple con técnica de mamografía es la que parece ofrecer mejores resultados.
Manejo terapéuticoEl tratamiento de la calcifilaxis podríamos articularlo en 3 niveles complementarios (tabla 4). El primero sería el manejo de las lesiones desde el punto de vista médico-quirúrgico; el segundo, modificar todos los posibles factores precipitantes de la calcificación ectópica; y el tercero, emplear todas aquellas herramientas que inhiben activamente el proceso de calcificación cutánea.
Posibles alternativas de tratamiento de la arteriolopatía urémica calcificante en el paciente con enfermedad renal crónica
| Manejo de las lesiones | Limpieza quirúrgica |
| Larvas estériles | |
| Antibioterapia | |
| Analgesia | |
| Cámara hiperbárica | |
| Modificar factores precipitantes | Evitar captores de base cálcica |
| Evitar análogos vitamina D | |
| Aumentar dosis de diálisis | |
| Normalizar PTH (cinacalcet/paratiroidectomía) | |
| Mejorar estado nutricional | |
| Evitar antagonistas vitamina K | |
| Inhibir el proceso de calcificación | Tiosulfato sódico |
| Bifosfonatos | |
| SNF472 |
La limpieza quirúrgica de la herida puede ser el primer paso en el manejo de las lesiones. En 2 estudios retrospectivos se ha reflejado que la supervivencia al año de los pacientes que se sometían a desbridamiento era del 60% a los 6 meses y del 70% al año, mientras que en los pacientes que no lo realizaban era del 27% a los 6 meses y del 50% al año9,32.
Las larvas estériles de Lucilia sericata se han mostrado de utilidad para el desbridamiento de heridas tales como úlceras no cicatrizantes de pacientes diabéticos, úlceras de presión o úlceras posquirúrgicas. Estas larvas secretan enzimas digestivas que selectivamente disuelven el tejido necrótico, desinfectan la herida y estimulan su cicatrización33. Se han empleado con éxito como terapia coadyuvante en las lesiones de calcifilaxis, sobre todo en lesiones con amplias áreas necróticas y paniculitis34.
También parece razonable intentar obtener un aislamiento microbiológico para pautar una terapia antibiótica específica o, si no es posible, se debería emplear una terapia de amplio espectro con cobertura para los grampositivos y los anaerobios.
El mecanismo del dolor es poco conocido, pero se cree que es debido tanto a la isquemia como al dolor neuropático secundario a la inflamación nerviosa. El dolor es muy severo y bastante resistente a los opiáceos. No existe ningún estudio controlado que muestre un enfoque analgésico óptimo. La necesidad de una analgesia potente y sin toxicidad requiere fármacos que no dependan del funcionalismo renal ni que sean fácilmente dializables. Sin embargo, las series de casos evidencian que un régimen de analgesia que incluya opioides, ketamina y adyuvantes no opioides (por ejemplo, gabapentina o antidepresivos tricíclicos) puede ser eficaz35. Ahora bien, quizá el fentanilo, la buprenorfina y la metadona podrían estar más recomendados que los opioides ya que, en pacientes con ERC, se asocian a menor toxicidad. El uso de lidocaína tópica u opiáceos tópicos, como los geles con infusión de morfina, puede ofrecer un razonable control local del dolor, con efectos secundarios potencialmente menos sistémicos, pero esto aún está muy poco estudiado.
Se ha reportado que el uso de la cámara hiperbárica puede favorecer la recuperación de las lesiones necróticas, así como suele pasar en los grandes quemados, también favoreciendo la proliferación de fibroblastos, de colágeno y la angiogénesis36.
El segundo paso, y teniendo en cuenta que muchos de los factores que producen la calcifilaxis son reversibles, es mandatorio modificarlos con el objetivo de intentar frenar el proceso de calcificación. Sobre el metabolismo calcio-fósforo, por ejemplo, será determinante evitar la hipercalcemia y la hiperfosforemia. Entonces, según los casos, hará falta suspender el tratamiento con análogos de la vitamina D y/o agonistas selectivos del VDR y emplear captores del fósforo, evitando cuidadosamente los que son de base cálcica.
En el caso de pacientes en programa de diálisis, el aumento de la dosis de esta es también importante para aumentar el aclaramiento del fósforo y de las toxinas urémicas.
Por lo que concierne al hiper o hipoparatiroidismo, se aconseja intentar alcanzar los valores planteados en las Recomendaciones de la Sociedad Española de Nefrología37, que para el paciente en diálisis contemplan valores de PTH intacta entre 150-300pg/ml, siendo aceptable hasta 500pg/ml. No hay que olvidar que tanto la enfermedad ósea de bajo remodelado como la de alto remodelado se asocian a calcificación ectópica. En caso de hiperparatiroidismo severo, además de tratar la hipocalcemia y la hiperfosforemia, se puede pautar cinacalcet o incluso plantearse la paratiroidectomía. Se ha visto que el manejo con cinacalcet de pacientes afectos de hiperpartiroidismo secundario podría disminuir el número de calcifilaxis38. En pacientes con hiperparatiroidismo secundario severo, la paratiroidectomía subtotal, comparada con la realizada en pacientes sin paratiroidectomía, se ha asociado con una supervivencia significativamente mejor tanto a los 6 meses (90 versus 42%) como a los 5 años (53 versus 11%)9. En el caso del hipoparatiroidismo, sobre todo se debería evitar a toda costa la hipercalcemia y la hiperfosforemia.
Como el estado nutricional está asociado al desarrollo de calcifilaxis, es muy importante mantenerlo en el mejor estado posible, incluso si es necesario añadiendo complementos o nutrición parenteral total.
Los antagonistas de la vitamina K (acenocumarol, warfarina) son probablemente uno de los factores precipitantes de calcifilaxis mejor conocidos. En los pacientes en tratamiento con antagonistas de la vitamina K, se debería intentar a toda costa su suspensión y, en caso de que sea imprescindible la anticoagulación, valorar la conversión a heparina subcutánea o a anticoagulantes orales no antagonistas de la vitamina K. Estos últimos presentan el problema de la dificultad en su ajuste de dosis. Rivaroxabán, apixabán y edoxabán (inhibidores del factor xa) están aprobados en Europa, con la correspondiente disminución de dosis, para pacientes con ERC estadio 4. Apixabán y edoxabán parecen los más recomendables. Apixabán se elimina en un 27% por orina y edoxabán en un 50%, pero en líneas generales se recomienda una reducción de dosis del 50% para ambos. Para pacientes en diálisis se han comunicado experiencias positivas con apixabán 2,5mg cada 12h y con rivaroxabán 10mg cada 24h. Con las otras alternativas o a mayores dosis existe un considerable riesgo de hemorragia39.
En el tercer nivel incluiremos las herramientas que nos puedan ayudar a mejorar/inhibir el proceso de calcificación.
La administración de tiosulfato sódico es probablemente la medida off-label más común para tratar la calcifilaxis. Su mecanismo de acción se basa en la capacidad de formar complejos solubles con muchos metales y minerales, además de un posible efecto vasodilatador, antioxidante y directamente inhibidor del proceso de calcificación11. En el estudio retrospectivo más amplio sobre 172 pacientes en hemodiálisis con calcifilaxis, se ha observado una recuperación total o mejoría en un 70% del total de los pacientes tratados40. La dosificación más ampliamente aceptada es la de 25g (100ml de solución al 25%) intravenosos 3 veces por semana (después de cada sesión de hemodiálisis). En la actualidad está en fase de selección de pacientes un ensayo clínico multicéntrico aleatorizado de tiosulfato sódico versus placebo en pacientes con calcifilaxis.
Otros fármacos que se han demostrado eficaces en el tratamiento de la calcifilaxis son los bifosfonatos, que poseen acción inhibidora de la calcificación a través de su enlace a los cristales de hidroxiapatita. En un estudio retrospectivo, 11 pacientes consecutivos tratados con bifosfonatos en el periodo 2002-2010 obtuvieron todos una restitutio ad integrum41. Por supuesto, hay que sopesar la eficacia de este tratamiento frente al riesgo de inducir una enfermedad de hueso adinámico en pacientes con enfermedad renal terminal. Sin embargo, teniendo en cuenta la mortalidad asociada a la calcifilaxis, la relación riesgo/beneficio juega sin duda a favor del uso de bifosfonatos. Nuestro esquema de tratamiento actual es de administración de 60mg de pamidronato intravenoso (en 100ml de suero fisiológico a pasar durante la última hora de diálisis), dosis que se repite a los 15 días y al mes. En caso de ausencia de completa restitución de las lesiones proponemos una nueva dosis de 60mg a los 3 meses.
Actualmente se encuentra en fase de desarrollo, como alternativa de tratamiento para la calcifilaxis en pacientes en hemodiálisis, el SNF472, que es una formulación intravenosa de mioinositol hexafosfato. El SNF472 inhibe selectivamente la formación y el crecimiento de los cristales de hidroxiapatita y, por tanto, la calcificación vascular. En ensayo fase 2 se ha mostrado eficaz en revertir las lesiones de calcifilaxis42.
ConclusionesEn resumen, la calcifilaxis es una enfermedad rara que afecta sobre todo a los pacientes con ERC en diálisis y es debida a la calcificación progresiva y crónica de los vasos de pequeño calibre seguida por una trombosis súbita de los mismos. Los factores de riesgo más asociados a su desarrollo son el tiempo en terapia renal sustitutiva, las alteraciones del metabolismo calcio-fósforo, el sexo femenino, la obesidad y el tratamiento con antagonistas de la vitamina K. La técnica diagnóstica más fiable es la biopsia cutánea, aunque a menudo la presentación clínica puede ser suficiente para hacer el diagnóstico. El inicio de un rápido tratamiento es fundamental para prevenir la progresión de las lesiones y su sobreinfección. La limpieza quirúrgica de las heridas, la antibioterapia, la eliminación de los factores precipitantes de la calcificación ectópica y la administración de fármacos como el tiosulfato sódico o los bifosfonatos son las opciones terapéuticas actuales para su manejo.
Para mejorar el conocimiento de la calcifilaxis en la actualidad existen varios registros internacionales y, concretamente en España, el registro de la Sociedad Española de Nefrología. Es fundamental que, cuando se diagnostica un paciente, se introduzcan los datos en el registro, pues es la única manera de poder realizar estudios con muestras de mayor tamaño.
Conceptos clave- •
La calcifilaxis, también conocida como arteriolopatía urémica calcificante, es una dolencia rara que afecta principalmente a los pacientes con enfermedad renal crónica, sobre todo en diálisis. La incidencia, aunque poco conocida, parece en aumento.
- •
Se trata de un síndrome clínico caracterizado típicamente por ulceración necrótica de la piel debida a calcificación de la media más fibrosis de la íntima arteriolar y posterior isquemia cutánea por trombosis.
- •
En su patogénesis, concurren muchos factores de riesgo que contribuyen al desarrollo de calcificaciones ectópicas en la pared de los vasos de pequeño calibre a nivel de la piel o del tejido subcutáneo.
- •
Factores de riesgo modificables son la obesidad o la malnutrición, el producto calcio-fósforo elevado, sobre todo la hiperfosforemia, dosis elevadas de captores de fósforo de base cálcica o de análogos de la vitamina D, la hipercoagulabilidad y, sobre todos ellos, el uso de antagonistas de la vitamina K.
- •
Se suele manifestar en 2 fases: la primera, con eritemas laminares cutáneos y prurito, y la segunda, con ulceración y necrosis cutánea muy dolorosa. Esta última presenta una alta tasa de mortalidad.
- •
La distribución puede ser proximal (áreas con mayor tejido adiposo) o distal, siendo esta última la más frecuente y la de mejor pronóstico.
- •
El diagnóstico es principalmente clínico, si bien el papel de la biopsia cutánea es muy importante, sobre todo en los casos dudosos.
- •
Las alternativas terapéuticas incluyen el manejo de las lesiones desde el punto de vista médico-quirúrgico, modificar todos los posibles factores precipitantes de la calcificación y emplear herramientas que inhiban activamente el proceso de calcificación cutánea, como el tiosulfato sódico o los bifosfonatos.
Los autores declaran no tener ningún conflicto de intereses.