El origen de la carencia de vitamina D en la enfermedad renal crónica (ERC) parece multifactorial, pero es incierta la importancia relativa de cada uno de sus potenciales determinantes.
ObjetivosDeterminar los factores asociados a los niveles de 25-hidroxi-colecalciferol (25OHD) y su importancia relativa en una cohorte de pacientes con ERC prediálisis.
Material y métodosSe incluyeron pacientes incidentes en una consulta de ERC, excluyendo a aquellos que recibían suplementos de vitamina D o anticonvulsivantes. Además de los datos demográficos y clínicos, se analizó la influencia de la actividad física, estación del año de la extracción, y tratamiento con estatinas, antiangiotensina e inhibidores de la xantino-oxidasa. Para la estimación de la importancia relativa se utilizó el método de ponderación relativa de Johnson, expresando los resultados como porcentajes de contribución al R múltiple.
ResultadosSe estudiaron 397 pacientes, de los cuales 30 fueron excluidos. La concentración media de 25OHD fue de 13,7±7,4ng/ml, presentando unos niveles inferiores a 20ng/ml el 81% de los pacientes. Por regresión lineal múltiple y ponderación relativa, los principales determinantes de unos niveles más bajos de 25OHD fueron por orden de importancia: una mayor proteinuria (28,5%), mayor edad (21,4%), disminución de la actividad física (19,4%), sexo femenino (19,3%), y menor bicarbonato sérico (11,4%).
ConclusiónLa magnitud de la proteinuria y la edad son los factores con mayor importancia relativa como determinantes de los niveles de 25OHD en la ERC.
The cause of vitamin D deficiency in chronic kidney disease (CKD) is probably multi-factorial; however, the relative importance of each potential determinant is uncertain.
AimsTo determine factors associated with serum levels of 25-hydroxy vitamin D (25OHD) and their relative importance in a cohort of pre-dialysis CKD patients.
Material and methodsIncident patients admitted to a CKD outpatient clinic were included. Those who were receiving vitamin D supplements or anticonvulsants were excluded. In addition to demographic and clinical data, information about outdoor physical activity, season of blood collection, prescription of statins, anti-angiotensin drugs and xanthine-oxidase inhibitors were included as potential determinants. Johnson's relative weights analysis was used to estimate the relative importance of each potential determinant and the results were expressed as percentage contribution to multiple R.
ResultsThe study group consisted of 397 patients, 30 of whom were excluded. The mean serum level of 25OHD was 13.7±7.4ng/ml, and 81% of patients had serum levels lower than 20ng/ml. By multiple linear regression and relative weights analyses, the best determinants of low serum 25OHD levels and their relative importance were: higher proteinuria (28.5%), old age (21.4%), low physical activity (19.4%), female gender (19.3%) and low serum bicarbonate levels (11.4%).
ConclusionsProteinuria and age are the determinants with the highest relative importance for predicting 25OHD levels in CKD patients.
En los últimos años se ha prestado un gran interés al diagnóstico de la deficiencia de vitamina D mediante la determinación de 25-hidroxi-colecalciferol (25OHD) en suero. Una importante proporción de la población general presenta niveles reducidos de 25OHD1,2, pero este déficit se observa en la mayoría de los pacientes con procesos crónicos, y en especial en la enfermedad renal crónica (ERC)3-8.
El origen de esta deficiencia parece multifactorial. Factores relacionados con la exposición a la luz ultravioleta (UV)7,9,10, y comorbilidad como la diabetes11-13 podrían explicar en gran parte el déficit de vitamina D. Además, en pacientes con ERC también podrían influir significativamente la reducción del filtrado glomerular14-16, la proteinuria3,17-19, o fármacos de uso frecuente20, factores cuya importancia relativa individual sobre este déficit es desconocida.
La regresión lineal múltiple es el método de elección para establecer el grado de variación de una variable dependiente usando la información que ofrecen las variables independientes.
Una de las asunciones que se debe cumplir para que los modelos de predicción sean fiables y precisos es que las variables independientes no tengan una correlación significativa entre ellas21. Este requisito resulta muy difícil de cumplir cuando se analizan los potenciales determinantes de los niveles de vitamina D en una población con ERC. Así, existe un alto grado de asociación entre factores como la actividad física o exposición a radiación ultravioleta (UV) con la edad, sexo y comorbilidad, o entre proteinuria y la prescripción de determinados fármacos como los antiangiotensina, lo que dificulta la interpretación y significado de los coeficientes de regresión y la importancia relativa de cada uno de estos potenciales determinantes.
Una forma de obviar estas dificultades que genera la multicolinealidad en un modelo de regresión lineal multivariante es la determinación, además de los coeficientes estandarizados (beta), de los coeficientes de estructura que aportan información adicional sobre la relación bivariable entre un predictor y el efecto observado, sin la influencia de otros predictores en el modelo21-23.
La «ponderación de la importancia relativa» es un método acreditado para establecer la contribución proporcional de cada predictor sobre el coeficiente de determinación (R2), corrigiendo los efectos de la intercorrelación entre predictores21-23.
El objetivo del presente estudio fue analizar los determinantes de los niveles de 25OHD en una cohorte de pacientes con ERC avanzada no en diálisis, y establecer la importancia relativa de aquellas variables que entraron a formar parte del mejor modelo predictivo.
Material y métodosPacientesSe incluyeron de forma consecutiva todos los pacientes incidentes en una consulta de ERC avanzada durante el periodo comprendido entre febrero de 2012 y marzo de 2015. Todos eran mayores de 18 años, y vivían en el área geográfica correspondiente a la provincia de Badajoz. Fueron excluidos del estudio aquellos que estaban siendo tratados con suplementos de vitamina D (ergocalciferol, colecalciferol, o 25-hidroxi-colecalciferol), o con medicamentos que tuvieran interacción con el metabolismo de la 25OHD, como la carbamazepina.
Mediante la anamnesis e historia clínica se recogieron los siguientes datos, que fueron incluidos como potenciales covariables en el análisis: edad, sexo, índice de masa corporal, índice de comorbilidad de Davies, fecha de la extracción, disminución de la actividad física, tratamiento con análogos de vitamina D, estatinas, inhibidores enzima de conversión angiotensina (IECA) y/o antagonistas receptores (ARA), e inhibidores de la xantino-oxidasa (alopurinol o febuxostat).
Según la estación del año de la extracción se compuso una variable cualitativa ordinal en la que el invierno se puntuó como 0, otoño 1, primavera 2 y verano 3.
La disminución de la actividad física se consideró cuando los pacientes referían nula actividad física fuera de sus domicilios y escasa exposición solar.
Análisis de laboratorioLa determinación de las concentraciones de 25OHD se realizó mediante el método de electroquimioluminiscencia (LIAISON® 25 OH Vitamina D TOTAL Assay, DiaSorin Inc, Stillwater, EE.UU.). Los intervalos de medición de este método comprenden concentraciones desde 4 hasta 150ng/ml, con una imprecisión intraensayo (coeficiente de variación) de ≤5,5% y una sensibilidad funcional de 4ng/ml.
Otros parámetros bioquímicos que fueron analizados como potenciales determinantes de los niveles de 25OHD fueron: filtrado glomerular (MDRD), albúmina sérica (inmunoturbidimetría, ADVIA 2400 Chemistry System, Siemens Health Care Diagnostic, EE.UU.), proteína C reactiva alta sensibilidad (turbidimetría, Siemens Health Care Diagnostic), y proteinuria medida en muestra de orina recogida durante 24h, expresando los resultados como g de proteína por g de excreción de creatinina. También se incluyeron como variables las concentraciones séricas de ácido úrico (ADVIA, Siemens) y el bicarbonato venoso (analizador de gases ABL 800 FLEX, Radiometer Ibérica).
No se consideraron como potenciales determinantes de los niveles de 25OHD las concentraciones séricas de calcio, fósforo, magnesio o PTH.
Métodos estadísticosPara establecer el mejor modelo de asociación entre los niveles de 25OHD (variable dependiente) y las variables independientes se utilizó la regresión lineal multivariante. La selección de las variables independientes se realizó por un procedimiento automático mediante la incorporación progresiva paso a paso. Además del coeficiente de determinación múltiple (R2) del modelo, también se calcularon los coeficientes de regresión parcial estandarizados (beta).
Se realizó un diagnóstico de multicolinealidad en el mejor modelo resultante, siendo considerada como significativa si el número de condición era superior a 20, siguiendo los criterios de Belsley et al.24.
Para determinar la importancia relativa de cada variable independiente en el modelo se calcularon los coeficientes de estructura, la ponderación relativa de Johnson y los test de significación para la comparación de la importancia relativa de los predictores22,23. La importancia relativa de cada variable se expresa como porcentaje de contribución al R múltiple.
Para las comparaciones de variables continuas se utilizaron el test t de Student, ANOVA, o test de Mann-Whitney, según las características de distribución de la variable. El test χ2 fue utilizado para la comparación de variables categóricas.
Los resultados se expresan como media o mediana y desviación típica o rangos, respectivamente. Una p<0,05 fue considerada como estadísticamente significativa.
Los análisis estadísticos se realizaron con el software IBM SPSS Statistics 21.0 (IBM Corp. Armonk, EE.UU.). Para el análisis de ponderación relativa de Johnson se utilizó el programa FIRE creado por Lorenzo-Seva y Ferrando23. Dicho programa utiliza una ventana de sintaxis del programa SPSS, a través de la cual se realizan los cálculos.
ResultadosEl número total de pacientes estudiados fue de 397, de los que 30 fueron excluidos porque ya estaban recibiendo suplementos de vitamina D (27 pacientes) o tratados con carbamazepina (3 pacientes).
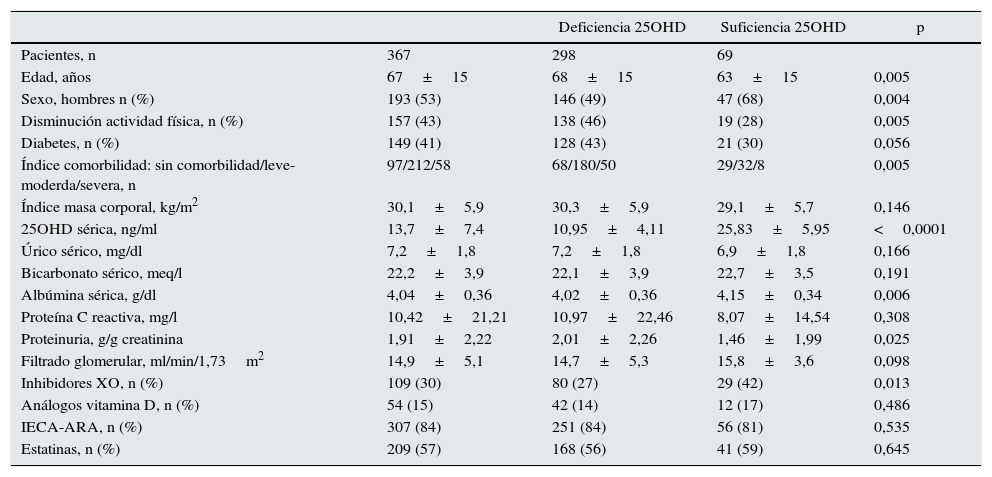
Las características de los 367 pacientes restantes que integraron el grupo de estudio se muestran en la tabla 1. El número total de pacientes con niveles séricos de 25OHD inferiores a 20ng/ml fue de 298 (81%).
Características del grupo total de estudio y de los subgrupos según presentaran unos niveles séricos de 25-hidroxi-colecalciferol (25OHD) inferiores (deficiencia) o superiores (suficiencia) a 20ng/ml
| Deficiencia 25OHD | Suficiencia 25OHD | p | ||
|---|---|---|---|---|
| Pacientes, n | 367 | 298 | 69 | |
| Edad, años | 67±15 | 68±15 | 63±15 | 0,005 |
| Sexo, hombres n (%) | 193 (53) | 146 (49) | 47 (68) | 0,004 |
| Disminución actividad física, n (%) | 157 (43) | 138 (46) | 19 (28) | 0,005 |
| Diabetes, n (%) | 149 (41) | 128 (43) | 21 (30) | 0,056 |
| Índice comorbilidad: sin comorbilidad/leve-moderda/severa, n | 97/212/58 | 68/180/50 | 29/32/8 | 0,005 |
| Índice masa corporal, kg/m2 | 30,1±5,9 | 30,3±5,9 | 29,1±5,7 | 0,146 |
| 25OHD sérica, ng/ml | 13,7±7,4 | 10,95±4,11 | 25,83±5,95 | <0,0001 |
| Úrico sérico, mg/dl | 7,2±1,8 | 7,2±1,8 | 6,9±1,8 | 0,166 |
| Bicarbonato sérico, meq/l | 22,2±3,9 | 22,1±3,9 | 22,7±3,5 | 0,191 |
| Albúmina sérica, g/dl | 4,04±0,36 | 4,02±0,36 | 4,15±0,34 | 0,006 |
| Proteína C reactiva, mg/l | 10,42±21,21 | 10,97±22,46 | 8,07±14,54 | 0,308 |
| Proteinuria, g/g creatinina | 1,91±2,22 | 2,01±2,26 | 1,46±1,99 | 0,025 |
| Filtrado glomerular, ml/min/1,73m2 | 14,9±5,1 | 14,7±5,3 | 15,8±3,6 | 0,098 |
| Inhibidores XO, n (%) | 109 (30) | 80 (27) | 29 (42) | 0,013 |
| Análogos vitamina D, n (%) | 54 (15) | 42 (14) | 12 (17) | 0,486 |
| IECA-ARA, n (%) | 307 (84) | 251 (84) | 56 (81) | 0,535 |
| Estatinas, n (%) | 209 (57) | 168 (56) | 41 (59) | 0,645 |
No se observaron diferencias significativas en las concentraciones de 25OHD según la estación del año de la extracción (invierno 13,8±8,1ng/ml; otoño 12,9±6,5ng/ml; primavera 13,7±7,2ng/ml, y verano 14,1±6,7ng/ml; p=0,886, ANOVA).
En la tabla 1 también se muestran las diferencias entre los pacientes que presentaban suficiencia o carencia de vitamina D. Las características más destacables de los que presentaron deficiencia de vitamina D fueron: mujeres de mayor edad, con más comorbilidad, menor actividad física, una concentración media de albúmina sérica más reducida y una mayor proteinuria, sin diferencias significativas en el filtrado glomerular estimado, y tratados en menor proporción con inhibidores de la xantino-oxidasa.
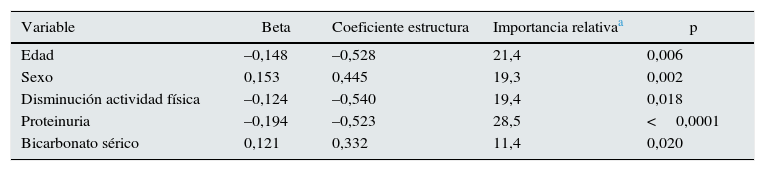
Por regresión lineal multivariante, el mejor modelo de predicción de los niveles de 25OHD estaba compuesto por (tabla 2): edad, sexo, disminución de la actividad física, proteinuria y bicarbonato sérico. Algunas variables que no entraron a formar parte de la mejor ecuación pero que se aproximaron en su significación fueron el índice de comorbilidad, las concentraciones séricas de ácido úrico, y el tratamiento con inhibidores de la xantino-oxidasa (p=0,05).
Regresión lineal múltiple y ponderación relativa. Factores mejor asociados a los niveles de 25OHD
| Variable | Beta | Coeficiente estructura | Importancia relativaa | p |
|---|---|---|---|---|
| Edad | –0,148 | –0,528 | 21,4 | 0,006 |
| Sexo | 0,153 | 0,445 | 19,3 | 0,002 |
| Disminución actividad física | –0,124 | –0,540 | 19,4 | 0,018 |
| Proteinuria | –0,194 | –0,523 | 28,5 | <0,0001 |
| Bicarbonato sérico | 0,121 | 0,332 | 11,4 | 0,020 |
R múltiple=0,356.
Variables que no entraron en la mejor ecuación de predicción: estación del año de la extracción, índice de comorbilidad (p<0,10), índice de masa corporal, eGFR, úrico (p<0,10), albúmina, proteína C reactiva, diabetes, análogos vitamina D, IECA-ARA, estatinas, e inhibidores xantino-oxidasa (p=0,05).
El análisis de multicolinealidad del modelo mostraba un número de condición de 19,57, es decir, en el límite para considerar el modelo con multicolinealidad grave.
Las variables independientes que presentaron correlación bilateral significativa fueron la edad con la actividad física — a mayor edad, menor actividad física — (R=0,357; p<0,0001), y la edad con el sexo — más jóvenes los hombres que las mujeres — (R=–0,121; p=0,021).
Mediante el análisis de ponderación relativa (tabla 2), la proteinuria fue la variable con mayor importancia relativa, seguida de la edad. La suma de ambas variables contribuía en casi un 50% al R múltiple. El otro 50% se repartía entre las siguientes variables independientes: la disminución de la actividad física, el sexo (más deficiencia de vitamina D en mujeres), y las concentraciones de bicarbonato sérico (más deficiencia de vitamina D cuanto menores eran las concentraciones de bicarbonato) (tabla 2).
Con las variables del mejor modelo predictivo transformadas en categóricas se compuso una puntuación de predicción de deficiencia severa de 25OHD (concentraciones <15ng/ml). Cada una de las siguientes categorías sumaba un punto: edad superior a 70 años, sexo femenino, disminución de la actividad física, proteinuria >1g/g de creatinina, y bicarbonato sérico inferior a 22meq/l.
Los valores de corte para transformar las variables continuas en discretas se estimaron observando los puntos con mayor sensibilidad y especificidad en curvas de característica operativa del receptor (índice de Youden).
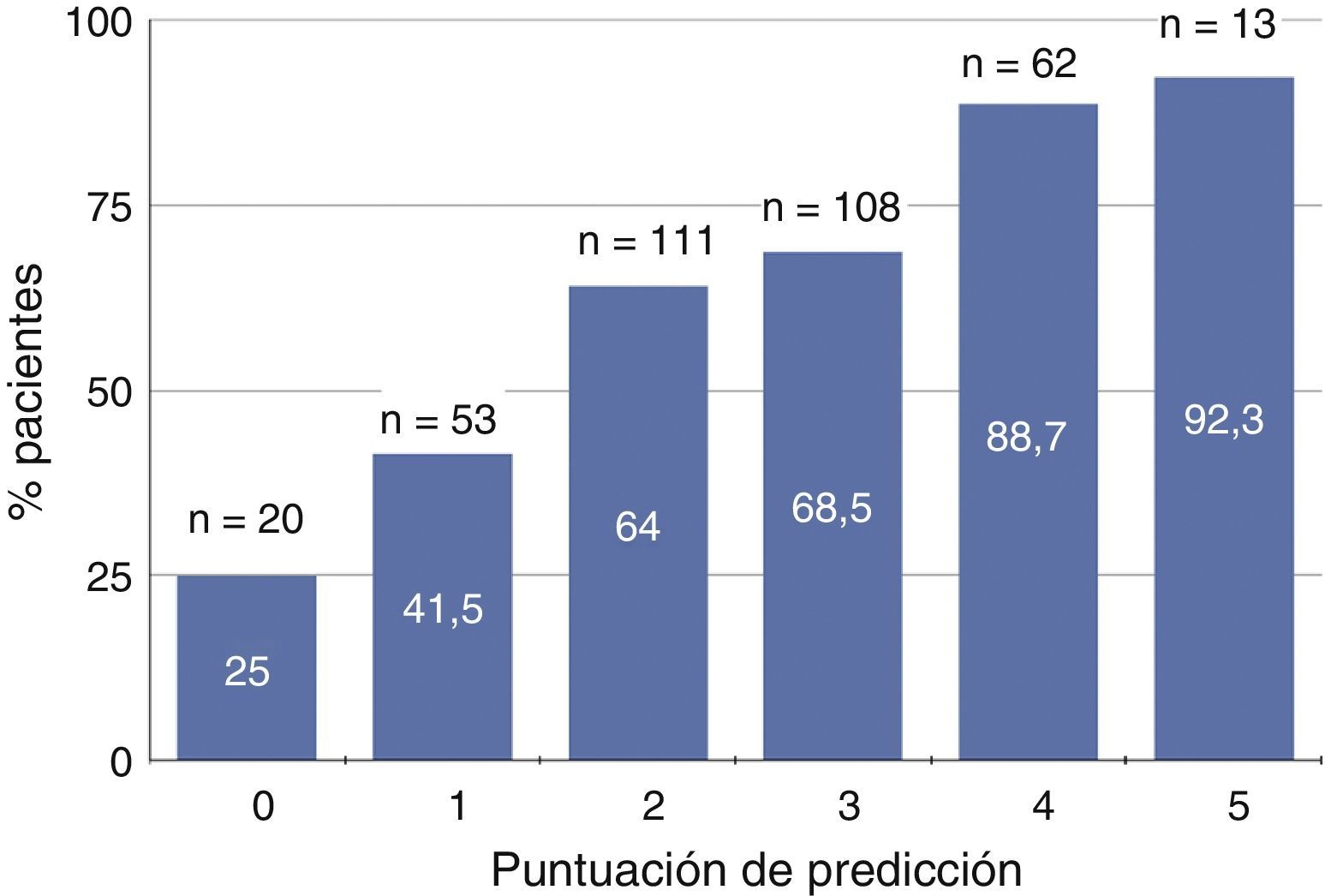
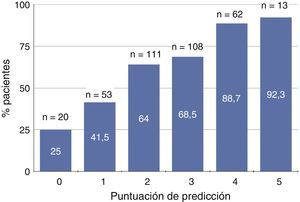
En la figura 1 se muestra el porcentaje de pacientes con deficiencia severa de 25OHD según la puntuación predictiva que oscilaba entre 0 y 5. Aproximadamente el 90% de los pacientes con puntuaciones de 4 o 5 presentaban deficiencia severa de vitamina D, mientras que tan solo un 25% de los que no tenían ninguna de estas características mostraban esta deficiencia (fig. 1).
Representación gráfica del porcentaje de pacientes con déficit de vitamina D (niveles séricos de 25-hidroxi-colecalciferol <15ng/ml) según la puntuación de predicción basada en edad, sexo, actividad física, proteinuria y bicarbonato sérico. En cada subgrupo de puntuación se especifica el número total de pacientes (n) y el porcentaje de ellos con déficit de vitamina D.
Los resultados de este estudio muestran la existencia de un déficit de vitamina D en más del 80% de los pacientes con ERC avanzada. Los predictores de las concentraciones de vitamina D con mayor importancia relativa fueron la proteinuria, edad, sexo, disminución de la actividad física y bicarbonato sérico.
Un estudio previo en una amplia población española, estudio OSERCE3, describe los principales parámetros de la enfermedad óseo mineral asociada a la ERC, incluyendo los niveles de 25OHD. Sin embargo, en este estudio no se podía ni se tenía como objetivo establecer los determinantes de los niveles de 25OHD. De hecho, se concluye que los niveles de 25OHD se asocian solo con la PTH y ligeramente con la proteinuria3.
El diseño de nuestro estudio deja de lado la relación de 25OHD con parámetros del metabolismo óseo mineral (probablemente más efecto que causa), y se centra en establecer cuál o cuáles fueron sus determinantes. Así, a diferencia del estudio OSERCE, la información predictiva aportada con nuestro estudio sobre los niveles de 25OHD es mucho más rigurosa y exhaustiva, y en su análisis se incluyen la mayoría de los potenciales determinantes conocidos. Pero la principal originalidad de nuestro estudio es el análisis estadístico para la ponderación de la «importancia relativa», es decir, no solo se determinó qué factores se asociaban cualitativamente con los niveles de 25OHD, sino que también se cuantificó la importancia de cada uno de ellos para explicar el modelo de asociación y compensar la colinealidad inherente a estos estudios.
Debido a la frecuente intercorrelación entre las variables que se proponen como determinantes de una variable dependiente, los modelos resultantes pueden ser imprecisos y sus resultados promover interpretaciones confusas21. Este podría ser el caso cuando se analizan los determinantes de las concentraciones de 25OHD en la ERC.
La utilización del método estadístico de ponderación relativa permite estimar la importancia relativa de cada variable independiente en un modelo de predicción, computando el efecto de la multicolinealidad21-23.
En este estudio, la proteinuria fue la variable con mayor importancia relativa en el modelo de predicción.
Otros estudios también han demostrado una asociación entre la magnitud de la proteinuria y el grado de deficiencia de vitamina D en pacientes con ERC3,17,18 o en trasplantados renales19.
En algunos estudios en los que la proteinuria no fue medida, se ha observado una asociación entre el déficit de vitamina D y la hipoalbuminemia4,7,18, o la presencia de glomerulopatías que suelen manifestarse con proteinuria severa11,13,25.
Como la mayoría de los estudios que se han realizado sobre este tema son transversales, no se puede concluir una relación causal entre proteinuria y déficit de vitamina D.
La vitamina D circulante va unida en un alto porcentaje a proteínas —DBP y albúmina— que son filtradas en grandes cantidades a través del glomérulo enfermo, pudiendo llegar a producirse pérdidas urinarias significativas14. De esta forma, una hipótesis plausible para explicar esta asociación sería el efecto de depleción de vitamina D causada por la proteinuria.
Otros datos que apoyan la hipótesis del déficit de vitamina D asociada a la depleción proteica son los niveles más reducidos de 25OHD en pacientes en diálisis peritoneal, que habitualmente presentan mayores pérdidas proteicas que los tratados con hemodiálisis26,27.
No obstante, también podría influir un hipotético efecto proteinúrico asociado al déficit de vitamina D. Aunque se ha observado que los análogos de la vitamina D (calcitriol, paricalcitol) tienen un efecto reductor de la proteinuria, un estudio también ha demostrado reducciones significativas de albuminuria tras la repleción de los niveles de vitamina D con colecalciferol28. De este modo, la proteinuria podría ser no solo causa, sino efecto del déficit de vitamina D, lo que reforzaría la interpretación de su mayor importancia relativa.
Otras características como la edad más avanzada, el sexo femenino o la disminución de la actividad física son factores que contribuyen a unos niveles más reducidos de vitamina D de una forma más esperable13,29.
Un hallazgo de difícil interpretación en este estudio es la observación de una asociación significativa, aunque con menor importancia relativa, entre la concentración de bicarbonato sérico y niveles de 25OHD.
La acidosis no provoca efectos sobre la síntesis o degradación de la 25OHD30,31. La cetoacidosis32 o dietas cetogénicas33 sí podrían provocar reducciones de los niveles de 25OHD, aunque este supuesto no parece de interés entre nuestros pacientes.
Un nexo común entre acidosis y reducción de 25OHD en el contexto clínico de una enfermedad renal proteinúrica podría ser la disfunción del túbulo proximal.
Un túbulo proximal más disfuncional, además de poder ser causa de una acidosis más intensa (acidosis tubular renal tipo II), podría provocar mayores pérdidas urinarias de 25OHD debido al déficit de reabsorción de proteínas (DBP, albúmina) que requieren la expresión tubular de receptores endocíticos multiligandos, como la megalina y cubilina34. Incluso se ha señalado como causa directa de disfunción del túbulo proximal al propio déficit de vitamina D35. Esta interacción túbulo proximal-proteinuria-vitamina D, aunque especulativa, podría ayudar a explicar estos hallazgos.
La estación del año en la que se realiza la extracción de la muestra para la medición del 25OHD ha demostrado tener influencia sobre los resultados en algunos estudios6,7. En climas continentales muy septentrionales del hemisferio norte existe una gran diferencia de radiación solar entre las estaciones frías y calientes. En cambio, el clima de Extremadura es continental meridional con inviernos bastante soleados —que invitan a la exposición solar—, primaveras y otoños benignos, pero veranos muy calurosos en los que es necesario refugiarse de la exposición solar. Estas características podrían ayudar a explicar la ausencia de diferencias significativas en los niveles de 25OHD según la estación del año en nuestros pacientes.
En este estudio no se observó una asociación significativa entre los niveles reducidos de 25OHD y estatinas o fármacos antiangiotensina (inhibidores enzima de conversión angiotensina y/o antagonistas receptores angiotensina). En otro estudio reciente, Yuste et al.20 encontraron en un grupo más reducido de pacientes con ERC prediálisis, que mostraban una deficiencia muy severa de vitamina D, unos niveles de 25OHD aún más bajos en aquellos tratados con estatinas, y más elevados en los que recibían fármacos antiangiotensina. Sin embargo, en el análisis multivariante de este estudio los autores no incluyeron en el ajuste del modelo la proteinuria, dato que podría haber sido de gran interés para la interpretación de los resultados.
En este mismo estudio, Yuste et al.20 observaron unos niveles de 25OHD más elevados en pacientes tratados con alopurinol. En nuestro estudio, el tratamiento con inhibidores de la xantino-oxidasa (alopurinol o febuxostat) se asociaba a unos niveles más elevados de 25OHD en comparación con los no tratados, aunque en el análisis multivariante esta covariable no alcanzó significación estadística por poco (p=0,05).
Existe una relación entre el metabolismo de las purinas y de la vitamina D, habiéndose demostrado un efecto inhibidor del ácido úrico y la xantina sobre la 1-α-hidroxilasa36-38. Sin embargo, resulta bastante incierto el papel que puede jugar la inhibición de la xantino-oxidasa sobre el metabolismo de la 25OHD.
Se ha postulado el efecto antiinflamatorio de los inhibidores de la xantino-oxidasa como causa de los niveles más elevados de 25OHD20. Sin embargo, en nuestro estudio las concentraciones de 25OHD no se correlacionaron con un marcador de inflamación como es la proteína C reactiva, ni los tratados con inhibidores de la xantino-oxidasa tenían una menor concentración de esta proteína C reactiva (datos no mostrados). En cambio, sí observamos que los pacientes tratados con inhibidores de xantino-oxidasa tenían una proteinuria significativamente menor que los no tratados (1,39±1,38 vs. 2,13±2,46g/g creatinina; p=0,005). Así, esta colinealidad con la proteinuria podría explicar al menos en parte la asociación del tratamiento con inhibidores de la xantino-oxidasa y los niveles de 25OHD.
Este estudio tiene limitaciones, sobre todo las relacionadas con el diseño transversal, que impiden establecer con firmeza inferencias causales.
En conclusión, la deficiencia de vitamina D es muy común en la ERC, y la magnitud de la proteinuria es un factor con una alta importancia relativa en la predicción de niveles reducidos de 25OHD. Debido a esta fuerte asociación con la proteinuria, cualquier estudio sobre los efectos adversos de un déficit de vitamina D en la ERC (por ej. progresión de la insuficiencia renal) debe tener en cuenta esta relación, ya que la magnitud de la proteinuria y sus factores asociados pueden tener también mucha importancia como determinantes de la evolución y pronóstico de esta enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses