Antecedentes: La certificación de biobancos según la norma ISO 9001:2008 pretende mejorar la gestión de los procesos realizados en estos con dos objetivos: la satisfacción del cliente y la mejora continua. En este trabajo se presenta el impacto de la certificación ISO 9001:2008 sobre los procesos de cesión de muestras de un biobanco español especializado en muestras de pacientes renales y con un gran aumento del número de estas entre los años 2009 (12 582 viales) y 2010 (37 042 viales). Métodos: El biobanco de la Red de Investigación Renal española (REDinREN) situado en la Universidad de Alcalá ha puesto en marcha la norma ISO 9001:2008 para la gestión eficaz del material humano cedido a los centros de investigación. Se han analizado mediante encuestas dos períodos en el proceso «cesión de muestras». Durante el primer período, entre las fechas 1-10-12 y 26-11-12 (8 semanas), se han realizado cambios mínimos para corregir errores puntuales. En el segundo período, entre las fechas 7-01-13 y 18-02-13 (6 semanas), se han realizado acciones correctivas generales. Resultados: La identificación de inconvenientes y la puesta en marcha de acciones correctivas para la certificación permitieron: reducir el 70 % del tiempo de ejecución del proceso, aumentar significativamente (200 %) el número de muestras procesadas y mejorar un 25 % el proceso. El aumento del número de muestras procesadas estuvo directamente relacionado con la mejora del proceso. Conclusión: La certificación de la norma ISO 9001:2008, obtenida en julio de 2013, permitió la mejora de los procesos del biobanco REDinREN, aumentando la calidad y la satisfacción del cliente.
Background: Biobank certification ISO 9001:2008 aims to improve the management of processes performed. This has two objectives: customer satisfaction and continuous improvement. This paper presents the impact of certification ISO 9001:2008 on the sample transfer process in a Spanish biobank specialising in kidney patient samples. The biobank experienced a large increase in the number of samples between 2009 (12,582 vials) and 2010 (37,042 vials). Methods: The biobank of the Spanish Renal Research Network (REDinREN), located at the University of Alcalá, has implemented ISO standard 9001:2008 for the effective management of human material given to research centres. Using surveys, we analysed two periods in the “sample transfer” process. During the first period between 1-10-12 and 26-11-12 (8 weeks), minimal changes were made to correct isolated errors. In the second period, between 7-01-13 and 18-02-13 (6 weeks), we carried out general corrective actions. Results: The identification of problems and implementation of corrective actions for certification allowed: a 70% reduction in the process execution time, a significant increase (200%) in the number of samples processed and a 25% improvement in the process. The increase in the number of samples processed was directly related to process improvement. Conclusion: The certification of ISO standard 9001:2008, obtained in July 2013, allowed an improvement of the REDinREN biobank processes to be achieved, which increased quality and customer satisfaction.
INTRODUCCIÓN
Los biobancos son indispensables en el avance del reconocimiento de marcadores de enfermedad y progresión, así como también en el descubrimiento de nuevos fármacos1. Biobanco con fines de investigación biomédica: establecimiento público o privado, sin ánimo de lucro, que acoge una o varias colecciones de muestras biológicas de origen humano con fines de investigación biomédica, organizadas como una unidad técnica con criterios de calidad, orden y destino, con independencia de que albergue muestras con otras finalidades (según el Real Decreto 1716/20112). Por lo tanto, dentro de las bases que garantizan el éxito del biobanco se incluye la implantación de un sistema de calidad1,3,4. En este contexto, la aplicación de normas de calidad genéricas permite lograr mejoras continuadas en el tiempo.
Entre las normas de calidad genéricas más utilizadas actualmente, se encuentra la norma internacional ISO 9001:2008 que se aplica a los sistemas de gestión de calidad (SGC)5. Esta norma se utiliza para implementar y mejorar la eficacia de un SGC, aumentando la satisfacción del cliente mediante el cumplimiento de sus requisitos. La ISO 9001 es aplicada por más de un millón de organizaciones en 178 países, perteneciendo el 47 % de estas a la Unión Europea. En ese sentido, España se ubicaba en el cuarto puesto mundial con certificaciones ISO 9001 en el año 20106. Asimismo, muchos biobancos están certificados con la ISO 9001. En todo el mundo podemos mencionar el UK Biobank (Reino Unido), UK DNA Banking Network (Reino Unido), Invidumed (Hamburg), Norwegian Mother and Child Cohort Study Biobank, Biobanque de Picardie, Biobank Graz (Austria) y Singapore BioBank1. En España, existen biobancos como el de ADN y VIH, el biobanco del Hospital Ramón y Cajal, el biobanco vasco para la investigación y el biobanco del Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas, entre otros.
Aunque no existe una norma internacional para la calidad técnica de estos centros, en las guías de buenas prácticas para los biobancos publicadas por la Organización para la Cooperación y Desarrollo Económico7, el Instituto Nacional del Cáncer8 y la Sociedad Internacional para el Almacenamiento Biológico y Medioambiental9 se aconsejan otras normas como la ISO 17025 (control y calibración de laboratorios)10 y la ISO Guide 34 (producción de material)11. Por otra parte, Betsu et al., analizando los estándares propuestos, recomiendan el uso de la ISO 9001 como norma general aplicable a todo biobanco y la ISO 17025 y la ISO Guide 34, según la actividad del biobanco12.
En los biobancos que han decidido mejorar sus procesos siguiendo el modelo presentado por la ISO 9001, se suele certificar la gestión de los procesos que realizan3,13,14. El enfoque de procesos, característico de la ISO 9001:2008, establece principalmente dos objetivos: la satisfacción del cliente y la mejora continua. Para ello y teniendo en cuenta las recomendaciones, al implantar la norma ISO 9001 se comienza con la identificación y el análisis de los procesos primarios del biobanco. El seguimiento del proceso se realiza a partir de indicadores de calidad cuantificables, controlando las actividades y promoviendo acciones correctivas (AC). Junto con el seguimiento, se miden actividades del proceso que son claves para lograr la mejora continua. Estas mediciones son elementos clave del SGC15.
En este trabajo se presenta la mejora del proceso de cesión, uno de los principales de un biobanco especializado en muestras biológicas, que en nuestro caso son sangre y orina procedentes de pacientes con enfermedad renal. El aumento sustancial de muestras observado entre el año 2009, con 12 582 viales, y el año 2010, con 37 042 viales, hizo necesaria la puesta en marcha de la norma ISO 9001:2008 para la gestión eficaz del material humano cedido a los centros de investigación16. Como resultado de la mejora se ha obtenido una reducción del tiempo de ejecución del proceso, acompañado de un aumento significativo en el procesamiento de las muestras. Finalmente, el análisis de los resultados permite concluir que el aumento del número de muestras procesadas está directamente relacionado con la mejora del proceso.
MÉTODOS
El biobanco que pertenece a la Red de Investigación Renal española (REDinREN) está situado en la Universidad de Alcalá, ciudad de Alcalá de Henares (Madrid), y financiado con fondos FEDER, RD6/0016/0002. Está especializado en coleccionar muestras biológicas procedentes de pacientes con enfermedad renal y funciona desde el año 2007.
Desarrollo para la mejora continua del proceso principal del biobanco
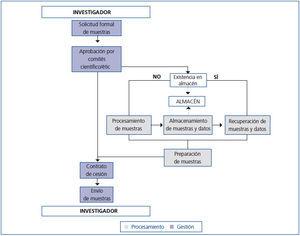
A lo largo de esta sección se describen los pasos iniciales y las AC que se han incorporado para la mejora de uno de los procesos principales del biobanco REDinREN, nodo Alcalá de Henares. El proceso principal del biobanco tiene como objetivo la cesión de muestras de ADN a los centros de investigación que pertenecen a la REDinREN y a otros centros adheridos, siendo muy importante mantener la cantidad y la pureza de las muestras. La implantación del proceso «cesión de muestras» tiene dos grandes partes: en la primera parte o «gestión» se han tenido en cuenta los aspectos de solicitud y gestión de las muestras. En la segunda parte o «procesamiento» se han agregado las tareas directamente relacionadas con el procesamiento de las muestras de células sanguíneas almacenadas de las cuales se aísla el ADN (figura 1). La gestión incluye: la solicitud formal de muestras (conforme a la Ley 14/2007 de Investigación Biomédica17), la aprobación por los comités científico y ético, la firma del contrato de cesión y la gestión del envío. El procesamiento incluye: el aislamiento de muestras de ADN, que se realiza mediante un extractor robotizado automático de ácidos nucleicos, el almacenamiento, la recuperación de las muestras y los datos, y finalmente la preparación de las muestras para realizar el envío.
La aplicación de este nuevo proceso ha sido dividida en dos períodos, en cada uno de los cuales el investigador elegido ha sido distinto, y para llevar a cabo las actividades del proceso no se ha cambiado el equipo técnico ni la gerencia. Durante el primer período se han realizado cambios mínimos iniciales para corregir errores puntuales, se ha denominado período 1 y su duración ha sido de ocho semanas. En el segundo período se han realizado AC generales, se ha denominado período 2 y su duración ha sido de seis semanas.
Métodos de evaluación del proceso
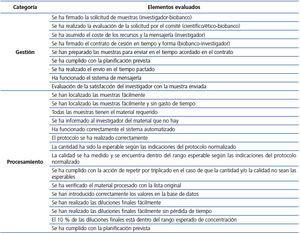
Las formas de medición de la calidad de los procesos son básicamente dos18: la medición interna (con la que se puede evaluar, entre otros, el incremento en la productividad)19 y la medición externa o relacionada con los efectos de mercado (con la que el cliente evalúa, entre otros, la calidad del producto). En nuestro caso realizamos una medición interna del proceso con el objetivo de evaluar la mejora en la productividad. El instrumento de medición fue la «encuesta» aplicada a través de un formulario de auditoría interna cumplimentada por el responsable de calidad. Esta encuesta se realizó sobre la gestión, una vez por período y compuesta por 9 preguntas, y sobre el procesamiento, que se realizó una vez por semana y estaba compuesta de 15 preguntas.
La puntuación fue de 0 cuando se identificaron errores sin corrección, de 0,5 cuando se identificaron errores pero se han corregido, y de 1 cuando no se identificaron errores. Se realizó la media y se comparó con un proceso en el que todos sus elementos fueran de 1. De esta manera obtenemos una puntuación relativa. Los ítems evaluados se recogen en la tabla 1.
Análisis estadístico
Para completar el análisis de los resultados se ha realizado un estudio del análisis de varianza (ANOVA) de la cantidad de muestras y de la puntuación del procesamiento. Este estudio somete a prueba la hipótesis según la cual las medias de varias muestras son iguales. Para nuestro caso comprobamos si había diferencias en la cantidad de muestras procesadas entre los dos períodos y en la puntuación del procesamiento o, por el contrario, eran iguales. Para ello se formulan las hipótesis:
H0 muestras = No existen diferencias en la cantidad de muestras entre los períodos.
H0 puntuación = No existen diferencias en la puntuación del procesamiento entre los períodos.
H1 = La hipótesis nula no es cierta.
Se empleó un nivel de significación de 0,05 para los errores tipo I. Para rechazar las hipótesis nulas debe comprobarse la ratio de las variaciones entre fases y dentro de las fases (llamada F). Este valor debe encontrarse alejado de su valor crítico.
Además se usó la correlación lineal simple para establecer la relación entre dos variables cuantitativas.
RESULTADOS
Período 1: puesta en marcha
Las mediciones realizadas durante el primer período de aplicación del proceso obtuvieron resultados que indicaban una baja productividad. El porcentaje de muestras procesadas con éxito fue de cerca del 25 % (44 de 178). En esta primera fase se han identificado, analizado y resumido un conjunto de inconvenientes indicados en la primera columna de la tabla 2.
Con la aplicación de las AC (tabla 2) se realizó una nueva planificación del proceso en donde se destacan los cambios más relevantes: la realización de un formulario, que permitió mantener la localización exacta de las muestras: se ha evitado así la pérdida de tiempo inicial. La adquisición de un servicio que brinda un equipo de sustitución del extractor robotizado automático de ácidos nucleicos en caso de posibles roturas o fallos mecánicos: ha evitado el freno de la actividad o la realización manual. El cambio en la disolución de la muestra: ha servido para obtener mayor rendimiento de la muestra, rapidez y disminución de errores de identificación. Y, por último, pero a la vez muy importante, fue la segregación de funciones: así se han evitado errores propios de la fatiga y/o aburrimiento del personal, corrigiendo la falta de datos, así como muchos errores puntuales.
Período 2: verificación y aplicación de las acciones correctivas
En la sección anterior se han comentado las AC tomadas para mejorar la eficiencia del proceso. Los objetivos principales para modificar el proceso han sido, por un lado, ahorrar tiempo y procesar mayor cantidad de muestras que en el período 1 y, por otro, evitar el cansancio del personal técnico. Todo esto manteniendo la cantidad y la pureza de la muestra.
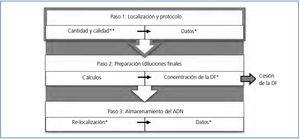
Tras el primer período se ha visto que, cuanto «mejor verificamos», más rápidamente se corrigen los errores. Por lo tanto, con el propósito de realizar una verificación efectiva, se ha propuesto una serie de puntos de control en los pasos más críticos del proceso. Como se observa en la figura 2, el paso 1 del proceso de cesión de muestras (tiempo en que se localizan las muestras y se realiza el protocolo de aislamiento) tiene dos puntos de control: uno al inicio y otro al final. Solo se avanza de izquierda a derecha (dentro de un paso) si se superan los puntos de control. Lo mismo se aplica para avanzar del paso 1 al paso 2 (de arriba hacia abajo).
Si un punto de control no se supera, se realiza una AC planificada, nuevamente se realiza una verificación y, al superarla, se avanza. Un resumen de las AC planificadas para cada punto de control es el siguiente:
- Cantidad y calidad: si no se obtiene una muestra pura y si la concentración no es la suficiente. Se entiende por muestra pura aquella que tras el procesamiento tiene un 90 % de un solo contenido intracelular (por ejemplo: ADN, ARN o proteínas). Se entiende por concentración suficiente la muestra que, tras el procesamiento, tiene una cantidad del contenido intracelular que corresponde al número de células de partida según indique el protocolo normalizado (por ejemplo: si se partió de 4 millones de células se espera obtener 40 ng/ul de ADN). AC: realizar un nuevo aislamiento con otro vial del mismo paciente, solo cuando antes fue verificada la cantidad y calidad por triplicado.
- Datos: si los datos introducidos en la base de datos del biobanco no son correctos. AC: modificación de los datos erróneos por una sola persona, verificando siempre los datos originales impresos.
- Concentración de la dilución final: si al verificar el 10 % de las muestras alguna no coincide con la concentración esperada. AC: descartar esa dilución y volver a realizar la dilución final; si es necesario y tras la verificación del supervisor, volver a cuantificar la muestra inicial. Verificar todas las diluciones finales.
- Re-localización de los viales: si al almacenar los viales en sus lugares correspondientes no coinciden. AC: verificar la posición de todos los viales para encontrar el fallo; el vial almacenado siempre debe estar en la posición original en la que la base de datos indica su concentración, calidad y volumen.
- Datos de la muestra almacenada: si los datos finales agregados a la base de datos del biobanco no son correctos. AC: modificación de los datos erróneos por una sola persona, verificando siempre los datos originales impresos.
Los cambios realizados reducen el tiempo y mejoran el proceso, aumentando la productividad
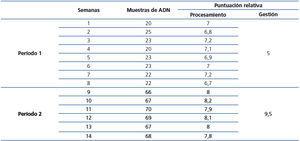
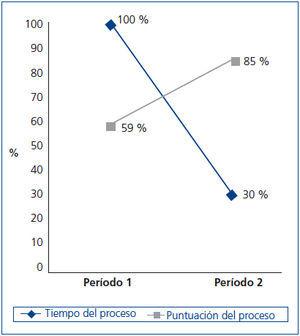
A continuación se presentan los resultados del análisis de los datos (tabla 3) obtenidos al utilizar el proceso con las modificaciones realizadas en el período 2. En primer lugar (figura 3), es destacable la reducción del 70 % del tiempo destinado al proceso. En segundo lugar, observamos un aumento en la puntuación global del proceso, con lo que podemos decir que hemos obtenido una mejora de un 25 % en nuestro proceso. La puntuación total del proceso fue realizada sumando las contribuciones de la gestión y el procesamiento en cada fase.
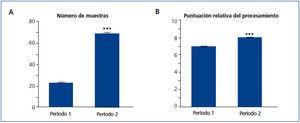
Para realizar un análisis más detallado y conocer si realmente hemos tenido un aumento en la productividad al realizar las modificaciones en el período 2, llevamos a cabo un análisis de la cantidad de muestras procesadas por semana. Observamos, en la figura 4 A, como se incrementó un 200 % el número de muestras en el período 2 con respecto al período 1 (de 22,25 a 67,83). Al examinar las medias de la puntuación de procesamiento (figura 4 B), hay un aumento muy sutil en el período 2 (de 6,9 a 8).
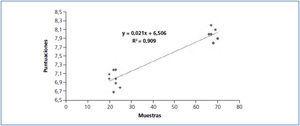
Esto nos induce a pensar que el aumento en la productividad no parecía depender de los elementos evaluados para puntuar el procesamiento. Por ello hemos realizado una correlación para conocer si estaban relacionados y observamos en la figura 5 que existe una correlación lineal clara con un coeficiente de determinación de 0,909. Con este análisis confirmamos que el número de muestras procesadas en cada semana está relacionado con la puntuación relativa del procesamiento.
El análisis de varianza de un factor (tabla 4), para comparar las variaciones, en el número de muestras y en la puntuación entre los dos períodos evaluados mostró una variación significativa entre estos, tanto para la cantidad de muestras (p = 4,57 E-18) como para la puntuación del procesamiento (p = 9,17 E-08).
DISCUSIÓN
En el proceso principal del biobanco, en el que se realiza la cesión de muestras a los centros de investigación de la REDinREN y centros adheridos, hemos respetado los pasos que indica la ISO 9001:2008 en el enfoque basado en procesos. Con una eficiente verificación fuimos capaces de implementar AC (ya documentadas y no de forma improvisada) que condujeron al aumento de la productividad. En este trabajo hemos demostrado de forma cuantitativa la mejora significativa que se produce tras la implementación de dicha norma. Consideramos que esta demostración de su correcta aplicación es de gran interés no solo para todos los usuarios de la REDinREN, sino para potenciales interesados en la utilización de las muestras que almacena el biobanco en las áreas de la investigación nefrológica básica y clínica. Aunque se ha publicado con anterioridad la implementación de esta norma en unidades de hemodiálisis20, este trabajo presenta por primera vez un análisis de procesos tras la aplicación de esta norma. Además, reporta información procedente de un biobanco con dedicación exclusiva a muestras biológicas de pacientes con enfermedad renal, provenientes de toda España.
En primer lugar, obtuvimos la mejora del tiempo del proceso con un ahorro de este que supone el 70 %. En segundo lugar, obtuvimos una mejora del proceso en cuanto a la cantidad de muestras procesadas por tiempo. Demostramos un aumento del procesamiento de muestras en un 200 %, lo que indica una estrecha relación con la inclusión de mejoras dentro del proceso, en concreto en el procesamiento. Tras realizar un estudio estadístico, hemos demostrado que entre los dos períodos existen diferencias altamente significativas para el aumento tanto en la puntuación del procesamiento como en la cantidad de muestras. Además, hemos demostrado que la mejora del procesamiento provocó el incremento de muestras procesadas, indicando una mejora de la productividad del biobanco. Cabe destacar que la mejora de la productividad que presentamos en este trabajo fue acompañada de una mayor organización del personal técnico y eficiencia de trabajo, la acreditación del biobanco y su registro en el Registro Nacional de Biobancos de España a finales de 2013.
En conclusión, la implementación de una norma genérica, como es la ISO 9001:2008, ha mejorado la productividad del biobanco de la REDinREN. Esto garantiza la mejora de nuestros servicios y la satisfacción de la comunidad científica, tanto a nivel nacional como también internacional.
AGRADECIMIENTOS
Instituto de Salud Carlos III: REDinREN, Red de Investigación Renal del Instituto de Salud Carlos III, Fondos FEDER, RD12/0021/0006, RD06/0016/0002.
Programa Intensificación Actividad Investigadora (ISCIII/Agencia Laín-Entralgo/CM).
Fundación Renal Íñigo Álvarez de Toledo (FRIAT).
Instituto Reina Sofía de Investigaciones Nefrológicas (IRSIN).
Vicerrectora de Investigación de la Universidad de Alcalá: Dra. María Luisa Marina Alegre.
Asesora legal de la Oficina de Transferencia de Resultados de Investigación: Dña. Ángela Fuentes Rodríguez.
Secretario General de la Universidad de Alcalá: Dr. Miguel Rodríguez Blanco.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Descripción de los elementos de evaluación
Tabla 2. Resumen de inconvenientes y acciones correctivas en el período 1
Tabla 3. Resumen de los datos evaluados
Tabla 4. Resultados ANOVA de un factor para las hipótesis nulas
Figura 2. Fases críticas del proceso de cesión de muestras.
Figura 1. Mapa del proceso de cesión de muestras.
Figura 3. Tiempo y puntuación del proceso principal del biobanco realizado en dos períodos.
Figura 4. Comparación del número de muestras y la puntuación del proceso.
Figura 5. Correlación lineal entre el número de muestras y la puntuación del procesamiento.