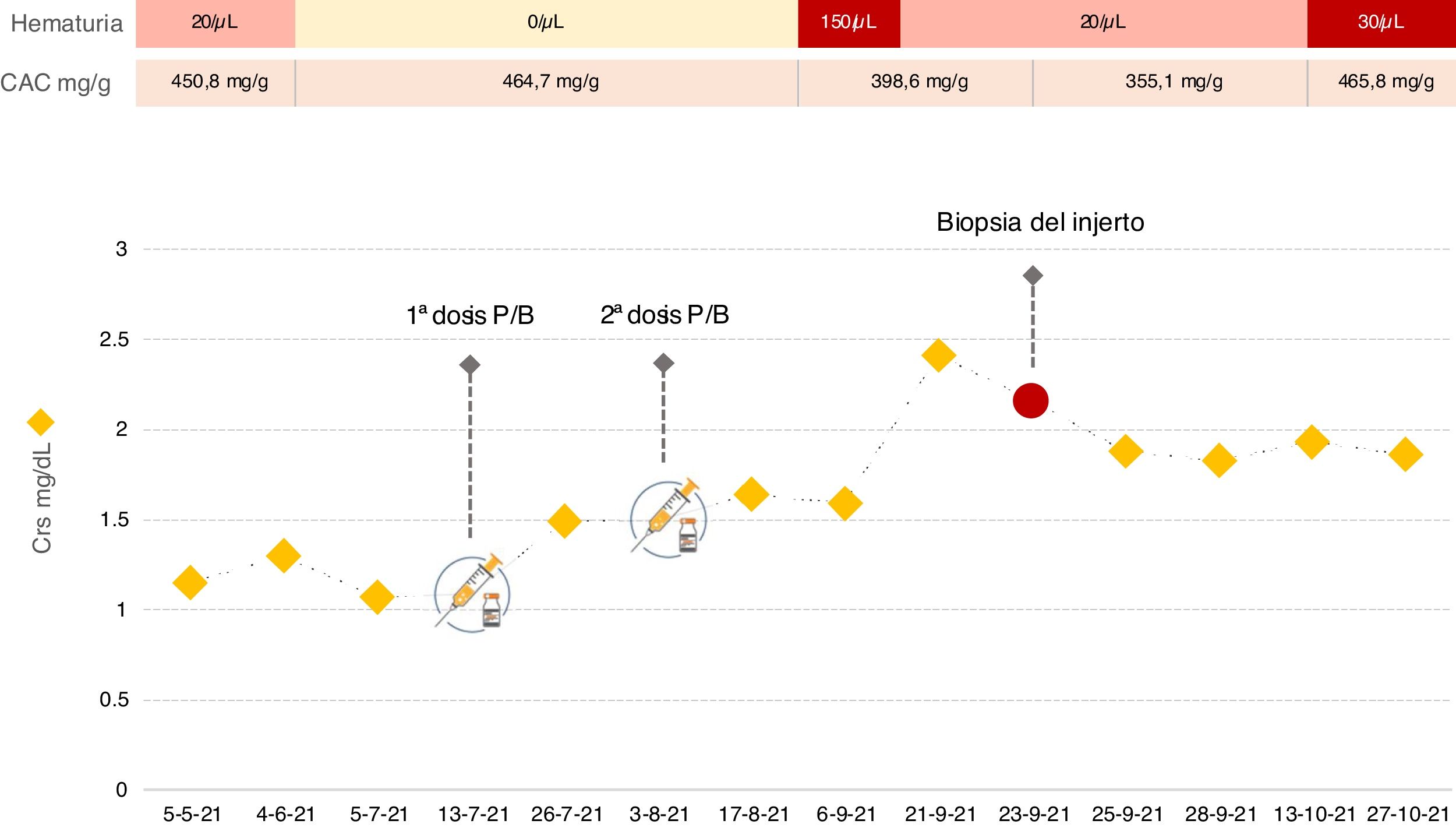
Presentamos el caso de un varón de 30 años diagnosticado de glomerulonefritis membranoproliferativa tipo 1 en 2011 y progresión hacia enfermedad renal crónica terminal. En 2019 recibió un trasplante de riñón (TR), manteniendo desde entonces función renal estable, con creatinina sérica (Crs) basal en torno a 1,1mg/dL y cociente albúmina/creatinina (CAC) en orina de aproximadamente 450mg/g, sin otras alteraciones del sedimento urinario. El tratamiento inmunosupresor incluía tacrolimus, micofenolato mofetil y esteroides. En abril de 2021, por el desarrollo de condilomas acuminados, se sustituyó micofenolato por everolimus. El 13/07/2021 recibió la primera dosis de la vacuna COVID-19 Pfizer-BioNTech sin documentarse efectos adversos. Trece días después, en control analítico rutinario, se evidenció deterioro de la función renal con Crs 1,5mg/dL. El 03/08/2021 recibió la segunda dosis y el deterioro de la función renal progresó hasta Crs 2,4mg/dL. Simultáneamente, el paciente desarrolló microhematuria, manteniéndose la proteinuria estable (fig. 1).
Ante el deterioro de la función renal se inició estudio. Los anticuerpos anti-HLA donante específicos fueron negativos. Se solicitó determinación de autoanticuerpos, proteinograma y complemento que no mostraron alteraciones. Se determinó PCR de citomegalovirus y virus BK en sangre, siendo ambas indetectables. Los anticuerpos IgG anti-SARS-CoV-2-S y la PCR de COVID-19 fueron negativos. Dada la aparición de microhematuria se solicitó citología de orina, que no presentaba alteraciones. Asimismo, la ecografía del injerto no mostró ectasia de la vía urinaria ni anomalías en la vascularización. Por todo ello, se decidió realizar biopsia del injerto. En la microscopia óptica, 2 de 9 glomérulos mostraron hipercelularidad mesangial. El estudio de inmunofluorescencia reveló depósitos de IgA mesangial granular intensos (4+, en una escala de 0 a 4). La tinción peritubular de C4d y SV-40 fueron negativas y no se observaron hallazgos compatibles con rechazo agudo. Según los datos histológicos, se realizó el diagnóstico de nefropatía IgA (NIgA). Aunque la experiencia es limitada en el tratamiento de la NIgA en el TR, dado el deterioro de función renal se decidió iniciar prednisona oral a dosis de 1mg/kg/día. Tras un mes de seguimiento no se ha observado mejoría.
Presentamos el primer caso de NIgA de novo confirmada mediante estudio anatomopatológico en un paciente con TR tras la vacunación contra el SARS-CoV-2. La vacuna del COVID-19 se ha relacionado con el desarrollo de enfermedad glomerular, y la NIgA es uno de los hallazgos histológicos más frecuentes1–4. También se han descrito brotes de NIgA tras la vacunación contra el Zóster recombinante o la influenza5,6. El mecanismo fisiopatológico no está bien descrito, pero probablemente se deba a una respuesta inmune aberrante de la proteína spike o ARN mensajero del SARS-CoV-2 en individuos predispuestos1. Hasta el momento se han publicado 15 casos de NIgA tras la vacunación contra el SARS-CoV-2 en población general, 10 son diagnósticos de novo confirmados mediante biopsia y los 5 restantes se consideraron recidivas ante un brote de macrohematuria en pacientes previamente diagnosticados1–4. En TR se ha comunicado un único caso de recidiva en un paciente con NIgA como enfermedad renal base y que presentó hematuria tras la vacunación, aunque no se realizó biopsia del injerto4.
La NIgA puede recidivar en el TR, con una incidencia del 20-53% y con un tiempo medio de aparición de 7 años. Aunque infrecuente, la NIgA puede también desarrollarse de novo en el TR7,8. Nuestro paciente presentó esta complicación de forma temprana tras vacunarse, por lo que, aunque no se puede excluir la asociación coincidente, la relación temporal parece sugerir causalidad9. Asimismo, era un varón joven, en tratamiento con everolimus y HLA A2 y DR1, todos ellos factores de riesgo de NIgA en el TR10. En el caso descrito, la vacuna pudo ser un estímulo más para el desarrollo del cuadro.
Casi todos los casos comunicados de NIgA asociados a vacunación frente a SARS-CoV-2 se presentaron en pacientes jóvenes y entre la primera y tercera semanas siguientes a la vacuna1–4. La principal manifestación clínica fue la hematuria macroscópica. La mayoría de los brotes ocurrieron tras la segunda dosis, pero el caso de recidiva en TR, antes mencionado, apareció a los pocos días tras la primera. En nuestro paciente el deterioro de función renal y el desarrollo de microhematuria comenzaron también precozmente, lo que hace que debamos prestar atención a una posible afectación temprana en el TR, especialmente en pacientes de riesgo2,4,10.
Hasta la fecha, 843 receptores de TR en nuestro centro han recibido al menos 2 dosis de la vacuna frente al SARS-CoV-2 sin que hayamos identificado más casos de NIgA (incidencia 0,1% en nuestra experiencia), lo que sugiere que se trata de un evento raro. No obstante, aunque el seguimiento de nuestro paciente es corto, esta complicación debe ser tenida en cuenta ya que podría tener consecuencias serias sobre la función del injerto renal.
Conflicto de interesesLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.