CASO CLÍNICO
Paciente, varón de 37 años, no afecto de hipertensión arterial ni diabetes mellitus, adicto a drogas por vía parenteral desde hacía 20 años; en los últimos 4 de manera más esporádica: en la actualidad opiáceos, benzodiacepinas y cocaína. Diagnosticado en 1990 de tuberculosis pulmonar y portador de anticuerpos VHI positivos; con tratamiento tuberculostático triple evolucionó satisfactoriamente. En 1998 presentó una infección pulmonar por pneumocystis carinii; se comprobó una alergia al cotrimoxazol y desde entonces recibía profilácticamente dapsona, además de tratamiento antirretroviral que realizaba de manera muy irregular. Se determinaron también anticuerpos a hepatitis C. En junio de 1999 ingresó en otro centro hospitalario por una sobreinfección respiratoria y se constataron CD4: 100 cels/mm3, pancitopenia con anticuerpos antiplaqueta positivos y medulograma normal. En este ingreso se constataron algunas determinaciones elevadas de tensión arterial. Prosiguió con fármacos antirretrovirales de forma irregular bajo el diagnóstico de síndrome de inmunodeficiencia adquirida (SIDA) estadio C3.
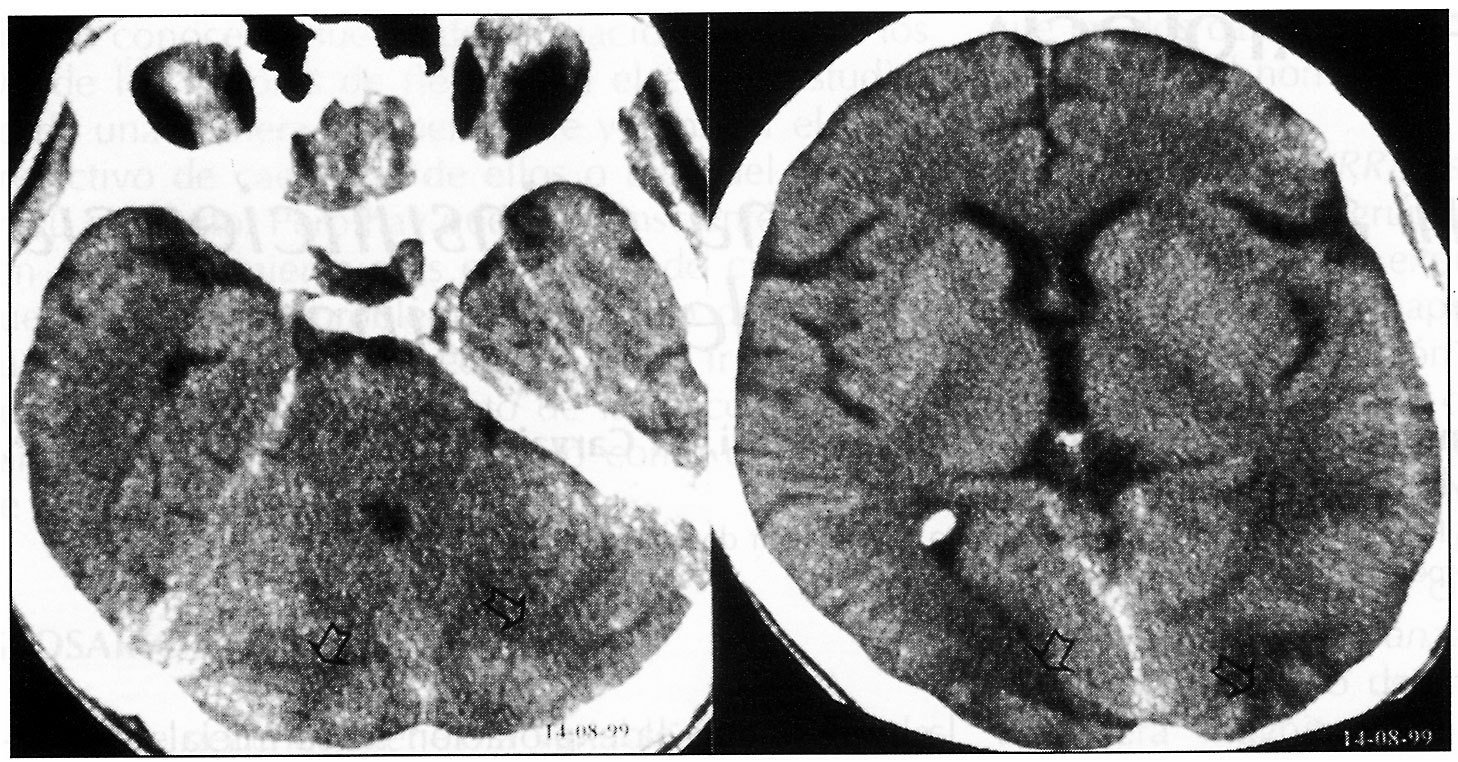
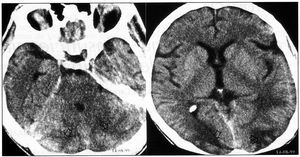
Acudió a emergencias de nuestro centro en agosto de 1999 por edemas maleolares de una semana de evolución, con cefalea occipital, somnolencia y pérdida de agudeza visual en los tres días previos a la consulta. En la exploración física inicial destacaron edemas maleolares y TA de 170/130 mmHg. Estando en emergencias presentó crisis comicial tonicoclónica generalizada seguida de disminución del nivel de consciencia y movimientos de descerebración, procediéndose a intubación orotraqueal (IOT) y a ventilación mecánica (VM). En la anamg/dla inicial destacó urea de 200 mg/di y creatinina de 4 mg/dl, con CK normales, siendo el resto de parámetros normales. El análisis toxicológico fue positivo para cocaína, benzodiacepinas, metoclopramida y posibles opiáceos. Una TAC cerebral demostró lesiones isquémicas, de baja perfusión sanguínea, occipitales y cerebelosas (figura 1).
La evolución neurológica fue correcta, recuperando nivel de consciencia en 24 horas. La TA se mantuvo inicialmente alrededor de 220/120 mmHg obligando a la administración de nitroglicerina y nitro-prusiato ev, pasándose posteriormente a tratamiento oral con hidralacina, doxazosina, enalapril y furosemida. Una ecocardiografía no demostró alteraciones morfológicas ni funcionales, informando de fracción de eyección de 56%. Tras la extubación presentó hemoptisis franca con infiltrado radiológico en lóbulo superior derecha, apareciendo posteriormente fiebre de 39ºC. En cultivo de esputo previo a extubación creció klebsiella sp. Se instauró tratamiento antibiótico con imipenem; empeoró la pancitopenia por lo que se cambió por cloxacilina más ciprofioxacino con los que evolucionó lenta pero satisfactoriamente, desapareciendo el infiltrado pulmonar. El examen del fondo de ojo mostró una retinopatía hipertensiva grado III, sin infiltrados por citomegalovirus.
Desde el punto de vista nefrológico, el paciente presentó progresivo deterioro de la función renal con diuresis conservada y con anemización importante: Hto 19, Hb 6,6 g/dl. Plaquetas 48.000/mm3. El resto de analítica mostró: VSG 88 mm 1ª h, reticulocitos 1,8%, recuento leucocitario y fórmula normales, urea 174 mg/dl, creatinina 5,2 mg/dl, CK 66 U/L, LDH 755 U/L, bilirrubina 0,8 mg/dl, haptoglobina < 5,8 mg/dl, Coombs negativo. Resto de analítica básica con coagulación normales. C3 80 mg/dl (N 90-180), C4 31 mg/dl (N 10-40), CHSO 37,4 U/ml (N 35-60). Crioglobulinas 1,4 mg/dl (N 0-2). AgsHB negativo. Ac. core, Acs hepatitis C y HIV positivos. CD4: 90 cels/mm3, carga viral: 757.443 copias/ml. IgG positiva a Epstein-Barr con IgM negativas. IgG e IgM positivas a citomegalovirus. Factor reumatoide, anticuerpos antinucleares, antimembrana basal y ANCAS negativos. En orina: proteinuria 2,8 g/24 h y sedimento con 10-15 hematíes y 6-7 leucocitos/ campo. La ecografía renal mostró siluetas renales de tamaño normal con corticales hiperecogénicas. Un medulograma mostró médula ósea hiperreactiva con plasmocitosis también reactiva.
Se inició hemodiálisis y transfusiones sanguíneas y de concentrados de plaquetas. Se mantuvo en situación de fracaso renal agudo no oligúrico, con altas dosis de furosemida, requiriendo repetidas sesiones de hemodiálisis. Por todo ello se practicó una biopsia renal percutánea tras transfusión de plaquetas.
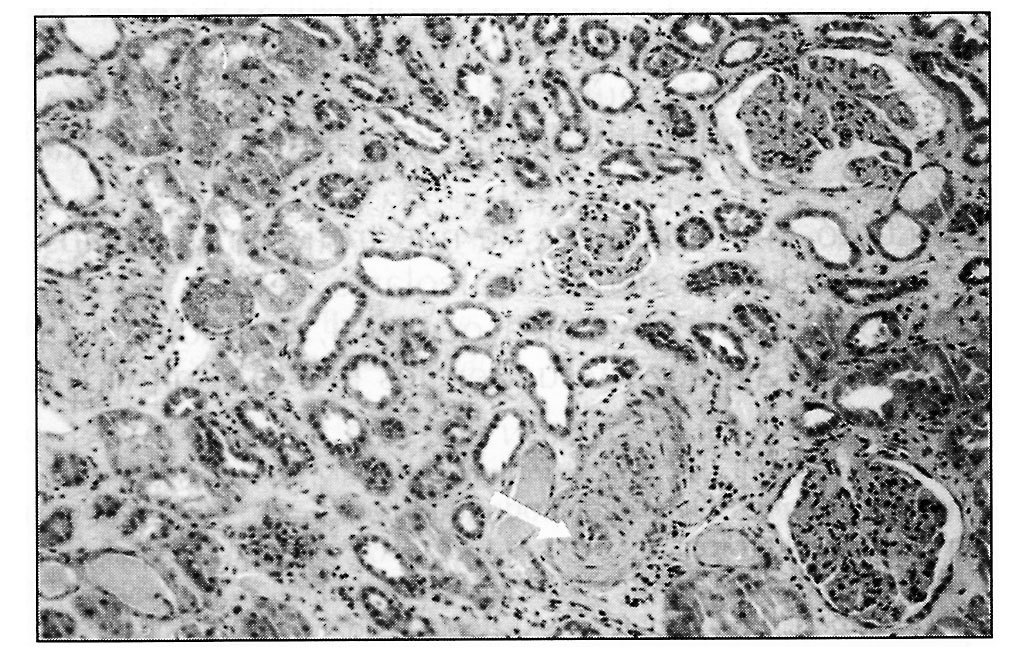
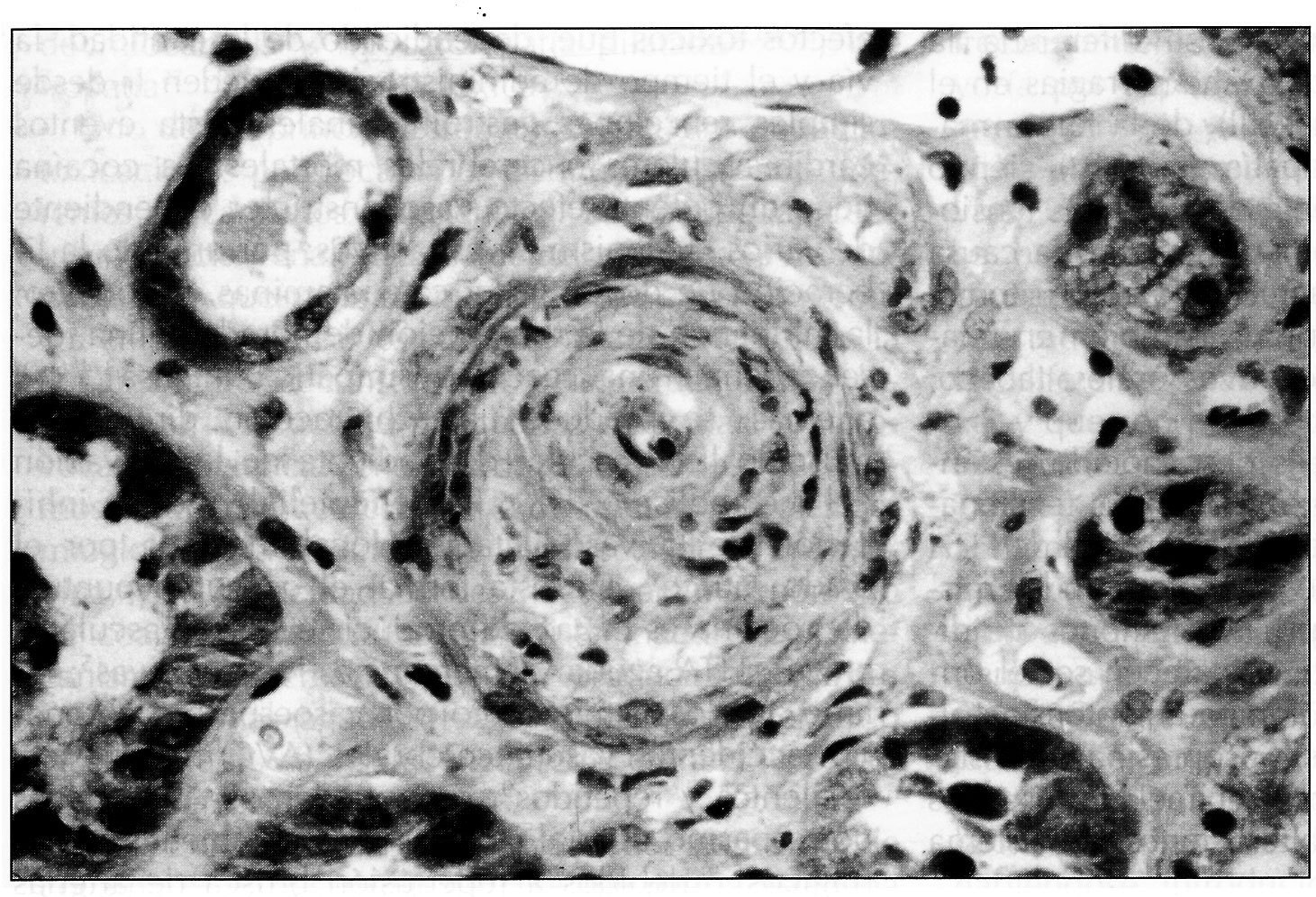
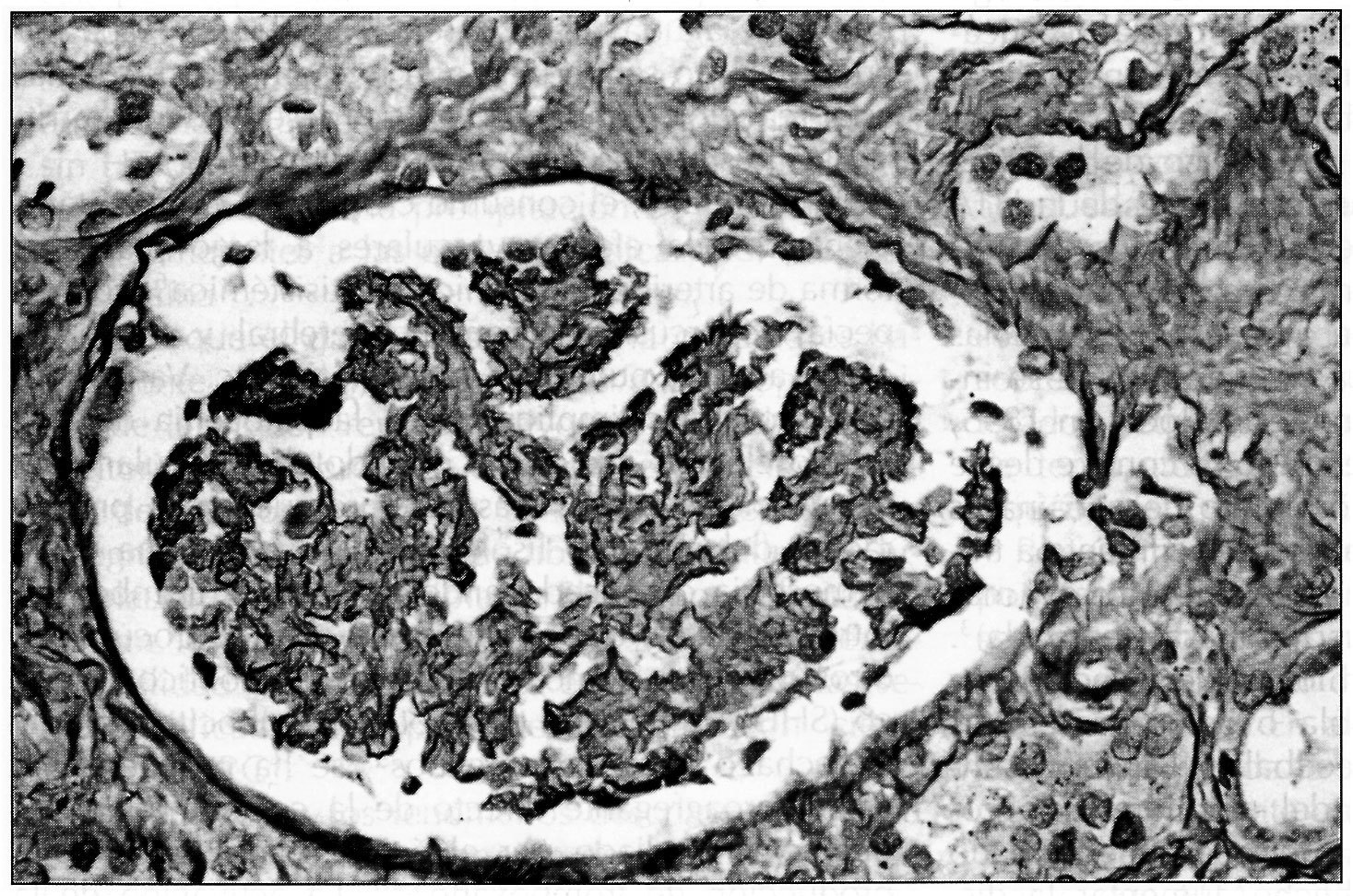
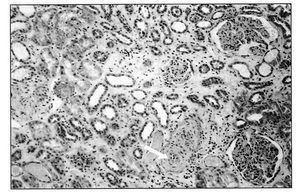
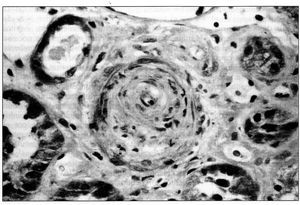
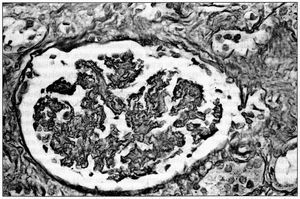
La biopsia renal (BR) demostró 18 glomérulos que presentaban afectación difusa de carácter isquémico con retracción y replegamiento de la pared capilar en las técnicas del PAS y argénticas, y rarefacción de la matriz mesangial. No se evidenció proliferación extracapilar. El intersticio presentaba fibroedema leve con infiltrado por células redondas, con atrofia tubular y cambios regenerativos del epitelio. Los vasos extraglomerulares de pequeño y mediano calibre presentaban cambios de arteriolopatía severa, necrosis fibrinoide de la pared y trombos fibrinoides intraluminales. La inmunofluorescencia fue negativa. Todo ello era compatible con HTA maligna (figura 2, figura 3 y figura 4).
La evolución posterior mostró una colostasis disociada con elevación importante de fosfatasas alcalinas y gammaGT pero con bilirrubina normal. Una nueva ecografía abdominal no mostró alteraciones destacables y una colangio-resonancia magnética sólo puso de manifiesto unas imágenes compatibles con hemangiomas hepáticos. La determinación de criptosporidium en heces fue negativa. Se atribuyó el cuadro a colangitis por citomegalovirus, evolucionando bien posteriormente sin la práctica de más exploraciones al respecto. También presentó un herpes esofágico que evolucionó bien con acyclovir. Una TAC cerebral de control mostró la resolución total de las lesiones de hipoperfusión de lóbulo cerebral occipital y de cerebelo.
Dado de alta hospitalaria a los tres meses del ingreso, con doxazosina, lisinopril, furosemida, carbonato cálcico, estavudina, lamivudina, nelfinavir, flunitracepam y hemodiálisis periódica, consultó al servicio de urgencia al mes y a los dos meses por sendos cuadros de encefalopatía, el primero con cocaína positiva en orina y el segundo con heroína. Sin embargo, a los 5 meses del alta presenta urea 161 mg/dl, creatinina 4 mg/dl, CD4 392 cels/mm3, carga viral: < 200 copias/ml, VSG 71 mm 1ª h, Hto 31%, Hb 11,3g/dl, leucocitos y fórmula normal, plaquetas 281.000.
Se ha retirado por el momento la hemodiálisis. Sigue cio de urgencias al mes y a los dos meses por sendos con el tratamiento hipotensor y antirretroviral.
DISCUSIÓN
La HTA maligna se define por la asociación de HTA y afectación vascular severa en forma de retinopatía avanzada1. Clásicamente se diferencia la forma acelerada, con exudados y hemorragias en el fondo de ojo (retinopatía grado III), de la forma maligna, con papiledema (retinopatía grado IV), siendo esta clasificación independiente de las cifras tensiona-les. Su frecuencia es algo mayor cuando la causa de la HTA es la vasculorrenal, el feocromocitoma, las vasculitis y glomerulonefritis, y también en relación al consumo de anticonceptivos orales, tabaco, y cocaína1-3
El mecanismo patogénico es desconocido, estando implicados diversos factores. Las cifras tensionales altas por sí solas no explican la aparición de HTA maligna, ya que la mayoría de pacientes con los mismos niveles no la desarrollan'. Alteraciones de diferentes mecanismos vasoactivos parecen ser el origen patogénico: el sistema renina-angiotensina-aldosterona, las catecolaminas, vasopresina, el sistema cininas-calicreina juegan un papel, todos ellos aún por dilucidar, junto las alteraciones del sistema de la hemostasia1.
Todas estas alteraciones condicionan lesiones oclusivas arteriolares en diversos órganos, siendo el riñón el más relevante tanto clínica como histológicamente. La cocaína podría ser una droga desencadenante de HTA maligna a través de originar un vasoespasmo inicial a nivel multisistémico4, y podría ayudar en el conocimiento patogénico de la «aceleración» de la HTA. Las manifestaciones de la HTA maligna son reflejo de la afectación de los órganos diana, principalmente cerebro, corazón y riñón.
La cocaína es un alcaloide que se obtiene de las hojas de la planta de la coca, y que, aunque se introdujo en medicina como anestésico local en 1855, su utilización como droga de abuso se conoce desde el tiempo de los incas. El clorhidrato de cocaína es una sal hidrosoluble que se absorbe fácilmente a través de cualquier mucosa, siendo la forma más común de uso la inhalación intranasal (esnifada)3. También se puede utilizar en forma de inyección ev dada su hidrosolubilidad, sola o asociada a otras drogas como la heroína («speedball»). Las formas alcaloideas obtenidas a partir del clorhidrato de cocaína son insolubles en agua y termoestables, y dado que se pueden fumar han hecho aumentar la disponibilidad y el consumo de cocaína desde su aparición en 1983 en Estados Unidos5 y en los últimos años en España. Estas formas son el crack y la cocaína base («freebase»), libre de adulterantes, y son más potentes y tienen más afinidad cerebrovascular que las formas solubles'', aunque no está clara la relación entre estos factores y la incidencia de fenómenos vasculares cerebrales5.
Además de los efectos estimulantes perseguidos por los adictos a cocaína, ésta produce una serie de efectos tóxicos que, dependiendo de la cantidad, la vía y el tiempo de administración, pueden ir desde simples reacciones gastrointestinales hasta eventos cardiovasculares o cerebrales mortales. La cocaína tiene un potente efecto vasoconstrictor dependiente de varios mecanismos vasoactivos: por un lado la liberación de dopamina y catecolaminas, y por otro, la inhibición de la recaptación de noradrenalina, desencadenan una reacción simpática intensa3,4,6'7); además, se produce una contracción directa del músculo liso vascular dependiente de la activación del metabolismo del calcio endotelial6 y de la inhibición de la vasodilatación local mediada por el óxido nítrico8. De esta forma, el consumo puntual de cocaína es capaz de producir eventos vasculares graves: HTA aguda y emergencias hipertensivas5; infarto agudo de miocardio por vasoespasmo coronario; accidentes vasculocerebrales (AVC) manifiestos, o silentes y repetidos9, que pueden ser isquémicos por espasmo arteriales, o más frecuentemente hemorrágicos5,9 debidos a reperfusión brusca de arterias constreñidas10, a crisis hipertensivas, o a ruptura de aneurimas y malformaciones anteriovenosas intracraneales ya presentes10; rabdomiolisis por isquemia muscular aguda; fracaso renal agudo por espasmo arteriolar", o secundario a la rabdomiolisis. Además esta reacción simpática puede desencadenar arritmias y respuestas hipertensivas graves.
Por otro lado, el consumo crónico de cocaína también provoca efectos vasculares a largo plazo en forma de arteriopatía crónica multisistémica6, con especial repercusión coronaria, cerebral y renal, así como aórtica, pulmonar, placentaria, etc. Varios mecanismos están implicados en la patogenia de esta arteriosclerosis acelerada: el endotelio vascular libera sustancias vasoactivas que promueven la proliferación del músculo liso6 y activan el sistema de la hemostasia desencadenando fenómenos trombóticos intravasculares, de forma similar a lo que ocurre en otros procesos como el síndrome hemolítico urémico (SHU), la púrpura trombótica trombocitopénica y el rechazo agudo de órganos4; se ha propuesto un efecto proagregante directo de la cocaína sobre las plaquetas mediado por el ácido araquidónico y la producción de tromboxano5,10 La activación de la respuesta inmune mediada por linfocitos T con poder quimiotáctico sobre monocitos y macrófagos cuya presencia en las lesiones arterioscleróticas mantendría activado el metabolismo lipídico y proteico, se ha propuesto en particular para el uso intravenoso de cocaína6, aunque no está claro si la aparición de una vasculitis franca estaría causada por la cocaína o por los adulterantes que sus distintas formas pueden conteners' 12. También se ha descrito la toxicidad directa de la cocaína sobre ciertos órganos, en forma de miocarditis y miocardiopatía dilatada6' 10' 13, nefropatía11' 14, o miopatía tóxica14
Uno de los principales órganos afectados en las intoxicaciones por cocaína es el riñón, existiendo diferentes mecanismos patogénicos. A menudo aparece insuficiencia renal, clásicamente atribuida a rabdomiolisis, y que también puede ser de causa isquémica. La rabdomiolisis es secundaria a los efectos de la cocaína de vasoconstricción e isquemia tisular, hipertermia, y toxicidad metabólica muscular14, y provoca insuficiencia renal aguda por distintos mecanismos, entre los que destacan la obstrucción tubular por mioglobina, la toxicidad renal directa de la mioglobina, y la capacidad de desencadenar un fenómeno de coagulación intravascular diseminada14. Los mecanismos isquémicos pueden producir una insuficiencia renal aguda (IRA)7'14 por infarto renal, o igualmente IRA e insuficiencia renal crónica (IRC) por arteriosclerosis acelerada.
Otra consecuencia renal grave del consumo de cocaína es el desarrollo de HTA refractaria asociada a insuficiencia renal, siendo éste un cuadro similar al de la HTA maligna o acelerada. El desarrollo de esta fase acelerada de la HTA se ha descrito sobre todo en pacientes con HTA previa o con ligera insuficiencia renal, en especial de raza negra7,11,15, aunque también es posible su aparición en sujetos sin HTA conocida6,16 También se ha descrito lesión renal secundaria a la precipitación de crisis reversibles, semejantes a las esclerodérmicas, por parte de la cocaína17.
Dado que el daño causado por la cocaína es básicamente vascular, los hallazgos anatomopatológicos de la BR son representativos de los del resto de territorios vasculares. En el riñón se aprecian lesiones de arteriosclerosis en las arterias interlobulares y segmentarias, en forma de fibrosis miointimal e hiperplasia parietal arteriolar7. El hecho de que no existan lesiones glomerulares6 es indicativo de reversibilidad11, a pesar de que en algunas de las series publicadas los pacientes quedan con cierto grado de IRC4.
Aunque todos los fenómenos descritos se pueden presentar tras la administración de cualquiera de las formas de cocaína, desde la aparición del crack se observó un aumento en la incidencia de complicaciones asociadas a la cocaína. Parece ser que las formas alcaloidales tienen más potencia y más afinidad cerebrovascular que el clorhidrato de cocaína4. Únicamente se han comparado estas dos formas de cocaína relacionadas con los fenómenos de AVC5, observándose igualdad de aparición de accidentes isquémicos y hemorrágicos tras la utilización de formas alcaloidales (crack), mientras que tras el uso de clorhidrato de cocaína se han presentado más frecuentemente hemorragias intracraneales18, la mayoría por ruptura de aneurismas o malformaciones arteriovenosas ya existentes y probablemente inducidas por la misma cocaína en administraciones previas19'20. Tras la administración de cocaína ev sólo se han observado accidentes hemorrágicos5. Las causas de estas diferencias no están claras. Dado que muchos consumidores de cocaína lo hacen por las diferentes vías de forma simultánea o alternativa, y que son pocos los que reconocen su uso, estas diferencias son difíciles de estudiar.
Hace años que se ha observado esta tendencia al aumento de fenómenos cardiovasculares asociados a la cocaína en EEUU, sobre todo entre la población afroamericana, quienes tienen una mayor tendencia a la HTA aún en ausencia del hábito cocaínico7. Con la aparición del crack la cocaína ha dejado de ser una droga de clase social alta, pasando a ser mucho más asequible y extendida. En España la heroína sigue siendo la primera droga de abuso, habiéndose introducido recientemente el crack, y está aún por ver si este hecho hará aumentar los eventos vasculares en personas jóvenes en servicios de urgencias. Por otro lado, es probable que la HTA maligna asociada a cocaína esté infradiagnosticada, debido al bajo índice de sospecha4.
No se ha demostrado entre los consumidores crónicos de cocaína una mayor prevalencia de HTA16, aunque las lesiones causadas por la cocaína podrían justificarlo. Asimismo, estos sujetos con lesiones vasculares difusas serían más sensibles a los efectos vasoconstrictores agudos de la cocaína, tras una sobredosis. Es decir, que sobre un lecho vascular alterado, pequeños cambios de flujo serían capaces de tener gran repercusión, provocando fenómenos isquémicos y hemorrágicos.
Por último, se han descrito casos de intoxicación por cocaína en pacientes embarazadas que se presentan como cuadros de preeclampsia y eclampsia y que obligan a su diagnóstico diferencial en esas circunstancias21. En algunos hospitales de EEUU ya está protocolizada la determinación de restos de cocaína en orina ante una preeclampsia o eclampsia21.
El enfermo presentado correspondería a un paciente con HTA maligna con afectación ya severa diagnosticado tardíamente por lo que sigue una evolución tórpida, todo y que por el momento parece poder dejar el tratamiento sustitutivo renal. Al presentar infiltrados pulmonares, se le practicó una BR para establecer el diagnóstico diferencial con otras entidades clínicas descritas, como el síndrome de Goodpasture22,23, asociadas al consumo de cocaína. Permitió también descartar una glomerulopatía asociada al virus de la inmunodeficiencia humana24,25, a los virus de la hepatitis B y C26, amiloidosis26, SHU24,27, nefropatía lupus-like24,28, y otras nefropatías menos frecuentes26, pero todas ellas descritas en el SIDA24-28. En algunas series europeas el SHU es la principal entidad causante de IRA27; la histología vascular del caso objeto de discusión sería más propia de HTA maligna.
Nuestra experiencia se circunscribe a otros dos casos de IRA relacionada con cocaína, uno de ellos con criterios también de HTA maligna en un paciente varón de 37 años de edad, consumidor esporádico de cocaína esnifada, no afecto de SIDA, que llegó a creatininas plasmáticas de 4,3 mg/dl y aclaramientos de 17,4 ml/min. Con tratamiento hipotensor cuádruple se controló la HTA, presentando en la actualidad a los 18 meses de seguimiento una creatinina plasmática de 2 mg/dl y requiriendo sólo dos hipotensores. No le practicamos BR.
El tercer caso corresponde a un paciente varón de 27 años de edad diagnosticado de SIDA estadio C3. Fue llevado a emergencias en estado de coma profundo, hipoventilando, con pupilas mióticas, TA 130/40 mmHg. Tras IOT y VM el paciente presentó hipotensión, se constató insuficiencia renal con creatinina plasmática de 3 mg/dl, CPK 215 U/L, GOT 744 U/L, GPT 2636 U/L. El despistaje toxicológico confirmó niveles extremadamente elevados de cocaína en plasma, además de opiáceos y benzodiacepinas. El paciente posteriormente refirió consumo endovenoso de cocaína y oral de opiáceos y benzodiacepinas la noche previa al ingreso. Presentó los días siguientes oligoanuria con creatinina máxima de 5,5 mg/dl, precisando hemodiálisis. Al quinto día de ingreso presentó nuevamente deterioro brusco del nivel de consciencia con Tá 39° C, sin focalidad neurológica. Requirió de nuevo IOT y VM. Se practicaron una TAC y una resonancia magnética (RM) craneales que evidenciaron múltiples áreas isquémicas con edema e hidrocefalia global, sin zonas de hemorragia. Evolucionó correctamente y la RM previa al alta hospitalaria mostró resolución prácticamente total de las lesiones isquémicas y desaparición de la hidrocefalia. La determinación de complemento, factor reumatoide, Acs antinucleares, ANCAs y Acs antimembrana basal fueron normales o negativos. Tras repetidas sesiones de hemodiálisis recuperó progresivamente función renal hasta la total normalidad. No se practicó BR.
Este último caso corresponde a un paciente con IRA probablemente multifactorial por hipotensión, vasoespasmo y rabdomiolisis; aunque las manifestaciones neurológicas por isquemia cerebral por vasoespasmo fueron espectaculares, a nivel renal tal vez jugaron un papel secundario en el fracaso renal agudo, al cursar éste como una necrosis tubular aguda sin HTA. Existen casos reportados29 semejan-tes a este último que cursan con IRA sin HTA o con HTA poco severa que se resuelve al recuperarse el fracaso renal agudo30. No se relacionan directamente con rabdomiolisis y recuperan la función renal íntegramente. Este enfermo presentó lesiones isquémicas cerebrales habiendo reconocido consumo de cocaína intravenosa, estando publicados por esta vía únicamente fenómenos hemorrágicos1.
Así pues, podemos concluir que la cocaína puede ser origen de IRA por 1) rabdomiolisis secundaria principalmente a isquemia muscular producida a su vez por vasoespasmo, 2) por isquemia renal directa por la misma condición de vasoespasmo, 3) por HTA maligna (en este caso la insuficiencia renal cursaría de manera subaguda y podría dar origen a IRC). La cocaína podría ser un buen ejemplo de factor etiopatogénico de la microangiopatía trombótica.
DISCUSIÓN DEL CASO «VARÓN DE 37 AÑOS DE EDAD, DROGADICTO, CON HIPERTENSIÓN ARTERIAL E INSUFICIENCIA RENAL»
Dr. Miguel A. de Frutos (Málaga). Me ha sorprendido en cierto modo, la evolución clínica que presentó el paciente durante el período de tratamiento con hemodiálisis. Tal como se ha dicho, siguió tomando cocaína y a la vista de las lesiones histológicas quizá sorprende la recuperación de la función renal en tan poco tiempo. ¿Crees que el control de la presión arterial ha sido el principal factor de recuperación de la función renal o hay algún otro mecanismo que haya facilitado la recuperación en una biopsia que a primera vista, hacía presagiar una evolución menos favorable?
Dr. Ángel Rodríguez Jornet. Efectivamente. El control de la tensión arterial es fundamental para la recuperación de los casos en que el mecanismo fundamental de fracaso renal es la hipertensión arterial. En la actualidad, a los 8 meses del inicio del cuadro clínico, el paciente tiene creatininas plasmáticas alrededor de 3 mg/dl y no precisa tratamiento sustitutivo renal. En su recuperación podría también considerarse la importante afectación tubulointersticial con necrosis tubular que se apreciaba en la biopsia renal, y que probablemente una vez recuperada, aunque parcialmente, haya contribuido a la mejoría de la función renal. La TA se controla bien aunque precisando cuatro fármacos y en este momento ignoramos cómo evolucionará a partir de ahora. Está realizando también el tratamiento antirretroviral de manera constante, y en este sentido también está evolucionando favorablemente.
Dr. Guillermo Martín Reyes (Málaga). Con relación al diagnóstico de hipertensión arterial maligna está descrita la hemólisis, pero en los cuadros comparativos y en los diagnósticos diferenciales el grado de hemólisis en la HTA maligna es inferior al presente en el síndrome hemolítico urémico. Creo que esto podría justificar las dificultades de los hematólogos en obtener una muestra con esquistocitos.
Dr. Ángel Rodríguez Jornet. Partíamos de un paciente que tenía una anemia previa. Quizá la anemia microangiopática que tenía en relación con la HTA maligna hubiera sido mejor detectada si hubiéramos partido de hematocritos cercanos a valores normales. En estas circunstancias el grado de anemia alcanzado podría no haber sido tan pronunciado.
Dr. Rafael Pérez García (Madrid). En relación con el mecanismo que has esbozado respecto a cómo actuaría la cocaína evitando la recaptación presináptica de mediadores, fundamentalmente dopamina i na y norpepinefrina, ¿ves alguna implicación respecto a cómo habiendo tantos consumidores de cocaína se presenten tan pocos casos de HTA maligna? Estaría por estudiar cuántos se hacen hipertensos de estos consumidores habituales. Según se comenta, la persona que se hace consumidor y empieza a tener trastornos neurológicos corno visión borrosa o cefalea el día de consumo o al día siguiente eso sería la digna de estudio. Primero, ¿qué coadyuvantes podrían actuar a ese nivel?, y la segunda cuestión es ¿si habría algún antihipertensivo mejor que otros para el control tensional de estos pacientes?
Dr. Ángel Rodríguez Jornet. Los cuadros de HTA maligna ligados al consumo de cocaína, se tratan en la fase aguda con nitroprusiato y nitroglicerina ev como otras situaciones de emergencias hipertensivas. Posteriormente con IECAs, aunque su mecanismo de acción, no esté inicialmente involucrado, y vasodilatadores directos más diuréticos. Así se han tratado los pocos casos que están relatados. En cuanto a que no sea tan frecuente, hay hospitales en EEUU que tienen protocolizado determinar la presencia de cocaína en orina en pacientes jóvenes que presentan accidentes vasculares cerebrales u otros cuadros clínicos atribuibles a vasoespasmo. En el Hospital Central de San Francisco tienen la experiencia actual de la presentación más frecuente de preeclampsias relacionadas con el consumo de cocaína que las formas idiopáticas. Ello da a entender que es una patología no tan infrecuente, y que es presagiable que se vaya constatando con frecuencia en el futuro si se confirma el aumento de consumo de los nuevos derivados de cocaína. En el caso de la preeclampsia, parece que los hijos normalmente evolucionan bien y sin lesiones. No obstante, antes de esta discusión hice una última revisión y en una revista de Biología hay un trabajo en ovejas en que les inyectan cocaína y realizan resonancias magnéticas a la oveja y su feto, observando esas lesiones de hipoperfusión relatadas en el caso clínico. Seguramente con el tiempo evolucionarán hacia lesiones de tipo más crónico.
Con relación a tu pregunta, también parece que existe un cierto grado de predisposición genética. Algunos autores confirman que los pacientes negros americanos estarían más predispuestos por factores predisponentes de raza. También se apunta algún caso en que un hábito de tabaquismo anterior muy pertinaz podría ser un factor predisponente. Parece ser también que en gente joven con terminaciones sinápticas más indemnes tendrían mayor posibilidad de presentar vasoespasmo. A nivel cerebral hay territorios donde estas lesiones se dan con mayor frecuencia que en otros: las áreas infratentoriales y subcorticales serían zonas donde con mayor frecuencia se muestran lesiones de hipoperfusión de este tipo.
Dr. que no se identifica (i). Los casos de cocaína están los confesados porque no les quedaba más remedio y los casos en los que no lo dicen. Me gustaría añadir que en estos casos donde no se sabe muy bien si el paciente es cocainómano o no, puede haber lesiones renales incluso por la aspiración de la cocaína a nivel nasal que simulan una enfermedad de Wegener con las mismas lesiones granulomatosas a nivel nasal. Así en la lista de las lesiones que has presentado habría que añadir las lesiones de los que presentan a nivel nasal o pulmonar por fumar crack deben hacer pensar en hacer una determinación de cocaína para no confundir el diagnóstico con este tipo de pacientes.
Dr. Ángel Rodríguez Jornet. La revisión que he realizado apunta fundamentalmente al hallazgo de lesiones isquémicas producidas por la misma inhalación nasal de cocaína incluso llegando en ocasiones a verdaderas necrosis de, por ejemplo, el tabique nasal. En cambio las lesiones de tipo granulomatoso del tipo de Wegener no he encontrado que pudieran confundirse con las de la inhalación de cocaína. Tal vez, pudieran existir lesiones granulomatosas a cuerpo extraño, a los contaminantes existentes en los preparados para ser inhalados.
Dr. Eduardo Junco (Madrid). A propósito de esto, quería comentar un caso que tuvimos ocasión de tratar hace un año. Se trataba de un varón joven con un cuadro aparentemente relacionado con cocaína que fue un infarto renal. Infarto renal que cuando llegó al hospital llevaba varios días de evolución con dolor lumbar, hematuria, LDH altas y todas las exploraciones de imagen eran compatibles con infarto renal. Fue imposible obtener ningún tipo de antecedente, el paciente lo negó todo. No se pudo hacer nada porque el infarto era periférico, ocupaba una pequeña parte del riñón y mostraba una buena evolución clínica. Pero pocos días después volvió a presentar otro cuadro de dolor lumbar intenso y hematuria macroscópica. Se repitieron las exploraciones con imágenes y se observó un infarto en casi la mitad de uno de los riñones. Tras esta afectación el paciente confesó que había esnifado cocaína antes del primer episodio y en el intervalo entre los dos infarto renales. No hubo fracaso renal agudo ni HTA maligna. Se anticoaguló y tuvo buena evolución.
Dr. Ángel Rodríguez Jornet. No he encontrado ningún caso en la bibliografía revisada de infartos renales tras cocaína. Si bien teóricamente podría suceder implicando a arterias renales de gran calibre.
Dr. Manuel Praga (Madrid). A la hora de extender el diagnóstico diferencial no hay que olvidar que el paciente está infectado por el virus HIV y hay otras posibilidades diagnósticas como la nefropatía IgA que en ocasiones da un cuadro de hipertensión arterial maligna y parece que la incidencia de pacientes con HIV está aumentada la nefropatía IgA. Este paciente además estaba también infectado por el virus C de la hepatitis y tenía crioglobulinas positivas. Teniendo en cuenta lo que presentó el Dr. Quereda anteriormente, sí se debería buscar la presencia de un síndrome antifosfolípido en relación con el virus C que pudiera tener relación con esta microangiopatía trombótica.
Dr. Ángel Rodríguez Jornet. En este paciente no tenemos determinaciones de anticuerpos antifosfolípido. Clínicamente no existían otros datos para pensar en este síndrome y la mayoría de determinaciones del TTPa fueron normales.
He comentado que la inmunofluorescencia en la biopsia renal fue totalmente negativa. No se observaron depósitos de ninguna inmunoglobulina ni de complemento ni tampoco de cadenas ligeras. En la serie de D'Agati sobre biopsias renales en enfermos con SIDA, un 1,5-2% eran nefropatías mesangiales por IgA. Dado que el paciente dos meses antes tenia un sedimento urinario normal, esta posibilidad me parecía más remota a la hora de comentarla con mayor extensión en el diagnóstico diferencial. No obstante, debería ser incluida entre las posibilidades diagnósticas.
Dr. José Ramón Armas (Sevilla). Me ha parecido entender que en los cuadros presentes en pacientes VIH positivos, los lupus-like se presentaban sólo en pacientes de raza negra. Recientemente en nuestro hospital hemos visto un caso de un varón seropositivo con un síndrome nefrótico que tenía un cuadro lupus-like con asas de alambre incluidas en la biopsia. Y era de raza blanca.
Dr. Ángel Rodríguez Jornet. El 90% de los afectados fueron pacientes de raza negra. Un 70% en va- rones y casi el 50% en niños. Hay pocas referencias de afectación en blancos por lo que sería interesante comunicar este caso en nuestro medio.
Figura 1.
Figura 2.
Figura 3. Biopsia renal.
Figura 4.