El sistema renina-angiotensina-aldosterona (SRAA) está profundamente implicado en la progresión de la enfermedad cardiovascular y renal. En los últimos meses se han publicado una serie de estudios que evalúan estrategias de bloqueo más intenso de dicho sistema, con resultados no siempre positivos. Mientras que la evidencia va a favor de su utilización en pacientes con proteinuria y, con ciertas reservas, en pacientes con insuficiencia cardiaca refractaria, la generalización de esta práctica en pacientes de alto riesgo cardiovascular no ha resultado exitosa, llamando incluso la atención sobre sus posibles efectos secundarios, muchos de ellos renales. Aparecen también nuevos grupos terapéuticos, como los inhibidores de la renina, y estudios que evalúan la monoterapia en dosis muy altas, que podrían comportar algunas diferencias respecto al más clásico bloqueo dual con inhibidores de la enzima de conversión de la angiotensina (IECA) y antagonistas del receptor AT1 de la angiotensina II (ARA II). Con toda la evidencia disponible, siguen faltando estudios comparativos para poder emitir recomendaciones concretas, pero en cualquier caso, cuando se considera la opción del bloqueo más intenso del SRAA debería introducirse vigilando la presión arterial (PA) de los pacientes y la evolución del potasio sérico y la función renal.
INTRODUCCIÓN
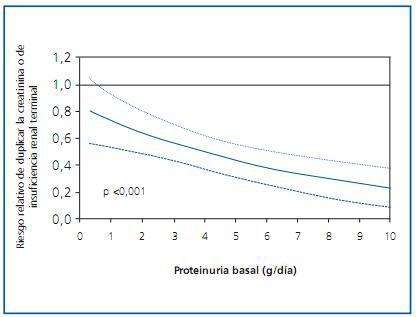
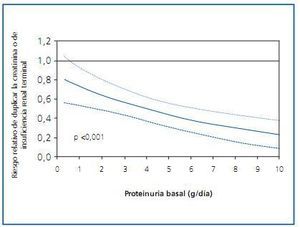
Si hay algún grupo de fármacos antihipertensivos que haya mostrado un beneficio renal más allá del atribuible a la reducción tensional, éste ha sido el de los bloqueadores del sistema renina-angiotensina-aldosterona (SRAA). Las diferencias entre estos fármacos y las otras clases de antihipertensivos se hacen más patentes cuanto mayor es la proteinuria del paciente1 (figura 1). El beneficio del bloqueo del SRAA se ha observado también en múltiples ensayos clínicos de prevención cardiovascular, de manera que en la actualidad se recomienda la utilización de este grupo de fármacos no sólo en caso de nefropatía proteinúrica, sino también en caso de insuficiencia cardiaca y de disfunción ventricular postinfarto2. Con todo, la utilización de bloqueadores del SRAA no ha conseguido frenar completamente la progresión de la enfermedad renal y cardiovascular, y algunos grupos han propuesto que ello podría ser debido a un insuficiente grado de bloqueo del sistema. Más aún, la evidencia de que la expresión del sistema SRAA local en órganos diana es más intensa que a nivel plasmático3, y mayor todavía en caso de daño tisular, ha hecho pensar en que el grado de bloqueo del sistema utilizado en práctica clínica podría ser suficiente para neutralizar dicho sistema a nivel plasmático, pero no a nivel tisular. Esta hipótesis plausible ha llevado a diseñar protocolos con una inhibición más potente del SRAA.
Habida cuenta de los múltiples pasos enzimáticos de la cadena del SRAA y las diversas opciones terapéuticas que existen en cada nivel, para conseguir una mayor inhibición del sistema hay dos opciones genéricas: administrar dosis mayores de las habituales en monoterapia o combinar grupos de fármacos, o ambas cosas a la vez.
En pacientes con nefropatía ya existía cierta evidencia del beneficio del bloqueo dual con inhibidores de la enzima de conversión de la angiotensina (IECA) y antagonistas del receptor AT1 de la angiotensina II (ARA II), recopilada en el metaanálisis de Kunz et al en enero de 20084. Dicho metaanálisis revisó 49 estudios que incluyen a 6.181 pacientes. Los autores concluyen que el bloqueo dual reduce la proteinuria de manera más eficaz que el bloqueo simple (un 22-24% más), aunque llaman la atención sobre la escasa calidad de algunos estudios, fundamentalmente en la recogida de datos acerca de la seguridad de los tratamientos, y también por la selección de pacientes de menor riesgo cardiovascular (mediana edad, pocas condiciones comórbidas). Acertadamente, los autores recuerdan lo que años atrás sucedió a raíz del estudio RALES, que añadía sistemáticamente espironolactona al tratamiento con IECA en pacientes con insuficiencia cardiaca5. Durante dicho estudio se registraron escasos episodios de hipercalemia, contrastando con la «epidemia» de casos que se detectaron más adelante con la generalización de aquel esquema terapéutico en la población con insuficiencia cardiaca6. Al leer el artículo de Kunz et al. sorprende no encontrar en la lista de estudios analizados al famoso COOPERATE, de Nakao et al., que mostraba una excelente reducción de la proteinuria con el bloqueo dual a la vez que un remarcable enlentecimiento de la progresión de la insuficiencia renal7. Los investigadores del metaanálisis observaron un inusual balance en la distribución de variables clave y discrepancias entre los métodos estadísticos y los resultados comunicados, que no pudieron clarificar tras contactar con la revista que publicó el estudio.
Es preciso remarcar que ya existían en la literatura científica evidencias del beneficio de otros tipos de bloqueo dual del sistema SRAA, por ejemplo de la asociación de un IECA (enalapril) y un antialdosterónico (eplerenona). Epstein et al. demostraron un mejor efecto antiproteinúrico en pacientes con nefropatía diabética8 y Pitt et al. una mayor reducción de la hipertrofia ventricular izquierda con la combinación respecto a las respectivas monoterapias9.
En abril del 2008 se publican los resultados del estudio ONTARGET, el mayor realizado comparando el bloqueo simple con el dual IECA/ARA II: 25.620 pacientes seguidos durante casi 5 años10. Aunque no es un estudio realizado en hipertensos, sino en pacientes con elevado riesgo cardiovascular, la mayoría (69%) presentaba hipertensión arterial (HTA). Los resultados de ONTARGET reflejan claramente que la combinación ramipril/telmisartán no es superior en términos de beneficio cardiovascular a cualquiera de los dos en monoterapia en este tipo de pacientes, y se asocia, además, a un mayor índice de acontecimientos adversos, muchos de ellos renales. La razón de la falta de mayor eficacia de la combinación podría atribuirse a dichos acontecimientos adversos con muchos abandonos por hipotensión, y parte de culpa podría haber tenido el diseño del estudio, que distribuyó a los pacientes aleatoriamente a recibir dosis máximas de ambos fármacos independientemente del nivel de PA previo del paciente. El estudio también evidencia un dato que ya sugerían Doulton et al. en un metaanálisis previo11: el bloqueo dual IECA/ARA II no comporta una reducción tensional muy importante respecto al bloqueo simple, 3,7-3,8/2,3-2,9 mmHg en el metaanálisis de Doulton y 2,4/1,4 mmHg respecto a ramipril y 1,5/0,8 mmHg respecto a telmisartán en ONTARGET. Paralelamente, el estudio desmonta una cierta polémica que se había instaurado respecto a si los ARA II comportaban un mayor riesgo de infarto de miocardio (IAM): telmisartán fue tan eficaz como ramipril en pacientes de elevado riesgo cardiovascular, sin ningún incremento del riesgo en episodios concretos.
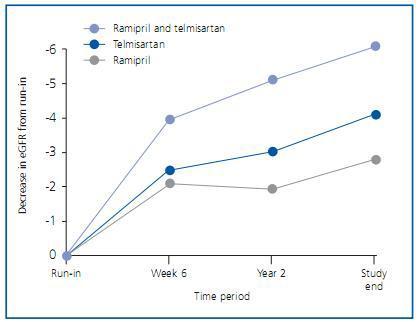
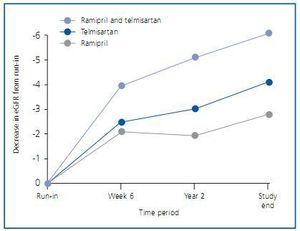
Unos meses después se publicaron los detalles renales de los pacientes de ONTARGET12. No son pacientes con patología renal importante, como evidencian los 73,6 ml/min/1,73 m2 de media del filtrado glomerular estimado por MDRD-4 (eFG) y los 0,81-0,83 mg/mmol (unos 7 mg/g) de albuminuria. Con todo, el 24,0% de pacientes presentaban un eFG <60 ml/min/1,73 m2 y el 1,0% un eFG <30 ml/min/1,73 m2. La microalbuminuria estaba presente en el 13,1% de pacientes al inicio del estudio y la macroalbuminuria en el 4,0%. Los resultados de ONTARGET señalan que el doble bloqueo consigue un mejor control de la albuminuria, consistente con los estudios metaanalizados por Kunz et al., pero también señala que dicho bloqueo dual no comporta una mejor evolución de la función renal, sino todo lo contrario. Mirando más detenidamente las curvas, se aprecia que el bloqueo dual presenta un deterioro de función renal más acusado en las primeras semanas, consistente con un efecto hemodinámico renal, y a partir de ahí las curvas corren casi paralelas durante el resto del estudio (figura 2). No extraña pues que los acontecimientos adversos renales observados en el grupo de doble bloqueo consistan fundamentalmente en episodios de hipercalemia y casos de diálisis aguda, pero no en una mayor tasa de duplicación de creatinina plasmática o de entrada en diálisis crónica. Hay que tener en cuenta también que los pacientes en ONTARGET no fueron distribuidos aleatoriamente teniendo en cuenta su eFG, así que podría haber sucedido que el porcentaje de pacientes con filtrados basales bajos fuera algo distinto entre los grupos.
Resulta interesante mencionar que, tal y como han comunicado otros estudios, el cálculo de función renal en este tipo de pacientes es más optimista si se usa la tradicional fórmula de Cockcroft-Gault que la de MDRD, un 6-8% mejor.
Para finalizar con ONTARGET, y centrándonos en el subgrupo de pacientes con microalbuminuria o macroalbuminuria (17,1%), los resultados renales parecían algo mejores en los grupos de telmisartán y de bloqueo dual, que consiguieron mayores reducciones de albuminuria, pero los resultados no alcanzaron significación estadística. En concreto, en los más de 700 pacientes con nefropatía diabética establecida, el riesgo relativo de diálisis, duplicar la creatinina plasmática, o muerte, fue un 8% inferior en el grupo de doble bloqueo respecto al de ramipril, con un intervalo de confianza que llegaba a un 24% de beneficio pero sin alcanzar significación estadística.
Siguiendo en la línea de un bloqueo más completo del SRAA, 2008 también es el año de la comercialización de un nuevo grupo de fármacos, los inhibidores de la renina, con su primer representante, aliskiren. Desde el punto de vista de su efecto antihipertensivo, los estudios publicados sugieren que es comparable al de los otros grupos terapéuticos existentes, con un detalle interesante que debería confirmarse en posteriores estudios: un efecto sinérgico cuando se asocia a IECA o ARA II, a diferencia del bloqueo dual clásico13. Desde el punto de vista de protección orgánica, el doble bloqueo aliskiren/ARA II se está estudiando en diversos ensayos, dos de los cuales ya se han publicado: AVOID y ALOFT. En AVOID, el bloqueo dual aliskiren/losartán durante 6 meses redujo un 20% más la proteinuria respecto al bloqueo simple con losartán en pacientes diabéticos tipo 2 con proteinuria, resultado comparable al bloqueo dual clásico, y mostró una tendencia no significativa a una progresión más lenta de la insuficiencia renal14. Los efectos no son atribuibles a un mejor control tensional ya que ambos grupos se trataron con otros fármacos con objeto de lograr un buen control de la PA y al final las diferencias entre los grupos fueron mínimas: 2 mmHg de presión arterial sistólica (PAS) y 1 mmHg de diastólica (PAD). El perfil de seguridad de la combinación no difirió sustancialmente del bloqueo simple, con la misma tasa de acontecimientos adversos graves y de abandonos. En ALOFT, un tratamiento corto (3 meses) con aliskiren asociado a bloqueo simple del SRAA con IECA o ARA II (pero no ambos) en pacientes con insuficiencia cardiaca estable y PA bien controlada redujo en mayor medida que placebo los niveles plasmáticos de péptido natriurético tipo B (BNP), marcador de descompensación de insuficiencia cardiaca15. El perfil de seguridad mostró tasas algo superiores aunque no significativas de hiperpotasemia, hipotensión sintomática y disfunción renal. En este punto cabe señalar que dicho estudio no está evaluando en realidad un doble bloqueo del SRAA, sino un triple o incluso un cuádruple bloqueo ya que un 94% de los pacientes tomaban betabloqueantes (que inhiben la secreción de renina) y un 33% tomaban fármacos antialdosterónicos.
Aquí podría radicar la explicación del talón de Aquiles del bloqueo intenso del SRAA, los acontecimientos adversos fundamentalmente renales, evidenciados también en ONTARGET y otros estudios en insuficiencia cardiaca (CHARM-Added, VALIANT, Val-HeFT, RESOLVD) metaanalizados por Phillips et al.16 El bloqueo intenso, hasta cuádruple en algunas ocasiones (IECA + ARA II + betabloqueantes + antialdosterónicos), y en pacientes con perfusión renal comprometida por insuficiencia cardiaca, podría motivar una caída del filtrado glomerular resultante en hiperpotasemia e insuficiencia renal aguda, acompañando o no a episodios de hipotensión sintomática. Con todo, será interesante ver si el perfil de seguridad en este tipo de pacientes es mejor con aliskiren/ARA II que con IECA/ARA II, tal y como sugiere el estudio ALOFT en un periodo de observación corto (12 semanas)15.
Existe, sin embargo, una manera de bloquear más intensamente el SRAA que no pasa por el bloqueo múltiple: el bloqueo simple en dosis muy altas. Existían evidencias previas de que al incrementar la dosis de IECA en pacientes con nefropatía se conseguía una mayor reducción de la proteinuria sin reducir más la PA, lo que sugiere que las dosis habituales utilizadas en clínica tenían un techo como antihipertensivos (SRAA circulante), pero que dicho techo no se había alcanzado para el daño orgánico (SRAA tisular). Recientemente, se han comunicado diversos estudios que exploran esta hipótesis. El estudio DROP analiza el efecto de dosis crecientes de valsartán (160, 320 y 640 mg/día) en pacientes con nefropatía diabética y evidencia una normalización de la albuminuria a las 30 semanas en más del doble de pacientes que recibieron las dosis mayores respecto a la habitual de 160 mg/día, sin incrementos en acontecimientos adversos, incluyendo hipotensión e hipercalemia17. Otro estudio, el SMART, comunicado en el congreso de la ASN 2007, mostró resultados parecidos con candesartán: un 17% de reducción de la proteinuria con 64 mg/día respecto a 16 mg/día y hasta un 33% más con la dosis de 128 mg/día18. Las dosis muy altas se toleraron bien y no comportaron reducciones adicionales de la PA. Un último estudio, el ROAD, aporta un valor añadido al comparar la estrategia de dosis habituales frente a dosis más altas tanto en un IECA (benazepril) como en un ARA II (losartán) y ofrece datos más consistentes acerca de los efectos sobre la progresión de la insuficiencia renal19. En ambos casos, las dosis más altas (hasta 40 mg/día de benazepril y 200 mg/día de losartán) consiguieron reducciones superiores de proteinuria, y también una notable mejoría de la progresión de la insuficiencia renal (51 y 53%, respectivamente) en comparación con las dosis de 10 y 50 mg/día, a lo largo de los 3,7 años de duración del estudio. Es interesante resaltar que los beneficios fueron muy similares ya se utilizara el IECA o el ARA II.
CONCLUSIÓN
Los estudios publicados recientemente sugieren que el bloqueo más intenso del sistema SRAA, ya sea con monoterapia en muy altas dosis o con bloqueo múltiple, no comporta una reducción adicional muy importante de la PA (esto podría ser algo distinto con aliskiren), pero sí consigue mejores resultados de control de marcadores intermedios en poblaciones seleccionadas (pacientes con proteinuria o insuficiencia cardiaca). En el caso de los pacientes con nefropatía proteinúrica, esto comportaría una mejora en la progresión de la insuficiencia renal y en el caso de insuficiencia cardiaca refractaria, una reducción de la morbimortalidad cardiovascular. Fuera de estas poblaciones, no parece razonable generalizar su utilización (ONTARGET). Lamentablemente, la ausencia de estudios comparativos entre la monoterapia en muy altas dosis y el bloqueo múltiple en dosis más bajas no permite hacer una recomendación sobre cuál de las dos estrategias puede ser más eficaz y/o segura. En cualquier caso, y sobre todo en pacientes con insuficiencia cardiaca en quienes la perfusión renal podría estar comprometida, es preceptivo controlar periódicamente el potasio sérico y la función renal, a la vez que introducir los fármacos y los incrementos de dosis de manera gradual y en función de la PA del paciente para evitar episodios de hipotensión. Por último, la diversidad de opciones para bloquear el sistema y las singularidades de los distintos grupos de fármacos para hacerlo posibilita individualizar en cada caso la mejor opción.
Figura 1.
Figura 2.