El pigmento Heme y el hierro contenidos en la hemoglobina y en la mioglobina tienen un efecto nefrotóxico agudo y crónico, que se manifiesta en situaciones de hemólisis masiva o rabdomiólisis. Describimos el caso de una paciente diagnosticada de hemoglobinuria paroxística nocturna tras iniciar un fracaso renal agudo en el seno de una crisis hemolítica grave. No se practicó biopsia renal por la rápida mejoría de la función renal tras hidratación intensa y corticoterapia. En este caso se remarca el papel nefrotóxico del pigmento Heme y del hierro, y se revisan los mecanismos fisiopatológicos implicados en la toxicidad aguda y crónica de ambos agentes y su tratamiento.
INTRODUCCIÓN
La hemoglobinuria paroxística nocturna (HPN) consiste en una alteraccorticoiión clonal de la célula madre hematopoyética que se caracteriza por presentar cuadros de hemólisis intravascular con tendencia a producir fenómenos trombóticos. Se cree que los hematíes presentan una alteración de la membrana, lo que los hace susceptibles a la acción lítica del complemento1.
Los pacientes con HPN presentan episodios de hemólisis desencadenados frecuentemente por infecciones virales o bacterianas. Los cuadros se caracterizan por emisión de orinas oscuras acompañados de mal estado general, astenia y, en ocasiones, abdominalgia2,3. Se han descrito distintas manifestaciones renales en la HPN en forma de pielonefritis crónica, trombosis de la vena renal e insuficiencia renal crónica1,4. Con menor frecuencia se recogen en la literatura episodios de fracaso renal agudo4 asociados a las crisis hemolíticas, y en ocasiones se precisa tratamiento renal sustitutivo1,4.
Describimos el caso de un paciente con síndrome mielodisplásico no conocido, con fenotipo de HPN, que se inicia con un fracaso renal agudo asociado con una crisis hemolítica grave, desencadenada probablemente por un proceso viral. Revisamos los posibles mecanismos fisiopatológicos implicados en la nefrotoxicidad de la hemoglobina y el hierro, así como el tratamiento.
CASO CLÍNICO
Mujer de 34 años, con historia de urticaria, migrañas y episodios de repetición de ictericia, coluria, dolor en fosas renales, anemia y exantema cutáneo con test de Coombs negativo. En noviembre de 2008 ingresa en Neurología por pérdida de visión de ojo izquierdo. Es diagnosticada de neuritis retrobulbar. Tras recibir bolos de metilprednisolona, es dada de alta en tratamiento con corticoides orales. Al finalizar el tratamiento corticoideo, acude 24 horas más tarde a Urgencias por una nueva pérdida de visión en el ojo izquierdo e intensa coluria. La paciente refiere un cuadro catarral en los días previos. En este momento presenta anemia con hemoglobina 9,5 g/dl, hematocrito del 28% y sedimento urinario con 15-20 hematíes/campo. Es dada de alta desde Urgencias con corticoides orales, volviendo a consultar a las 24 horas por dolor intenso en fosas renales con datos analíticos de fracaso renal agudo y anemia en rango transfusional, motivo por el que es ingresada en el servicio de Nefrología.
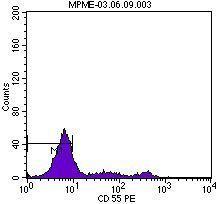
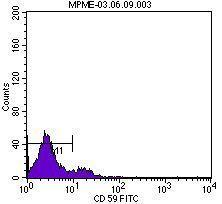
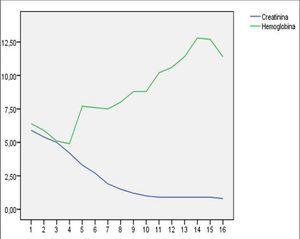
En el momento del ingreso presentaba una presión arterial (PA) de 120/65 mmHg y una temperatura de 36 ºC. En la exploración física destacaba intensa palidez cutaneomucosa con tinte ictérico en escleras, disnea de esfuerzo, ausencia de edemas en miembros inferiores y lesiones exantemáticas en resolución generalizadas. La determinación analítica realizada al ingreso confirmó la existencia de anemia hemolítica no microangiopática, con hemoglobina 6,4 g/dl, hematocrito del 19%, leucocitos 4300 miles/ml, plaquetas 187.000 miles/ml, bilirrubina indirecta 1,7 mg/dl, láctico deshidrogenasa (LDH) 1504 U/l, haptoglobina que no se detecta, ácido fólico >24 ng/ml, vitamina B12 260 pg/ml, transaminasa glutamicooxalacética (GOT) 105 U/l, transaminasa glutamicopirúvica (GPT) 24 U/l, con frotis sanguíneo sin esquistocitos y con anisopoiquilocitosis; test de Coombs negativo e insuficiencia renal con creatinina de 5,9 mg/dl y urea 114 mg/dl; orina elemental y sedimento urinario: densidad 1005, pH 6, proteínas 25 mg/dl, hematíes 1-5/campo, leucocitos 10-25/campo, bacterias abundantes y células epiteliales aisladas. Las determinaciones de inmunoglobulinas, complemento, anticuerpos antinucleares (ANA) y anticuerpos anticitoplasma de neutrófilos (ANCA) fueron normales. En la radiografía de tórax llamaba la atención un índice cardiotorácico incrementado para lo esperado por la edad de la paciente. En el ecocardiograma se visualizaba un derrame pericárdico en la región basal, con función ventricular conservada. La ecografía abdominal informó de riñones con buena diferenciación corticomedular y espesor de la cortical conservada sin dilatación de la vía excretora, con papilas hiperecogénicas de forma bilateral. Ante la sospecha de enfermedad hematológica como origen de la insuficiencia renal, se consultó con el servicio de Hematología y se realizó citometría de flujo para analizar la expresión de CD55 (figura 1) y CD59 (figura 2) en la membrana celular de los polimorfonucleares y linfocitos, así como la expresión de CD14 en población monocitaria. La expresión de estos marcadores fue baja o prácticamente ausente, por lo que la paciente fue diagnosticada de HPN tipo clásico según la clasificación de Parker5. Se inició tratamiento con hidratación intensa, corticoides intravenosos y transfusión de tres concentrados de hematíes. La función renal fue mejorando progresivamente (figura 3), sin precisar terapia renal sustitutiva, motivo por el que se trasladadó al servicio de Hematología, donde se iniciaron los trámites para la administración de eculizumab. Se pautó anticoagulación oral con warfarínicos ante la posibilidad de afectación neurológica grave de probable origen trombótico. Al alta tenía una creatinina de 1 mg/dl. Durante el ingreso fue diagnosticada, mediante biopsia de piel, de urticaria tipo vasculitis de pequeño vaso y de carácter leucocitoclástico. Actualmente sigue revisiones en las consultas de Hematología, donde se ha iniciado tratamiento con eculizumab por presentar nuevas crisis hemolíticas.
DISCUSIÓN
La HPN es una enfermedad clonal adquirida de las células madre hematopoyéticas pluripotenciales que surge por una mutación del gen pig-A en el brazo corto del cromosoma X, que es clave en la síntesis de la molécula de engarce de glucosil-fosfatidil-inositol (GPI). Este engarce es necesario para que varias proteínas puedan unirse a la membrana del hematíe. La ausencia parcial o completa del factor acelerador de descomposición (FAD, CD55) y del inhibidor de membrana de lisis reactiva (IMLR, CD59), que se unen al GPI, hacen a los hematíes más sensibles a la acción lítica del complemento activado, lo que provoca hemólisis intravascular. Las crisis hemolíticas suelen verse desencadenadas por factores no específicos, como las infecciones, las transfusiones y la cirugía. En nuestro caso, parece que el proceso viral que sufrió días antes la paciente pudo ser el factor causal de la crisis hemolítica.
La asociación entre afectación renal y HPN fue descrita por primera vez en el año 19706. Posteriormente, se han descrito distintas alteraciones de la morfología y de la función renal en pacientes diagnosticados de HPN, aunque poco se conoce sobre ellas, dado que no son muchos los enfermos sometidos a biopsia renal. La afectación renal parece estar relacionada con el daño tubular agudo provocado tras la exposición a la proteína Heme, la cual presenta un alto potencial nefrotóxico. Se han reconocido distintos mecanismos como causantes de la toxicidad renal aguda del grupo Heme7. En primer lugar, la formación de los cilindros intraluminares con proteínas Heme daría lugar a obstrucción y dilatación de los túbulos, asociado al efecto citotóxico directo que potencia las lesiones tubulares isquémicas. A su vez, la proteína Heme neutraliza el óxido nítrico, un importante vasodilatador endógeno8, el cual tiene un papel muy importante en la oxigenación medular9 al favorecer las lesiones tubulares isquémicas. Otro hallazgo que se ha visto con frecuencia en las biopsias renales de estos enfermos han sido lesiones compatibles con nefropatía intersticial crónica, posiblemente secundaria a los depósitos de hierro en las células tubulares. En los túbulos, el hierro del grupo Heme es liberado, lo que puede generar radicales libres10. Estos serían capaces de poner en marcha mecanismos locales inflamatorios, liberando factores quimiotácticos, que darían lugar a un infiltrado celular inflamatorio crónico, a fibrosis intersticial y a fracaso de la función renal a largo plazo. Se ha descrito algún caso de fracaso renal y HPN por complicaciones trombóticas. En nuestro caso no se practicó la biopsia renal por la rápida mejoría de la función renal tras hidratación intensa y por el diagnóstico de HPN, lo que nos hizo pensar que el fracaso renal agudo estaba justificado por la nefrotoxicidad de los derivados hemoglobínicos liberados tras la crisis hemolítica. Por ello, suponemos que las lesiones histológicas subyacentes eran de necrosis tubular aguda y/o nefritis tubulointersticial aguda; aunque no tenemos constancia óptica de las lesiones renales, hemos descartado las complicaciones trombóticas renales mediante estudio Doppler de los vasos renales, así como por la rápida mejoría de la función renal tras hidratación, transfusión y tratamiento corticoideo. Es importante destacar que los episodios de pérdida brusca de visión podrían estar relacionados con las crisis hemolíticas y con el estado protrombótico que presentan estos enfermos, motivo por el cual se decidió iniciar tratamiento anticoagulante. En esta paciente se planteó la utilización de eculizumab como alternativa válida para prevenir nuevos cuadros hemolíticos y minimizar el riesgo trombótico, ya que existen evidencias de que este anticuerpo monoclonal humanizado disminuye el número de crisis hemolíticas en los pacientes, así como la necesidad de requerimiento transfusional y de las complicaciones derivadas de éstas. Además, parece que reduce la incidencia de otras complicaciones asociadas con esta enfermedad, como la enfermedad tromboembólica11. El mecanismo de acción consiste en la unión del anticuerpo a la proteína C5 del complemento e inhibe la activación del complemento terminal, lo que evita la hemólisis intravascular mediada por el complemento en estos pacientes. A su vez, preserva los primeros componentes de la activación del complemento que son esenciales para la opsonización de los microorganismos y la eliminación de inmunocomplejos.
En resumen, con nuestro caso queremos sumarnos a la evidencia que existe de fracaso renal agudo como una importante manifestación de la HPN, y resaltar la importancia del diagnóstico de HPN, así como del conocimiento de los mecanismos y agentes causales que pueden provocar afectación renal en el seno de una crisis hemolítica, las complicaciones trombóticas que pueden presentar, permitiéndonos anticiparnos al daño renal tratando las infecciones e intensificando la hidratación. Algunos datos sugieren que el pronóstico es favorable cuando la enfermedad se diagnostica y maneja de manera adecuada6, aunque la información de la que disponemos es escasa.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Expresión del marcador CD55 en la citometría de flujo.
Figura 2. Expresión del marcador CD59 en la citometría de flujo.
Figura 3. Evolución de la hemoglobina y de la creatinina tras iniciar el tratamiento.