Sr. Director:
La amiloidosis secundaria (AA) sistémica es una entidad frecuente, asociada con enfermedades inflamatorias e infecciones de larga evolución, así como con algunas neoplasias. Durante los primeros 15-20 años, la enfermedad suele cursar sin síntomas, y habitualmente la afectación renal es el primer dato clínico que aparece y se manifiesta como proteinuria. Su evolución suele ser un fracaso renal terminal entre 2 y 10 años después1. Asimismo, la recidiva de amiloidosis en el trasplante renal también es una entidad ampliamente descrita2. La amiloidosis primaria (AL), o amiloidosis secundaria (AA) de novo en el trasplante renal, se considera una enfermedad lentamente progresiva, que en la mayoría de los casos no se asocia con pérdida del injerto3 o lo hace tras años de evolución4.
El pioderma gangrenoso (PG) es una entidad clinicopatológica cutánea bien definida, caracterizada por la presencia de pústulas eritematosas únicas o múltiples que progresan rápidamente a úlceras necróticas. La etiología se desconoce, aunque se han descrito defectos en el metabolismo oxigenado de los neutrófilos, sobreexpresión de algunas citoquinas (interleuquina-8, interleuquina-16) y anomalías de la inmunidad humoral y celular, pero ninguna específica5. En las formas leves se inicia tratamiento con corticoides tópicos o intralesionales pero casi siempre es insuficiente, y se precisa tratamiento sistémico. Los casos refractarios a los corticoides pueden responder a otros inmunosupresores, como la ciclosporina oral, y en ocasiones también son eficaces el micofenolato mofetil, la azatioprina o el metotrexato, así como las nuevas terapias biológicas (anticuerpos monoclonales anti-TNF).
Presentamos el caso de una paciente mujer de 38 años, con antecedentes de hipertensión arterial de larga evolución bien controlada y PG en las extremidades inferiores diagnosticado en 1989. Por su PG recibió tratamiento prolongado con inhibidores de la calcineurina (ciclosporina y tacrolimus), sin respuesta, mostrando múltiples complicaciones infecciosas por gérmenes multirresistentes que obligaron a tratamientos antibióticos prolongados. Seguida en nuestro servicio por enfermedad renal crónica (ERC), se realiza biopsia renal en febrero de 2002, en la que se informó de esclerosis y atrofia glomerular parchada, con hialinosis vascular, compatible con alteraciones secundarias al tratamiento con anticalcineurínicos.
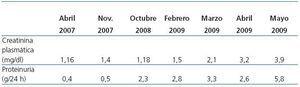
En agosto de 2002 inicia terapia renal sustitutiva con hemodiálisis, y en octubre de 2005 recibe un trasplante renal de cadáver, siendo la creatinina plasmática en el momento del alta de 1 mg/dl sin proteinuria. Durante 4 años mantuvo tratamiento con tacrolimus, micofenolato mofetil y prednisona a dosis bajas. La función renal se mostró estable, con creatinina plasmática en torno a 1,1 mg/dl y proteinuria mantenida menor de 0,5 g/24 h a pesar de presentar varias complicaciones infecciosas secundarias al PG. En febrero de 2009 el deterioro de función renal se hace manifiesto (creatinina plasmática 1,5 mg/dl), así como el incremento de la proteinuria (2,8 g/24 h) (tabla 1). Los posibles diagnósticos diferenciales fueron: nefropatía crónica del injerto, toxicidad por calcineurínicos, enfermedad glomerular de novo, nefritis túbulo-intersticial o causas obstructivas. En el examen físico la paciente estaba normotensa, y presentaba disminución del panículo adiposo en relación con una desnutrición calórico-proteica de larga evolución, lesiones en las extremidades inferiores secundarias al PG y leves molestias a la palpación en la zona del injerto renal. Se obtuvo un perfil analítico completo para estudio de enfermedades glomerulares, incluyendo proteinograma e inmunoelectroforesis en sangre y orina; todas las pruebas resultaron negativas.
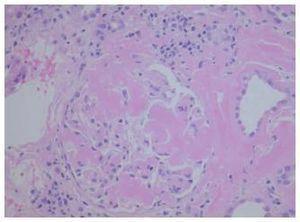
En la ecografía renal se detectó un injerto de 13,2 x 6,2 cm, con parénquima y ecoestructura conservada sin evidencias obstructivas. El 23 de mayo de 2009 se realiza biopsia renal obteniéndose 25 glomérulos en los que se observó una cantidad variable de un material amorfo eosinófilo, que en la mayoría de los glomérulos se deposita en el penacho glomerular y se extiende hacia el resto. Dicho material también se observa en el intersticio, alrededor de los túbulos y en el espesor de la pared de vasos, haciendose aún más patente con la tinción Rojo Congo con brillo en verde manzana bajo luz polarizada (figura 1). Con pretratamiento de permanganato potásico, se pierde en la tinción para Rojo Congo. Se observan también túbulos con epitelio edematoso y un infiltrado inflamatorio crónico poco marcado en el intersticio, constituido por linfocitos de pequeño tamaño. El estudio de inmunofluorescencia resultó negativo. El diagnóstico anatomopatológico fue de amiloidosis secundaria tipo AA. Mediante ecocardiografía se descartó la existencia de una miocardiopatía infiltrativa, así como la infiltración en otras localizaciones. El 25 de junio, 3 meses después del inicio del cuadro, la paciente comienza terapia renal sustitutiva, falleciendo a los 6 meses por hemorragia cerebral en el contexto de plaquetopenia e intolerancia al injerto.
Se expone el caso de una mujer de 36 años, con una amiloidosis AA de novo en el injerto renal en el contexto de un proceso inflamatorio crónico, hechos ya ampliamente descritos en la bibliografía, como mencionamos anteriormente, pero con varias singularidades que nos hace mostrar el cuadro, sirviendo de reflexión para otros casos de deterioro agudo de injerto renal. En primer lugar, exponemos el primer caso descrito en la literatura de asociación con PG, proceso inflamatorio crónico, como ya hemos mencionado anteriormente, con amiloidosis AA. En segundo lugar, la aparición de amiloidosis AA de novo sobre el injerto renal, sin afectación sistémica, tras 16 largos años de proceso inflamatorio e infeccioso asociado a las úlceras en las extremidades inferiores, manifestación de su PG. En la bibliografía científica se exponen casos en los que la amiloidosis sistémica se desarrolla tras un proceso inflamatorio largo, o incluso lo hace sobre el injerto renal, pero tras años con la propia inflamación. En el caso que nos ocupa, tras 16 años de inflamación la paciente no desarrolla amiloidosis y sí lo hace en tan sólo 4 años de trasplante renal manifestándose sólo en este órgano. En tercer lugar, tanto la amiloidosis AL como la AA de novo, lo que hasta ahora se describe en la bibliografía médica es un deterioro lento e insidioso de la función renal. En nuestra paciente la pérdida del injerto ocurrió en apenas 3 meses, produciéndose posteriormente el fallecimiento.
Sirva este caso como reflexión a la hora de establecer el diagnóstico diferencial en aquellos pacientes con injerto renal y proceso inflamatorio crónico asociado que inician un deterioro de la función de forma rápida asociado con proteinuria y en quienes todos los resultados clínico-analíticos son negativos.
Tabla 1. Evolución de la creatinina plasmática y proteinuria
Figura 1. Amiloidosis en glomérulo de biopsia renal.