Los donantes renales pierden la mitad de su masa renal tras la nefrectomía. Se estima que el riñón remanente compensa idóneamente un 70% de la función renal previa a la donación. Los factores asociados con el grado de compensación posdonación no están bien establecidos.
MétodosAnálisis retrospectivo de 66 donantes renales consecutivos. Edad media 48,8 años; 74,2% mujeres. Se estudiaron los potenciales factores asociados con la compensación del riñón remanente comparando donantes según su tasa de compensación renal (TCR) (grupo A, infra-compensación [<70%]; grupo B compensación normal [>70%]).
ResultadosComparamos los grupos A (n=38) y B (n=28). Los factores predictores de una TCR>70% fueron una mayor creatinina basal (A vs. B 0,73±0,14 vs. 0,82±0,11; p=0,03) y menor filtrado glomerular (FG), tanto estimado mediante MDRD-4 (A vs. B 97,7±18,8 vs. 78,6±9,6ml/min; p<0,001) como por CKD-EPI (A vs. B 101,7±15 vs. 88,3±11,7ml/min; p≤0,001). La edad, el sexo, el tabaquismo, la hipertensión o el FG medido con Tcm-DTPA no mostraron asociación con la TCR. El análisis multivariante confirmó el FGe como predictor de compensación: a mayor FG basal menor probabilidad de compensar>70% (MDRD-4, odds ratio [OR]=0,94 [IC 95%: 0,8-0,9], p=0,01). La tasa de compensación era 0,4% (p<0,001) y 0,3% (p=0,006), menor por cada ml/min de FG basal más, por MDRD-4 y CKD-EPI respectivamente.
ConclusionesUn año después de la donación renal el riñón remanente compensa parcialmente la función renal basal. En nuestra experiencia el FGe basal se asocia de forma inversamente proporcional a la tasa de compensación renal al año.
Kidney transplant donors lose 50% of their renal mass after nephrectomy. The remaining kidney compensates for this loss and it is estimated that 70% of the baseline renal function prior to donation is recovered. Factors associated with post-donation renal compensation are not well understood.
MethodsRetrospective study of 66 consecutive kidney donors (mean age 48.8 years, 74.2% women). We analysed the potential factors associated with the compensatory mechanisms of the remaining kidney by comparing donors according to their renal compensation rate (RCR) (Group A, infra-compensation [<70%]; Group B, normal compensation [>70%]).
ResultsWe compared Group A (n=38) and group B (n=28). Predictors for RCR>70% were higher baseline creatinine (A vs B: 0.73±0.14 vs 0.82±0.11; P=.03) and a lower baseline glomerular filtration rate (GFR), estimated both by MDRD-4 (A vs B: 97.7±18.8 vs 78.6±9.6ml/min; P<.001) and CKD-EPI (A vs B: 101.7±15 vs. 88.3±11.7ml/min; P≤.001). Age, gender, smoking, hypertension and GFR measured by Tc-DTPA did not show any correlation with the RCR. The multivariate analysis confirmed baseline estimated glomerular filtration rate (eGFR) to be a predictor of compensation: the higher the baseline eGFR, the lower the likelihood of >70% compensation (MDRD-4, OR=0.94 [95% CI 0.8–0.9], P=.01). The compensation rate decreased by 0.4% (P<.001) and 0.3% (P=.006) for every ml/min increase in baseline eGFR estimated by MDRD-4 and CKD-EPI, respectively.
ConclusionsOne year after living donor nephrectomy, the remaining kidney partially compensates baseline renal function. In our experience, baseline eGFR is inversely proportional to the one-year renal compensation rate.
El trasplante renal de donante vivo (TRDV) es la mejor terapia renal sustitutiva (TRS) para pacientes con enfermedad renal crónica (ERC) avanzada. Proporciona una mejor supervivencia del injerto y del paciente, y menor tasa de complicaciones quirúrgicas al tratarse de una intervención programada1,2. El TRDV supuso en España un 11,4% de todos los trasplantes renales realizados en 20163. Los beneficios aportados por esta modalidad de trasplante en términos de morbimortalidad y calidad de vida para los receptores4, así como los avances en las técnicas quirúrgicas empleadas y en el estudio previo y seguimiento posterior del donante, han permitido flexibilizar los criterios necesarios para la donación renal.
La donación renal no supone beneficios biológicos para quien voluntariamente se somete a ella.
Durante años se ha debatido sobre la evolución de la función renal y la morbimortalidad en los donantes. En este sentido la literatura no es concluyente. Algunos estudios clásicos con seguimiento a medio y largo plazo descartan mayor riesgo de ERC o de muerte en donantes renales comparados con población general5,6, pero otros más recientes, al establecer un grupo control sano mejor apareado, encuentran un pequeño aumento del riesgo absoluto de ERC a muy largo plazo, enfermedad cardiovascular e incluso muerte del donante7,8. Este riesgo podría restringirse a donantes genéticamente relacionados con pacientes cuyas enfermedades renales podrían ser familiares7. Por todo esto, es esencial realizar un proceso de selección meticuloso y responsable, informando sobre los riesgos a los que cada potencial donante se somete y respetando al mismo tiempo el principio de autonomía9.
Al año de la donación el riñón remanente consigue aportar hasta el 70% de la función renal previa a la nefrectomía10. Estudios fisiológicos recientes indican que inmediatamente tras la nefrectomía se produce una vasodilatación y aumento de flujo plasmático renal (FPR). Estos cambios, junto con un proceso todavía no bien caracterizado de hipertrofia glomerular, hacen que el filtrado glomerular del riñón remanente aumente aproximadamente un 40%, sin que se produzca un aumento de la presión del capilar glomerular11,12. La capacidad de compensación del riñón remanente, y en consecuencia la función renal que el donante alcanza a partir del riñón que le queda, son esenciales para evaluar el grado de morbilidad que conlleva la donación. El objetivo de nuestro estudio fue estimar el valor pronóstico que tiene la función renal previa a la nefrectomía para estimar la compensación de función renal posterior y si existen factores basales relacionados con el donante que permitan predecir el grado de recuperación renal a partir del riñón remanente. Conocer las diferencias en la respuesta compensadora entre distintos subgrupos
de donantes será útil para informar a futuros donantes.
Material y métodosSe diseñó un estudio retrospectivo observacional de una cohorte de donantes renales que consecutivamente se sometieron a una nefrectomía para donación renal entre enero de 2001 y diciembre de 2015 en el Hospital del Mar, Barcelona.
Se analizaron las características demográficas, médicas y analíticas considerando función renal basal y al año posnefrectomía de los 66 donantes que completaron este tiempo de seguimiento.
Evaluación de la función renal predonaciónSe obtuvo el filtrado glomerular medido (FGm) mediante renograma con 99mTc-DTPA entre 2 y 6 meses antes de la nefrectomía. El filtrado glomerular estimado (FGe) se obtuvo mediante las fórmulas basadas en creatinina plasmática MDRD-4 y CKD-EPI dentro del estudio de donante vivo, como se describe en trabajos previos de nuestro grupo13. Se tomó como referencia el valor de creatinina más cercano a la fecha de la donación.
Evaluación de la función renal al año de la donaciónLa valoración de la función renal al año de la nefrectomía se realizó mediante las fórmulas MDRD-4 y CKD-EPI. Evaluamos la compensación de la función renal al año de la donación como el porcentaje de FGe alcanzado por el riñón remanente al año respecto al FGe basal. El cálculo se realizó empleando FGe por MDRD-4, como en otros estudios14,15, mediante la fórmula:
(Tasa compensación renal):(FG al año de la nefrectomía/FG basal)*100.
Comparamos los donantes con tasa de compensación mayor y menor al 70% al año de la donación y analizamos las características basales para identificar factores predictivos del grado de compensación renal.
Evaluación del cambio absoluto de filtrado glomerularSustrayendo el FGe al año de la donación al FGe inicial, ambos estimados mediante MDRD-4, se obtuvo el cambio absoluto de FG. Dado que la reducción de FG se espera de entre 25-40ml/min al año de la donación16 escogimos 40ml/min como punto para clasificar a los donantes de la cohorte, según su reducción de FG al año.
Análisis estadísticoLas variables cuantitativas con una distribución normal se expresaron como media y desviación estándar; las variables categóricas como frecuencia/porcentaje. Las variables que no seguían una distribución normal se expresaron como mediana y rango intercuartílico. Se comprobó la distribución normal de todas las variables continuas mediante la prueba de Kolmogorov-Smirnoff. Se establecieron comparaciones entre los grupos descritos mediante análisis de «t» de Student para variables continuas o Chi-cuadrado o test de Fisher para variables categóricas. Se realizó un análisis multivariante mediante regresión logística binaria para evaluar la relación entre diferentes variables basales y compensación alcanzada al año de la nefrectomía mayor o menor al 70%, expresada como OR, valor de p e intervalo de confianza del 95%. Se realizó un análisis de regresión lineal entre variables basales continuas y la tasa de compensación. Se realizó el mismo análisis para el cambio absoluto de FGe. Para ello se establecieron diferentes modelos separando las variables colineales. Todos los análisis estadísticos se realizaron con el programa SPSS (SPSS Inc., Chicago, IL) versión 20.0. Se consideró estadísticamente significativo un valor p<0,05.
ResultadosCaracterísticas de la cohorte de donantesLa tabla 1 muestra las características basales demográficas, antropométricas y de función renal de la cohorte de donantes.
Características basales y función renal al año de la nefrectomía en la cohorte de donantes
| Edad a la donación (media±DE; años) | 48,8±10 |
|---|---|
| Sexo mujer (%) | 74.2 |
| Raza (n, %) | |
| Caucásica | 58 (87,8) |
| Hispánica | 6 (9) |
| Negra | 1 (1,5) |
| Asiática | 1 (1,5) |
| Índice masa corporal (media±DE) | 26,4±3,8 |
| Tabaquismo (n, %) | 27 (41) |
| HTA (n, %) | 4 (6) |
| Obesidad (n, %) | 2 (3) |
| Dislipidemia (n, %) | 22 (33) |
| Creatinina basal (media±DE; mg/dl) | 0,78±0,14 |
| FGe MDRD-4 basal (media±DE; ml/min) | 89,32±19,8 |
| FGe CKD-EPI basal (media±DE; ml/min) | 95,4±17 |
| Creatinina al año mg/dl (media±DE) | 1,1±0,20 |
| FG MDRD-4ml/min al año (media±DE) | 58,9±10,3 |
| FG CKD-EPI ml/min al año (media±DE) | 65,4±12,6 |
| Cambio absoluto FG MDRD-4ml/min al año (media±DE) | 30,41 ± 16 |
| Cambio absoluto FG CKD-EPIml/min al año (media±DE) | 30,1±13,5 |
| Tasa de compensación por MDRD (%) | 67,6±13,1 |
| Tasa de compensación por CKD-EPI (%) | 69,2±12,1 |
DE: desviación estándar; FGe: filtrado glomerular estimado; HTA: hipertensión arterial.
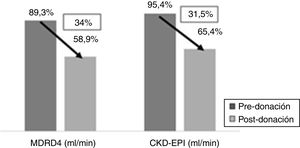
Al año de la donación la creatinina sérica fue significativamente más alta que en el momento basal (1,1 vs. 0,78mg/dl, p<0,001) y el FGe inferior por MDRD-4 (58,9 vs. 89,3ml/min, p<0,001) y por CKD-EPI (65,4 vs. 95,4ml/min, p<0,001). Esto supone respecto a la función renal basal una pérdida media de 34% de FGe por MDRD-4 y 31,5% por CKD-EPI (fig. 1).
Al año de la donación, mediante MDRD-4, 2 (3%) donantes mantenían FG 30-45ml/min, 38 (57,5%) donantes entre 45-60ml/min y 26 (39,4%) donantes con FG>60ml/min por MDRD-4. Por CKD-EPI, un (1,5%) donante con FG 30-45ml/min, 26 (39,4%) donantes con FG 45-60ml/min y 39 (59%) donantes con FG>60ml/min.
Evaluación de la tasa de compensación al año de la donación y factores predictoresLa tasa de compensación media al año de la donación fue de 67,6% (±13,1) por MDRD4 y 69,2% (±12,1) por CKD-EPI. Se compararon los perfiles de los donantes con compensaciones superiores e inferiores al 70% del valor basal al del año de la donación (tabla 2).
Factores pronósticos de tasa compensación superior al 70% al año de la donación y evolución de la función renal al año de la donación según tasa de compensación> o <70%
| Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|
| FGe 12m<70% (N=38) | FGe 12m>70% (N=28) | p | OR (IC 95%) | p | |
| Edad donante (media ±DE; años) | 48,8±11 | 48,9±10,7 | 0,9 | ||
| Sexo mujer (n, %) | 29 (67) | 19 (86) | 0,08 | ||
| Raza caucásica (n, %) | 37 (86) | 20(87) | 0,4 | ||
| IMC (media±DE) | 25,6±2,9 | 27,6±4,6 | 0,04 | 1,05 (0,9-1,2) | 0,5 |
| Tabaquismo (n, %) | 20 (47) | 7 (30) | 0,4 | ||
| HTA (n, %) | 1 (2%) | 3 (13%) | 0,08 | ||
| Obesidad (n, %) | 3 (7%) | 6 (26%) | 0,09 | ||
| Dislipidemia (n, %) | 12 (28%) | 10 (43%) | 0,2 | ||
| Creatinina basal mg/dl (media ±DE) | 0,79±0,14) | 0,83±0,14 | 0,04 | 30 (0,7-1225) | 0,8 |
| FGe MDRD basal ml/min (media±DE) | 94,5±19,4 | 77,8±15 | 0,01 | 0,94 (0,91-0,99) | 0,01 |
| FGe CKD-EPI basal (media±DE) | 98,6±14,4 | 85,9±15 | 0,01 | 0,95 (0,9- 0,99) | 0,01 |
| 99mTc-DTPA basal (media±DE) | 102,3±24,4 | 96,4±19,7 | 0,4 | ||
| FGe 12m<70% (N=38) | FGe 12m>70% (N=28) | p | |
|---|---|---|---|
| Creatinina al año mg/dl (media ± DE) | 1,14±0,21 | 1,01±0,16 | 0,02 |
| FG MDRD-4ml/min al año (media ±DE) | 57,49±10,6 | 61,7±9,1 | 0,1 |
| FG CKD-EPIml/min al año (media ±DE) | 63,6±12,9 | 68,9±11,5 | 0,1 |
| Cambio absoluto FG MDRD-4ml/min al año (media ±DE) | 38,5±11,99 | 14,31±9,9 | <0,001 |
| Cambio absoluto FG CKD-EPIml/min al año (media ±DE) | 36,9±8,5 | 16,4±11,1 | <0,001 |
DE: desviación estándar; FGe: filtrado glomerular estimado; FGm filtrado glomerular medido; HTA: hipertensión arterial; IMC: índice de masa corporal.
Los factores predictores de una compensación>70% al año de la donación por MDRD-4 fueron una mayor creatinina basal (A vs. B 0,73±0,14 vs. 0,82±0,11; p=0,03) y menor FG tanto estimado mediante MDRD-4 (A vs. B 97,7±18,8 vs. 78,6±9,6ml/min; p<0,001) como por CKD-EPI (A vs. B 101,7±15 vs. 88,3±11,7ml/min; p≤0,001). La edad, el sexo, el tabaquismo, la obesidad o el IMC, la hipertensión o la dislipidemia no se asociaron significativamente con la tasa de compensación renal. Tampoco el FGm-TcDTPA mostró asociación. Para realizar el análisis multivariante se emplearon modelos distintos que incluían creatinina basal y FGe basal por MDRD4 o FGe por CKD-EPI. El FGe basal por MDRD-4 permaneció como único factor predictivo independiente de compensación, siendo la relación inversa, ya que a mayor FGe basal, menor capacidad de compensar>70%, (OR=0,94 [IC 95% 0,8-0,9], p=0,04).
La tasa de compensación presentó correlación positiva con la creatinina basal (r=0,46; p<0,001) y negativa con el FG basal, tanto estimado por MDRD-4 (r=–0,73; p<0,001) como por CKD-EPI (r=0,51;p=0,001). La compensación era 0,4% (p<0,001) y 0,3% (p=0,006) menor por cada ml/min de FG basal por MDRD-4 y por CKD-EPI respectivamente.
La tabla 2 muestra la evolución de la FR según la tasa de compensación.
Evaluación del cambio absoluto en filtrado glomerularSe calculó el cambió absoluto de FG. Mediante MDRD-4 el FG disminuyó 30,41±16 y 30,1±13,5ml/min mediante CKD-EPI.
Se agruparon los donantes entre aquellos con una disminución superior 40ml/min de FG basal y aquellos con un descenso inferior. La tabla 3 recoge las diferencias entre ambos grupos. La tabla 3 muestra la función renal al año dependiendo de si la pérdida de FG fue mayor o menor de 40ml/min.
Factores pronósticos de pérdida >40ml/min respecto a la función renal basal al año de la donación y evolución de la función renal según la pérdida absoluta de FG respecto a la basal> o <40ml/min
| Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|
| Cambio absoluto Fge 12m>40ml/min (N=18) | Cambio absoluto Fge 12m<40ml/min (N=48) | p | OR (IC 95%) | p | |
| Edad donante (media±DE; años) | 45,6±13,3 | 50±9,6 | 0,1 | ||
| Sexo mujer (n, %) | 10 (5,5) | 39 (81,2) | 0,03 | ||
| Raza caucásica (n, %) | 15 (83,3) | 43(89,5) | 0,5 | ||
| IMC (media±DE) | 25,6±2,6 | 26,5±4 | 0,4 | 1,05 (0,9-1,2) | 0,5 |
| Tabaquismo (n, %) | 9 (50) | 187(37,5,8) | 0,3 | ||
| HTA (n, %) | 0 (0) | 4(8,3) | 0,2 | ||
| Obesidad (n, %) | 0 (0) | 2 (4,1) | 0,2 | ||
| Dislipidemia (n, %) | 3 (16,6) | 19(39,6) | 0,07 | ||
| Creatinina basal mg/dl (media ±DE) | 0,72±0,12 | 0,80±0,15 | 0,06 | 30 (0,7-1225) | 0,8 |
| FGe MDRD basall/min (media±DE) | 101,86±10,7 | 84,62±20,4 | 0,001 | 0,94 (0,91-0,99) | 0,01 |
| FGe CKD-EPI basal (media±DE) | 109,1±12,6 | 90,3±15,6 | <0,001 | 0,95 (0,9-0,99) | 0,01 |
| 99m Tc-DTPA basal (media±DE) | 108,7±25,4 | 97,2±20,5 | 0,08 | ||
| Cambio absoluto Fge 12m>40ml/min (N=18) | Cambio absoluto Fge 12m<40ml/min (n=48) | p | |
|---|---|---|---|
| Creatinina al año mg/dl (media±DE) | 1,14±0,21 | 1,01±0,16 | 0,02 |
| FG MDRD-4ml/min al año (media±DE) | 57,49±10,6 | 61,7±9,1 | 0,1 |
| FG CKD-EPIml/min al año (media±DE) | 63,6±12,9 | 68,9±11,5 | 0,1 |
| Cambio absoluto FG MDRD-4ml/min al año(media±DE) | 38,5±11,99 | 14,31±9,9 | <0,001 |
| Cambio absoluto FG CKD-EPIml/min al año (media±DE) | 36,9±8,5 | 16,4±11,1 | <0,001 |
DE: desviación estándar; FGe: filtrado glomerular estimado; FGm filtrado glomerular medido; HTA: hipertensión arterial; IMC: índice de masa corporal.
Los donantes que perdieron>40ml/min del FG basal partían de FG más elevados por MDRD-4 (101,86±10,7 vs. 84,62±20,4ml/min; p≤0,001) y por CKD-EPI (109,1±12,6 vs. 90,3±15,6ml/min; p≤0,001).
La pérdida absoluta de FG presentó correlación negativa con la creatinina basal (r=–0,3; p<0,001) y positiva con el FG basal, MDRD-4 (r=0,5; p<0,001). La pérdida absoluta de FG era 0,5ml/min mayor por cada ml/min de FGe basal más (p<0,001).
DiscusiónEn este estudio de una cohorte de donantes renales vivos, hemos analizado el valor de la función renal previa a la nefrectomía y otras variables basales del donante en la capacidad de compensación de la función renal posterior. Al evaluar la tasa de compensación renal encontramos que los donantes que presentaban una creatinina más elevada, y por tanto un menor FG basal, compensaron en mayor proporción que aquellos con un mayor FGe. La mayor parte de trabajos publicados ha analizado la capacidad de los donantes renales de alcanzar un FGe determinado, en general superior a 60ml/min, considerando que esta función demuestra una adecuada evolución tras la donación. La proporción de donantes que no alcanza dicha cifra varía según las series entre 10-91%15,16. Los estudios que valoran los factores basales asociados a la recuperación de la función renal basal coinciden en que un mayor FG basal predice una mejor función renal al año de la donación12. Nuestros resultados son similares: un mayor FG basal es un factor predictor de alcanzar >60ml/min de FGe al año de la donación (datos no mostrados). Sin embargo, no está clara la idoneidad de este criterio para la evaluación de la función renal. El valor de 60ml/min considerado para establecer ERC en la población general17 no es aplicable a los donantes renales sanos que, si bien padecen una disminución de su masa renal, preservan íntegra la función del riñón remanente18,19.
Numerosos estudios han descrito el proceso mediante el cual el riñón remanente aumenta su FG tras la nefrectomía del riñón contralateral. En humanos, inmediatamente después de la nefrectomía se incrementa el flujo renal, de manera que a pesar de que se extrae la mitad de la masa renal, el FG alcanza el 70% de la función renal previa10,12. Estudios morfométricos recientes indican que el flujo aumenta en paralelo al volumen renocortical y al coeficiente de ultrafiltración, calculado mediante modelos matemáticos, y concluyen que el aumento de FG posnefrectomía puede explicarse exclusivamente por el aumento en flujo sin que exista incremento en la presión glomerular11.
En consistencia con estudios previos, en la cohorte de donantes descrita el FGe medio al año de la donación desciende en torno al 30% de la FR previa16. Teniendo en cuenta que se considera óptimo alcanzar el 70% de la función renal basal al año de la nefrectomía, nuestro objetivo fue estudiar la evolución de la función renal basal según este criterio. Nuestros resultados muestran que si bien aquellos donantes con FG basales mayores alcanzan más probablemente un FGe>60ml/min al año, un FGe menor previo a la donación está asociado a una mayor compensación al año de la donación. Al realizar el análisis de la pérdida absoluta de FR se objetiva que los donantes que pierden>40ml/min del FG basal partían de FG más elevados. Comprobamos que este hecho se debe a que los donantes que compensan más presentan una menor disminución absoluta del FG. Se desconocen los mecanismos fisiológicos subyacentes que puedan explicar este hallazgo. Podría ocurrir que los individuos con menor FG basal presenten mecanismos de compensación más eficaces (mayor capacidad de vasodilatación, mayor hipertrofia glomerular, etc.). Pocos estudios en la literatura evalúan la tasa de compensación renal14,15, por lo que se requieren más estudios y con mayor tiempo de seguimiento para analizar si la tasa de compensación renal predice la evolución de la función renal a largo plazo.
Aparte de la función renal basal no se identificaron características basales que pudieran pronosticar una adecuada tasa de compensación renal al año de la donación. Aunque existen estudios que valoran el peso de algunos factores en alcanzar o no un FGe>60ml/min tras la nefrectomía6,16,20, hay pocos estudios sobre los factores pronósticos de la tasa de compensación renal15. Los resultados de la influencia de los factores estudiados no son homogéneos. Algunos trabajos han descrito que los pacientes con mayor índice de masa corporal con mayor probabilidad no alcanzan FG>60ml/min después de la nefrectomía6,12, si bien este concepto no es unánime21. La edad disminuye el número de nefronas y además aumenta la arterioesclerosis15. Aunque estudios previos indican que los donantes mayores de 60 años tienen una menor función renal antes y después de la nefrectomía6,22, no se encontraron diferencias significativas en la proporción de función renal perdida respecto a los donantes más jóvenes. Dols et al.23 describieron que tras una disminución inicial en el FG, sin diferencias entre donantes mayores o menores de 60 años, no había evidencia de una pérdida acelerada de FG, manteniéndose la tendencia de disminución de 5-10ml/min por década descrita para la población general. Recientemente otro estudio confirmó que la tasa de compensación renal no difiere según la edad15. La mayoría de los trabajos no han demostrado un efecto del género per se en la evolución de la función renal tras la nefrectomía14,20,22. De igual manera, varias publicaciones asocian la raza afroamericana a peor evolución de la función renal a largo plazo24, aunque no se han podido demostrar diferencias a corto plazo tras la nefrectomía. Tampoco hay resultados unánimes sobre la hipertensión arterial20,25.
La principal limitación de nuestro estudio es su carácter observacional retrospectivo unicéntrico, con un limitado número de donantes. La escasa variabilidad étnica o la baja prevalencia de obesidad entre nuestros donantes no permite explorar adecuadamente el impacto de estos factores. Por otro lado, al no formar parte de nuestro protocolo de seguimiento al año de la donación no tuvimos oportunidad de emplear y comparar la tasa de compensación renal mediante FGm.
En nuestra experiencia, los donantes con mayor creatinina y menor FG basal son los que presentan mayor tasa de compensación renal en el mismo tiempo de seguimiento. Únicamente la función renal alcanzanzó significación como predictor de la tasa de compensación. Son necesarios mayores estudios y con tiempo de seguimiento más largo para evaluar la idoneidad de la tasa de compensación renal como criterio para evaluar la evolución de la función renal en donantes renales.
FinanciaciónEste estudio se ha podido realizar, en parte, gracias a la financiación de los proyectos FIS-FEDER PI13/00598, FIS-FEDER PI16/00617 y RETIC Redinren FEDER RD16/0009/0013 (RedinRen).
Conflicto de interesesLos autores declaran no tener conflicto de intereses relacionado con el contenido de este artículo.
Los autores agradecen a Sara Álvarez, Montserrat Folgueiras, Anna Faura, María Vera, Raquel Martín, Ernestina Junyent y a todo el equipo de enfermería nefrológica del Hospital del Mar su inestimable colaboración en este proyecto.
El estudio se ha realizado como parte de la tesis doctoral de Carla Burballa en la Universitat Autònoma de Barcelona.