La timoglobulina forma parte del esquema de inmunosupresión en receptores de trasplante renal de alto riesgo inmunológico. Hemos comparado, en un estudio observacional y prospectivo, la incidencia de rechazo agudo, de infecciones oportunistas y de neoplasias, así como la supervivencia del injerto y del receptor, entre un grupo de 50 receptores de alto riesgo inmunológico con tratamiento de inducción que incluía timoglobulina, frente a un grupo de bajo riesgo cuyos 50 receptores recibieron injertos procedentes de los mismos donantes, en nuestro hospital en el período 2002-2006. El grupo de alto riesgo estaba formado por receptores hiperinmunizados (>50%), retrasplantes con pérdida de injerto previa inmunológica, reactividad en prueba cruzada, raza negra, o alta incompatiblidad HLA. La inmunosupresión consistió en administrar timoglobulina a dosis que mantuvieran un recuento de linfocitos T inferior a 10 μl, FK a partir del día 5, micofenolato mofetil y esteroides, y los pacientes recibían profilaxis frente al CMV con ganciclovir. El grupo de bajo riesgo incluía los pacientes sin estas características, a quienes se les realizaba la inmunosupresión con ciclosporina A, micofenolato mofetil y prednisona. Todos los receptores seronegativos con donantes seropositivos recibieron valganciclovir durante 100 días. Se descartaron aquellos pacientes en quienes se perdió el injerto por causas técnicas en el postoperatorio inmediato, junto con sus parejas. En todos los receptores se llevó a cabo un seguimiento mínimo de un año posterior al trasplante, con una mediana de 41,7 meses. Los dos grupos eran homogéneos en cuanto a edad y sexo del donante, edad del receptor e incompatibilidades HLA, pero el porcentaje de receptores varones era significativamente superior en el grupo control. El porcentaje de retrasplantes y de receptores hiperinmunizados fue significativamente superior en el grupo de alto riesgo, de acuerdo con los criterios de selección del grupo. La incidencia de rechazo agudo histológicamente probado fue superior en el grupo control (el 30 frente al 6%; p =0,003) y no se han producido diferencias significativas en cuanto a la incidencia de infecciones oportunistas ni de neoplasias; se ha diagnosticado un caso de leucemia aguda y un caso de enfermedad linfoproliferativa en el grupo de bajo riesgo. La supervivencia de los pacientes fue del 97,9% en ambos grupos al año y a los 3 años, mientras que la supervivencia del injerto fue del 89,8 y del 84,8% en el grupo de alto riesgo frente al 93,8 y al 90,4% en el grupo sin riesgo al año y a los 3 años (p = NS). En nuestra experiencia, la evolución de receptores de trasplante renal con alto riesgo inmunológico es similar a la del grupo de riesgo normal mientras se utilice una inmunosupresión lo suficientemente potente, que condicionó una incidencia de rechazo agudo significativamente menor en el grupo de alto riesgo.
INTRODUCCIÓN
La timoglobulina es un agente linfocitario policlonal formado por una amplia variedad de anticuerpos específicos frente a varios marcadores de superficie celular linfocitarios: CD2, CD3, CD4, CD8, CD11a, CD18, CD25, HLA-DR y HLA clase I1. El tratamiento con anticuerpos policlonales induce una importante depleción de linfocitos T, con una notable variación interindividual2, por lo que su monitorización resulta esencial para evitar tanto la aparición de rechazo agudo como una excesiva inmunosupresión3,4.
Por su potencia, es un fármaco que forma parte del esquema de inmunosupresión en receptores de trasplante renal de alto riesgo inmunológico4,5, frente a los esquemas de inmunosupresión empleados en pacientes sin dicho riesgo inmunológico6,7. Los criterios de selección del grupo de alto riesgo se encuentran limitados por los pacientes quienes basándose en datos clínicos e inmunológicos son capaces, desde el punto de vista teórico, de desarrollar una respuesta inmunológica importante que condicionaría una alta tasa de rechazo agudo y de pérdida del injerto4,5,8.
Hemos comparado la incidencia de rechazo agudo, de infecciones oportunistas y de neoplasias no dermatológicas, así como la supervivencia del injerto y del receptor, entre un grupo de receptores de alto riesgo inmunológico con tratamiento de inducción en el que se incluía timoglobulina frente a un grupo de bajo riesgo cuyos pacientes recibieron injertos procedentes de los mismos donantes.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional y prospectivo, que se efectuó en receptores de un injerto renal que fueron sometidos al trasplante en nuestro hospital durante el período comprendido entre los años 2002 y 2006.
Todos los injertos procedían de donante cadáver; se trasplantaron 50 a pacientes considerados de alto riesgo inmunológico y su pareja a 50 receptores de bajo riesgo.
El grupo de alto riesgo inmunológico estaba formado por receptores hiperinmunizados (>50% de anticuerpos actuales frente apanel), retrasplantes con pérdida de injerto por causa previa inmunológica, reactividad en prueba cruzada, raza negra o alta incompatiblidad HLA a criterio del servicio de inmunología. La inmunosupresión consistió en la administración de timoglobulina a dosis que mantuvieran un recuento de linfocitos T inferior a 10 μl9, tacrolimus (FK) a partir del quinto día para alcanzar una concentración sérica de 12-15 ng/ml, micofenolato mofetil (MMF) en dosis de 1.000 mg/24 h y esteroides (1 mg/kg/24 h) en pauta decreciente. Todos los receptores recibieron profilaxis frente a CMV con ganciclovir durante el tiempo de tratamiento con timoglobulina. La dosis de ésta fue de 1-1,25 mg/kg y los receptores recibieron una media de 5,5 dosis/paciente.
En el grupo de bajo riesgo se incluían los pacientes sin las características mencionadas; su inmunosupresión se realizaba con ciclosporina A (CYA), MMF y esteroides (1 mg/kg/24 h) en pauta decreciente. La dosis de CYA se estableció para alcanzar valores, a las 2 h de la toma, de 1.700 ng/ml. La dosis de MMF fue de 2.000 mg/24 h y se redujo en caso de intolerancia o de leucopenia. Todos los pacientes CMV seronegativos con donante seropositivo en ambos grupos recibieron tratamiento profiláctico con valganciclovir durante 100 días. La infección por CMV se diagnosticó cuando el paciente desarrolló datos clínicos de infección en presencia de una antigenemia superior a 10 células/2.000.000 leucocitos.
Los episodios de rechazo agudo se diagnosticaron siempre siguiendo un estudio histológico, y los pacientes afectados recibieron tratamiento que consistió en la administración de 500 mg de metilprednisolona iv. al día durante 3 días. En caso de resistencia al tratamiento mencionado o en presencia de rechazo agudo de grados IIB o III de Banff, se administró tratamiento con timoglobulina con el mismo esquema de monitorización que en el tratamiento profiláctico9.
Los pacientes que perdieron el injerto por causas técnicas en el postoperatorio inmediato, junto con su pareja correspondiente, fueron descartados con anterioridad. Todos los receptores tenían un seguimiento mínimo de un año posterior al trasplante, con una mediana de 41,7 meses (percentil 25: 22,7; percentil 75: 57,2).
Estudio estadístico
La descripción de las características basales de los pacientes se realizó mediante porcentaje para variables cualitativas y para variables cuantitativas con distribución normal se efectuó la media con su desviación estándar, mientras que para las que no seguían la distribución normal se utilizó la mediana con sus percentiles. Se realizó la prueba de la chi cuadrado para variables cualitativas y para las variables cualitativas con distribución paramétrica la prueba de la t de Student. Se consideró estadísticamente significativa una p <0,05.
Se utilizó el método de Kaplan-Meier para estimar la función de supervivencia del conjunto de tiempos de supervivencia.
RESULTADOS
Los dos grupos eran homogéneos en cuanto a edad y sexo del donante, ya que compartían los mismos donantes, edad de receptor e incompatibilidades HLA, pero el porcentaje de receptores varones era significativamente superior en el grupo de bajo riesgo. El porcentaje de retrasplantes y de receptores hiperinmunizados fue significativamente mayor en el grupo de alto riesgo, de acuerdo con los criterios de selección del estudio (tabla 1).
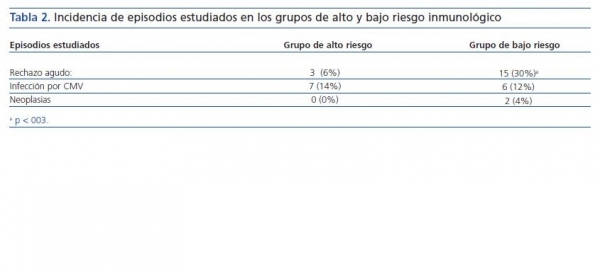
En relación con la incidencia de infección por CMV y la aparición de neoplasias no dermatológicas durante el seguimiento, no se observaron diferencias significativas (tabla 2).
El grupo de bajo riesgo presentó en su evolución dos neoplasias, una leucemia aguda, bajo inmunosupresión con CYA, MMF y esteroides sin ningún factor de riesgo sobreañadido, que precisó tratamiento quimioterápico y cambio de inmunosupresión a M-TOR (sirolimus) con buena evolución, y una enfermedad linfoproliferativa posterior al trasplante que cursó favorablemente a pesar de perder el injerto al minimizar la inmunosupresión y administrar tratamiento con rituximab. No se registró ningún episodio en el grupo de alto riesgo (tabla 2).
La incidencia de rechazo agudo fue significativamente superior (p <0,03) en el grupo de bajo riesgo inmunológico (tabla 2) y del 30 frente al 6% en el grupo de alto riesgo. En el grupo de bajo riesgo inmunológico hubo tres episodios de rechazo agudo resistente a corticoides que se resolvieron en los 3 receptores con tratamiento con timoglobulina.
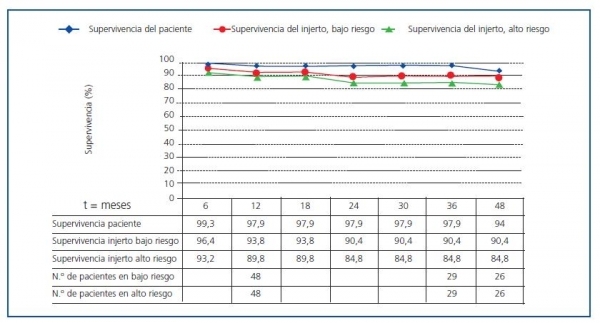
La supervivencia de los pacientes fue del 97,9% a los 12 y 36 meses en ambos grupos, mientras que la de los injertos fue del 89,8 y del 84,8% en el grupo de alto riesgo frente al 93,8 y al 90,4% en el grupo de bajo riesgo a los 12 y 36 meses (figura 1), sin que se detectaran diferencias significativas.
En el grupo de alto riesgo fallecieron 3 pacientes: dos con injerto funcionante a los 12 y 53 meses, y otro a los 42 meses tras haber perdido el trasplante a los 4 meses de forma crónica. Otros 5 receptores perdieron el injerto, uno de ellos al mes por rechazo agudo y los otros cuatro a los 4, 5, 17 y 24 meses de forma crónica, uno de ellos por mal cumplimiento del tratamiento. En el grupo de bajo riesgo, 2 pacientes fallecieron a los 2 y 37 meses por sepsis abdominal y por patología vascular con injerto funcionante, respectivamente. Otros 2 receptores perdieron los injertos de forma crónica a los 9 y 2 meses, este último al minimizar la inmunosupresión como tratamiento de una enfermedad linfoproliferativa difusa.
DISCUSIÓN
Los criterios de inclusión en el grupo de alto riesgo inmunológico fueron superponibles a los utilizados en otros estudios y a los empleados en la práctica clínica4,5,8 y permiten identificar a un grupo de pacientes con una teórica respuesta inmunológica alta. Algunos autores incluyen la función retardada del injerto en la valoración de un marcador (score) para su inclusión como paciente de alto riesgo4, aunque éste no es nuestro caso.
La tasa de rechazo agudo en nuestra serie fue del 6% en el grupo tratado con timoglobulina, resultado superponible a los de otras series publicadas con las mismas características de selección donante-receptor10, pero fue elevada en el caso del grupo de receptores de bajo riesgo, si se compara con otras series publicadas con el mismo esquema de inmunosupresión11. En este punto debemos insistir en que todos los rechazos agudos se diagnosticaron histológicamente, y no hemos encontrado una explicación a la discordancia de este dato. Esta alta tasa de rechazo agudo, junto con su menor incidencia recogida en la literatura con un régimen de inmunosupresión
basado en FK frente a ciclosporina6,7, conllevó el cambio de nuestro protocolo de inmunosupresión en los pacientes con un bajo riesgo inmunológico.
La incidencia de infección por CMV fue similar en ambos grupos. Este hecho se puede explicar por el uso de profilaxis con ganciclovir universal en el grupo de alto riesgo y también por la mayor incidencia de rechazo agudo en el grupo de bajo riesgo que, sin duda, condicionó un aumento de la inmunosupresión administrada a este grupo, lo cual confirma los datos publicados de que el rechazo agudo es un factor de riesgo para el desarrollo de infección por CMV12. El empleo profiláctico de valganciclovir en los receptores seronegativos con donantes seropositivos conllevó una baja incidencia de infección en este tipo de pacientes, hecho ya descrito por otros autores13.
La incidencia de neoplasias no dermatológicas en ambos grupos fue baja, nula en el grupo de alto riesgo, lo que sería achacable al número de pacientes de la serie y a que su seguimiento fue sólo a medio plazo. Es llamativo el hecho de que el único caso de enfermedad linfoproliferativa posterior al trasplante se produjo en el grupo de bajo riesgo inmunológico, cuando lo esperable hubiera sido encontrarlo entre los pacientes de alto riesgo, ya que estos receptores recibieron timoglobulina, fármaco considerado como factor de riesgo en el desarrollo de esta entidad14. En nuestra experiencia la incidencia de enfermedad linfoproliferativa es del 1,3%15, semejante a la referida en la literatura16 y no hemos encontrado en nuestra serie relación alguna entre dicha incidencia y la administración de anticuerpos monoclonales o policlonales15. La estrategia terapéutica ante la enfermedad linfoproliferativa posterior al trasplante consistente en la administración de rituximab y cambio de inmunosupresión a M-TOR está bien documentada en la literatura17, pero no fue una medida eficaz en nuestro paciente.
La supervivencia de pacientes y receptores fue similar en ambos grupos, y resultó elevada, aunque hay que tener en cuenta la exclusión en el estudio de todas las pérdidas precoces. Todo hace pensar en que el empleo de una inmunosupresión potente fue decisivo en la consecución de la supervivencia del injerto en el grupo de alto riesgo, aunque es de destacar que no condicionó un aumento de la mortalidad en dichos receptores. El hecho de efectuar una estrecha monitorización de la dosis de timoglobulina mediante el recuento de linfocitos T9 podría haber sido un factor importante, tanto en la baja incidencia de rechazo agudo como en la ausencia de efectos secundarios a la sobreinmunosupresión. En nuestra experiencia, la evolución de receptores de trasplante renal con alto riesgo inmunológico es similar a la del grupo sin riesgo, siempre que se utilice una inmunosupresión lo suficientemente potente, que conlleva una incidencia de rechazo agudo significativamente inferior en el grupo de alto riesgo.
Tabla 1.
Tabla 2.
Figura 1.