Introducción y objetivos: Se ha descrito que el nivel de anticuerpos circulantes contra el receptor tipo M de la fosfolipasa A2 tiene correlación significativa con la actividad clínica de la enfermedad en la nefropatía membranosa idiopática (NMI). Sin embargo, la utilidad de la monitorización del título de anticuerpos como predictor de respuesta clínica tras el inicio del tratamiento no ha sido formalmente analizada. En el siguiente estudio se analiza el valor predictivo de la evolución del título de anticuerpos anti-PLA2R sobre la respuesta clínica en enfermos con NMI tratados con tacrolimus. Pacientes y métodos: 36 enfermos con síndrome nefrótico secundario a NMI, con criterios de indicación de tratamiento inmunosupresor, fueron tratados con tacrolimus en monoterapia. Se determinó el nivel de anticuerpos anti-PLA2R antes del tratamiento y a los 3, 6, 9 y 12 meses tras su inicio. Se analizó el valor predictivo de la pendiente de reducción en el título de anticuerpos y de la reducción absoluta y relativa en el título de anticuerpos a los 3 y 6 meses sobre el tiempo hasta la remisión y sobre la probabilidad de remisión a los 6, 9 y 12 meses. Resultados: La reducción relativa en el título de anticuerpos anti-PLA2R fue significativamente mayor en los enfermos que presentaron remisión y precedió a la respuesta clínica. No se apreció asociación entre el título de anticuerpos previo al tratamiento con el tiempo medio de respuesta o la respuesta a los 12 meses. La pendiente de reducción en el título de anticuerpos se asoció significativamente con el tiempo hasta la evidencia de remisión. La reducción relativa en el título de anticuerpos anti-PLA2R a los 3 meses tuvo una elevada sensibilidad y especificidad para predecir la respuesta a los 6 y 9 meses, pero no a los 12 meses, mientras que la reducción relativa en el título de anticuerpos a los 6 meses tuvo una elevada sensibilidad y especificidad para predecir la respuesta a los 12 meses. Conclusión: En enfermos con NMI asociada a anticuerpos anti-PLA2R, la monitorización del título de anticuerpos tras el inicio del tratamiento es útil para estimar el período de tiempo hasta la remisión y para predecir la probabilidad de remisión a los 12 meses.
Introduction and objectives: The level of circulating antibodies against M-type phospolipase A2 receptor has been reported as having a significant correlation with clinical activity in idiopathic membranous nephropathy. However, the usefulness of monitoring antibody titre as a predictor of clinical response following the onset of treatment has not been formally analysed. The predictive value of the evolution of anti-PLA2R antibody titre on the clinical response of idiopathic membranous nephropathy patients treated with tacrolimus is analysed in the following study. Patients and method: 36 patients with nephrotic syndrome secondary to idiopathic membranous nephropathy with immunosuppressive treatment indication criteria were treated with tacrolimus in monotherapy. The level of anti-PLA2R antibodies was determined before treatment and at 3, 6, 9 and 12 months after the onset of treatment. The study analysed the predictive value of the reduction in antibody titre and the relative and absolute reduction in antibody titre at 3 and 6 months over the period until remission and on the probability of remission at 6, 9 and 12 months. Results: The relative reduction in the anti-PLA2R antibody titre was significantly greater in those patients with remission and it preceded the clinical response. No association was observed between the antibody titre prior to treatment and the mean response time or the response at 12 months. Reduction in antibody titre is significantly associated with the time until signs of remission. Relative reduction in anti-PLA2R antibody titre at 3 months had a high sensitivity and specificity to predict the response at 6 and 9 months, but not at 12 months; however the relative reduction in the antibody titre at 6 months had a high sensitivity and specificity for predicting the response at 12 months. Conclusion: In patients with IMN associated with anti-PLA2R antibodies, the monitoring of antibody titre following the onset of treatment is useful for estimating the time period until remission and predicting the probability of remission at 12 months.
INTRODUCCIÓN
La nefropatía membranosa idiopática (NMI) es una enfermedad mediada por anticuerpos, causada por depósitos de IgG y C3 en el espacio subepitelial de la membrana basal glomerular1,2. En la actualidad, hay acuerdo en que los enfermos con función renal normal en los que el síndrome nefrótico persiste más de 6-12 meses tras el diagnóstico son candidatos a recibir terapia inmunosupresora. Los fármacos cuya eficacia ha sido contrastada en ensayos clínicos aleatorios y se consideran de elección como primera línea de tratamiento son los agentes alquilantes asociados a esteroides y los anticalcineurínicos3,4. Ambos tratamientos poseen una eficacia probada y similar para inducir remisión del síndrome nefrótico y preservar la función renal, pero tienen algunas limitaciones. En primer lugar, aproximadamente un 20 % de los enfermos pueden presentar resistencia a uno o a ambos fármacos3-13. En segundo lugar, la evidencia disponible indica que, tras el inicio de la terapia, la probabilidad de respuesta aumenta de forma progresiva con el tiempo, incluso más allá del período de exposición al fármaco5-13, y en la actualidad no hay ninguna variable que permita predecir si el enfermo responderá o no al tratamiento ni el momento en el que se va a producir la respuesta. Recientemente, se ha identificado al receptor tipo M de la fosfolipasa A2 como uno de los antígenos diana de la respuesta autoinmune en enfermos con NMI14-16 y se ha descrito que los anticuerpos circulantes frente a este (anti-PLA2R), presentes en aproximadamente el 70-75 % de los enfermos, tienen correlación significativa con la actividad clínica de la enfermedad17,18. Por ello, la evolución del título de anticuerpos anti-PLA2R tras el inicio del tratamiento podría ser útil para predecir la respuesta. Algunas evidencias indican que tras el tratamiento con rituximab la reducción en el título de anticuerpos precede a la remisión de la proteinuria19. Sin embargo, la utilidad de la monitorización del título de anticuerpos como predictor de respuesta clínica no ha sido formalmente analizada y no se dispone de datos sobre la evolución del título de anticuerpos anti-PLA2R en enfermos tratados con tacrolimus.
En el presente estudio, se realizaron determinaciones repetidas del título de anticuerpos anti-PLA2R antes y durante los 12 meses siguientes al inicio del tratamiento en enfermos afectos de NMI que recibieron tacrolimus, con el objetivo de analizar el valor predictivo de la evolución del título de anticuerpos anti-PLA2R sobre la respuesta clínica.
PACIENTES Y MÉTODOS
Se incluyeron un total de 36 enfermos que cumplieron los siguientes criterios: 1. Edad > 18 años. 2. Síndrome nefrótico causado por NMI confirmada por biopsia renal. 3. Exclusión de etiologías secundarias. 4. Títulos de anticuerpos anti-PLA2R > 20 RU/ml en el momento del diagnóstico. 5. Criterios de tratamiento inmunosupresor por persistencia del síndrome nefrótico tras 6 meses de tratamiento sintomático con bloqueantes de angiotensina II, estatinas, diuréticos y dieta hiposódica, de acuerdo con las guías de tratamiento3,4. 6. Función renal normal, definida por un valor de CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) > 60 ml/min/1,73 m2.
Las biopsias renales fueron teñidas con hematoxilina-eosina, PAS, metenamina de plata y tricrómico de Masson para análisis morfológico, y se realizaron estudios de inmunofluorescencia con anticuerpos frente a IgA, IgG, IgM, C3, fibrinógeno y cadenas ligeras. El diagnóstico de NMI se realizó ante la presencia de un patrón morfológico compatible, asociado a la evidencia de depósitos subepiteliales de IgG y C3 en la inmunofluorescencia.
Al momento del diagnóstico, los pacientes recibieron tratamiento con inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de angiotensina II, dieta hiposódica y tratamiento de la dislipemia con estatinas. Tras un período de observación de 6 meses y después de constatarse ausencia de remisión espontánea, todos los enfermos recibieron tratamiento con tacrolimus en monoterapia en una dosis inicial de 0,06 mg/kg/día, que se ajustó posteriormente para mantener niveles diana a las 12 horas de 7-9 ng/ml. Ningún paciente había recibido previamente terapia inmunosupresora. El tratamiento con tacrolimus se mantuvo durante tres meses tras la evidencia de remisión o un máximo de 12 meses en los casos en los que al final de este período no entraron en remisión. Tras evidencia de remisión total o parcial, la dosis de tacrolimus se redujo a razón de un 30 % cada mes hasta la supresión total o la presencia de recidiva.
Por protocolo, todos los enfermos fueron controlados con frecuencia mensual hasta la evidencia de remisión y, en caso de remisión, cada 2-3 meses hasta la supresión del tratamiento, evidencia de recidiva o ausencia de respuesta a los 12 meses. En todos los enfermos incluidos se dispone de muestras de suero extraídas antes y tras el inicio del tratamiento, con frecuencia trimestral hasta finalizar el primer año de evolución. Dichas muestras fueron utilizadas para la determinación del título de anticuerpos anti-PLA2R mediante ELISA (Euroimmun, Lübeck, Alemania; linealidad: 6-1500 RU/ml; límite inferior de detección 0,6 RU/ml).
Como variables de resultado, se consideró la probabilidad de obtener remisión total o parcial en el transcurso de los 12 meses siguientes al inicio del tratamiento, el tiempo entre el inicio de este y la evidencia de remisión, la evolución del título de anticuerpos a lo largo del período de observación y el porcentaje de enfermos que presentaron negativización del título de anticuerpos al final del período de observación de 12 meses.
Definiciones:
- Remisión completa: proteinuria < 0,3 g/día, albúmina > 3,5 g/dl y filtrado glomerular > 60 ml/min/1,73 m2.
- Remisión parcial: reducción > 50 % de la proteinuria basal, siendo la última < 3,5 g/día y con filtrado glomerular > 60 ml/min/1,73 m2.
- No respuesta: ausencia de remisión completa o parcial 12 meses tras el inicio del tratamiento.
- Negativización del título de anticuerpos: título de anticuerpos anti-PLA2R < 20 RU/ml.
El presente trabajo siguió los parámetros de la Declaración de Helsinki. Todos los pacientes otorgaron consentimiento informado por escrito y el comité de bioética del centro aprobó el estudio.
Análisis estadístico
Los resultados se expresan como media y desviación típica para las variables de distribución normal o como mediana y cuartiles para las de distribución no normal. Las diferencias en proporciones se analizaron mediante la prueba de χ2 o el test exacto de Fisher. El análisis de la evolución del título de anticuerpos a lo largo del tiempo se realizó mediante análisis de la varianza para medidas repetidas. Para examinar el valor predictivo de la reducción en el título de anticuerpos sobre la respuesta, se calculó la reducción absoluta y relativa del título de anticuerpos a los 3 y 6 meses, en relación con el valor basal, así como la pendiente de reducción en el título de anticuerpos durante el período de seguimiento, expresándola en RU/ml/mes. Se realizó un análisis univariado para identificar las variables asociadas a la probabilidad de remisión a lo largo del período de observación de 12 meses mediante el método de Kaplan-Meier, utilizando la prueba de log-rank para comparar entre grupos. La relación entre la pendiente de reducción en el título de anticuerpos y el tiempo hasta evidencia de remisión se llevó a cabo mediante regresión lineal simple. Mediante curvas ROC, se analizó el valor de reducción del título de anticuerpos anti-PLA2R a los 3 y 6 meses con mayor sensibilidad y especificidad para identificar a los pacientes en remisión a los 3, 6, 9 y 12 meses. Se consideraron estadísticamente significativos todos los valores de p < 0,05. Se utilizó el programa estadístico SPSS versión 20.0.
RESULTADOS
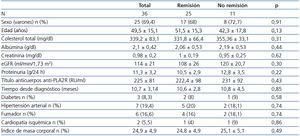
En la tabla 1, se resumen las características clínicas y bioquímicas basales del total de los enfermos incluidos en el estudio y en función de la respuesta al tratamiento a los 12 meses. No se apreciaron diferencias significativas en ninguna de las variables analizadas entre aquellos que respondieron y los que no.
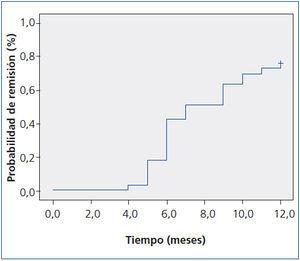
En el transcurso de los 12 meses de seguimiento (figura 1), la probabilidad de remisión aumentó de forma progresiva a lo largo del tiempo, con una probabilidad de remisión del 40 % a los 6 meses, del 60 % a los 9 meses y del 69,4 % (25/36 enfermos) a los 12 meses. Del total de los enfermos en remisión, 9 (25 %) presentaron remisión total y 16 (75 %) remisión parcial. La mediana de tiempo entre el inicio del tratamiento y la evidencia de remisión fue de 8,5 meses (rango intercuartil: 5,5-9,6 meses). El porcentaje de enfermos que se hallaban en remisión total o parcial sin tratamiento con tacrolimus a los 12 meses fue del 28 % (7/25). La dosis media de tacrolimus fue de 0,05 ± 0,017 mg/kg/día y los niveles medios 7,9 ± 1,9 ng/ml, sin diferencias significativas entre los que respondieron y los que no. Durante el período de observación, ningún enfermo presentó recidiva al suspender la terapia con tacrolimus.
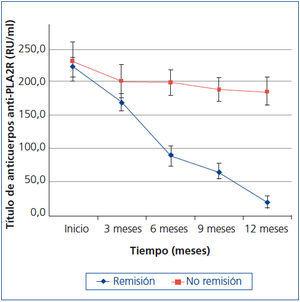
En la figura 2, se representa la evolución del título de anticuerpos en función de la respuesta al tratamiento en el conjunto de los 36 enfermos estudiados. En relación con el valor basal, en el conjunto de los enfermos, la reducción relativa en el título de anticuerpos al final del período de observación de 12 meses fue del 61,3 ± 37 % (p: 0,004). No hubo diferencias en los niveles basales de anticuerpos entre los enfermos que entraron en remisión y los que no. Tras el tratamiento, el título de anticuerpos a los 3, 6, 9 y 12 meses fue significativamente inferior en aquellos que presentaron remisión total o parcial (F: 25,9, p: 0,000) frente a los que no respondieron. El título medio de anticuerpos anti-PLA2R en el momento de la remisión fue de 17,4 ± 8,3 RU/ml. Veinte de los 25 (80 %) enfermos que entraron en remisión presentaban un título de anti-PLA2R < 20 RU/ml en el momento de la remisión. En la figura 3 se representa la evolución del título de anticuerpos anti-PLA2R y de la proteinuria en los enfermos que no respondieron al tratamiento. En ella puede apreciarse una reducción estadísticamente significativa en el título de anticuerpos entre el nivel basal y el tercer mes (18,5 ± 4,8 %, p: 0,037) y una reducción acumulada en el título de anticuerpos a los 12 meses del 21,4 ± 13,6 %. La pendiente de reducción en el título de anticuerpos durante los 12 meses de seguimiento en los enfermos que no respondieron fue de -7,53 ± 5,50 RU/ml/mes. A lo largo del período de seguimiento, no se apreciaron cambios significativos en la excreción urinaria de proteínas.
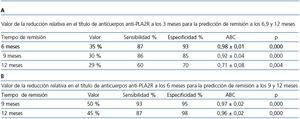
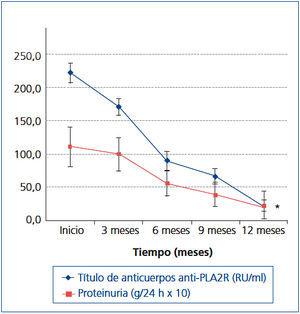
En la figura 4, se representa la evolución del título de anticuerpos anti-PLA2R y de la proteinuria en los enfermos que presentaron remisión. La reducción relativa en el título de anticuerpos precedió a la disminución en la proteinuria y fue estadísticamente significativa a partir del tercer mes. La reducción relativa en el título de anticuerpos a los 3 meses fue del 35 ± 18,4 % al tercer mes, del 60 ± 16,4 % en el sexto, del 70 ± 12 % en el noveno mes y del 78,9 ± 14,2 % a los 12 meses. La pendiente de reducción en el título de anticuerpos a lo largo del período de observación en los enfermos que respondieron fue de -21,5 ± 3,78 RU/ml/mes. Mediante análisis de regresión simple, se apreció una relación estadísticamente significativa entre el ritmo de reducción en el título de anticuerpos y el tiempo hasta remisión (tabla 2). En la tabla 3 A, se resume el valor de la reducción relativa en el título de anticuerpos a los tres meses sobre la predicción de respuesta al tratamiento a los 6, 9 y 12 meses. En la tabla 3 B, se resume el valor de la reducción relativa en el título de anticuerpos a los 6 meses sobre la predicción de respuesta al tratamiento a los 9 y 12 meses. Puede apreciarse que la reducción relativa en el título de anticuerpos a los 3 meses tiene una elevada sensibilidad y especificidad para predecir la respuesta a los 6 y 9 meses, pero no a los 12 meses, mientras que la reducción relativa en el título de anticuerpos a los 6 meses tiene una elevada sensibilidad y especificidad para predecir la respuesta a los 9 y 12 meses.
DISCUSIÓN
En el presente estudio, se realizaron determinaciones repetidas del título de anticuerpos anti-PLA2R antes y durante los 12 meses siguientes al inicio del tratamiento en enfermos afectos de NMI que recibieron tacrolimus como primera línea terapéutica, con el objetivo de analizar el valor predictivo de la evolución del título de anticuerpos anti-PLA2R sobre la respuesta clínica. El grupo de enfermos incluido estuvo integrado por una muestra no seleccionada de enfermos con NMI asociada a anticuerpos anti-PLA2R que fueron tratados siguiendo un mismo protocolo, tras un intervalo de tiempo prolongado de tratamiento sintomático desde el diagnóstico acorde al recomendado en diferentes guías3,4. El período de observación se limitó a 12 meses, debido a que este es el período máximo en el que se mantuvo la monoterapia con tacrolimus en caso de no apreciarse respuesta. Tanto la probabilidad de remisión observada a lo largo del tiempo como el porcentaje de enfermos en remisión a los 12 meses observados en nuestros enfermos fueron muy similares a los descritos en estudios previos con anticalcineurínicos11-13. Por estas razones, los resultados observados en nuestros enfermos podrían ser extrapolables a otros grupos de enfermos con NMI que reciban tacrolimus.
Los resultados de nuestro estudio aportan los siguientes datos de interés clínico. En primer lugar, de forma similar a los datos descritos tras tratamiento con rituximab19,20, indican que en enfermos tratados con tacrolimus la reducción en el título de anticuerpos anti-PLA2R tras el inicio del tratamiento precede a la remisión de la proteinuria y se relaciona con la respuesta clínica. La evidencia de una reducción progresiva en el título de anticuerpos tuvo un alto valor predictivo de remisión, mientras que la persistencia de títulos elevados se asoció a persistencia de síndrome nefrótico, con diferencias estadísticamente significativas en el título de anticuerpos entre enfermos con y sin respuesta que fueron evidentes a partir del tercer mes y se mantuvieron a lo largo de todo el período de observación. Además, en los enfermos que respondieron, el ritmo de descenso en el nivel de anticuerpos se asoció con la rapidez de la respuesta clínica. Ambos datos indican que la monitorización del título de anticuerpos anti-PLA2R tras el inicio del tratamiento posee utilidad en la práctica clínica y puede tener dos implicaciones prácticas. La primera es que el ritmo de reducción en el título de anticuerpos tras el inicio del tratamiento puede ser utilizado como estimador del tiempo de respuesta. La segunda es que la reducción relativa en el título de anticuerpos a los 3 y 6 meses puede servir de guía para predecir la probabilidad de respuesta. Dado que la evidencia disponible indica que la respuesta al tratamiento con tacrolimus aumenta progresivamente con el tiempo de exposición al fármaco13 y que ninguna de las características clínicas o bioquímicas basales permiten predecir la probabilidad de respuesta al tratamiento, en los enfermos que presentan respuestas tardías un valor en la reducción relativa en el título de anticuerpos igual o superior al 50 % a los 6 meses puede ser un criterio útil para tomar la decisión de mantener la terapia inmunosupresora, mientras que la persistencia de reducciones menores a esta cifra a los 6 y 9 meses debe sugerir una alta probabilidad de resistencia al tratamiento.
La NMI es una glomerulopatía mediada por anticuerpos. En el 70 % de los casos aproximadamente, dichos anticuerpos se hallan dirigidos contra el receptor tipo M de la fosfolipasa A2. En un 30 %, dichos anticuerpos no son identificados bien sea en forma circulante o depositados en la membrana basal glomerular. La identidad de los anticuerpos que constituyen los depósitos inmunes responsables del daño y disfunción glomerular en estos casos es por el momento incierta. Los anticalcineurínicos (ciclosporina y tacrolimus) inducen regulación hacia bajo (downregulation) de una serie de citocinas sintetizadas por los linfocitos T cooperadores (T-h1 y T-h2) y las células presentadoras de antígeno; particularmente, la interleucina-2, la cual entre otras funciones se halla involucrada en la activación de los linfocitos B y la producción subsecuente de anticuerpos21. Este sería el mecanismo fundamental a través del cual la terapia con anticalcineurínicos induce el descenso observado en los títulos de anti-PLA2R y su correlación con la remisión.
En resumen, nuestros datos indican que en enfermos con NMI la pendiente de reducción en el título de anticuerpos anti-PLA2R se asocia significativamente con el tiempo hasta la evidencia de remisión. Además, la reducción relativa en el título de anticuerpos anti-PLA2R a los 3 meses tiene una elevada sensibilidad y especificidad para predecir la respuesta a los 6 y 9 meses, pero no a los 12 meses, mientras que la reducción relativa en el título de anticuerpos a los 6 meses tiene una elevada sensibilidad y especificidad para predecir la respuesta a los 9 y 12 meses. Estos datos pueden ser de utilidad en el seguimiento clínico de los enfermos tras el inicio de la terapia y tener especial relevancia en los casos en los cuales, como se ha propuesto recientemente22,23, se plantee planificar las decisiones en cuanto al tratamiento en el título de anticuerpos anti-PLA2R.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 2. Relación entre la pendiente de reducción en el título de anticuerpos y el tiempo hasta remisión en enfermos con respuesta al tratamiento
Tabla 3. Valor de la reducción relativa en el nivel de anticuerpos anti-PLA2R en relación con el título basal y en la predicción de remisión a los 6, 9 y 12 meses
Tabla 1. Características clínicas y bioquímicas basales y respuesta terapéutica
Figura 1. Probabilidad de remisión y tiempo en la muestra estudiada.
Figura 2. Título de anticuerpos anti-PLA2R y remisión en la muestra estudiada.
Figura 3. Evolución de la proteinuria y título de anticuerpos anti-PLA2R en los pacientes sin remisión en el período de observación.
Figura 4. Evolución de la proteinuria y título de anticuerpos anti-PLA2R en los pacientes con remisión en el período de observación.