Entre los puntos clave de una consulta monográfica de acceso vascular (AV) se encuentran una adecuada valoración preoperatoria, así como una correcta gestión y optimización de las listas de espera. El principal objetivo fue evaluar el grado de concordancia explorador/dependiente entre nefrología y cirugía vascular en una consulta externa monográfica respecto al AV finalmente implantado.
Material y métodosSe analizaron todos los AV creados o reparados quirúrgicamente entre los años 2021 y 2022. Se comparan las diferencias en las variables preoperatorias entre los grupos en los que las valoraciones entre ambos equipos fueron coincidentes y no coincidentes, la cirugía indicada y la permeabilidad primaria (PP) y secundaria (PS) durante el período de seguimiento (curvas de Kapplan-Meier y Log-rank test, y análisis de regresión de Cox). P significativa ≤0,05.
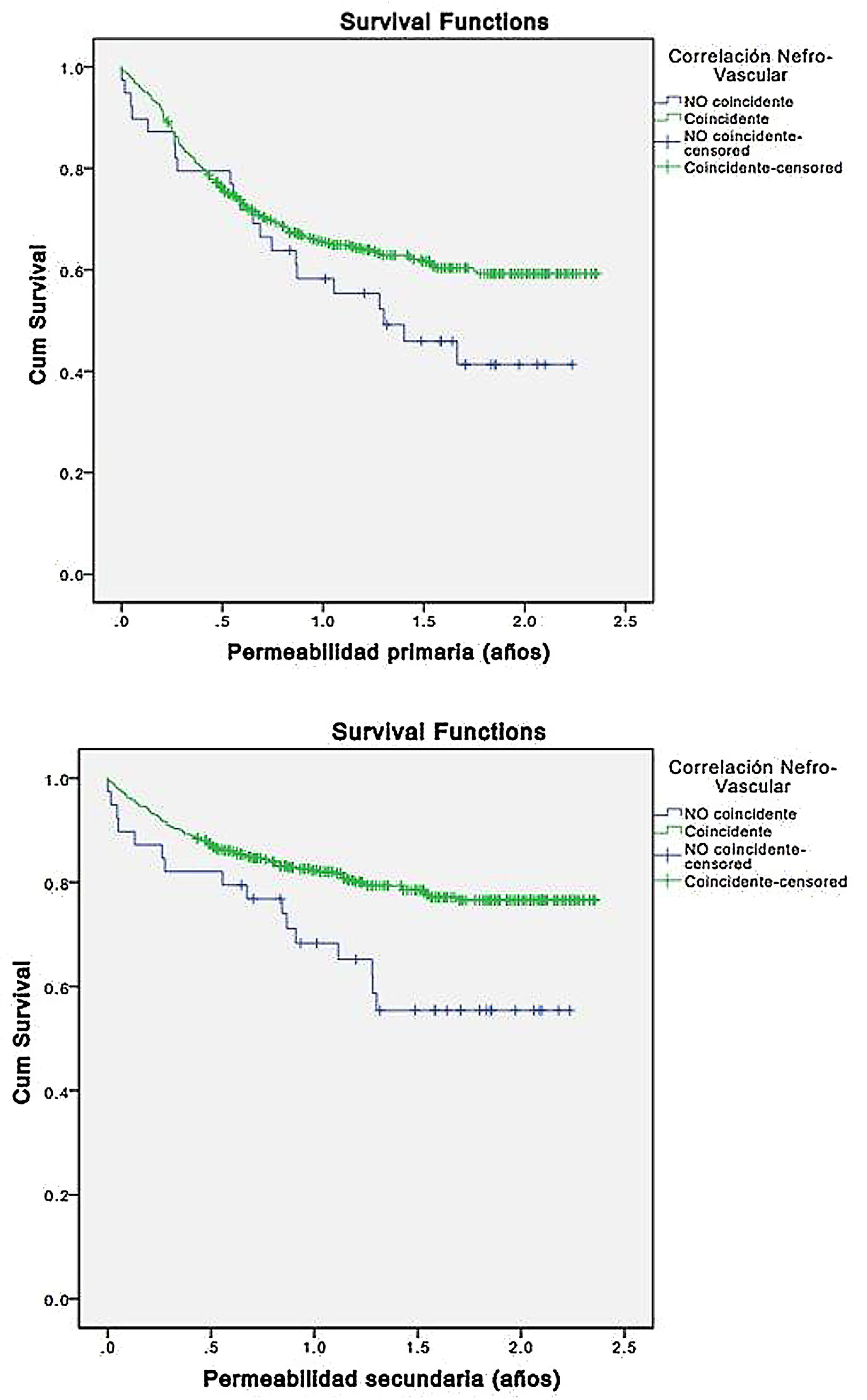
ResultadosSe han analizado un total de 605 creaciones o reparaciones de AV: 74 ligaduras (12,2%), 207 FAVn distales (34,3%), 237 FAVn proximales (39,2%), 35 reparaciones (5,7%), 41 FAVp (6,7%) y 11 otros procedimientos (1,9%). Tras un tiempo medio en lista de espera de 16,5±11,6 días, excluyendo las ligaduras, se observó una adecuada maduración al mes en el 87,6% de los casos. En el seguimiento postoperatorio se realizaron un total de 158 procedimientos endovasculares y 17 reparaciones quirúrgicas. Las permeabilidades primarias (PP) y secundaria (PS) a 6, 12 y 24 meses, fueron PP: 76,2, 64,9 y 57,5% y PS: 86,4, 81,2 y 74,7%, respectivamente. Del total de los procedimientos nefrología obtuvo respecto a cirugía vascular un adecuado grado de concordancia en el 93,6% de los casos (índice kappa: 0,886). Los factores preoperatorios significativos entre los casos coincidentes y no coincidentes fueron la edad (p=0,022) y el diámetro arterial (p=0,032). El subgrupo de valoraciones no coincidentes entre nefrología y cirugía vascular (39 casos), presentaron una similar PP (a 2 años: 59,2 vs. 41,3%; p=0,099), pero peor PS (a 2 años: 76,6 vs. 55,4%; p=0,005).
ConclusionesNo se observaron diferencias significativas observador dependiente (nefrólogo vs. cirujano vascular) en la toma de decisiones en cuanto al acto quirúrgico a realizar (93,6% de coincidencia), y los casos discordantes presentaron peor PS. Tras una formación específica, el equipo de coordinación de nefrología puede realizar una adecuada optimización de los recursos socio sanitarios reservando las derivaciones a cirugía vascular para aquellos casos de mayor complejidad.
The key points of a monographic vascular access (VA) consultation are an adequate preoperative assessment, as well as a correct management and optimization of waiting lists. Our main objective of present study was to evaluate the degree of exploratory-dependent concordance in outpatient clinics regarding implanted VA, between nephrology and vascular surgery.
Materials and methodsWe analyzed VA created or surgically repaired between 2021 and 2022. We compared the differences in the preoperative variables between the groups in which the assessments between the two teams were coincident and non-coincident, and the primary (PP) and secondary (PS) patencies during the follow-up period (Kapplan-Meier curves and Log-rank test, and Cox regression analysis). Significant P≤.05.
ResultsA total of 605 VA creations or repairs were analyzed: 74 ligations (12.2%), 207 distal arterio-venous fistulaes (AVF) (34.3%), 237 proximal AVF (39.2%), 35 repairs (5.7%), 41 grafts (6.7%) and 11 others (1.9%). After an average waiting list time of 16.5±11.6 days, excluding ligations, adequate 1-month maturation was observed in 87.6% of cases. A total of 158 endovascular procedures and 17 surgical repairs were performed during postoperative follow-up. Primary (PP) and secondary (PS) patencies at 6, 12 and 24 months were PP: 76.2%, 64.9%, 57.5% and PS: 86.4%, 81.2%, 74.7%, respectively. Of the total number of procedures, nephrology obtained an adequate degree of agreement in 93.6% of the cases (kappa index: 0.886). The preoperative factors associated with greater discrepancies in assessments were age (P=.022) and arterial diameter (P =.032). The subgroup of non-matched assessments between nephrology and vascular surgery (39 cases) presented a similar PP (at 2 years: 59.2% vs 41.3%, P =.099) but worse PS (at 2 years: 76.6% vs 55.4%, P =.005).
ConclusionsNo significant observer-dependent differences (nephrologist vs. vascular surgeon) were observed in decision-making regarding the surgical procedure to be performed (93.6% agreement), and discordant cases presented worse secondary patency. After specific training, the nephrology coordination team can make a proper optimisation of social and health resources by reserving referrals to vascular surgery for those cases of greater complexity.
Diferentes estudios han evidenciado como los pacientes en hemodiálisis portadores de fístulas arterio-venosas nativas (FAVn) como acceso vascular (AV) definitivo, presentan un mayor tiempo de permeabilidad y menor número de complicaciones asociadas1,2. Las actuales guías clínicas españolas de AV recomiendan la creación de diferentes equipos multidisciplinares dedicados al AV integrados por nefrólogos, cirujanos vasculares, radiólogos intervencionistas y enfermería nefrológica de practica avanzada3. En este sentido diferentes publicaciones, concluyen como la coordinación entre las diferentes especialidades permite obtener una mejor optimización de los resultados en el campo del AV4–7.
Dentro de los principales objetivos de toda unidad funcional de acceso vascular (UFAV), se encuentra el fomentar la implantación de la FAVn. Alguno de los factores modificables más importantes son el contar con un equipo experimentado e implicado de cirugía vascular8,9, una remisión temprana y precoz a las consultas de enfermedad renal crónica avanzada (ERCA)10, así como la modificación de los diferentes modelos organizativos encaminados a una mejor optimización de los resultados en el ámbito de los accesos vasculares11. Además de la evolución y de la progresión de la función renal, deberán ponerse en consideración otros factores intrínsecos a cada centro hospitalario, como son la gestión de los tiempos de espera del servicio de cirugía vascular o las características intrínsecas de cada paciente12. Sin duda alguna, todos estos factores permitirían obtener un menor número de pacientes portadores de catéteres venosos centrales y de negativas para la implantación de FAVn. Este último factor es de gran importancia, pues según el reciente artículo publicado por Arenas MD et al.13, la negativa del paciente representa la principal causa (36%) para no alcanzar los estándares de AV propuestos por las actuales guías españolas de AV3.
En este contexto de creciente demanda asistencial, una de las principales amenazas del sistema representa la sobresaturación de las consultas externas de cirugía vascular. Dada la implementación de una consulta monográfica y multidisciplinar del AV en la que intervienen diferentes profesionales, se hipotetizó que una correcta valoración por parte del equipo de nefrología podría ayudar a descongestionar la presión asistencial de cirugía vascular. En este sentido, el objetivo primario del presente estudio fue evaluar el grado de concordancia entre nefrólogos y cirujanos vasculares en relación con el procedimiento quirúrgico vascular indicado desde las consultas externas y finalmente realizado. De forma secundaria también se analizaron aquellos factores preoperatorios entre los casos coincidentes y no coincidentes. Según nuestro conocimiento este es el primer estudio que evalúa este nuevo rol del equipo de coordinación de una unidad funcional de AV desde esta perspectiva.
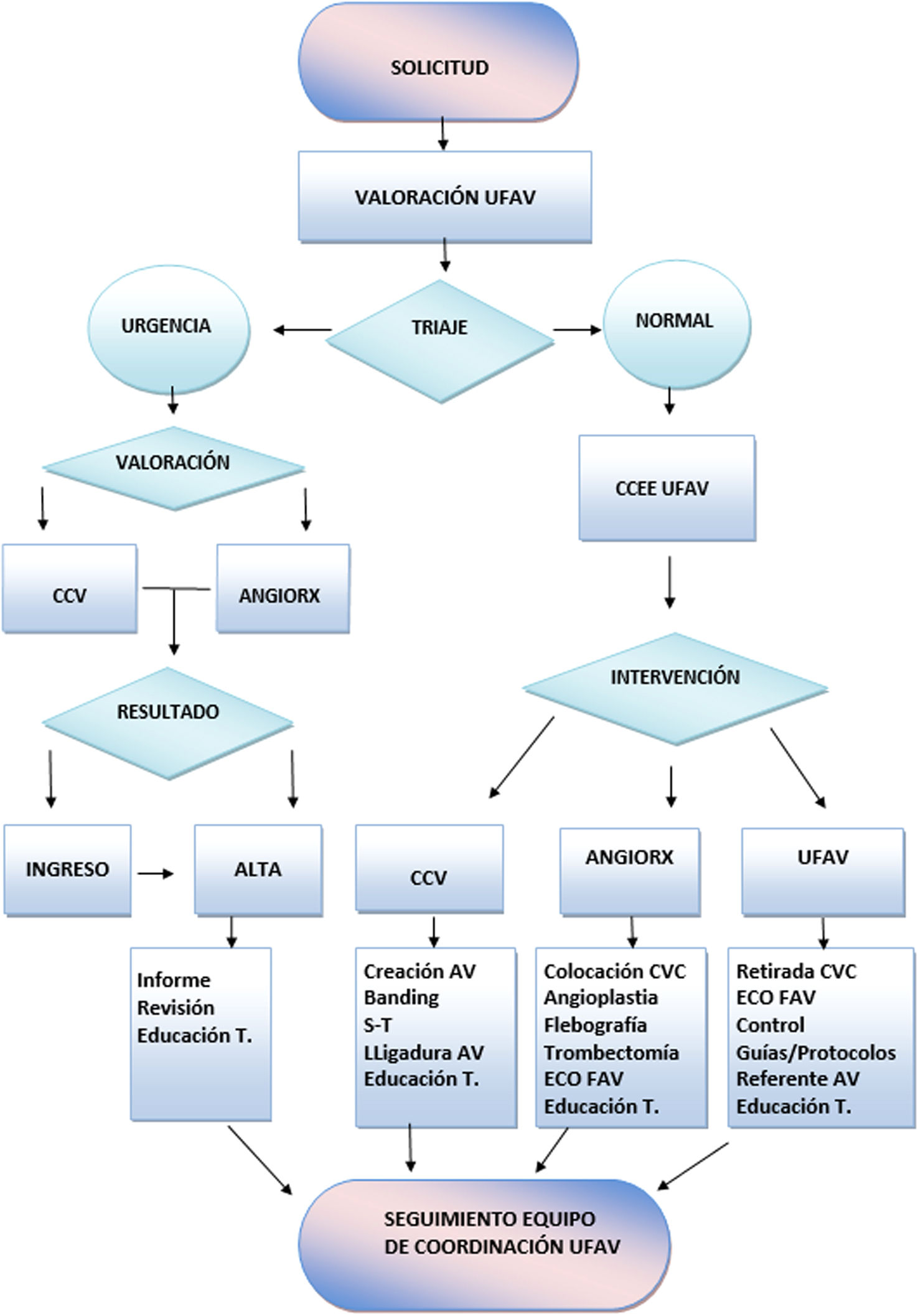
Material y métodosLa UFAV de nuestro centro se encuentra integrada por un equipo de coordinación formado por nefrología (nefrólogo y enfermería nefrológica de practica avanzada) que establece una atención integral y multidisciplinaria con el resto de los especialistas en el campo del AV. Nuestra unidad atiende a diferentes pacientes tanto de nuestra zona asistencial directa como de soporte para otros centros de Cataluña, representando esta última un 45-50% de la actividad quirúrgica total. En la figura 1 mostramos un esquema sobre el funcionamiento de nuestra unidad vascular. Entre los diferentes recursos, contamos con 2 consultas monográficas semanales con el soporte de cirugía vascular en otra planta para la derivación de consultas de mayor complejidad el mismo día, con el objetivo de evitar nuevas citaciones y desplazamientos para el paciente. Nuestra dotación quirúrgica es de 10-11 quirófanos mensuales destinados a la realización de procedimientos quirúrgicos de AV (3-4 procedimientos/quirófano), de los cuales, aproximadamente la mitad con recurso de anestesiología.
Entre los años 2021 y 2022 se evaluaron un total de 605 procedimientos quirúrgicos o reparaciones realizadas en nuestra UFAV. Se analizaron todos los pacientes que fueron valorados por nuestra unidad, y posteriormente intervenidos quirúrgicamente para la creación o reparación de un AV. Se registraron y analizaron diferentes datos sociodemográficos, clínicos y tiempo en lista de espera. Todos los pacientes fueron valorados de forma independiente por el equipo de nefrología (coordinador médico de la unidad) y posteriormente por el equipo de cirugía vascular (cirugía finalmente realizada), realizando una exploración física y ecográfica sistemática siguiendo nuestro protocolo de evaluación preoperatoria basada en las recomendaciones de las guías de la GEMAV3 y ESVS14; finalmente, se registró la propuesta de creación de AV de cada equipo. En los casos valorados en consultas externas solo por el equipo de nefrología se programó el acto quirúrgico con la propuesta indicada. El mismo día de la intervención los cirujanos vasculares realizaron un mapeo ecográfico en el quirófano validando o no la propuesta previa realizada en consultas por el equipo de coordinación de nefrología. En función de estos datos, se definieron los casos coincidentes y los no coincidentes entre ambos grupos considerándose la localización (distal vs. proximal), lateralidad, indicación de creación, ligadura o reparación.
Para las valoraciones en consultas externas se han utilizado los equipos ecográficos portátiles SonoSite® M-Turbo y SII (Fujifilm). Tanto en el estudio preoperatorio (exploración física y ecográfica), así como en el cumplimiento de los diferentes niveles asistenciales de derivación, se han tomado los estándares marcados por la vigente guía española de AV3.
Tras la intervención, se realizó un seguimiento postoperatorio habitual en estos casos, y se registró tanto la permeabilidad, utilización del AV, así como la necesidad de reintervención endovascular y/o quirúrgica durante el período de seguimiento en nuestra base de datos hasta la fecha actual. En los pacientes externos a nuestra zona asistencial, los controles posquirúrgicos se hicieron en sus centros de referencia. Se consideró una adecuada maduración clínica la utilización exitosa de las FAVn tras las primeras 4-6 semanas de su creación. En cada centro de referencia se realizó la monitorización y seguimiento de los AV en pacientes con ERC 5D (hemodiálisis) según los métodos clásicos de primera generación (alteraciones durante la sesión de hemodiálisis), medición de recirculaciones y/o dosis on-line(Kt), o segunda generación mediante la estimación del flujo vascular (Qa) mediante técnicas indirectas dilucionales o ecografía-doppler. Ante la sospecha de probable disfunción se contactó con nuestra unidad vascular para programar una resolución endovascular o quirúrgica de forma directa (casos urgentes) o previa valoración en consultas externas. Los pacientes con ERC 5 (etapa prediálisis), fueron seguidos en consultas ERCA por su médico responsable tras un control de maduración realizado por el equipo de coordinación en el caso de pacientes de área asistencial directa o por su nefrólogo de referencia en los centros externos.
Análisis estadísticoSe realizó una descripción de las variables preoperatorias, intraoperatorias y de seguimiento mediante medias y rangos, o número y porcentaje. Se calculó el grado de correlación en la indicación quirúrgica (lateralidad, localización e indicación de creación/reparación/cierre) entre los equipos de cirugía vascular y nefrología mediante el coeficiente kappa, y se realizó una comparación de las variables preoperatorias y de seguimiento entre aquellos casos en los que la valoración nefrológica y de cirugía vascular fue coincidente o no coincidente, utilizando test de Chi-cuadrado para las proporciones y T-Test para las variables continuas. Se han utilizado curvas de supervivencia de Kaplan-Meier para el cálculo de la maduración, permeabilidad primaria (PP) y secundaria (PS), así como el análisis de regresión de Cox para la comparación de los casos coincidentes y no coincidentes, con la utilización del paquete estadístico SPSS® v. 23 (IBM Corp., Armonk, NY, EE. UU.), comparando ambos grupos y buscando factores predictores independientes de no coincidencia. Para estos cálculos de maduración y permeabilidad, se excluyeron las ligaduras. Se consideró significativa una p≤0,05.
ResultadosSe han analizado un total de 605 creaciones o reparaciones de AV realizados, 67% varones con una edad media de 69,3±13,1 años (21-94). Referente a los factores de riesgo cardiovascular encontramos el 91% de hipertensión arterial, el 50,8% de dislipemia, el 47% de diabetes mellitus, el 15,7% de cardiopatía isquémica, el 10,9% de fibrilación auricular, el 8,4% de vasculopatía periférica y el 6,4% de enfermedad cerebrovascular. Un 24,3% de los pacientes recibían tratamiento con algún agente antiagregante y un 13,9% con anticoagulantes.
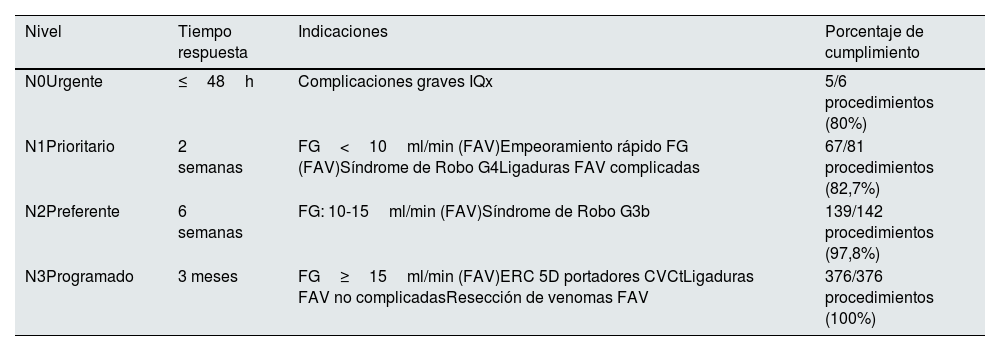
Un 61,6% (373) de los procedimientos quirúrgicos fueron realizados en pacientes en programa de hemodiálisis, un 29,2% (177) en ERCA y un 9,1% (55) en trasplantados renales, especialmente ligaduras quirúrgicas. Un 66,6% (403) de las intervenciones se realizaron con anestesia local y un 33,4% (202) con requerimientos de anestesista mediante la realización de bloqueos locorregionales. Del total de los procedimientos quirúrgicos, se realizaron 74 ligaduras de FAVn (12,2%), 207 FAVn distales (34,3%), 237 FAVn proximales (39,2%), 35 reparaciones (5,7%), 41 FAVp (6,7%) y en 11 otros procedimientos (1,9%). En la tabla 1 se resume el porcentaje de cumplimiento de los diferentes niveles asistenciales según los estándares de la actual guía española de AV3.
Cumplimiento de los tiempos de respuesta según el nivel de gravedad recomendados por las guías españolas de nefrología3
| Nivel | Tiempo respuesta | Indicaciones | Porcentaje de cumplimiento |
|---|---|---|---|
| N0Urgente | ≤48h | Complicaciones graves IQx | 5/6 procedimientos (80%) |
| N1Prioritario | 2 semanas | FG<10ml/min (FAV)Empeoramiento rápido FG (FAV)Síndrome de Robo G4Ligaduras FAV complicadas | 67/81 procedimientos (82,7%) |
| N2Preferente | 6 semanas | FG: 10-15ml/min (FAV)Síndrome de Robo G3b | 139/142 procedimientos (97,8%) |
| N3Programado | 3 meses | FG≥15ml/min (FAV)ERC 5D portadores CVCtLigaduras FAV no complicadasResección de venomas FAV | 376/376 procedimientos (100%) |
CVCt: catéter venoso central tunelizado; FAV: funcionales de acceso vascular; FG: filtrado glomerular estimado (ml/min); ERC: enfermedad renal crónica.
El tiempo medio en lista de espera fue de 16,4±11,5 días (0-76) para FAVn y 16,7±12,4 días (2-58) para FAVp. Excluyendo las ligaduras de los posteriores análisis, se obtuvo una adecuada maduración al mes en el 87,6% de los casos. En el seguimiento postoperatorio se realizaron un total de 158 procedimientos endovasculares y 17 reparaciones quirúrgicas. La PP y PS obtenidas a 6, 12 y 24 meses, fueron PP: 76,2, 64,9 y 57,5%, y PS: 86,4, 81,2 y 74,7%, respectivamente.
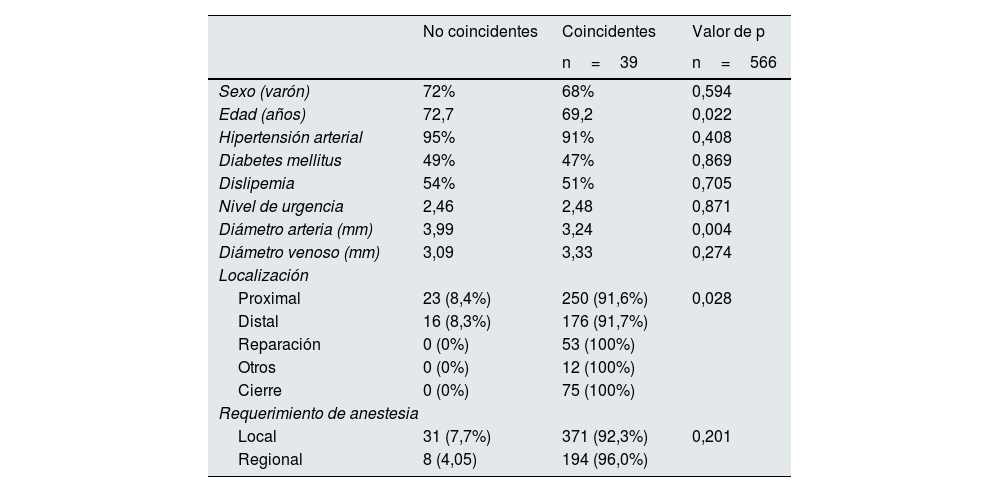
Del total de los procedimientos quirúrgicos, nefrología obtuvo un adecuado grado de concordancia respecto cirugía vascular en el 93,6% de los casos con un índice kappa de 0,886. Tal y como se muestra en la tabla 2, los casos con mayores discrepancias en las valoraciones presentaron mayores edades (72,7 vs. 69,2 años; p=0,022) y diámetros arteriales (3,99 vs. 3,24mm; p=0,032); es decir, mayores discrepancias en casos de edad mayor y diámetros arteriales mayores. En la figura 2 mostramos como el subgrupo de valoraciones no coincidentes entre nefrología y cirugía vascular (39 casos), presentaron una similar PP (a 2 años: 59,2 vs. 41,3%; p=0,099), pero peor PS (a 2 años: 76,6 vs. 55,4%; p=0.005).
Factores preoperatorios entre los casos coincidentes y no coincidentes
| No coincidentes | Coincidentes | Valor de p | |
|---|---|---|---|
| n=39 | n=566 | ||
| Sexo (varón) | 72% | 68% | 0,594 |
| Edad (años) | 72,7 | 69,2 | 0,022 |
| Hipertensión arterial | 95% | 91% | 0,408 |
| Diabetes mellitus | 49% | 47% | 0,869 |
| Dislipemia | 54% | 51% | 0,705 |
| Nivel de urgencia | 2,46 | 2,48 | 0,871 |
| Diámetro arteria (mm) | 3,99 | 3,24 | 0,004 |
| Diámetro venoso (mm) | 3,09 | 3,33 | 0,274 |
| Localización | |||
| Proximal | 23 (8,4%) | 250 (91,6%) | 0,028 |
| Distal | 16 (8,3%) | 176 (91,7%) | |
| Reparación | 0 (0%) | 53 (100%) | |
| Otros | 0 (0%) | 12 (100%) | |
| Cierre | 0 (0%) | 75 (100%) | |
| Requerimiento de anestesia | |||
| Local | 31 (7,7%) | 371 (92,3%) | 0,201 |
| Regional | 8 (4,05) | 194 (96,0%) | |
En el presente estudio se define un nuevo rol asistencial del equipo de coordinación de nefrología en la evaluación preoperatoria de la implantación de nuevos accesos vasculares, ligaduras o reparaciones quirúrgicas. Según los resultados obtenidos, ello permitió tras una formación específica la obtención de unos adecuados resultados de concordancia con el equipo de cirugía vascular tanto en el mapeo prequirúrgico y toma de decisiones, así como una óptima gestión de las listas de espera según los estándares marcados por las guías actuales de AV3.
Diferentes factores preoperatorios como la edad avanzada, la diabetes mellitus, el sexo femenino, la enfermedad coronaria, la vasculopatía periférica y pequeños diámetros venosos y/o arteriales, así como la localización distal, se han relacionado con menores tasas de permeabilidad tras la creación de las fístulas arteriovenosas15–18. Aunque la historia clínica y la exploración física proporcionan una información útil, añadir el mapeo prequirúrgico con ultrasonidos ha demostrado mejorar significativamente los resultados obtenidos19. La aplicación de la ecografía doppler permite detectar la presencia de estenosis arteriales y venosas que dificulten la implantación de accesos distales. También resulta útil en la determinación de los diámetros y la profundidad de cara a definir si se precisa de la superficialización y/o trasposición en uno o 2 actos quirúrgicos (>6mm de profundidad). En este sentido, se aconsejan unos diámetros venosos y arteriales mínimos de 2mm para FAVn radio-cefálicas, de 3mm para FAVn húmero-cefálicas o húmero-basílicas y de 4mm para FAVp en el antebrazo14,20,21. A pesar de que el diámetro es el factor pronostico más estudiado, existen otros marcadores ecográficos que pueden ser de utilidad como son el análisis de la curva doppler, las medidas de velocidad pico sistólico, el estudio arterial, así como la estimulación del flujo mediante la hiperemia reactiva22.
El control de la maduración del AV representa otro de los grandes pilares de toda UFAV. El objetivo principal es detectar fallos en la maduración subsidiarios a reparaciones endovasculares o quirúrgicas y realizar un mapeo en las primeras punciones. El establecimiento de programas activos de monitorización podría reducir significativamente el número de catéteres venosos centrales al inicio de hemodiálisis. Entre los criterios para considerar una FAVn madura, se consideran clínicos con la obtención de un buen tramo de vena eferente para realizar punciones (8-10cm)23 y ecográficos con un diámetro de vena ≥5mm, profundidad ≤6mm y flujo vascular (Qa)≥500ml/min23–27. Según los datos reportados en el presente estudio, aplicando un control estricto en la maduración se pueden obtener unas tasas de adecuada maduración >85% de los casos. A pesar de obtener unas adecuadas tasas de PS, futuros estudios nos demostraran si la creación de fístulas por vía percutánea28 o la implantación de nuevos dispositivos encaminados a favorecer la maduración (dispositivo VasQTM)29,30 mejoran dichos resultados y resultan coste-efectivos.
Existen pocos estudios comparativos en el campo del AV. Uno de ellos es el de Asif et al.31 que evaluó la concordancia obtenida con la exploración física sistematizada en la disfunción de la FAVn en una cohorte de 142 pacientes con ERC 5D remitidos a su unidad vascular. Entre los resultados obtenidos destacó como una formación específica en la exploración del AV realizada por el residente de nefrología, permitió obtener un índice kappa de 0,78 en el diagnostico de estenosis proximales «out-flow stenosis», confirmadas por fistulografía. En este sentido, según los resultados obtenidos en nuestro estudio, es posible obtener por parte del equipo de coordinación de nefrología unos buenos niveles de concordancia (93,6%) con un índice kappa de 0,886 en la valoración preoperatoria con mapeo prequirúrgico y toma de decisiones en cuanto a complicaciones del AV (ligaduras con aneurismorrafía o reparaciones). Los 2 únicos factores preoperatorios en nuestro estudio relacionados con mayores discrepancias en las valoraciones fueron la edad (p=0,022) y el diámetro arterial (p=0,032); es decir, mayores discrepancias en casos de edad mayor y diámetros arteriales mayores. Posiblemente estos datos obedecen a la actitud más conservadora por parte del equipo de nefrología y el intento de implantar fístulas más distales por parte de cirugía vascular incluso en el subgrupo de pacientes con edad más avanzada, o a las discrepancias en diámetros arteriales mayores a forzar accesos más distales a pesar de peores vasos venosos. Tal y como se muestra en el apartado de resultados, el subgrupo de valoraciones no coincidentes (39 casos) presentaron unas peores tasas de PS a 2 años (76,6 vs. 55,4%; p=0,005). Es decir, cuando las valoraciones entre ambos grupos coinciden, los resultados son mejores en base a la aplicación de unos mismos criterios, a diferencia en los no coincidentes, resultan peores al tratarse de casos más limite.
Otra de las grandes ventajas del mapeo preoperatorio realizado por el equipo de nefrología es la reducción en el tiempo medio para la valoración en consultas externas, así como la mejor selección de aquellos casos más complejos que requieran de una valoración específica por parte de cirugía vascular. La adquisición de este nuevo rol asistencial en el AV permitiría optimizar los recursos sanitarios, evitándose la sobresaturación de las consultas de cirugía vascular además de cumplir con una adecuada gestión de las listas de espera quirúrgicas. En este sentido, según los datos obtenidos en nuestra cohorte se consiguieron unos porcentajes de cumplimiento >80% en cada uno de los diferentes niveles de prioridad asistencial (N0-N3). Avanzando pues en el campo de la nefrología intervencionista, resultaría sensato poder incluir según las características intrínsecas de cada centro, la valoración preoperatoria por parte de nefrología como uno de los estándares en los actuales programas de certificación avanzada en PoCUS de los accesos vasculares32.
A modo de conclusión, no se observaron diferencias significativas observador dependiente (nefrólogo vs. cirujano vascular) en la toma de decisiones en cuanto al acto quirúrgico a realizar (93,6% de coincidencia con índice kappa de 0,886), y los casos discordantes presentaron peor PS. Tras una formación específica, el equipo de coordinación de nefrología puede realizar una adecuada optimización de los recursos socio sanitarios, reservando las derivaciones a cirugía vascular para aquellos casos que impliquen mayor complejidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.