INTRODUCCIÓN
La hipertensión arterial (HTA) en la población general es el resultado de la interacción entre múltiples factores etiopatogénicos. Simultáneamente, la propia HTA es un factor etiológico de primer orden de enfermedad renal avanzada y de su progresión y, por tanto, igualmente en el trasplante renal.1 De este modo, la compleja red de interrelaciones que se establecen entre enfermedad renal y la HTA no se interrumpe tras el trasplante renal, sino que se mantiene e incluso incrementa su complejidad.
Pese a su elevada prevalencia y las potenciales consecuencias en términos de morbimortalidad para la población trasplantada, existen importantes lagunas en la información disponible para la selección bajo criterios de evidencia, tanto de los factores de riesgo más relevantes de HTApostrasplante como de las herramientas diagnósticas y de seguimiento más adecuadas en esta población.
METODOLOGÍA
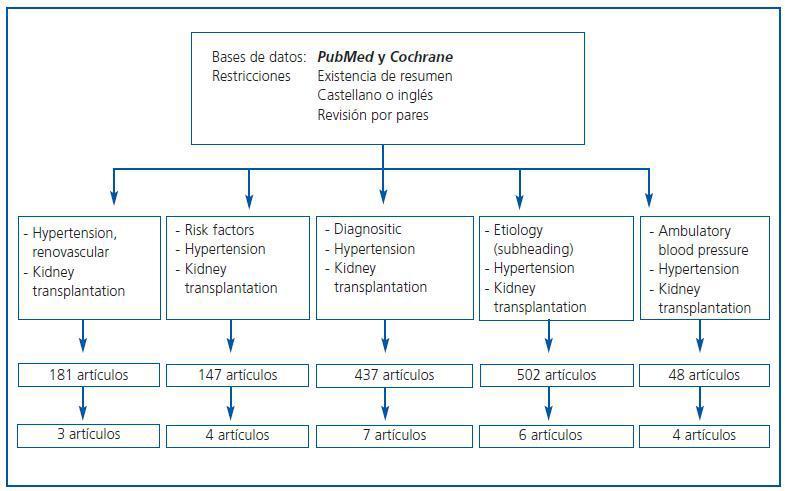
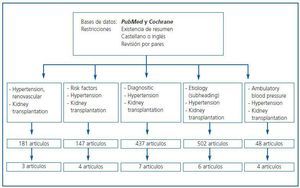
En esta sección se resumen las evidencias disponibles siguiendo el esquema explicado en metodología general. En la figura 1 se muestran las palabras clave utilizadas, así como el número de artículos obtenidos y la distribución de dichos artículos en las diversas áreas temáticas de esta revisión. Los motivos de descarte de artículos fueron la ausencia de relación directa con el tema de estudio, inconsistencia metodológica o duplicación.
RESULTADOS
Etiopatogenia y factores de riesgo
La etiología de la HTA postrasplante es multifactorial. Por una parte, puede deberse a la enfermedad renal primaria del receptor y al daño vascular establecido previo al trasplante, pero también puede estar relacionada con factores ligados al donante o al proceso de donación y trasplante. Tras el trasplante, se añaden otros factores como el tratamiento inmunosupresor y la disfunción crónica del injerto (tabla 1).
La mayor proporción de la información disponible en esta área proviene de estudios retrospectivos2-5 (tabla 2). En ellos se analizan múltiples factores de riesgo ligados al donante o al proceso de donación que son determinantes de HTA postrasplante. Cabe destacar la edad y las lesiones de aterosclerosis aortorrenal del donante3,4 (nivel de evidencia C). Otros factores también relevantes, como la presencia de función retrasada del injerto o los períodos prolongados de isquemia fría, pierden su capacidad de marcar un riesgo específico cuando la función renal postrasplante se tiene en cuenta en el análisis. Sin duda, la función renal postrasplante es el factor identificado de forma más constante, asociado a la presencia de HTA en el receptor (nivel de evidencia C).
La enfermedad renal primaria del receptor también se ha ligado al ulterior desarrollo de HTA postrasplante. La enfermedad renal poliquística del adulto parece asociarse a un menor riesgo.2 En la población española se ha demostrado que estos pacientes acceden al trasplante con un menor índice de comorbilidad global y, más específicamente, menores tasas de enfermedad cardiovascular asociada.6 De forma contraria, la glomerulonefritis crónica en población pediátrica y la nefropatía diabética en adultos se han asociado a un incremento en el riesgo de HTA postrasplante.4,5 Independientemente de la enfermedad renal primaria, la presencia de HTA pretrasplante constituye un factor predictivo de su desarrollo posterior. Por último, y también ligado al receptor, el índice de masa corporal guarda una relación estrecha, tanto en adultos como en población pediátrica, con la presencia de HTA postrasplante3-5 (nivel de evidencia C).
El tratamiento inmunosupresor se relaciona de diversas formas con la génesis de la HTA postrasplante. La HTA es un probado efecto secundario del tratamiento crónico con esteroides, incluso a dosis bajas, que se suma a la dislipemia y a la alteración del metabolismo de la glucosa producida por estos fármacos, en el incremento de riesgo cardiovascular del paciente trasplantado.7-9
Los fármacos inhibidores de la calcineurina participan en la fisiopatología de la HTA por múltiples vías. Inducen vasoconstricción de la arteriola aferente, incremento de la reabsorción de sodio, disfunción endotelial y activación del SRA. Además, de forma independiente a los fenómenos hemodinámicos, estos agentes inducen cambios histológicos en el riñón que favorecen el progresivo deterioro de la función renal y, secundariamente, el desarrollo de HTA.10 Aunque la ciclosporina (CSA) y el tacrolimus (TAC) comparten un perfil de efectos secundarios muy similar, CSA se asocia a un mayor riesgo de HTA postrasplante.11-13 En pacientes con trasplante renal de novo, el estudio aleatorizado publicado por Margreiter et al. demuestra, sobre un total de 560 pacientes tratados con CSA microemulsión versus TAC, una diferencia en la incidencia de HTA postrasplante del 7,5% a favor del primero (CSA 23,2% vs. TAC 15,7%; p = 0,032).11 En el mismo sentido, la conversión de CSA a TAC en el paciente estable demuestra un efecto beneficioso sobre las cifras de PA.13
Diagnóstico y seguimiento
Actualmente, los criterios diagnósticos, y que a su vez fijan los objetivos de tratamiento, han quedado definidos con los recientes consensos internacionales, aunque su uso supone la extrapolación de datos de la población general a este grupo particular de pacientes (ver apartado «Tratamiento de la hipertensión arterial postrasplante renal»).
A pesar de sus limitaciones, la presión arterial (PA) casual, es decir, la PA tomada en la consulta médica por personal entrenado, sigue siendo el patrón de referencia para el diagnóstico de la HTA.14 Sin embargo, para el seguimiento a largo plazo puede ser un instrumento insuficiente (tabla 3).
Diversos estudios muestran que el patrón non-dipper y la HTA enmascarada son hechos frecuentes en la población trasplantada. La prevalencia de estas alteraciones guarda una relación inversa con el grado de función renal15-19 (nivel de evidencia B). La realización de la monitorización ambulatoria de PA (MAPA) de forma sistemática tras el trasplante renal podría mejorar el diagnóstico y el control de la HTA postrasplante. Además, la MAPA podría ser superior a la PA casual como predictor de daño renal y en órganos diana.19 La MAPA estaría especialmente indicada en pacientes con disfunción crónica del injerto, definida por la presencia de proteinuria (>300 mg/24 h) o incremento igual o superior al 20% de la creatinina plasmática en los últimos 12 meses (nivel de evidencia D).
Por otra parte, la automedida de la PA (AMPA) mediante dispositivos semiautomáticos debidamente validados puede suponer una valiosa ayuda en el seguimiento.20 La AMPA elimina el efecto «bata blanca», mejora la evaluación de la respuesta al tratamiento antihipertensivo, ayuda a interpretar los síntomas de hipotensión en pacientes bajo tratamiento farmacológico y mejora la adherencia al tratamiento14,18,19 (nivel de evidencia D).
Diagnóstico: hipertensión renovascular
La hipertensión renovascular (HRV) merece la consideración especial de tratarse de una causa potencialmente curable de HTA postrasplante. La Estenosis de Arteria Renal (EAR) es además una causa de disfunción renal y tiene una incidencia reconocida creciente (1-20%) a medida que mejoran los métodos no invasivos para su diagnóstico. En la literatura revisada existe una clara coincidencia en que la ecografía-doppler renal es la prueba diagnóstica indicada para el despistaje de esta entidad21,22 (nivel de evidencia B).
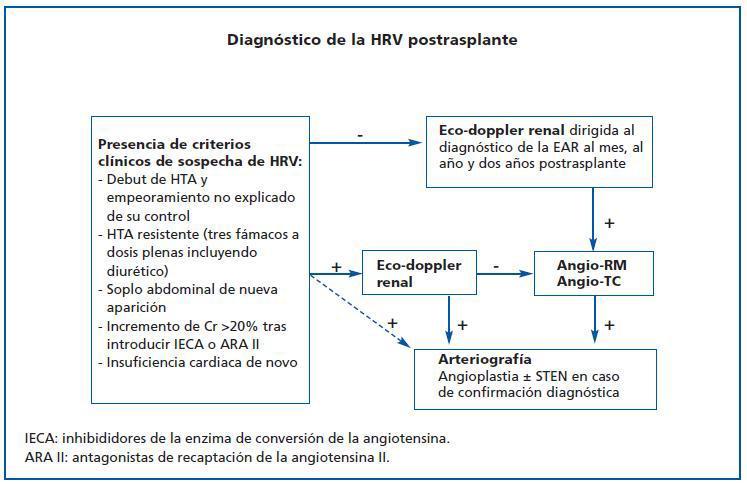
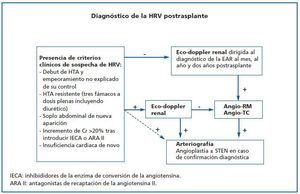
El período de riesgo para el desarrollo de EAR es máximo inmediatamente postrasplante y se extiende hasta los primeros dos años de seguimiento. En este intervalo estaría recomendada la realización sistemática de un doppler específicamente dirigido al diagnóstico de la EAR. Se propone una exploración un mes tras el trasplante, y al cumplir 12 y 24 meses de seguimiento postrasplante (nivel de evidencia D). En cualquier caso, la presencia de datos clínicos sugestivos de EAR23 impone la realización sin demora de un doppler sobre la arteria renal del injerto (figura 2) (nivel de evidencia C).
Tras la ecografía-doppler renal confirmatoria o, incluso, tras una exploración negativa con alta sospecha clínica, la arteriografía sigue siendo el patrón de referencia en el diagnóstico de la EAR (nivel de evidencia C). Además, esta exploración puede seguirse de una maniobra potencialmente terapéutica, la angioplastia con o sin colocación de stent. Actualmente, y con el creciente perfeccionamiento y accesibilidad de la angio-RM y la angio-TC, pruebas que demuestran una elevada sensibilidad y especificidad para el diagnóstico de la EAR,24 parece indicado utilizar estas pruebas como escalón previo a la arteriografía en aquellos casos que presentan dudas diagnósticas, siempre que estas pruebas no estén contraindicadas (nivel de evidencia D). Dada la ausencia de unos criterios hemodinámicos claramente estandarizados para el diagnóstico de la EAR, la utilización adecuada de un árbol diagnóstico escalonado puede mejorar la indicación de la arteriografía y los resultados a largo plazo de la angioplastia (figura 2).
Figura 1.
Figura 2.
Tabla 1. Factores etiopatogénicos relacionados con la HTA postrasplante
Tabla 2. Factores que identifican a los pacientes con un riesgo más elevado de HTA postrasplante
Tabla 3. Recomendaciones en el diagnóstico y el seguimiento de la HTA postrasplante