Existe controversia si la hipercalciuria idiopática (HI) produce alteraciones en el manejo renal del agua. Por primera vez en la literatura, llevamos a cabo un estudio longitudinal del manejo renal del agua (MRA) en pacientes diagnosticados de HI en edad pediátrica y con seguimiento hasta la edad adulta (media de seguimiento de 17,7±1,4 años).
MétodosVeintinueve pacientes (7 M, 22 F) mayores de 24 años (media 28,2±2,9 años, rango: 24,1-35,9) que fueron diagnosticados de HI en la edad pediátrica (media 7,6±3,2 años, rango: 1-14) fueron incluidos. Se determinaron la osmolaridad urinaria máxima (OsU) y/o el volumen urinario ajustado para 100ml de tasa de filtrado glomerular (V/TFG) en ambos tiempos (pediátrico y adulto). Además, siempre que fue posible, en ambas edades se recogieron los niveles plasmáticos de creatinina, sodio plasmático, ácido úrico, cociente citrato/creatinina y calcio/citrato y, además, se realizó una ecografía renovesical.
ResultadosEl MRA estuvo alterado en edad pediátrica en 9/29 casos (31%) (4 con OsU máxima reducida y 5 con V/TFG elevado). En la edad adulta, 7/29 (24,1%) presentaron alteración del MRA (6 OsU reducidos y uno con V/TFG elevado). En comparación con el grupo de edad pediátrica, los pacientes adultos mostraron valores reducidos de V/TFG, cociente calcio/creatinina y citrato/creatinina, así como aumento de creatinina plasmática, ácido úrico y del cociente calcio/citrato. No hubo diferencias en la OsU máxima en ambos tiempos. Sin embargo, la OsU en la edad adulta fue significativamente menor en aquellos que tenían cólicos renales comparado con aquellos que no los tuvieron (p=0,04).
ConclusionesLa alteración del MRA ocurrió en aproximadamente un tercio de los pacientes con HI, y no se alteró tras 20 años después de su diagnóstico. Nosotros pensamos que estos resultados pueden ser debido a un cierto cumplimiento de la dieta protectora recomendada y al tratamiento farmacológico administrado en el diagnóstico de HI en la edad pediátrica.
There is much debate about whether idiopathic hypercalciuria (IH) affects kidney water management. For the first time in the literature, we carried out a longitudinal study of kidney water management (KWM) in patients diagnosed with IH in childhood and followed-up until adulthood (mean follow-up 17.7±1.4 years).
MethodsTwenty-nine patients (7 M, 22 F) over the age of 24 years (mean 28.2±2.9 years, range: 24.1-35.9) who were diagnosed with IH in childhood (mean 7.6±3.2 years, range: 1-14) were included. Maximum urine osmolality (UO) and/or urine volume adjusted for 100ml of glomerular filtration rate (V/GFR) in both age groups (paediatric and adult) were determined. Moreover, whenever possible, in both age groups plasma creatinine levels, plasma sodium levels, uric acid levels, the citrate/creatinine ratio and the calcium/citrate ratio were recorded and a renal and bladder ultrasound was performed.
ResultsIn the paediatric age group, KWM was altered in 9/29 cases (31%) (4 with reduced maximum UO and 5 with elevated V/GFR). In adulthood, KWM was found to be affected in 7/29 cases (24.1%) (6 with reduced UO and one with elevated V/GFR). Compared to the paediatric age group, adult patients had lower V/GFR, calcium/creatinine and citrate/creatinine values, as well as higher plasma creatinine, uric acid and calcium/citrate. There were no differences in the maximum UO in both age groups. However, UO in adulthood was significantly lower in subjects who had renal colic compared to those who did not (P=.04).
ConclusionsKWM was affected in approximately one third of patients with IH, which persisted 20 years after diagnosis. We think that these results may be due to adherence to the recommended protective diet and to the pharmacological treatment administered at the diagnosis of IH during childhood.
La hipercalciuria idiopática (HI) es la anomalía metabólica más frecuente que causa cálculos renales en niños y adultos. La causa más probable de HI es un aumento en el número de receptores de vitamina D. Esto ha sido demostrado en ratas con hipercalciuria espontánea (genetic hypercalciuric stone-forming)1,2 y confirmada en humanos3. Además, se ha observado que los monocitos sanguíneos incrementan la producción de citoquinas, tales como interleuquina-1, factor estimulante de colonias de granulocitos-macrófagos y factor de necrosis tumoral4,5 que por varios mecanismos pueden incrementar la eliminación urinaria de calcio 6.
En 1960 se descubrió que en pacientes adultos con HI podría haber un defecto en la capacidad de concentración renal7. Desde entonces se han publicado resultados discrepantes en pacientes adultos8–12 y niños11–14 con HI. Por primera vez en la literatura, llevamos a cabo un estudio longitudinal de manejo renal del agua (MRA) en pacientes con HI diagnosticados en edad pediátrica con seguimiento hasta la edad adulta.
Pacientes y métodosSe realizó un estudio longitudinal donde se incluyeron 29 pacientes (7M, 22 F) mayores de 24 años (media 28,2±2,9 años, rango: 24,1-35,9) que fueron diagnosticados de HI en la edad pediátrica (media 7,6±3,2 años; 1-14) por presentar una eliminación urinaria de calcio de más de 4mg/kg/día13,14 (5,65±2,12; rango: 4-11,8); cociente urinario calcio/creatinina: 0,30±0,09; rango: 0,2- 0,5. Todos los pacientes adultos incluidos en el estudio aceptaron participar de una conversación telefónica realizada por uno de los autores. Sus nombres aparecen en un antiguo archivo, en el que se incluyeron 104 pacientes diagnosticados de HI en la infancia, y que tenían realizada una densitometría ósea. La entrevista posterior se realizó personalmente en consulta. Solo un paciente fue controlado en la consulta externa del Servicio de Nefrología de adultos y otro en el Servicio de Reumatología. Ninguno de estos 2 pacientes recibió tratamiento farmacológico en el momento del estudio. Los criterios de inclusión utilizados para la selección de los pacientes fueron que, en ambos tiempos, tuvieran un estudio del MRA mediante la determinación de osmolaridad urinaria (OsU) realizada con un test de desmopresina (niños n=4, adultos n=2), volumen urinario ajustado por 100ml de filtrado glomerular (V/ TFG) (niños n=12, adultos n=3) o ambos (niños n=13, adultos n=24). En la edad adulta los datos recogidos se registraron entre abril y junio de 2016. Además, siempre que fue posible, en ambas edades se recogieron los siguientes parámetros analíticos: creatinina, sodio y ácido úrico plasmático. Además de los cocientes urinarios citrato/creatinina y calcio/citrato. Estos parámetros corresponden a la primera muestra de orina de la mañana. Los datos clínicos iniciales se recogieron en el momento de diagnostico de la HI y ninguno de los niños mostró niveles elevados de creatinina en plasma, hipertensión ni datos de acidosis tubular renal distal. En la edad adulta, los pacientes fueron entrevistados sobre antecedentes de cólicos renales y antecedentes familiares de urolitiasis en primera y segunda generación. No había antecedentes de consanguinidad en las historias familiares. La ecografía renal y vesical se realizó en todos los pacientes en ambos tiempos. La tasa de filtrado glomerular (TFG) se estimó en la edad adulta mediante la fórmula CKD-EPI. El V/TFG se calculó utilizando valores de creatinina en plasma y orina que se obtuvieron usando la siguiente fórmula: creatinina plasmática×100/ creatinina en orina15,16 y se consideró elevado si era superior a 1,03ml/100ml TFG16.
Prueba de concentración de orina de desmopresinaDespués de vaciar la vejiga, se administró 0,2mg (200μg) de desmopresina por vía oral o 0,12mg (120μg) de desmopresina liofilizada (MELT) sublingual11,17,18. Posteriormente, se tomaron 3 muestras consecutivas en intervalos de 90min, siendo el valor máximo, la OsU. Un valor máximo de OsU inferior a 800mOsm/kg se consideró indicativo de defecto de concentración renal11,17,18.
Cociente calcio/creatininaEn la edad adulta, un cociente calcio/creatinina mayor de 0,2mg/mg fue considerado elevado4–6.
Determinaciones de laboratorio y ecografíaLa creatinina se determinó en la infancia mediante el método de creatininasa (análisis enzimático colorimétrico). En la edad adulta se uso la prueba colorimétrica cinética (método Jaffe cinético [método compensado] y se usó el analizador Beckman Coulter.
El calcio urinario se realizó mediante calcio: NM-BAPTA y el citrato mediante determinación colorimétrica enzimática (Trinitry Biotech). Estos parámetros se midieron con un analizador Cobas-501 Roche Diagnostics. El ácido úrico se determinó usando el analizador Cobas-702 Analyzer Roche Diagnosis. La osmolaridad urinaria se determinó por depresión del punto de congelación en el osmómetro Osmo Station OM-6050 (Menarini Diagnostics). La ecografía renal y vesical se realizó con un ecógrafo esaote MyLab25 Gold y las exploraciones fueron realizadas por un solo radiólogo para evitar la variabilidad interobservador.
Análisis estadísticoSe realizó la prueba de Kolmogorov-Smirnov para estudiar la distribución de las variables. Las variables cuantitativas se expresaron como media±desviación estándar. Se usaron análisis bivariados para una evaluación inicial de las diferencias. Las diferencias entre las variables iniciales y de seguimiento se analizaron usando la t de Student para muestras pareadas. Se utilizó la prueba U de Mann-Whitney para la comparación de medias en variables cuantitativas en relación con la historia de la urolitiasis del paciente o la familia. Se utilizó el software estadístico SPSS (SPSS v. 19.0, SPSS Inc., EE. UU.). Un valor p<0,05 se consideró estadísticamente significativo.
Todos los pacientes firmaron el consentimiento informado. Los procedimientos y protocolos realizados en este estudio cumplieron con los requisitos éticos, administrativos y de protección de datos establecidos por el Hospital Universitario Nuestra Señora de Candelaria, que se establecen de acuerdo con la ley de España y la declaración de Helsinki.
ResultadosLos síntomas clínicos en el momento del diagnóstico de HI fueron variables: infección del tracto urinario sin síntomas asociados (n=2) o con otros síntomas (n=7), síntomas urinarios (disuria, frecuencia, enuresis nocturna, n=4), dolor abdominal inespecífico (n=6) o supuestamente asociado con cólico renal (n=3) y hematuria macroscópica (n=1). En los 6 casos restantes la determinación de la eliminación urinaria de calcio se realizó por los antecedentes familiares de HI.
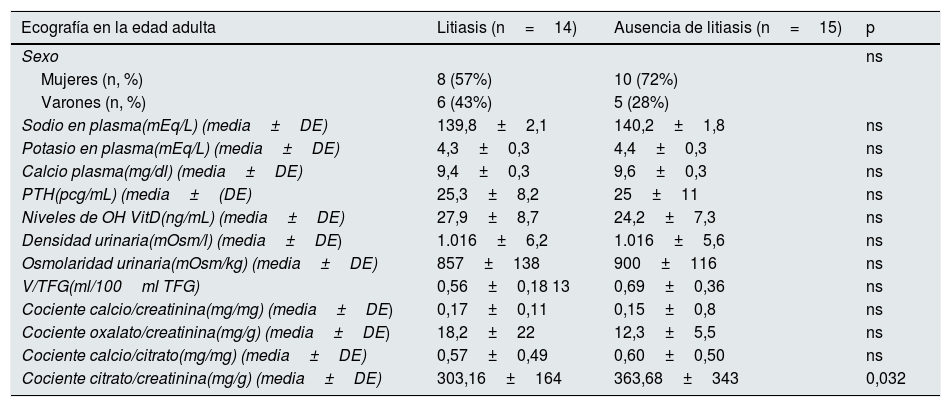
En la revisión de las historias clínicas observamos que, en la edad pediátrica, 23 pacientes seguían una dieta preventiva, 2 de ellos fueron tratados con tiazidas, 2 recibieron tratamiento con citrato de potasio y los otros 2 recibieron ambos medicamentos en diferentes momentos de su vida. En todos los casos, el tiempo de prescripción de estos medicamentos se mantuvo durante al menos un año. En la edad adulta, 9 pacientes (29%) tuvieron cólico renal a lo largo de sus vidas y 18 de las 29 familias (62,1%) tenían antecedentes familiares de urolitiasis. Diecinueve pacientes (65,5%) presentaron un cociente calcio/creatinina normal en la edad adulta. En la ecografía renal realizada en la edad pediátrica, 8 niños (26%), presentaron nefrolitiasis, predominando en el sexo femenino (n=5; 62%) y en la edad adulta se observó la presencia de nefrolitiasis en 14 de los 29 pacientes (48%). En la tabla 1 se recogen los principales parámetros bioquímicos y urinarios de los pacientes con y sin litiasis en la edad adulta.
Parámetros bioquímicos y urinarios de los pacientes con y sin litiasis en la edad adulta
| Ecografía en la edad adulta | Litiasis (n=14) | Ausencia de litiasis (n=15) | p |
|---|---|---|---|
| Sexo | ns | ||
| Mujeres (n, %) | 8 (57%) | 10 (72%) | |
| Varones (n, %) | 6 (43%) | 5 (28%) | |
| Sodio en plasma(mEq/L) (media±DE) | 139,8±2,1 | 140,2±1,8 | ns |
| Potasio en plasma(mEq/L) (media±DE) | 4,3±0,3 | 4,4±0,3 | ns |
| Calcio plasma(mg/dl) (media±DE) | 9,4±0,3 | 9,6±0,3 | ns |
| PTH(pcg/mL) (media±(DE) | 25,3±8,2 | 25±11 | ns |
| Niveles de OH VitD(ng/mL) (media±DE) | 27,9±8,7 | 24,2±7,3 | ns |
| Densidad urinaria(mOsm/l) (media±DE) | 1.016±6,2 | 1.016±5,6 | ns |
| Osmolaridad urinaria(mOsm/kg) (media±DE) | 857±138 | 900±116 | ns |
| V/TFG(ml/100ml TFG) | 0,56±0,18 13 | 0,69±0,36 | ns |
| Cociente calcio/creatinina(mg/mg) (media±DE) | 0,17±0,11 | 0,15±0,8 | ns |
| Cociente oxalato/creatinina(mg/g) (media±DE) | 18,2±22 | 12,3±5,5 | ns |
| Cociente calcio/citrato(mg/mg) (media±DE) | 0,57±0,49 | 0,60±0,50 | ns |
| Cociente citrato/creatinina(mg/g) (media±DE) | 303,16±164 | 363,68±343 | 0,032 |
El MRA estuvo alterado en la edad pediátrica en 9/29 casos (31%) (4 con OsU máxima reducida y 5 con V/TFG alto), mientras que en adultos esta alteración fue observada en 7/29 casos (24,1%) (6 con OsU máxima reducida y uno con V /TFG elevado).
En adultos, el FG estimado por CKD-EPI fue de 113,9±13,9ml/min/1,73 m2 y el cociente albúmina/creatinina en orina fue de 8,3±10,6mg/g. Tres pacientes mostraron un TFG estimado por CKD-EPI entre 81 y 90ml/min/1,73 m2. En 2 de ellos (67%) se observó una alteración en el MRA (p=n/s).
No hubo concordancia en los resultados del estudio del MRA en ambos momentos de la vida. Por lo tanto, solo 3 de los 9 niños con alteración del MRA mostraron el mismo defecto en la edad adulta.
En comparación con la edad pediátrica, los pacientes adultos mostraron valores reducidos de V/TFG (0,59±0,24 vs. 0,75±0,28 en la infancia, p=N/S), calcio/creatinina (0,15±0,9 vs. 0,22±0,9 en la edad pediátrica, p=0,000) y cociente citrato/creatinina (384±363 vs. 822±362 en la edad pediátrica, p=0,000).
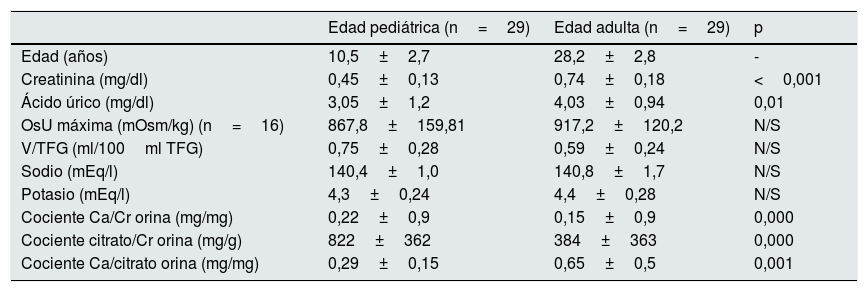
Además, en la edad adulta se observó un aumento significativo del cociente calcio/citrato (0,65±0,5 vs. 0,29±0,15 en la edad pediátrica, p<0,001), los niveles de creatinina (0,74±0,18 vs. 0,45±0,13 en la edad pediátrica, p<0,001) y ácido úrico (4,03±0,94 vs. 3,05±1,2 en la edad pediátrica, p<0,001). No hubo diferencias significativas en los valores del OsU máxima al comparar ambas edades (tabla 2).
Características de los pacientes en ambas edades: pediátrica y adulta
| Edad pediátrica (n=29) | Edad adulta (n=29) | p | |
|---|---|---|---|
| Edad (años) | 10,5±2,7 | 28,2±2,8 | - |
| Creatinina (mg/dl) | 0,45±0,13 | 0,74±0,18 | <0,001 |
| Ácido úrico (mg/dl) | 3,05±1,2 | 4,03±0,94 | 0,01 |
| OsU máxima (mOsm/kg) (n=16) | 867,8±159,81 | 917,2±120,2 | N/S |
| V/TFG (ml/100ml TFG) | 0,75±0,28 | 0,59±0,24 | N/S |
| Sodio (mEq/l) | 140,4±1,0 | 140,8±1,7 | N/S |
| Potasio (mEq/l) | 4,3±0,24 | 4,4±0,28 | N/S |
| Cociente Ca/Cr orina (mg/mg) | 0,22±0,9 | 0,15±0,9 | 0,000 |
| Cociente citrato/Cr orina (mg/g) | 822±362 | 384±363 | 0,000 |
| Cociente Ca/citrato orina (mg/mg) | 0,29±0,15 | 0,65±0,5 | 0,001 |
No se encontró una correlación entre el cociente Ca/Cr y el MRA en las edades pediátricas y adulta.
Al dividir la muestra según existía ó no historia personal de cólicos renales no encontramos diferencias en los parámetros bioquímicos iniciales estudiados. Por el contrario, la OsU en la edad adulta en aquellos que habían tenido cólicos renales a lo largo de sus vidas fue significativamente menor que en los que no lo presentaron (773,5 [245] [n=9]) vs. 931 [142]mOsm/kg [n=17]; p=0,04). Estas diferencias no se demostraron en relación con la presencia o ausencia de cálculos renales en la ecografía realizada en la edad adulta. Se observó una correlación negativa entre la edad y la osmolaridad urinaria máxima en la edad adulta (r=−0,4; p=0,04).
DiscusiónEn este estudio, el manejo renal del agua se analizó mediante la determinación de la capacidad de concentración urinaria y del V/TFG en orina. La concentración de orina es el resultado de un complejo mecanismo glomerulotubular que culmina en la estimulación de la arginina-vasopresina (ADH) mediada por la estimulación de acuaporinas y diseñadas para reabsorber agua en el túbulo colector renal. La capacidad de concentración renal depende de un suministro adecuado del ultrafiltrado glomerular a los túbulos, un intersticio medular hipertónico, un mecanismo de contracorriente medular estructuralmente intacto y de la normal permeabilidad al agua en los túbulos colectores en respuesta a la ADH19. La capacidad de concentración es entonces altamente dependiente de la médula renal20. No es sorprendente, por lo tanto, que cuando hay un defecto en cualquiera de los muchos factores involucrados en un mecanismo muy complejo, la capacidad de concentrar la orina se deteriora tempranamente.
En datos de nuestro grupo publicados recientemente observamos que la OsU máxima se altera cuando hay una pérdida de parénquima renal (una o más cicatrices, riñón único, hipodisplasia, enfermedad renal crónica), en los casos donde hay un aumento de presión en el parénquima renal (reflujo vesicoureteral, obstrucción de la unión ureteropélvica) y cuando existe una inflamación aguda en el parénquima renal (pielonefritis aguda)21. El volumen de orina está estrechamente relacionado con la función glomerulotubular y la capacidad de concentración. Se ha establecido que el 99% del contenido de fluido en el ultrafiltrado glomerular se reabsorbe a lo largo de los túbulos renales. Cuando se altera cualquiera de los diferentes mecanismos implicados en la capacidad de concentración, hay un aumento en el volumen urinario que, sin embargo, puede no ser clínicamente detectable en los casos leves. Se sabe desde hace muchos años que el volumen urinario aumenta progresivamente y la capacidad de concentración progresivamente empeora en relación con el deterioro de la TFG22. El volumen urinario corregido por 100ml de FG rara vez se usa en la práctica diaria. Los resultados obtenidos por nuestro grupo en un estudio previo muestran que el volumen urinario corregido por 100ml de FG es un parámetro fácil de calcular que puede usarse como marcador para detectar la pérdida de parénquima renal y es casi tan sensible como la osmolalidad urinaria máxima23. En nuestro estudio, los niveles de ácido úrico se recogieron como una expresión indirecta de la contracción y la expansión del volumen24,25.
La alteración del MRA en pacientes adultos fue descrita por primera vez por Gill y Bartter en 1961. Estos autores verificaron que este defecto podría estar relacionado con el exceso de calcio y que no dependía de un fallo grave del transporte de sodio7. Gill y Bartter observaron una alteración de la reabsorción máxima de agua libre (Tc H2O) durante la diuresis osmótica en 3 individuos con hipercalciuria. El aclaramiento de agua máximo negativo fue normal en estos mismos pacientes cuando se corrigió la hipercalciuria.
En 1976, Backman estudió a 41 pacientes adultos con cálculos renales recurrentes idiopáticos e investigó la excreción de electrólitos durante la hidropenia y la diuresis acuosa. Todos los pacientes tenían una capacidad de concentración normal según la determinación de Tc H2O 8. En un trabajo posterior sobre este tema realizado en pacientes adultos, Yumiya et al. confirmaron que el calcio urinario alto no interfiere en la concentración urinaria9. Por el contrario, Suki et al. observaron una reducción de la OsU máxima en adultos con HI (701±138mOsm/kg) en relación con los controles (1.108±72mOsm/kg). Estos autores postularon que este defecto de concentración no es consecuencia de la hipercalciuria ya que la reducción de la excreción de calcio por administración oral de fosfato no logró corregir el defecto10.
En pacientes pediátricos con HI estudiados por Stapleton y Miller, la osmolalidad urinaria después de 18h de privación de líquidos varió de 700 a 1.018mOsm/kg, con un valor medio de 864±34mOsm/kg que fue estadísticamente menor que los controles (1.059±31,2mOsm/kg). Tres de los 10 niños estudiados (30%) mostraron valores por debajo de 800mOsm/kg 13. En otro estudio pediátrico, el 10,2% (5/49) de pacientes con HI tenían una OsU máxima reducida14.
La existencia de un posible defecto en la capacidad de concentración en pacientes con HI se ha relacionado con la misma hipercalciuria a través de su posible efecto estimulante sobre el receptor sensible al calcio (CaSR)26–28 o el deterioro en el mecanismo de concentración debido a depósitos de sales de calcio en el parénquima renal11,12.
En este sentido, ha sido descrito que la activación del CaSR de la superficie celular en las membranas apicales de las células principales del conducto medular interno (IMCD)26,27 reduce la acuaporina-2 y por lo tanto, la tasa de reabsorción de agua28). Incluso se ha postulado que la modulación del volumen urinario a través de la activación de IMCD CaSR podría ser un mecanismo importante de protección contra la formación de cálculos29.
Aunque los mecanismos que relacionan la concentración de iones de calcio con la abundancia de acuaporinas en la membrana están bien respaldados por experimentos en células y animales28,30, sin embargo, la relevancia de este mecanismo en humanos con cálculos renales cálcicos no parece ser significativa31,32. Este efecto sería mucho más notable en casos de hipercalcemia33.
Además, en la rama ascendente gruesa del asa de Henle, CaSR reduce la reabsorción activa de Na+ y Cl− por inhibición del canal de potasio ROMK (y de forma indirecta del cotransportador NKCC2), lo que induce una disminución de la carga luminal positiva necesaria para la reabsorción pasiva de Ca2+, Mg2+ y Na+34. Este defecto de reabsorción de Na+ se acompañaría de una pérdida obligada de agua35
En nuestro estudio, el manejo renal del agua se alteró en el 31% de los niños y en el 24,1% de los adultos, por lo que la activación del CaSR de la superficie celular no debe descartarse, al menos en pacientes pediátricos con HI. Además, en este estudio, no se encontraron diferencias en los valores de la OsU máxima al comparar los valores correspondientes a ambas edades. Incluso el V/FGR fue menor en la edad adulta (tabla 2).
Nuestro grupo, en 2 estudios transversales previos, encontró una reducción de la OsU máxima en el 14% de los niños (n=42; 8,3±3,1 años) y en el 48% de los adultos (n=52; 39,7±11,8 años) con HI11,12. Aunque los resultados no son exactamente comparables porque en el presente estudio también hemos incluido el valor de V/TFG, la frecuencia de alteración en el MRA en los adultos incluidos en el primer trabajo fue mucho más alta que la actual.
En ese estudio previo, se observó que los adultos con HI y capacidad de concentración deteriorada, en relación con aquellos con MRA normal, tenían una mayor eliminación urinaria de prostaglandina E2 y una mayor frecuencia de cálculos ecográficos en el parénquima renal11,12. En este sentido, el estudio actual, la OsU máxima en la edad adulta fue significativamente menor en los que tenían cólico renal en comparación con los que no lo tenían (p<0,04).
La menor frecuencia de defectos en la capacidad de concentración en la edad adulta en el estudio actual en comparación con el estudio transversal anterior se puede explicar por 3 razones:
- a)
Una edad más joven (media: 28,2 años) que en el estudio anterior (media: 39,7 años), lo que, al menos en teoría, reduce la posibilidad de que se formen depósitos de calcio en el parénquima renal y, por lo tanto, para alterar el mecanismo de concentración de la orina. En este sentido, la correlación negativa observada en el estudio actual entre la edad y la osmolalidad urinaria máxima en la edad adulta es significativa.
- b)
Calciuria inferior en este estudio (19 pacientes habían normalizado la relación calcio/creatinina) que la observada en pacientes en el estudio transversal inicial en el que todos eran hipercalciúricos.
- c)
El posible efecto preventivo del tratamiento dietético y farmacológico recomendado a nuestros pacientes en la edad pediátrica podría haber evitado los depósitos cristalinos en el parénquima renal.
Finalmente, aunque no era el objetivo del estudio, los resultados obtenidos demuestran un hecho que habíamos observado previamente en nuestra experiencia clínica con respecto a la eliminación urinaria de calcio y citrato36. Nos referimos al hecho de que, por razones desconocidas, algunos pacientes con HI diagnosticados en la infancia, pueden normalizar la eliminación urinaria de calcio en la adolescencia y la edad adulta sin recibir tratamiento farmacológico en ese momento. Al mismo tiempo, la eliminación urinaria de citrato disminuye e incluso aumenta el riesgo litogénico (mayor cociente calcio/citrato) (tabla 1). Este hallazgo, que los pacientes con HI puedan tener hipocitraturia en ausencia de acidosis tubular renal distal, ha sido descrito previamente en la literatura37. En nuestro estudio, la alteración del MRA fue observada en aproximadamente un tercio de los pacientes con HI, y no se alteró tras 20 años del diagnóstico. En adultos, parece estar relacionado con enfermedad urolitiásica. Es difícil saber si estos resultados positivos pueden ocurrir para un cierto cumplimiento de la dieta protectora recomendada y el tratamiento farmacológico administrado en el diagnóstico de HI en la edad pediátrica.
Conflicto de interesesNo declarado.