La incidencia y la prevalencia de hígado graso no alcohólico o enfermedad hepática metabólica (EHmet) está en aumento y es mayor en pacientes con diabetes mellitus tipo 2 (DM2). El riesgo cardiovascular y renal está claramente incrementado en estos pacientes, especialmente cuando se desarrolla nefropatía diabética. El eje cardio-reno-hepato-metabólico, conformado por la enfermedad cardiovascular (ECV), la enfermedad renal crónica (ERC), la EHmet y la DM2, tiene una base fisiopatogénica común. La relación clínica entre todos los componentes es inevitable y multidireccional, pudiendo la EHmet preceder al desarrollo de complicaciones cardiovasculares y renales, y también empeorar el pronóstico de las mismas una vez desarrolladas. En esta revisión enfatizamos la importancia de buscar y tratar la EHmet en pacientes con ERC y DM2 con el objetivo de identificar pacientes de mayor riesgo y de mejorar su pronóstico.
Non-alcoholic fatty liver disease or metabolic-associated fatty liver disease (MAFLD) is a common condition with increasing prevalence and incidence, specially in patients with type 2 diabetes mellitus (DM2). Both cardiovascular and renal disease are clearly increased in these patients, particularly in those with diabetic nephropathy. In the liver–heart–kidney–metabolic axis, the common pathophysiological basis of MAFLD, cardiovascular disease (CVD), chronic kidney disease (CKD), and DM2 is the same. The clinical relationship between all of them is clear and is multidirectional: MAFLD may precede the development of cardiovascular and renal disease, and may also worsen the prognosis of these complications once developed. In this review we emphasize the importance of targeting MAFLD in diabetic kidney disease, with the goal of detecting high-risk patients in order to improve their prognosis.
El hígado graso no alcohólico o enfermedad hepática grasa no alcohólica (en inglés, Non-alcoholic fatty liver disease [NAFLD]), se define como el depósito de grasa en el hígado (esteatosis) demostrada en técnicas de imagen o en biopsia, en ausencia de consumo de alcohol de riesgo (≥30g de alcohol/día en varones o ≥20g de alcohol/día en mujeres), consumo de fármacos que causen esteatosis y en ausencia de enfermedades por depósito graso de origen hereditario o genético. Por tanto, es un trastorno generalmente asociado a factores de riesgo metabólico. De ahí, que se haya propuesto un cambio de nomenclatura a enfermedad hepática metabólica (EHmet, en inglés, Metabolic-associated fatty liver disease [MAFLD])1.
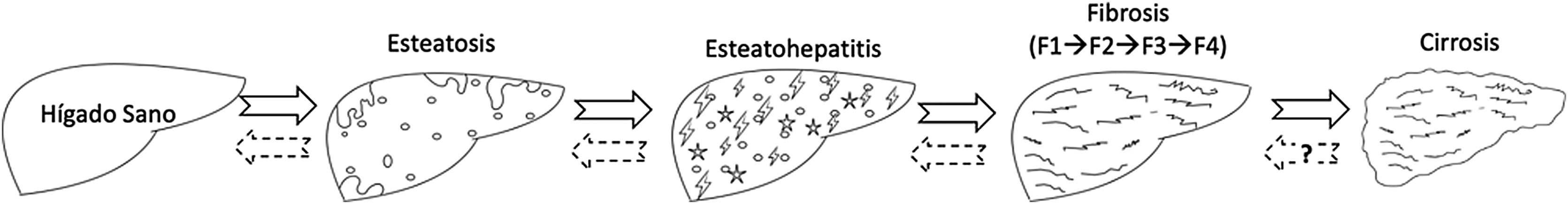
La EHmet en realidad es un término genérico que abarca diferentes estadios de gravedad de la enfermedad que van desde la esteatosis simple hasta la cirrosis, pasando por esteatohepatitis no alcohólica (Non-alcoholic steatohepatitis [NASH]) y diferentes grados de fibrosis (estadios F0 a F4). Por tanto, el término NASH es únicamente una fase de la EHmet, concretamente la fase de inflamación de la grasa (esteatohepatitis). Esta fase implica una progresión más acelerada de la EHmet, puesto que es donde se estimulan mecanismos fibrogénicos que causan fibrosis en diferentes estadios, hasta llegar, en última instancia, a la cirrosis. La historia natural de la enfermedad se muestra en la figura 1.
Evolución histológica del hígado graso no alcohólico o enfermedad hepática metabólica (EHmet). Las diferentes fases de la EHmet pueden ser reversibles si se actúa a tiempo con las medidas necesarias, aunque en fase de cirrosis la reversibilidad completa es más controvertida.
Fuente: elaboración propia.
La EHmet es considerada actualmente la hepatopatía más frecuente en los países occidentales, con una prevalencia global del 25% en población general y de más del 60% en población diabética, y es una causa creciente de cirrosis y trasplante hepático2,3. La incidencia de la EHmet aumenta en paralelo a la incidencia de diabetes y obesidad, íntimamente relacionada con la resistencia a la insulina. Actualmente, la prevalencia de diabetes mellitus tipo 2 (DM2) en adultos en España (20-79 años) es del 14,8%4, mientras que la de obesidad y sobrepeso es del 16% y del 35-40%, respectivamente5. Si tenemos en cuenta que hasta un 40% de los pacientes diabéticos pacientes desarrollarán nefropatía diabética (ND) a lo largo de su evolución6, y que la ND es la principal causa de enfermedad renal crónica (ERC) se hace patente la gran magnitud del problema y la necesidad de actuar. Hay una estrecha relación entre la EHmet y la ERC, existiendo cada vez mayor evidencia de que la EHmet puede influir negativamente en la evolución de la enfermedad renal o incluso precederla. El objetivo de este trabajo es resumir los principales nexos de unión entre EHmet y ND, y proponer un algoritmo de colaboración que ayude a detectar pacientes de mayor riesgo y mejorar su pronóstico.
Diagnóstico de la EHmet y estratificación de riesgoLa mayor parte de los pacientes con EHmet no tiene signos ni síntomas de enfermedad hepática en el momento diagnóstico. El hígado graso suele ser un hallazgo casual en una técnica de imagen realizada por otro motivo (ecografía, tomografía computarizada o resonancia magnética). Sin embargo, la distinción entre esteatosis simple, esteatohepatitis o el estadiar la gravedad de la fibrosis, únicamente se puede realizar fehacientemente mediante una biopsia hepática. Al ser la biopsia una técnica costosa y no exenta de riesgo, se han desarrollado marcadores no invasivos tanto de esteatosis como de fibrosis. Desafortunadamente, todavía no tenemos marcadores no invasivos que detecten esteatohepatitis de forma fiable.
La principal causa de mortalidad global en la EHmet son las enfermedades cardiovasculares, seguido de las neoplasias extrahepáticas y, por último, la propia enfermedad hepática (cirrosis descompensada y hepatocarcinoma)7. La mortalidad está directamente relacionada con la fibrosis hepática siendo este factor, por tanto, el principal predictor de mal pronóstico en los pacientes con EHmet8, lo que obliga a centrar los esfuerzos de detección en el subgrupo de pacientes con EHmet y mayor fibrosis9.
El término fibrosis significativa se refiere a un estadio histológico F2 o superior, y fibrosis avanzada a un estadio F3 o superior. Se han desarrollado multitud de marcadores no invasivos de fibrosis: biomarcadores indirectos, biomarcadores directos, técnicas de imagen, «ómicas», etc…, pero no es objeto de esta revisión ser exhaustivos en la descripción de todos y cada uno de ellos, y vamos a describir los más utilizados en práctica clínica real:
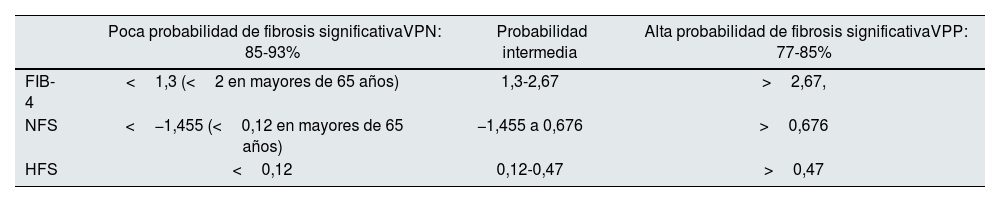
Marcadores indirectos de fibrosis hepática: las transaminasas no se correlacionan con el nivel de fibrosis ni la gravedad de la enfermedad. Sin embargo, sí que son de utilidad cuando se les da un uso integrado con otras variables en fórmulas matemáticas que nos dan una puntuación o score de fibrosis. Los índices de mayor uso en práctica clínica son el FIB-4 (incluye edad, AST, ALT, plaquetas)10, NAFLD fibrosis score o NFS (edad, DM/glucemia basal alterada en ayunas, AST/ALT, plaquetas, albumina)11 y Hepamet fibrosis score (HFS) (edad, AST, DM, plaquetas, albúmina, HOMA-IR)12. En general, tienen un elevado valor predictivo negativo (VPN) que les permiten descartar la presencia de fibrosis avanzada con bastante fiabilidad (tabla 1). Esta característica, unido a su bajo coste y elevada accesibilidad, les convierte en la prueba de primera línea para identificar a los pacientes con menor riesgo de fibrosis y disminuir la cantidad de exploraciones necesarias. Además, el uso combinado de HFS, NFS y FIB-4 aumenta la capacidad de discriminación de pacientes sin fibrosis avanzada, por lo que son los métodos de elección en atención primaria o en consultas no hepatológicas9.
Tabla 1.Dinteles o puntos de corte de los principales índices no invasivos de fibrosis para descartar o detectar fibrosis significativa
Poca probabilidad de fibrosis significativaVPN: 85-93% Probabilidad intermedia Alta probabilidad de fibrosis significativaVPP: 77-85% FIB-4 <1,3 (<2 en mayores de 65 años) 1,3-2,67 >2,67, NFS <−1,455 (<0,12 en mayores de 65 años) −1,455 a 0,676 >0,676 HFS <0,12 0,12-0,47 >0,47 FIB-4: Fibrosis-4-Index; HFS: hepamet fibrosis score; NFS: NAFLD fibrosis score; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Marcadores directos de fibrosis hepática y metabolómica: Los marcadores directos de fibrosis miden productos de síntesis o de degradación de colágeno o de matriz extracelular, por lo que tienen mayor precisión diagnóstica que los marcadores indirectos, aunque la disponibilidad en los laboratorios suele ser menor y su coste es más elevado al ser índices patentados.Enhanced Liver Fibrosis (ELF®) es un método basado en la determinación de los niveles de ácido hialurónico (AH), péptido aminoterminal del procolágeno III (PIIINP) y el inhibidor tisular de la metaloproteinasa I (TIMP-1).Por otra parte, el OwlLiver® es una técnica lipidómica con un VPN del 75% para esteatohepatitis y fibrosis significativa.Tanto el ELF® como el OwlLiver® se suelen utilizar en casos en los que los marcadores de primera línea (indirectos) ofrecen dudas respecto al grado de fibrosis hepática. Por ejemplo, la utilización de ELF® como test de segunda línea tras FIB-4 reduce significativamente las tasas de derivación a hepatología. Pese a estos buenos resultados, el bajo coste y la fácil accesibilidad de los marcadores indirectos ha hecho que estos sean los más utilizados en la práctica clínica diaria9.
Elastografía hepática: se podría incluir dentro del grupo de las técnicas de imagen, porque en realidad se considera una técnica de ecografía modificada. Se basa en la medición de la rigidez de un tejido mediante la emisión de un pulso mecánico que produce una onda elástica que se transmite a través del tejido. La velocidad de propagación de la onda elástica es proporcional a la rigidez del tejido (cuanto más fibrótico sea el tejido, más rápidamente se propagará la onda). El resultado se expresa en unidades de kilopascal (kPa). La elastografía de transición mediante FibroScan® en la mayoría de algoritmos se sitúa como la prueba de segunda línea a realizar en los pacientes en los que no se ha podido descartar la fibrosis avanzada con métodos analíticos más sencillos. Un valor de rigidez hepática <8kPa descarta fibrosis avanzada con un VPN: 95-100%. Los pacientes con ≥8kPa deben ser estudiados en profundidad, en ocasiones con una biopsia hepática9.
La DM2 es un claro factor predisponente para EHmet y también empeora su pronóstico, porque el curso evolutivo es más acelerado en diabéticos que en población no diabética. Pero la EHmet también predispone al desarrollo de DM2 e hipertensión arterial, sobre todo cuando la fibrosis está más avanzada13. Por ello, las principales sociedades científicas de hepatología y de endocrinología recomiendan cribar y estratificar la EHmet en todo paciente diabético y buscar diabetes en todo paciente con esteatosis hepática7,14-17.
Numerosas publicaciones apuntan a un riesgo cardiovascular (RCV), especialmente aumentado en pacientes con EHmet. Estos pacientes tienen un mayor riesgo de enfermedad cardiovascular (ECV) subclínica (disfunción endotelial, aterosclerosis, aumento del grosor de la capa íntima media carotídea) y de eventos cardiovasculares mayores (cardiopatía isquémica, arritmias, insuficiencia cardíaca con fracción eyección preservada, valvulopatía e ictus)18-20. Esta asociación parece ser independiente de los factores de riesgo cardiovascular tradicionales y su magnitud aumenta con la gravedad de la afectación hepática. No obstante, la EHmet aún no se puede considerar como un factor de riesgo cardiovascular independiente, pero claramente es un potenciador del mismo, y debería tenerse en cuenta a la hora de evaluar el RCV en cualquier paciente21.
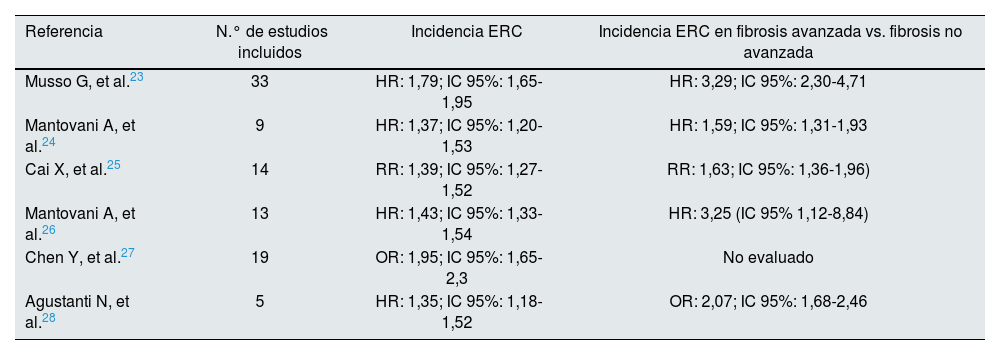
La EHmet también incrementa el riesgo de la ERC, definida por una tasa de filtrado glomerular menor de 60ml/min/1,73m2 o cociente albumina/creatinina urinario (ACR) mayor de 30mg/g. Existen muchos puntos en común entre EHmet y ERC, tanto desde el punto de vista fisiopatológico como clínico. Es ampliamente conocido que el desarrollo de ERC en todo paciente diabético conlleva un incremento paralelo en el riesgo cardiovascular y la mortalidad, y en este contexto, de nuevo la EHmet podría considerarse seriamente como un potenciador22. En ambas patologías, los acontecimientos cardiovasculares son la principal causa de mortalidad. Hasta la fecha, existen 6 metaanálisis publicados que muestran una evidente relación entre EHmet y ERC (tabla 2)23-28. Aunque la mayoría son estudios retrospectivos, y con heterogeneidad en cuanto a poblaciones, seguimientos, definiciones (EHmet, ERC) se observa claramente que los pacientes con EHmet y función renal basal conservada tienen una incidencia entre 1,5 y 1,95 veces superior a la población general de comenzar con ERC en los 5-10 años siguientes. Esta asociación persiste tras corregir por variables de confusión que predisponen también a ERC (edad, género, IMC, dislipemia, HTA, DM2, tabaquismo, función renal basal).
Metaanálisis que han analizado la relación entre la EHmet y ERC
| Referencia | N.° de estudios incluidos | Incidencia ERC | Incidencia ERC en fibrosis avanzada vs. fibrosis no avanzada |
|---|---|---|---|
| Musso G, et al.23 | 33 | HR: 1,79; IC 95%: 1,65-1,95 | HR: 3,29; IC 95%: 2,30-4,71 |
| Mantovani A, et al.24 | 9 | HR: 1,37; IC 95%: 1,20-1,53 | HR: 1,59; IC 95%: 1,31-1,93 |
| Cai X, et al.25 | 14 | RR: 1,39; IC 95%: 1,27-1,52 | RR: 1,63; IC 95%: 1,36-1,96) |
| Mantovani A, et al.26 | 13 | HR: 1,43; IC 95%: 1,33-1,54 | HR: 3,25 (IC 95% 1,12-8,84) |
| Chen Y, et al.27 | 19 | OR: 1,95; IC 95%: 1,65-2,3 | No evaluado |
| Agustanti N, et al.28 | 5 | HR: 1,35; IC 95%: 1,18-1,52 | OR: 2,07; IC 95%: 1,68-2,46 |
ERC: enfermedad renal crónica; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; OR: odds ratio; RR: riesgo relativo.
De los 13 artículos solamente uno evaluaba la fibrosis mediante biopsia hepática.
Además, parece que el incremento de riesgo de ERC se relaciona más con el componente metabólico que con la propia esteatosis hepática. Los pacientes que cumplen criterios de EHmet tienen mayor incidencia de ERC, pero no así los pacientes con esteatohepatitis no alcohólica sin síndrome metabólico29.
Análogamente a lo que ocurría con la afectación cardiovascular, la afectación renal es tanto mayor cuanto más avanzada está la fibrosis hepática (aunque hay pocos estudios con biopsia hepática).
Si abordamos el problema de la EHmet desde el punto de vista renal, uno de los pocos estudios con ND confirmada por biopsia renal demuestra que la existencia de EHmet empeora el pronóstico de la ERC30, sobre todo cuando existe más fibrosis hepática estimada por marcadores no invasivos.
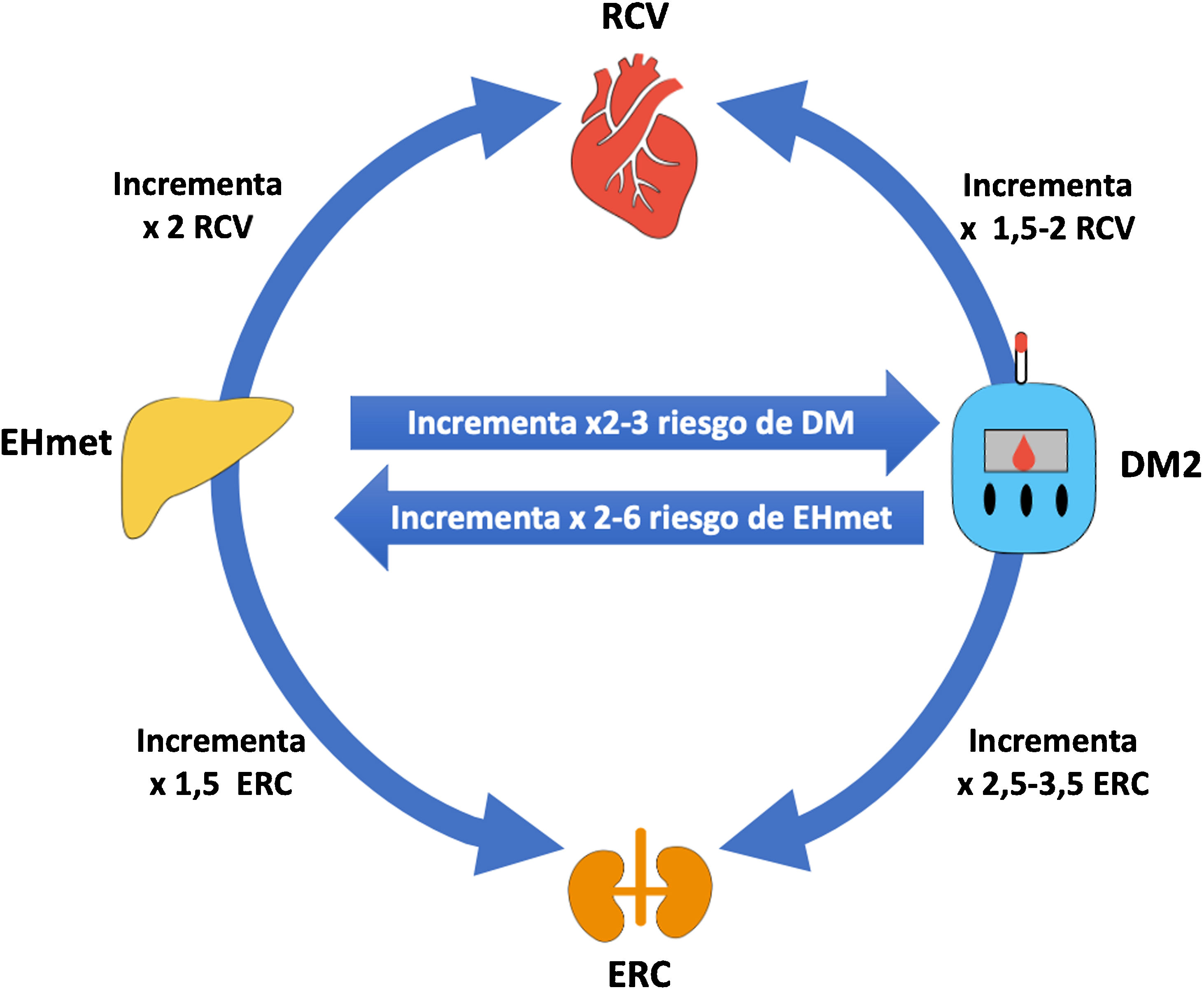
En la figura 2 se ilustra un esquema de las interacciones entre EHmet, DM2, ECV y enfermedad renal. Puede observarse cómo tanto la EHmet como la DM2 incrementan el riesgo CV y renal de forma independiente, y además cuando coexisten ambas entidades tanto la DM como la EHmet se potencian y multiplican dicho riesgo15,31,32.
Interrelación hígado graso, riesgo cardiovascular, diabetes y enfermedad renal.
DM2: diabetes mellitus tipo 2; EHmet: esteatosis hepática metabólica; ERC: enfermedad renal crónica; RCV: riesgo cardiovascular.
Fuente: modificado de Targher et al.31.
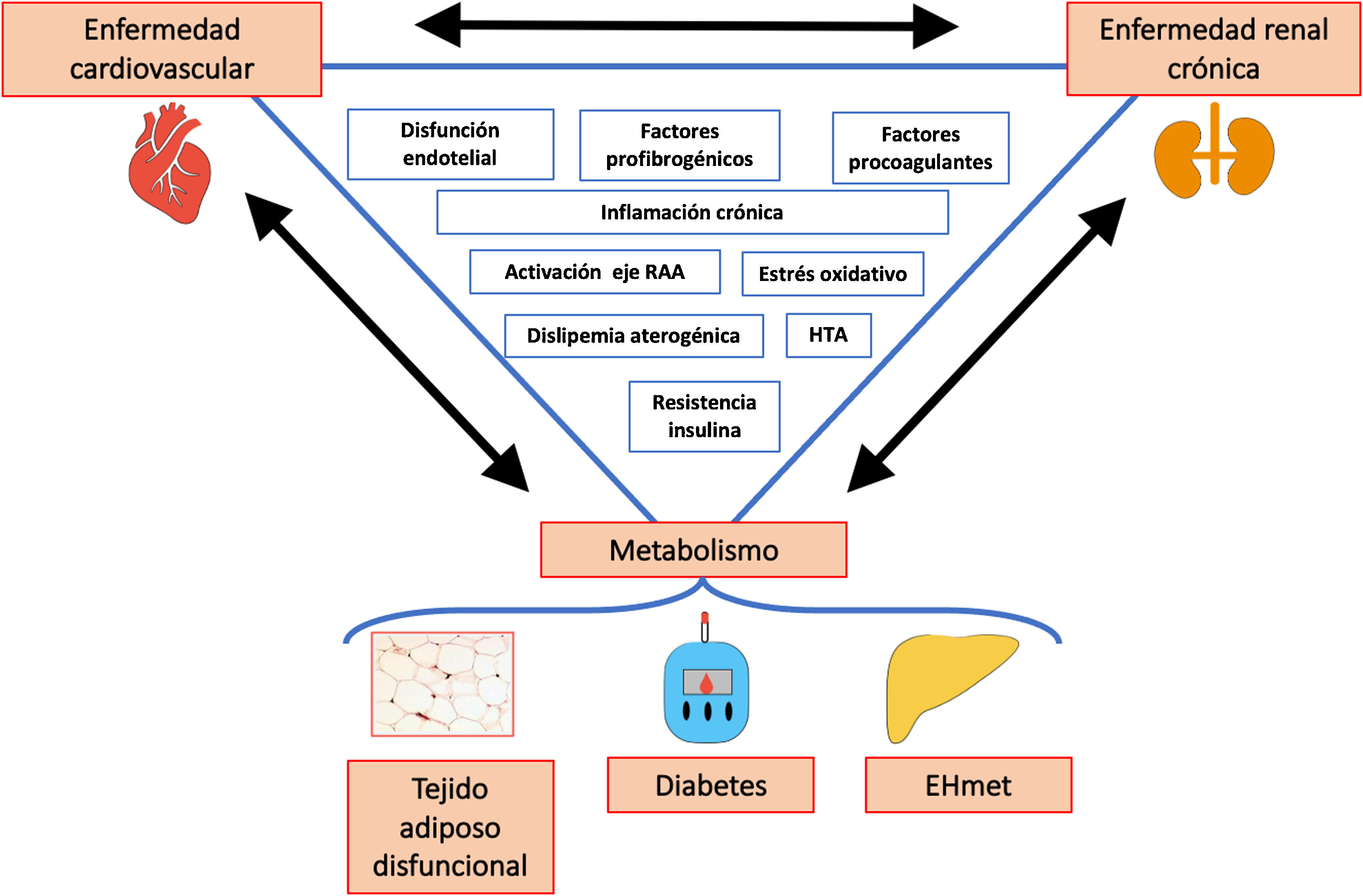
La hipótesis de que la EHmet aumenta la incidencia y prevalencia de ERC tiene plausibilidad biológica. El vínculo patogénico principal es la inflamación crónica y la resistencia periférica a la insulina. Aunque se requieren más estudios prospectivos, la evidencia disponible sugiere que la EHmet (especialmente cuando hay más fibrosis) exacerba la resistencia a la insulina (RI) y empeora la evolución de la HTA y la DM2 a la vez que promueve la dislipemia aterogénica. La RI a su vez interfiere con el tejido adiposo y empeora su disfunción, favoreciendo la llegada de más ácidos grasos al hígado, lo que provoca más RI a modo de círculo vicioso.
A nivel molecular, tanto en la EHmet como en la ERC existe una liberación al torrente sanguíneo de citoquinas proinflamatorias (TNF-α, IL-1, IL-6, IL-17, IL-22, 23, PCR) y una disminución de las antiinflamatorias (adiponectina, TGF-beta, IL-4, IL-10), así como aumento de factores procoagulantes (PAI-1, fibrinógeno, factor VII) y pro-fibrogénicos (FGF-21, TGF-beta), y factores de estrés oxidativo y de lesión endotelial que claramente incrementan el riesgo de ECV y renal32,33.
Merece la pena destacar la importancia del estrés oxidativo en la patogénesis de la EHmet, puesto que tiene un papel acelerador del paso de esteatohepatitis a fibrosis. De manera análoga, en la ND la producción de radicales libres está incrementada por la hiperglucemia, y eso resulta en liberación de citoquinas proinflamatorias, factores de crecimiento y factores de transcripción que paulatinamente van provocando cambios en la estructura y función renales que finalmente conducen a ERC.
Hay otras moléculas implicadas en la relación entre EHmet y ERC (adiponectina, fetuina-A, leptina, resistina, visfatina, aldosterona, ácido úrico), aunque los mecanismos no están del todo claros aún y el análisis de la evidencia está fuera de los objetivos de esta revisión. En la figura 3 se muestra un resumen de la compleja interacción entre los componentes del eje cardio-nefro-hepatometabólico22,33,34.
Papel de los marcadores no invasivos en la identificacion de pacientes de mayor riesgoEl hecho de que los pacientes con EHmet más evolucionada tengan mayor riesgo de ERC y de ECV obliga a centrar los esfuerzos en el subgrupo de pacientes con EHmet y mayor fibrosis.
Los marcadores no invasivos de fibrosis no solo sirven para estratificar la gravedad hepática de los pacientes, sino que también han demostrado utilidad como marcadores de riesgo cardiovascular y renal. Previamente se ha comentado la relación que existe entre fibrosis avanzada medida mediante marcadores no invasivos de fibrosis y eventos cardiovasculares18. Análogamente, desde el punto de vista nefrológico, también existen estudios tanto prospectivos como retrospectivos que muestran que valores de FIB-4 elevados35-38, incrementan el riesgo de padecer ERC tanto en población diabética como no diabética. Resultados similares se han obtenido con el NFS39-41. La elastografía hepática mediante FibroScan® también es capaz de predecir el deterioro de función renal en los pacientes con EHmet con o sin DM242,43. Así, el metaanálisis de Ciardullo et al. detectaron una asociación entre valores elevados de FibroScan® y un aumento del cociente albuminuria/creatininuria (OR: 1,98; IC 95%: 1,29-3,05; p=0,002), y una mayor incidencia de ERC (OR: 2,49; IC 95%: 1,89-3,29; p<0,001).
El motivo principal de la utilización de marcadores no invasivos de fibrosis en pacientes con ERC es la identificación de pacientes de mayor riesgo de progresión de la enfermedad tanto hepática como renal para, en última instancia, actuar precozmente y mejorar su pronóstico.
Manejo actual de la EHmetEl tratamiento tiene dos objetivos: mejorar el pronóstico hepático y mejorar el pronóstico cardiovascular. De ahí la importancia de trabajar de una forma multidisciplinar. Es importante insistir en que los esfuerzos deben ir dirigidos a la detección y al tratamiento de los estadios avanzados de la EHmet (fibrosis avanzada), ya que son los que verdaderamente incrementan el riesgo de padecer otras enfermedades como las cardiovasculares, además de los riesgos que la propia enfermedad hepática comporta.
Modificación del estilo de vidaLa modificación del estilo de vida (dieta mediterránea, ejercicio físico) es la piedra angular en el tratamiento de estos pacientes. Una pérdida de peso del 3-5% de peso mejora la esteatosis, del 7-10% mejora la esteatohepatitis y ≥10% consigue mejorar la fibrosis hepática15. La pérdida de peso también mejora el pronóstico de las comorbilidades metabólicas y del riesgo cardiovascular. Es más, estudios con biopsia hepática han demostrado que la mejoría de la fibrosis hepática obtenida con las modificaciones del estilo de vida se asociaron de forma independiente a la mejoría de la función renal en pacientes con EHmet44. El ejercicio físico, incluso en ausencia de pérdida ponderal, mejora la EHmet. Se recomienda combinar ejercicio aeróbico con anaeróbico, de una duración de 150-300min por semana si es de moderada intensidad o 75-150min por semana si es vigoroso45.
Huelga decir que es necesario promover la abstinencia alcohólica y el cese del hábito tabáquico en estos pacientes.
FarmacoterapiaActualmente no existe un tratamiento farmacológico específico de la EHmet que, por lo que hay múltiples ensayos clínicos en desarrollo. Existen excelentes revisiones sobre las moléculas y los fármacos que podrían ser futuras terapias para la EHmet46,47, pero su exposición detallada está fuera de los objetivos de este artículo.
El concepto fundamental de un posible abordaje farmacológico es tener en mente que los pacientes con EHmet tienen mayor riesgo renal y cardiovascular, por una parte, y mayor riesgo hepático por otra. Teniendo en cuenta estas premisas, es especialmente importante en estos pacientes un buen control de la hipertensión arterial, la dislipemia y la diabetes. Las estatinas son seguras en los pacientes con EHmet. Una aproximación lógica sería pautar fármacos que sirvieran para lograr dos objetivos a la vez: disminuir el riesgo cardiovascular y disminuir el riesgo hepático. Esto incluiría agentes actualmente en investigación contra la diana metabólica, contra el estrés oxidativo, contra la inflamación y el estrés oxidativo o contra la fibrosis. Actualmente es muy interesante la opción que ofrecen los nuevos antidiabéticos, como los agonistas del receptor glucagón-like-peptide 1 (GLP-1), los inhibidores del cotransportador sodio-glucosa-2 (iSGLT-2) o incluso los agonistas duales GLP1-GIP, porque dichos agentes no solo ejercen acciones hepatoprotectoras, sino que también ofrecen claro beneficio a nivel renal y cardiovascular48,49.
Recientemente se ha publicado un subanálisis del estudio CANVAS y CANVAS-R (CANagliflozin cardioVascular Assessment Study [CANVAS] Program), donde se evidencia el papel de los iSGLT2 sobre los marcadores no invasivos de fibrosis en los pacientes con EHmet y DM2, con un efecto independiente del control glucémico y la pérdida de peso. Asociando este efecto a los beneficios de estos fármacos en la ERC, hacen que sea una herramienta muy prometedora en los pacientes con EHmet y ERC50.
Propuesta de algoritmo de manejo conjuntoA la vista de los estudios publicados hasta la fecha sobre la relación entre EHmet y ERC, no cabe duda de la necesidad de una evaluación doble y recíproca: por una parte, la evaluación periódica de función renal en pacientes con EHmet (por su mayor riesgo de desarrollar ERC) y, por otra parte, la evaluación hepática en pacientes con ERC, especialmente nefropatía diabética.
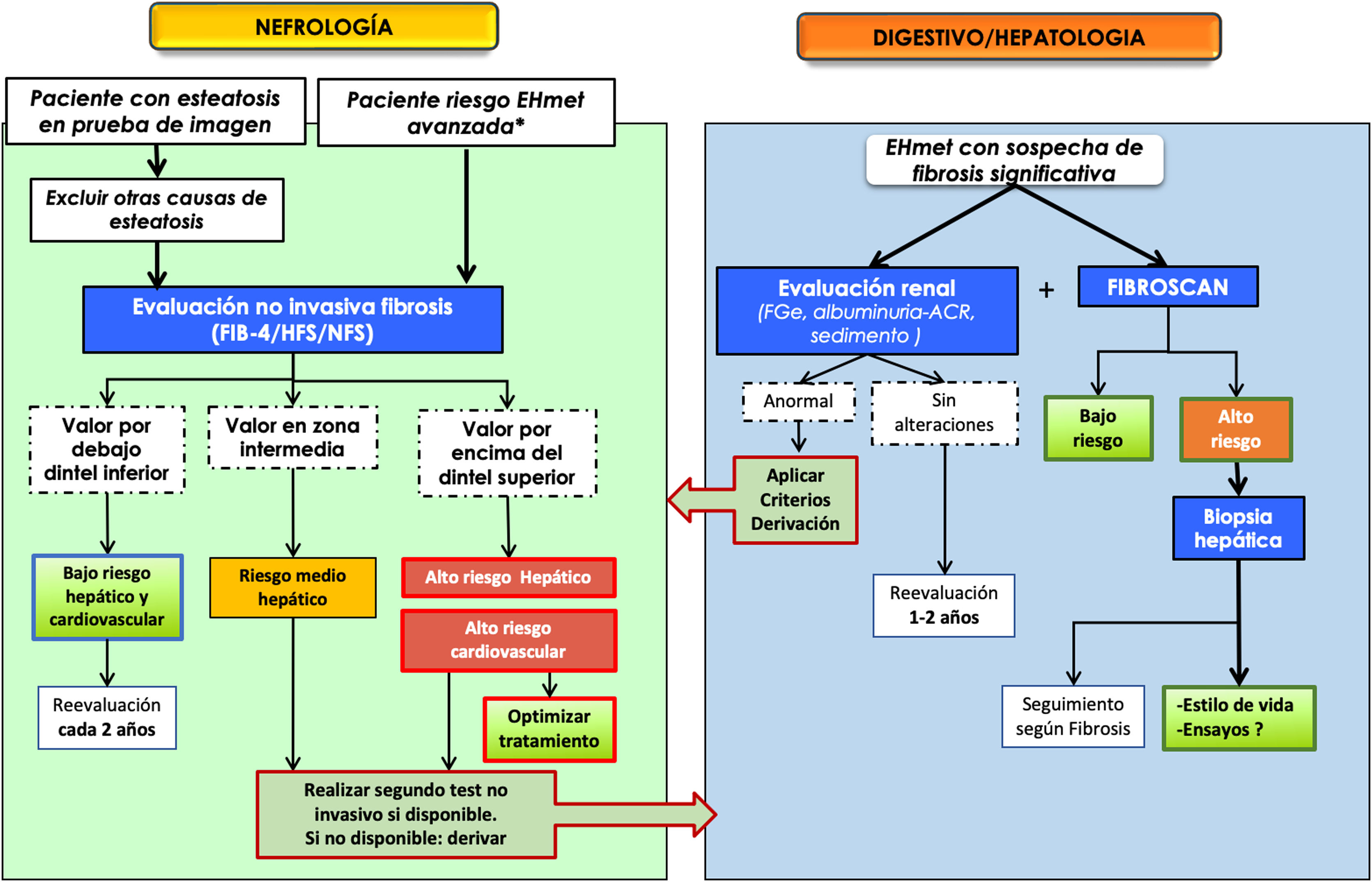
Por otro lado, dado el gran impacto sanitario que supone la morbimortalidad cardiovascular asociada a ERC y EHmet, también es necesario profundizar al máximo en el exquisito control de los factores de riesgo cardiovascular para mejorar el pronóstico de estos pacientes. Por ello no es de extrañar que el abordaje multidisciplinar cobre especial importancia en la EHmet. En este sentido, ya se han publicado recientemente algunas recomendaciones para facilitar también el manejo conjunto de pacientes diabéticos con EHmet14,17,49. Siguiendo la evidencia científica y siendo coherente con los principales documentos de consenso y guías de práctica clínica respecto al diagnóstico y manejo de la EHmet7,9,14,15, la población diana de mayor riesgo serían los pacientes con DM2, obesidad o síndrome metabólico, especialmente con una edad >50 años. Se recomienda un algoritmo en 2 pasos: primero empezar solicitando un estudio no invasivo mediante los índices de fibrosis hepática como FIB-4, HFS o NFS para descartar o detectar fibrosis importante. Si el resultado del test es indeterminado o bien arroja resultado compatible con fibrosis avanzada, se debe realizar otra prueba más exacta, preferentemente la elastografía de transición (FibroScan®), y si no está disponible, se puede optar por tests patentados como el ELF® o el OwlLiver®. Si ninguno de estos tests está disponible o bien los resultados siguen siendo indicativos de fibrosis avanzada, se debe indicar la derivación a digestivo para completar el estudio diagnóstico, ajustar el seguimiento y valorar las opciones terapéuticas.
En la figura 4 se ha dibujado un posible diagrama de flujo en el que queda patente la necesaria interacción entre los distintos profesionales sanitarios que atienden a pacientes con ERC, diabetes, ND o cardiopatía. Los métodos y los intervalos de cribado y monitorización son aproximados, a falta de más estudios prospectivos en los que se elucidará finalmente cuál va a ser la mejor ruta asistencial.
Algoritmo propuesto para el manejo conjunto entre nefrología y hepatología para la enfermedad hepática metabólica o hígado graso no alcohólico.
ACR: cociente albuminuria/creatininuria; EHmet: enfermedad hepática metabólica; FGe: filtrado glomerular estimado; HFS: hepamet fibrosis score; NFS: NAFLD fibrosis score.
*Paciente con riesgo de EHmet avanzada (fibrosis significativa): paciente con obesidad (especialmente si IMC>35) o DM tipo 2 o con síndrome metabólico, sobre todo si es mayor de 50 años9.
.
La EHMET y la ERC, especialmente la nefropatía diabética, son 2 entidades muy prevalentes y con importantes consecuencias en la salud cardiovascular. Comparten factores de riesgo y vías fisiopatológicas comunes y complejas, pudiendo la EHmet preceder a la ERC. Además, cuando coexisten, se potencian sus efectos deletéreos. El algoritmo de aproximación al manejo multidisciplinar es una llamada a la acción para detectar pacientes de alto riesgo en los cuales poder ajustar mejor el seguimiento y el tratamiento y, en última instancia, mejorar su pronóstico.
FinanciaciónEl trabajo no tiene ninguna fuente de financiación.
Conflicto de interesesSB declara no tener ningún conflicto de intereses con relación al presente trabajo. FM declara no tener ningún conflicto de intereses y JLG informa honorarios personales de NovoNordisk (Honorarios, Advisory), Boehringer (honorarios, asesoramiento y consultoría), Eli Lilly (honorarios), AstraZeneca (honorarios, asesoramiento y subvenciones).