Tipo de diseño y seguimiento Ensayo clínico aleatorizado, multicéntrico con seguimiento a 16 semanas.
Ética y registro Protocolo aprobado por los comités de ética de investigación de los centros participantes. Se obtuvo el consentimiento informado de todos los pacientes. Registrado en clinicaltrials.gov NCT00330369.
Asignación Aleatorización realizada por un grupo externo al laboratorio financiador. Se adjudicó de forma centralizada por un sistema telefónico automatizado y se estratificó por presencia de diabetes mellitus (DM), enfermedad renal crónica (ERC) y raza (negra frente a otras).
Enmascaramiento Doble ciego.
Ámbito Se incluyeron en el estudio 117 centros de Norteamérica, Sudamérica, Europa, Nueva Zelanda y Australia
Pacientes Pacientes con hipertensión arterial (HTA) resistente al tratamiento, definida como presión arterial sistólica (PAS) igual o superior a 140 mmHg (o a 130 mmHg en presencia de DM o ERC) en tratamiento con 3 fármacos, incluyendo un diurético a dosis plenas. Se consideró una dosis mínima de 25 mg de hidroclorotiazida (o su equivalente de otras tiazidas) y la dosis del resto de antihipertensivos debía ser la más alta aprobada para esta indicación o tolerada, la habitual en la práctica clínica local o la más apropiada a juicio del investigador. Además, el índice de masa corporal (IMC) debía estar comprendido entre 20 y 43 kg/m2 y el filtrado glomerular estimado (FGe) ser igual o superior a 30 ml/min/1,73 m2. Las mujeres incluidas no podían tener posibilidad de gestación. Se excluyeron aquellos pacientes con PAS igual o superior a 180 mmHg, PAD igual o superior a 110 mmHg, insuficiencia cardíaca, DM mal controlada, anemia, hepatopatía, así como los que hubieran sufrido un episodio coronario, arritmia o ictus en los 6 meses previos.
Intervenciones Tras un período de 2 semanas de simple ciego controlado con placebo para confirmar el rango de las cifras de PA se realizó un cribado inicial con 718 pacientes, 379 pacientes fueron incluidos y aleatorizados en proporción 7:7:7:11 a tratamiento con darusentán 50, 100, 300 mg o placebo una vez al día. Las dosis más elevadas de darusentán se alcanzaron por titulación bisemanal y se permitió una reducción de dosis enmascarada en caso de intolerancia. No se permitió modificar el resto de los fármacos antihipertensivos, a excepción de la dosis de diurético que se pudo aumentar en caso de edema o expansión de volumen extracelular (VEC).
Variables de resultado
Principal: cambios en PAS y PAD en consulta de basal a semana 14.
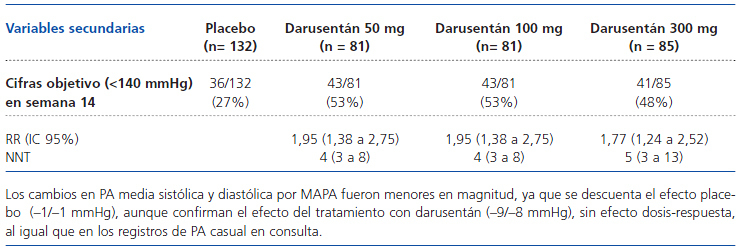
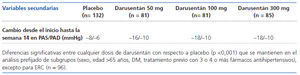
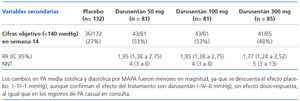
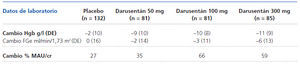
Secundarias: cambios en PAS y PAD por MAPA, porcentaje de pacientes que alcanzan cifras objetivo de PA, cambios en FGe, seguridad y tolerancia de darusentán.
Tamaño de la muestra Con el supuesto de una diferencia ajustada con placebo desde la basal de 8 mmHg (DE 15) en PAS para cualquier dosis de darusentán, se necesitarían 121 pacientes en el grupo placebo y 77 en cada grupo de tratamiento activo para detectar una diferencia entre el placebo y al menos una dosis de darusentán con una potencia del 95%.
Estadística Análisis por intención de tratar, sin reemplazar datos perdidos, aunque se utilizó el último registro disponible en ausencia del dato de la semana 14. Se realizó un ANCOVA con el grupo de tratamiento, los factores utilizados para la estratificación (DM, ERC y raza) y los valores basales de PAS y PAD como variables independientes y los cambios en PAS y PAD desde basal a la semana 14 como variable dependiente. La proporción de pacientes que alcanzaron las cifras objetivo de PA se analizó con regresión logística con las mismas covariables. Los cambios en FGe y PA por MAPA se analizaron de forma similar a la variable principal. Sólo se incluyeron los datos de MAPA que cumplieran criterios de calidad preespecificados. Se ajustó el error de tipo I de acuerdo con el método de secuencia fija de Bonferroni.
Promoción y conflicto de intereses Financiado por el laboratorio farmacéutico Gilead Sciences. Siete de los autores de la publicación del estudio reconocen haber recibido honorarios como consultores o becas de investigación de varias compañías farmacéuticas y tres trabajan o han trabajado en la compañía farmacéutica que financia el ensayo.
RESULTADOS PRINCIPALES
ANÁLISIS BASAL DE LOS GRUPOS Se incluyeron 379 pacientes, 132 en el grupo de placebo, 81 en los grupos de darusentán 50 y 100 mg y 85 en el grupo de darusentán 300 mg; 31 pacientes (8,2%) no completaron el estudio por retirada de consentimiento, efectos adversos, pérdida de seguimiento u otras razones, sin diferencias entre los grupos. Las características basales fueron similares entre los grupos, con una edad media (DE) de 62 (9) años, el 50% eran hombres, el 20% de raza negra, IMC 32 (5) kg/m2, FGe 79 (21) ml/min/1,73 m2, el 27% tenían cardiopatías, el 40% DM, el 25% ERC y el 39% albuminuria/creatinina mayor de 30 mg/g. La PAS media fue de 151 (11) mmHg, la PAD media de 86 (11) mmHg, la frecuencia cardíaca de 67 (10) lat/min y el 58% estaban en tratamiento con cuatro o más fármacos antihipertensivos que incluían diuréticos (99%), IEAC o ARA2 (97%), bloqueadores de los canales de Ca (74%), betabloqueantes (66%) y otros (21%). Además, el 46% recibían estatinas, el 39% AAS y 135 uno o más antidiabéticos, incluyendo insulina. Por MAPA, la PAS media fue de 135 (13) mmHg y la PAD de 78 (11) mmHg.
CONCLUSIONES DE LOS AUTORES El tratamiento con darusentán reduce de forma eficaz la PAS y la PAD en pacientes con HTA resistente bajo tratamiento con 3 o 4 fármacos, con un buen perfil de seguridad, salvo por la expansión de volumen, lo que obliga a tratamiento concomitante con diuréticos en un alto porcentaje de pacientes.
COMENTARIOS DE LOS REVISORES A pesar del reconocido papel patogénico de la endotelina en la hipertensión esencial1, la utilización de antagonistas de receptores de endotelina no selectivos, como el bosentán, no ha encontrado un hueco en el tratamiento de la HTA, aunque estudios de hace más de 10 años2 demostraron su eficacia. El bajo perfil de seguridad por la teratogenicidad y, sobre todo, el alto potencial (mayor del 10%) de hepatotoxicidad, que obliga a controles mensuales, han limitado su aprobación para esta indicación por las agencias reguladoras. Sin embargo, sí se utiliza el bosentán, aunque a dosis mucho mas bajas (125 mg/12 h) que las descritas, para el control de las cifras de PA, en el tratamiento de la hipertensión arterial pulmonar grupo 1 de la OMS. El presente estudio describe el empleo de otro antagonista de los receptores endoteliales de la endotelina, en este caso selectivo para receptores tipo A, el darusentán, en el tratamiento de la HTA resistente. Es un ensayo clínico con metodología correcta, realizado en población representativa de HTA resistente3, que presenta una importante reducción de las cifras de PA, tanto PAS como PAD (9 y 8 mmHg, respectivamente), con un buen perfil de seguridad salvo por la expansión de VEC hasta en un 25% de los pacientes, que obligó a aumentar la dosis de diuréticos. Además, redujo la microalbuminuria en un 60% de media, a pesar del tratamiento concomitante con IECA o ARA2, aunque otros estudios no han demostrado la existencia de efectos sobre las lesiones en órgano diana, como remodelado del ventrículo izquierdo4. Supone una alternativa a la utilización habitual de espironolactona en estas circunstancias5, quizá no tan efectiva, aunque sin duda se necesitan más estudios clínicos para definir el papel de los antagonistas selectivos de la endotelina en el tratamiento de la HTA6.
CLASIFICACIÓN
Tema: Nefrología clínica.
Subtema: Hipertensión arterial resistente.
Tipo de artículo: Tratamiento.
NIVEL DE EVIDENCIA: Alto.
GRADO DE RECOMENDACIÓN: Fuerte.
Sistema GRADE (www.gradeworkinggroup.org)
Tabla . Variables secundarias I
Tabla . Variables secundarias II
Tabla . Datos de laboratorio