Describimos el caso de una paciente de 27 años con antecedentes de hipertensión y lupus cutáneo, que ingresa para la realización de una biopsia renal al presentar proteinuria (2.081mg/g), microhematuria (10-20 hematíes/campo) y leve deterioro funcional (Crp 1,3mg/dl). Como complicaciones presentó grave hematoma perirrenal que precisó embolización selectiva y, posteriormente, fiebre que se atribuyó al procedimiento y reabsorción del hematoma, siendo los estudios microbiológicos negativos. El hemograma mostraba anemización (Hb 8g/dl) en el contexto referido, con leucocitos y plaquetas normales. Respecto a la autoinmunidad, ANA positivos (1/160), anti-DNA positivo (33U/ml) y ENA, SSA, SSB, U1-RNP, Sm y Scl-70 negativos. El anticoagulante lúpico (2,3) y los anticuerpos anticardiolipina IgG (253U/ml) fueron positivos con niveles de C3 disminuidos (70mg/dl). La biopsia renal se tipificó como nefropatía lúpica tipo iii. En ella se apreciaban solo 3 glomérulos (2 con aumento de matriz mesangial y uno con esclerosis-hialinosis focal y segmentaria), sin asas de alambre ni semilunas. La inmunofluorescencia mostró depósitos en mesangio y en membrana basal glomerular de gran intensidad para IgG, C3 y C1Q, y de intensidad leve-moderada para IgA, IgM y C4.
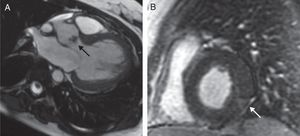
Ante la presencia de un soplo a la auscultación, y la persistencia de fiebre, se realizó un ecocardiograma que demostró una válvula aórtica bicúspide con una imagen de vegetación en el borde libre de sus 2 velos, condicionando una insuficiencia severa. Aunque el origen infeccioso de dicha lesión era improbable debido al resultado negativo de los hemocultivos, se realizó una RMN cardiaca con contraste para esclarecer el diagnóstico. En dicha exploración, además de la vegetación, se apreciaba una imagen de realce subepicárdico a nivel inferolateral, sugestiva de proceso vasculítico (fig. 1), sin evidencia de abscesos, derrame pericárdico ni otras complicaciones.
RMN cardiaca con contraste. A) Secuencia Fast Imaging Employing Steady State Acquisition (FIESTA) en plano de tracto de salida del ventrículo izquierdo (VI), que muestra imagen de vegetación a nivel de la válvula aórtica (flecha). B) Secuencia de realce tardío de gadolinio en eje corto del VI, que demuestra a nivel del segmento inferolateral una imagen de realce subepicárdico sugestivo de proceso vasculítico (flecha).
Con el diagnóstico de endocarditis de Libman-Sacks (ELS) se inició tratamiento anticoagulante en combinación con esteroides (1mg/kg/día) y micofenolato (MMF) hasta alcanzar dosis de 1g/12h. En la actualidad, un año más tarde, presenta la función renal normal, habiendo mejorado la insuficiencia aórtica a un gradiente moderado.
Aunque el uso de esteroides en el tratamiento del lupus eritematoso (LES) ha provocado una importante reducción de la incidencia de ELS, su frecuencia actual podría alcanzar hasta el 10-35% de los casos1,2. Pese a ello, sus manifestaciones clínicas suelen ser leves, por lo que frecuentemente transcurre de forma inadvertida1. La ELS suele asociarse con una mayor duración de la enfermedad y con la existencia de anticuerpos anticardiolipina (aCL) y síndrome antifosfolípido (SAF)1,3. La «hipótesis de los 2 impactos» descrita por Bordin et al.4, plantea que el estado pro-trombótico generado por los aCL (primer evento) favorecería (tras un segundo evento como intervención quirúrgica cardiaca, embarazo, etc.), la formación del trombo sobre un endotelio valvular previamente inflamado3–5. Aunque en el caso que presentamos, la afectación al menos desde el punto de vista renal era reciente, siguiendo la hipótesis del doble impacto, podríamos especular que no solo la presencia de un brote lúpico con aCL positivos, sino que también la agresión que supuso el hematoma y posterior embolización pudo actuar como desencadenante del cuadro de endocarditis sobre una válvula de por sí susceptible, al presentar una morfología bicúspide.
Por otra parte, el presente caso ilustra asimismo la dificultad que entraña el diagnóstico diferencial con otras malformaciones valvulares o la propia endocarditis infecciosa, que incluso podría asentarse sobre una lesión de ELS previa. Aunque la ELS suele localizarse sobre la válvula mitral, también puede presentarse en la aórtica, como en el paciente descrito, tricuspídea (menos del 10% de los casos) y pulmonar1,3. Al carecer de una localización e imagen ecocardiográfica característica, la RMN fue de gran utilidad para esclarecer el diagnóstico tal y como han documentado también otros autores6.
Respecto al tratamiento, la cirugía se reserva para los casos de disfunción valvular severa o con grandes vegetaciones móviles de elevado riesgo embólico7. Aunque el tratamiento con esteroides puede reducir las lesiones, generalmente no es suficiente para erradicar el riesgo embólico, por lo que la anticoagulación no debería cuestionarse8. En nuestro caso, dada además, la existencia de SAF y nefropatía lúpica se planteó tratamiento con MMF con buena respuesta renal y llamativamente también cardiaca, con una importante mejoría de las lesiones.
En conclusión, la ELS debe incluirse en el diagnóstico diferencial del paciente con LES y fiebre, en especial si existen aCL positivos y un desencadenante previo. Ante la ausencia de marcadores específicos, la RMN supone una herramienta importante para aclarar el diagnóstico. Aunque la disfunción valvular es rara, cuando esta se produce, el tratamiento con esteroides y MMF puede reducir las lesiones y diferir la necesidad de reemplazo valvular. De todos modos, dado el riesgo embólico que supone, el mantener la anticoagulación con una estrecha vigilancia clínica y de imagen es fundamental.