El embarazo en la paciente trasplantada renal constituye el máximo exponente de la normalización del medio interno derivado de la recuperación de la función renal. A diferencia de la paciente afecta de insuficiencia renal avanzada o incluida en diálisis, en la que resulta excepcional la viabilidad del embarazo, la paciente trasplantada renal, en virtud de los cambios sistémicos derivados del restablecimiento de la función renal, puede quedar embarazada y dar a luz a término sin complicaciones.
El trabajo de Díaz y cols.1 en el presente número de NEFROLOGÍA comunica la experiencia de diez casos de embarazo en pacientes trasplantadas renales pertenecientes a la Fundación Puigvert que, con la salvedad de un aborto espontáneo en el primer trimestre del embarazo, terminaron con el alumbramiento de recién nacidos sanos. Los autores destacan la baja incidencia de complicaciones, señalando tan solo la necesidad de incrementar el tratamiento antihipertensivo en una paciente y la aparición de hipertensión de novo en un segundo caso, que se complicó con preeclampsia y necesidad de cesárea urgente. Salvo incremento ligero y transitorio de la proteinuria en el tercer trimestre, la función renal se mantuvo estable tras el embarazo. En cuanto a los recién nacidos, dos presentaron prematuridad o bajo peso, pero todos evolucionaron sin complicaciones relevantes.
El embarazo en la mujer trasplantada viene a satisfacer, a menudo, un deseo de maternidad que puede o no previamente haberse realizado; sin embargo, los riesgos potenciales que puede acarrear para la evolución del injerto renal, así como para la madre y el feto, hacen necesario que la posibilidad de embarazo tras el trasplante y sus posibles consecuencias ean abiertamente comentadas con la paciente cuando se incluye en lista de espera, debiendo ser de nuevo recordadas tras la realización del trasplante. Con la recuperación de la función renal, el restablecimiento del eje hipotálamo-hipófiso-gonadal y con ello de la ovulación, se posibilita que la paciente pueda quedar embarazada desde los primeros meses después del trasplante2. En esta etapa precoz, las mayores dosis acumuladas de inmunosupresores, la mayor incidencia de infecciones víricas (herpes, CMV, etc.), así como la presencia de hipertensión arterial o una función renal subóptima, hacen desaconsejable que la paciente se quede embarazada hasta haber transcurrido un mínimo de un año desde la realización del trasplante.
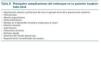
Idealmente, el embarazo en la paciente trasplantada debería acontecer en presencia de una función renal conservada, con una creatinina sérica inferior a 1,5 mg/dl, ausencia de proteinuria y con una tensión arterial normal (tabla I). Proteinuria mínima, inferior a 0,5 gramos al día, que no se haya incrementado en los meses previos, en ausencia de tratamiento con antiproteinúricos, IECA o ARAII, o bien la presencia de hipertensión arterial leve que se controla (TA < 130/80) con un solo antihipertensivo podrían resultar aceptables. No obstante, incluso en las circunstancias más favorables la paciente trasplantada renal tiene un riesgo incrementado de presentar hipertensión arterial y/o proteinuria de novo o agravamiento de las previamente existentes3.
En ocasiones las pacientes trasplantadas muestran, como en la serie de Díaz y cols, este perfil más favorable; pero con frecuencia el escenario en que acontece el embarazo es más complejo. Creatininas séricas de 1,5 mg/dl o superiores traducen en una paciente de constitución media una reducción importante del filtrado glomerular que la predispone al desarrollo o agravamiento de la hipertensión arterial y proteinuria con el embarazo. En estas circunstancias, la paciente embarazada estaría expuesta a un riesgo incrementado de presentar preeclampsia, con los consiguientes riesgos para la madre y el feto. Por todo ello, se ha establecido que en presencia de una creatinina sérica superior a 2 mg/dl el embarazo sea desaconsejable por el elevado riesgo de aborto espontáneo, retraso en el desarrollo fetal, bajo peso al nacer, prematuridad, preeclampsia y deterioro acelerado de la función renal3,4. Probablemente, además de la cifra absoluta de creatinina sérica antes del embarazo, la estimación del filtrado glomerular y la toma en consideración de la información relevante relativa a las características del donante (tipo de donante, edad, causa de muerte) y evolutivas de la paciente (antecedentes de NTA, episodios de rechazo y su gravedad, episodios de nefrotoxicidad, etc) permitan aproximarnos a un mejor conocimiento del estado del injerto, a falta de disponer de una biopsia renal. Una creatinina sérica lentamente ascendente, aún siendo inferior a 1,5 mg/dl o la aparición de hipertensión arterial o proteinuria de novo, aún de baja cuantía, debe alertarnos acerca de la posible existencia de un daño renal evolutivo, que debería ser adecuadamente evaluado y filiado, previamente a que la paciente quedara embarazada.
A diferencia de los pacientes inmunosuprimidos clásicamente con azatioprina y esteroides, quienes, superada la etapa inicial postrasplante, mantenían una función renal estable muchos años después de efectuado el trasplante, en la actualidad las pautas de inmunosupresión con inhibidores de la calcineurina, con el consiguiente riesgo de nefrotoxicidad, y la mayor edad de la población donante condicionan que la prevalencia de hipertensión sea más elevada y el filtrado glomerular sea menor5. Estudios mediante biopsias seriadas de protocolo en pacientes con trasplante renal han mostrado ya desde etapas precoces, en el primer año postrasplante, una elevada prevalencia de daño renal crónico, atribuible a nefrotoxicidad por los inhibidores de la calcineurina, y en menor medida de causa inmunológica, y que dicho daño es progresivo, no teniendo una traducción precoz en los valores analíticos de referencia como son la creatinina o la proteinuria6. En este escenario de daño renal histológico creciente, resultaría aconsejable que el embarazo no se demorara, a ser posible, un excesivo número de años desde la realización del trasplante.
Los riesgos del embarazo en la población trasplantada derivan fundamentalmente de la presencia de una función renal disminuida, incluida la detección de proteinuria y de hipertensión arterial en el momento del embarazo3. El impacto que la presencia de intolerancia hidrocarbonada o diabetes mellitus, así como de obesidad o hábito tabáquico en las mujeres trasplantadas embarazadas ha sido menos estudiado, pero no debe ser menor que en la población no trasplantada, debiéndose hacer un esfuerzo por evitar o controlar dichos factores. El tratamiento inmunosupresor administrado podría influir en la frecuencia de partos prematuros, tal y como se ha señalado que ocurre con la ciclosporina7. Por otra parte, si bien la incidencia de episodios de rechazo es baja, inferior al 5%, en algunas series alcanza el 15-17%, por lo que deben vigilarse los niveles de ciclosporina y tacrolimus en sangre, tanto durante el embarazo como en el puerperio para asegurar que se hallan en rango terapéutico. Es habitual que las pacientes requieran incrementos de las dosis de los inhibidores de la calcineurina, ya que el aumento del volumen de distribución en el embarazo se acompaña de un descenso de los niveles en sangre3.
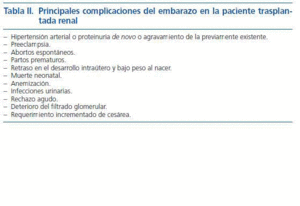
Las series publicadas de embarazos en la población trasplantada renal han mostrado que existe un riesgo de aborto espontáneo aumentado durante el primer trimestre, que llega a afectar al 35% de las pacientes, siendo posible culminar el embarazo con éxito en el 90% de las que superan el citado primer trimestre8 (tabla II). Más allá de la semana 24, las complicaciones más relevantes son un aumento de la incidencia o gravedad de la hipertensión arterial y de la proteinuria, incluido el riesgo de preeclampsia, que puede llegar a afectar a más de la tercera parte de las pacientes embarazadas; un aumento de la incidencia de retraso de desarrollo fetal intrauterino y de bajo peso al nacer, así como de partos prematuros que alcanza a la mitad de los recién nacidos, predominando el nacimiento por cesárea frente al parto por vía vaginal4. Asimismo, se ha señalado una mayor prevalencia de anemia en las pacientes trasplantadas que se ha relacionado con unos niveles de eritropoyetina inapropiadamente bajos9, al igual que de infecciones urinarias que llegan a afectar al 34% de dicha población10. Estos embarazos de alto riesgo obligan a un estrecho seguimiento tanto por el obstetra familiarizado con este tipo de pacientes como por el nefrólogo; las visitas a ambos deben ser al menos mensuales, al tiempo que la paciente debe monitorizarse la presión arterial en su domicilio, pudiendo hacerse dichas visitas más frecuentes en caso de aparición de hipertensión arterial o agravamiento de la previamente existente. En casos de elevado riesgo de presentar preeclampsia la paciente debe ingresar en el hospital para ser estrechamente vigilada y proceder a la monitorización fetal. La vía del parto se decidirá por criterios obstétricos, pero el recurso a la cesárea alcanza al 50% de las pacientes en la mayoría de las series4. Tras el parto, la proteinuria suele regresar a niveles similares a los previos al embarazo, si bien en aquellas pacientes con función renal disminuida, con creatininas séricas superiores a 1,5 mg/dl, podemos asistir a un deterioro acelerado de la función renal y fracaso del injerto11.
En relación con los neonatos de madres trasplantadas, se ha señalado muertes en el periodo perinatal, así como un riesgo aumentado de complicaciones infecciosas especialmente en los niños prematuros o de bajo peso al nacer4. Con estas excepciones, en general, los recién nacidos no presentan especiales problemas y se señala que con las pautas de inmunosupresión que incorporan esteroides, ciclosporina, tacrolimus o azatioprina la incidencia de malformaciones no está significativamente aumentada respecto a la población general. No es el caso de los inhibidores de la IMPDH, de los que el micofenolato de mofetilo es el más comúnmente utilizado, ya que estudios en animales y la experiencia clínica han mostrado que son teratógenos12. Igualmente, los inhibidores de la señal de proliferación, sirolimus y everolimus, aunque con una experiencia clínica limitada, también han mostrado que son teratógenos en animales13. Ambos grupos de fármacos están contraindicados en la paciente que desea quedar embarazada y deberían ser suspendidos un mínimo de seis a ocho semanas antes del embarazo.
Las repercusiones a medio y largo plazo de haber estado sometido a un tratamiento inmunosupresor en la fase intrautero se desconoce en nacidos de madre trasplantada renal. Se han señalado disminuciones de las poblaciones de celulas T y B en los primeros meses de vida en niños sometidos a tratamiento inmunosupresor intraútero que se normalizan en el transcurso del primer año, desconociéndose las implicaciones que sobre el sistema inmune pueda tener esta situación en seguimientos a largo plazo14. Tampoco se conocen las posibles repercusiones que a nivel neurocognitivo y de otros aparatos pueda tener el haber recibido tratamiento con inmunosupresores y diferenciarlo del derivado de una alta prevalencia de prematuridad en la población de niños nacidos de madres con un trasplante renal.
Este escenario nos permite concluir que las mujeres que reciben un trasplante renal y se hallan en edad fértil deben conocer la posibilidad de quedarse embarazadas, debiendo disponer de métodos anticonceptivos, especialmente de barrera, para evitar los embarazos no deseados. En aquellas que lo deseen, el embarazo debería poderse programar, adoptando las medidas más convenientes y tratando de evitar aquellos fármacos inmunosupresores con un potencial de teratogenicidad. Además, toda paciente que manifieste su interés por quedarse embarazada debe conocer a través de un diálogo franco y sincero de los nefrólogos con ella y, en su caso, su pareja, y en un tratamiento individualizado en cada caso, no solamente los beneficios derivados de la maternidad, sino también los riesgos y posibles complicaciones que puedan aparecer con motivo del embarazo, así como las atenciones que el hijo pueda demandar, todo ello en presencia de una situación clínica de la madre que puede llegar a limitar su calidad de vida y su pronóstico vital.
Tabla 1.
Tabla 2.