Introducción: La asociación de ciclosporina A (CsA) y micofenolato mofetil (MMF) tiene un efecto inmunosupresor sinérgico y, en consecuencia, podría inducir una remisión del síndrome nefrótico en enfermos con glomeruloesclerosis segmentaria y focal resistente a esteroides y a CsA. Objetivo: Analizar la eficacia y el perfil de seguridad de la asociación CsA y MMF en enfermos con GSF resistente a ciclosporina A. Pacientes y método: 27 enfermos con GSF resistente a CsA recibieron tratamiento con CsA (4 mg/kg/día) asociada a MMF (2 g/día) durante 12 meses. El seguimiento total fue de 5 años. Como medida de resultado, se consideró la proporción de enfermos con remisión de la proteinuria y la evolución de la función renal a los 5 años. Resultados: Al finalizar el período de tratamiento, ningún paciente presentó remisión completa; 4 pacientes (14,8%) presentaron reducción de proteinuria a valores <3,5 g/día. Estos enfermos presentaban proteinuria basal (5,62 ± 2,19 frente a 8,1 ± 2,96 g/día, p = 0,042) y pendientes de FG (–0,08 ± 0,12 frente a –0,69 ± 0,38; p = 0,003) significativamente inferiores y mayor función renal basal (99,6 ± 12,9 frente a 85,05 ± 15,5 ml/min; p = 0,003). Dieciséis de los 27 enfermos (59,2%) presentaron una enfermedad renal progresiva o estadio V al final del período de seguimiento. Se apreciaron efectos adversos gastrointestinales en el 33,3% de los enfermos y nefrotoxicidad aguda transitoria en el 14,8%. El 22,2% de los enfermos precisó un incremento en la dosis y/o número de hipotensores durante los 12 meses de tratamiento. Conclusiones: En enfermos con GSF resistente a ciclosporina, el tratamiento con asociación de CsA y MMF durante 12 meses, aunque puede inducir reducciones parciales de la proteinuria, no modifica significativamente el curso evolutivo de la función renal.
Introduction: The combination of cyclosporin A (CsA) and mycophenolate mofetil (MMF) has a synergistic immunosuppressive effect and, as a result, it may induce remission of nephrotic syndrome in patients with steroid- and CsA-resistant focal segmental glomerulosclerosis (FSGS). Objective: To analyse the efficacy and safety of the combined CsA and MMF treatment in patients with cyclosporin A-resistant FSGS. Patients and methods: Twenty-seven patients with CsA-resistant FSGS were treated for 12 months with CsA (4mg/kg/day) combined with MMF (2g/day). The overall follow-up was 5 years. The proportion of patients with remission of proteinuria and the evolution of kidney function after 5 years were used to measure the outcome. Results: At the end of the treatment period, no patients were in complete remission and 4 patients (14.8%) had reduced proteinuria to values <3.5g/day. These patients had significantly lower baseline proteinuria (5.62±2.19 compared to 8.1±2.96g/day, P=.042), significantly lower GFR (-0.08 compared to -0.69±0.38; P=.003) and higher baseline kidney function (99.6±12.9 compared to 85.05±15.5ml/min; P=.003). Sixteen out of the 27 patients (59.2%) had progressive or stage 5 kidney disease at the end of the follow-up period. Adverse gastrointestinal effects were observed in 33.3% of the patients and acute transitory nephrotoxicity in 14.8%. The dosage and/or number of anti-hypertensive drugs had to be increased in 22.2% of patients during the 12 months of treatment. Conclusions: Twelve months of combined CsA and MMF therapy does not significantly alter the evolution of kidney function in patients with cyclosporin-resistant FSGS, although it may induce partial reductions in proteinuria.
INTRODUCCIÓN
La evidencia actualmente disponible indica que en enfermos con glomeruloesclerosis segmentaria y focal (GSF) que presentan síndrome nefrótico corticorresistente, el tratamiento con ciclosporina A (CsA) puede mejorar el pronóstico de la función renal a largo plazo. Sin embargo, a pesar de que se ha descrito que, inicialmente, hasta un 75% de los enfermos pueden presentar remisión total o parcial de la proteinuria, más del 50% de los casos corticorresistentes desarrollan también resistencia al tratamiento con ciclosporina y, a largo plazo, sufren enfermedad renal progresiva. En estos casos, al margen del control de la hipertensión arterial y del bloqueo de la acción de la angiotensina II, no se dispone de ningún tratamiento con eficacia contrastada que permita modificar el curso clínico de la enfermedad1-4.
En los últimos años, se han realizado diversos estudios observacionales para analizar la eficacia y seguridad de micofenolato mofetil (MMF), en monoterapia o asociado con esteroides, en el tratamiento de la GSF idiopática, con porcentajes de respuesta discordantes y en general bajos5-13. Estudios realizados en el trasplante de órganos indican que la asociación de MMF y CsA tiene un efecto inmunosupresor aditivo o sinérgico14,15. Como hipótesis, este efecto podría ser útil en el tratamiento de los enfermos con GSF que presentan resistencia a esteroides y/o CsA. Sin embargo, hasta el momento, la eficacia de esta asociación en la GSF ha sido descrita en un único estudio observacional en enfermos corticorresistentes que, además, recibieron tratamiento asociado con otros inmunosupresores16.
El objetivo del presente estudio piloto ha sido analizar la potencial eficacia y el perfil de seguridad de la asociación de CsA y MMF en un grupo de enfermos con GSF primaria resistente a CsA.
PACIENTES Y MÉTODOS
Diseño
Estudio observacional con seguimiento prospectivo.
Pacientes
Entre los años 1996 y 2004 se incluyeron en el estudio 27 pacientes que cumplieron los siguientes criterios:
1. Diagnóstico histológico de GSF (todas las biopsias fueron analizadas por los mismos patólogos).
2. Exclusión de etiologías secundarias incluyendo: reducción de masa renal, obesidad mórbida, nefropatía asociada al VIH, consumo de heroína o cocaína, consumo de analgésicos, reflujo vesicoureteral o apnea obstructiva del sueño.
3. Resistencia previa a un ciclo de tratamiento de 6 meses con esteroides y a un ciclo de tratamiento de 6 meses con CsA, definida como persistencia de proteinuria >3,5 g/día.
4. Filtrado glomerular >60 ml/min/1,73 m2.
5. Ningún tratamiento con cualquier otro inmunosupresor o con antiinflamatorios no esteroideos en los 6 meses previos a la inclusión.
6. Ausencia de antecedentes familiares de enfermedad renal crónica o tratamiento sustitutivo renal.
7. Ausencia de contraindicaciones para tratamiento con MMF.
8. Otorgaron consentimiento informado por escrito.
Estudios previos a la inclusión
Tras la evidencia de resistencia a esteroides y CsA, todos los enfermos fueron seguidos durante un mínimo de 6 meses antes de proceder a la inclusión en el estudio. Durante este período, se prescribió únicamente una dieta baja en sodio (5 g/día) y tratamiento con inhibidores de la enzima de conversión (IECA) o antagonistas de receptor de angiotensina II (ARAII). Las dosis de estos fármacos se ajustaron para conseguir cifras tensionales < 140/80). En caso necesario, se asoció tratamiento con amlodipino y/o furosemida. Ningún enfermo fue tratado con asociación IECA/ARAII ni con antagonistas de aldosterona. En caso de hipercolesterolemia, se prescribieron estatinas para conseguir un colesterol LDL <120 mg/dl.
Protocolo de tratamiento
Tras la inclusión en el estudio y durante todo el seguimiento, las dosis de IECA y ARAII se mantuvieron constantes. Todos los enfermos recibieron tratamiento con CsA a dosis inicial de 4 mg/kg/día que posteriormente se ajustaron para mantener niveles valle (12 h posdosis en sangre total) entre 150 y 200 ng/ml. La dosis de MMF fue de 2.000 mg/día en todos los casos.
Tras 12 meses de tratamiento, los enfermos con persistencia de proteinuria >3,5 g/día fueron considerados resistentes y se procedió a la supresión de ambos fármacos. En caso de evidencia de remisión total o parcial de la proteinuria, se consideró mantener el tratamiento durante 12 meses más. Al final de este período, se inició una reducción de dosis a razón de un 25% cada mes hasta la supresión total.
Análisis anatomopatológico de las biopsias renales
Todas las biopsias fueron teñidas con hematoxilina-eosina, PAS y tricrómico de Masson para análisis morfológico y se realizaron estudios de inmunofluorescencia con anticuerpos frente a IgA, IgG, IgM, C3, fibrinógeno y cadenas ligeras. En cada biopsia se determinó el porcentaje de glomérulos con esclerosis total o segmentaria y se midió la extensión de la fibrosis intersiticial mediante morfometría cuantitativa, en secciones de 5 μm teñidas con tricrómico de Masson, utilizando un autoanalizador Olympus WCUE-2.
Definiciones operativas
Se consideró proteinuria de rango nefrótico todo valor >3,5 g/día. El síndrome nefrótico se definió como proteinuria >3,5 g/día asociada con hipoalbuminemia <3,5 g/dl. Remisión completa: proteinuria <0,3 g/día en dos controles consecutivos. Remisión parcial: proteinuria <3,5 g/día y >0,3 g/día. Hipertensión arterial: presión arterial sistólica (PAS) >140 mmHg o presión arterial diastólica (PAD) >90 mmHg. Insuficiencia renal crónica: TFG <60 ml/min calculado por aclaramiento endógeno de creatinina. Insuficiencia renal crónica estadio V: TFG <15 ml/min. Nefrotoxicidad aguda por ciclosporina: aumento de creatinina sérica >30% reversible tras reducción de un 25% en la dosis de CsA.
Seguimiento y controles clínicos
Tras su inclusión en el estudio, los enfermos fueron controlados de forma ambulatoria con frecuencia mensual los primeros 6 meses, bimensual hasta el final del primer año y cada 4 meses durante el período de seguimiento restante hasta completar 60 meses o inicio de tratamiento sustitutivo renal. En cada control, se determinaron la PAS y la PAD, y se practicó un examen bioquímico general incluyendo creatinina sérica, función hepática, electrolitos, aclaramiento de creatinina endógeno, glucemia, nivel de CsA y proteinuria de 24 h. El filtrado glomerular se midió mediante el aclaramiento de creatinina endógeno. La excreción urinaria de proteínas se cuantificó en orina de 24 horas.
En caso de evidencia de aumento de cratinina >30%, la dosis de CsA se redujo un 25% y se practicó un nuevo control de función renal a los 7 días. En los casos en los que tras el inicio del tratamiento con MMF se presentaron síntomas gastrointestinales, la dosis total se redujo un 50% durante una semana y, posteriormente, se incrementó de forma progresiva hasta la máxima dosis tolerada. El MMF se suspendió en caso de síntomas gastrointestinales persistentes, aparición de leucopenia o fiebre.
Variables de resultado
La variable principal de resultado fue el número de enfermos con remisión total o parcial de la proteinuria tras 12 meses de tratamiento. Como variables secundarias, se consideró el número de enfermos con reducción de proteinuria a niveles no nefróticos, la presencia de enfermedad renal progresiva o el requerimiento de tratamiento sustitutivo renal durante el seguimiento y la identificación de predictores independientes de la evolución de la pendiente del filtrado glomerular.
Análisis estadístico
Los resultados se expresan como la media ± 1 DE. Los cambios en la excreción urinaria de proteínas y en la TFG a lo largo del tratamiento se analizaron mediante análisis de varianza para medidas repetidas tras transformación logarítmica de ambas variables. Como criterio de pérdida de función renal, se consideró la pendiente del FG mediante estimación realizada incluyendo al menos 10 valores de FG, asumiendo un modelo lineal de progresión. Se realizó un análisis de regresión lineal simple considerando como variable dependiente el logaritmo de la pendiente del filtrado glomerular hasta final del seguimiento o el inicio de tratamiento sustitutivo renal. Para analizar los predictores independientes de la evolución del filtrado glomerular, con las variables que tuvieron asociación significativa en el análisis univariado, se elaboró un modelo de regresión muútiple paso a paso. Se consideró significativo todo valor de p <0,05.
El estudio cumplió la normativa contemplada en la Declaración de Helsinki y fue aprobado por el comité ético del hospital. El tratamiento fue autorizado por el Ministerio de Sanidad con la indicación de uso compasivo en todos los enfermos.
RESULTADOS
Características basales
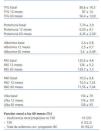
Variables clínicas y bioquímicas
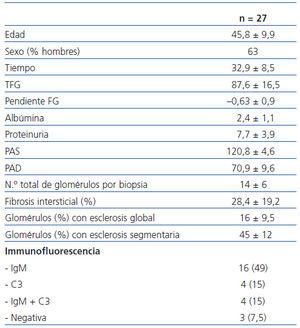
En la tabla 1 se resumen las principales características de la muestra de 27 enfermos estudiada.
Datos anatomopatológicos
Según el patrón morfológico, todos los enfermos presentaban lesiones de GSF de predominio periférico (forma clásica, NOS). Ningún enfermo presentaba un patrón colapsante. En la inmunofluorescencia, se evidenciaron depósitos de IgM focal en 16 enfermos, C3 en 4 casos IgM y C3 en cuatro, y ausencia de depósitos en 3 enfermos. Se apreció una correlación significativa entre el FG y el número de glomérulos con esclerosis total (r = 0,48; p <0,01) y la extensión de las lesiones de fibrosis intersiticial (r = 0,52; p <0,01).
Respuesta al tratamiento
Al finalizar el período de tratamiento, ningún paciente presentó remisión completa. En 23 enfermos, la proteinuria no sufrió cambios significativos. Cuatro pacientes (14,8%) presentaron reducción de proteinuria a valores <3,5 g/día (remisión parcial). Estos 4 enfermos presentaban proteinuria basal (5,62 ± 2,19 frente a 8,1 ± 2,96 g/día; p = 0,042), pendientes de FG previas a la inclusión en el estudio (–0,08 ± 0,12 frente a –0,69 ± 0,38; p = 0,003), significativamente inferiores y mayor función renal basal (99,6 ± 12,9 frente a 85,05 ± 15,5 ml/min/1,73 m2; p = 0,003) que los enfermos en los que no se apreciaron cambios en la excreción urinaria de proteínas. El tratamiento con CsA y MMF en estos 4 enfermos se mantuvo durante una media de 17,6 meses (máximo: 24 meses, mínimo: 17 meses). Tras la supresión del mismo, la proteinuria se mantuvo en valores inferiores a 3,5 g/día en 3 enfermos durante todo el seguimiento y en el cuarto, aumentó a valores de 5,5 g/día, pero no se indicó una nueva pauta de tratamiento inmunosupresor.
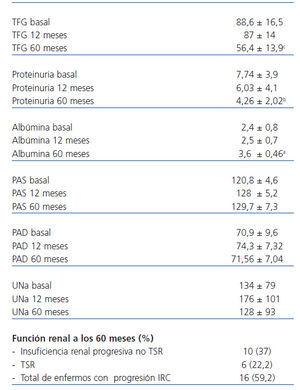
Durante los 5 años de seguimiento, en el conjunto de los enfermos, la TFG sufrió un descenso significativo (descenso absoluto medio: –32,5 ± 13,77 ml/min/1,73 m2; p = 0,0001; pendiente media: –0,54 ± 0,19 ml/min/mes; p = 0,001). Dieciséis de los 27 enfermos (59,2%) cumplieron criterios de insuficiencia renal progresiva o IRC en estadio V al final del seguimiento. En relación los enfermos sin evidencia de pérdida significativa de función renal, estos 16 enfermos presentaban niveles basales de FG significativamente inferiores (70,3 ± 7,39 frente a 97 ± 10,3 ml/min/1,73 m2; p = 0,001), mayor proteinuria basal (10,56 ± 3,2 frente a 6,1 ± 2,42 g/día; p = 0,006), evidencia de descenso más rápido de función renal durante el seguimiento previo a la inclusión en el estudio (–1,3 ± 0,8 frente a –0,19 ± 0,41 ml/min/mes; p = 0,002) y una mayor proteinuria durante el seguimiento tras tratamiento con CsA y MMF (7,2 ± 3,1 frente a 4,1 ± 1,93 g/día; p = 0,033). La pendiente de pérdida de filtrado glomerular de los 4 enfermos con remisión parcial fue significativamente inferior a la de los enfermos que no respondieron (–0,073 ± 0,19 frente a –0,71 ± 0,29; p = 0,002); sin embargo, en ninguno de los 4 enfermos se apreció una diferencia significativa entre la pendiente previa y la posterior al período de tratamiento. En el conjunto de la muestra, tampoco se apreciaron diferencias significativas entre la pendiente de pérdida de FG previa a la inclusión en el estudio y la observada durante los 5 años de seguimiento postratamiento con CsA y MMF (–0,63 ± 0,9 ml/min/mes frente a –0,54 ± 0,19 ml/min/mes; p = NS). Las únicas variables asociadas con la pendiente del filtrado glomerular a lo largo del período de seguimiento en el análisis multivariado fueron el filtrado glomerular inicial (p = 0,041) y la proteinuria media durante el seguimiento (p = 0,037).
Efectos adversos
Todos los enfermos completaron el período de tratamiento de 12 meses. Se apreciaron efectos adversos gastrointestinales en el 33,3% de los enfermos. En todos los casos, los síntomas fueron leves y desaparecieron al reducir la dosis de MMF. En ningún caso fue necesario suprimir el tratamiento. Se apreció nefrotoxicidad aguda transitoria en el 14,8% de los enfermos. Tres pacientes (11,1%) presentaron hiperplasia gingival. El 22,2% de los enfermos precisó un incremento en la dosis y/o número de hipotensores durante los 12 meses de tratamiento con CsA y MMF (en la tabla 2 se resume el tratamiento hipotensor utilizado a lo largo del período de seguimiento). Ningún enfermo presentó episodios febriles o leucopenia.
DISCUSIÓN
El presente estudio fue planteado con el objetivo de analizar la potencial eficacia y seguridad de la asociación de CsA + MMF en el tratamiento de la GSF resistente a esteroides y a CsA. En el momento en que fue diseñado, la utilidad clínica de la CsA en el tratamiento de la GSF había sido adecuadamente contrastada en ensayos clínicos aleatorios1-3, pero no se disponía de datos sobre la potencial eficacia de MMF. La decisión de asociar ambos fármacos se basó exclusivamente en el posible efecto inmunosupresor aditivo descrito en el trasplante de órganos14,15.
Los resultados observados indican que en enfermos con resistencia a glucocorticoides y a CsA, el tratamiento con CsA asociada a MMF durante 12 meses no induce remisiones totales de la proteinuria. A lo largo del período de seguimiento se apreció, sin embargo, una reducción moderada pero significativa de la proteinuria en 4 enfermos. Considerando la relación observada entre la proteinuria media y la pendiente del filtrado glomerular durante el seguimiento, cabría esperar que el tratamiento con CsA y MMF tuviera un efecto beneficioso en la preservación de la función renal en los enfermos en los que se observó una mayor reducción de la proteinuria. Sin embargo, en ninguno de los 4 casos se apreciaron diferencias significativas entre las pendientes de pérdida del filtrado glomerular pretratamiento y postratamiento. La mejor evolución de este pequeño subgrupo de enfermos está asociada al curso de la enfermedad previo a la inclusión en el estudio, pero no en el efecto del tratamiento. Una explicación razonable sería considerar que dado que los enfermos con mayor reducción de proteinuria basalmente presentaban también niveles de proteinuria significativamente inferiores, mejor función renal y menor pendiente de pérdida de filtrado glomerular, es posible que sufrieran una forma de GSF de evolución más lenta o más benigna, aunque aparentemente indistiguible desde el punto de vista histológico. Tanto el porcentaje como el tipo de respuesta observado en nuestros enfermos son inferiores a los descritos en el único estudio publicado hasta la fecha en el que se analiza el efecto de la asociación MMF con inhibidores de la calcineurina en enfermos con GSF16, probablemente porque en dicho estudio se incluyeron enfermos con resistencia a glucocorticoides, mientras que en el presente estudio se han incluido enfermos con resistencia a glucocorticoides y a CsA. Por otra parte, los datos observados en nuestra cohorte de enfermos en cuanto a reducción de proteinuria se sitúan en el límite inferior del intervalo descrito en estudios observacionales en los que se analiza la potencial eficacia de MMF (en monoterapia o asociado a esteroides) en el tratamiento de la GSF del adulto5-13. En conjunto, la información disponible no sugiere que la asociación de CsA y MMF pueda tener un papel relevante en la inducción de remisiones en enfermos con múltiple resistencia.
Aunque no se trata de un estudio controlado, la probabilidad de progresión a insuficiencia renal crónica y tratamiento sustitutivo renal observada en el conjunto de la muestra de enfermos tras 5 años de seguimiento no difiere de la descrita en la mayor parte de las series en enfermos con resistencia a CsA tratados de forma sintomática3,4,17-19, lo que supone también un argumento en contra de un posible efecto beneficioso de la asociación de CsA y MMF sobre la preservación de la función renal a largo plazo.
Todos los enfermos incluidos presentaban proteinuria de rango nefrótico e hipoalbuminemia y fueron rigurosamente estudiados para descartar etiologías secundarias. A pesar de ello, no puede descartarse definitivamente que algunos de ellos presentaran formas de GSF no modificables mediante tratamiento inmunosupresor. A este respecto, debe destacarse que en ningún caso se realizó un estudio genético y, por ello, es posible que algunos de los enfermos que fueron clasificados como portadores de formas idiopáticas sufrieran en realidad mutaciones esporádicas en proteínas podocitarias. Esta limitación es común a todos los estudios realizados hasta la fecha para analizar la eficacia de distintos inmunosupresores en enfermos con GSF. Sin embargo, dada la baja prevalencia descrita de este tipo de mutaciones en la GSF del adulto en ausencia de antecedentes familiares, es improbable que ésta sea la razón fundamental que justifique la ausencia de respuesta al tratamiento inmunosupresor observada.
El tratamiento fue bien tolerado pero no estuvo exento de efectos adversos. El más relevante fue la elevada incidencia de síntomas gastrointestinales que, sin embargo, fueron leves y no requirieron la supresión de ninguno de los dos fármacos.
En conclusión, los datos del presente estudio piloto indican que en enfermos con GSF resistente a CsA, el tratamiento con asociación de CsA y MMF durante 12 meses, aunque puede inducir reducciones parciales de la proteinuria en algunos enfermos, no modifica significativamente el curso evolutivo de la función renal.
Tabla 1. Características clínicas, bioquímicas e histológicas basales
Tabla 2. Evolución de la proteinuria y función renal a lo largo del seguimiento