Introducción: La esclerosis tuberosa (ET) es una enfermedad sistémica, de herencia autosómica dominante, ocasionada por mutaciones en dos genes (TSC1 y TSC2), que causan la aparición de tumores (angiolipomas [AML], angiofibromas, astrocitomas, etc.). La proliferación inadecuada y constante que existe en la ET puede ser bloqueada por inhibidores de la kinasa mTOR (mammalian target of rapamycin), como la rapamicina. Material y métodos: Se han incluido 17 pacientes afectados de ET y, al menos, un AML mayor de 2 cm de diámetro diagnosticado por resonancia magnética (RM). Han recibido tratamiento con rapamicina durante 12 meses. Los niveles plásmáticos se han mantenido entre 4 y 8 ng/dl. El tamaño del AML se ha monitorizado semestralmente mediante RM abdominal. Resultados: A los 12 meses de la inclusión, con la RM se ha objetivado una disminución del tamaño del AML en todos los pacientes incluidos, mostrando una reducción de, al menos, un 50% en el 82,4% (14/17; intervalo de confianza [IC] 95% [56,57%, 96,20%]). El porcentaje medio de reducción fue del 66,3% (IC95 [56,9%, 75,6%]; p <0,0001). Los principales efectos secundarios observados han sido: aftas orales (5/17); hipertrigliceridemia (3/17); microcitosis e hipocromía (3/17); diarrea (2/17); acné (1/17); pielonefritis aguda (1/17), y proteinuria (1/17). Conclusiones: Los datos clínicos preliminares sugieren que la rapamicina puede desempeñar un papel beneficioso en el tratamiento de la ET. Nuestra experiencia en 17 pacientes tratados durante 12 meses demuestra seguridad y eficacia en la reducción de AML.
Background: Tuberous sclerosis (TS) is a systemic disease, with an autosomal dominant pattern of inheritance caused by mutations in two genes (TSC1 and TSC2) that cause tumours (angiomyolipomas [AML], angiofibromas, astrocytomas). Constant and inadequate proliferation occurring in TS may be blocked by mTOR inhibitors (mammalian target of rapamycin), such as rapamycin. Material and methods: At present, our study includes 17 patients with TS. All had at least one AML greater than 2cm in diameter diagnosed by MRI. They received rapamycin during 12 months. Plasma levels remained stable between 4-8ng/dl. The AML size was monitored every six months by abdominal MRI. Results: At 12 months of inclusion, MRI indicated a decrease in the size of AML in all patients showing at least a 50% reduction in 82.4% (14/17, 95% CI [56.57%, 96.20%]). The mean percent reduction was 66.3% (95% CI [56.9%, 75.6%], P<.0001). The major side effects observed were: oral aphthous ulcers (5/17); hypertriglyceridemia (3/17); microcytosis and hypochromia (3/17); diarrhea (2/17); acne (1/17); acute pyelonephritis (1/17); and proteinuria (1/17). Conclusions: These preliminary clinical data suggest that rapamycin can play a beneficial role in the treatment of TS. Our experience in 17 patients treated for 12 months demonstrates safety and efficacy in reducing AML volume.
INTRODUCCIÓN
La esclerosis tuberosa (ET), o enfermedad de Pringle-Bourneville, es una enfermedad sistémica, de herencia autosómica dominante. Se trata de una enfermedad rara, con una prevalencia estimada en 1/6.0001.
Clínicamente cursa con afectación dermatológica (angiofibromas faciales, manchas hipomelánicas, fibromas ungueales), renal (angiomiolipomas, quistes), neurológica (epilepsia, retraso mental, astrocitomas subependimarios, tuber corticales), pulmonar (linfangioleiomiomatosis) y cardíaca (rabdomiomas). Estas manifestaciones clínicas son muy variables, así como su grado de penetrancia. La presentación clínica oscila desde adultos con pocos rasgos de la enfermedad hasta niños con grave afectación neurológica.
Los angiomiolipomas (AML) renales son tumores benignos formados por vasos anómalos, tejido muscular liso inmaduro y adipocitos. Pueden detectarse por ecografía, tomografía computarizada (TC) o resonancia magnética (RM). En la mayoría de los pacientes son bilaterales y múltiples. La incidencia aproximada oscila entre el 55 y el 75%2, y son motivo de elevada morbilidad; pueden ocasionar hemorragias espontáneas y, más raramente y en casos de AML muy abundantes, hipertensión arterial (HTA) e insuficiencia renal. Es, tras la afectación neurológica, la afección más importante.
El riesgo de rotura y de hemorragia espontánea se relaciona generalmente con el tamaño del AML3 y es especialmente frecuente cuando éste supera los 3-4 cm. La tasa de crecimiento de los AML varía entre sujetos y entre tumores. En general, se elude su resección para evitar la pérdida de parénquima renal y, por lo tanto, de función renal. Hasta el momento, las principales opciones terapéuticas son la embolización de los AML, la cirugía electiva o la nefrectomía urgente en casos de hemorragia incoercible4.
Además de AML renales, en los pacientes con ET se pueden hallar quistes, poliquistosis renal y carcinomas renales.
La ET está ocasionada por mutaciones en dos genes: TSC1 y TSC2. El gen TSC1 causa la enfermedad en un porcentaje bajo de casos y da lugar a las formas más benignas de la enfermedad2. Está localizado en el cromosoma 9q34, constituido por 23 exones y codifica para la proteína denominada hamartina5. El gen TSC2 está localizado en el cromosoma 16p13, constituido por 41 exones y codifica para la proteína llamada tuberina6.
Tuberina y hamartina se asocian en un complejo regulador para mTOR (mammalian target of rapamycin) a través de la proteína ribosomal S6 kinasa (S6K) y de los represores del factor de iniciación de la síntesis proteica eIF4EEl, el 4E binding protein (4EBP1). Mutaciones que ocasionan la ausencia o la disfunción de tuberina o de hamartina dan lugar a una inactivación constitutiva de S6K y 4E-BP1 y a una pérdida del control proliferativo7 por activación permanente de mTOR.
La rapamicina (Sirolimus, Rapamune®) es un inmunosupresor que inhibe la capacidad de mTOR para fosforilar a S6Ks y a 4EBP1, con lo que se controlan el crecimiento celular y la proliferación inadecuada que se produce en los pacientes afectados de ET.
El objetivo de este ensayo es demostrar que la proliferación inadecuada que existe en la ET en forma de AML puede ser bloqueada por inhibidores de la cascada de señales Akt, como la rapamicina, que es una alternativa terapéutica efectiva y segura en el tratamiento de pacientes con ET.
MATERIAL Y MÉTODOS
Ensayo clínico en fase IV, unicéntrico, no controlado, no ciego, de 24 meses de duración, con un fármaco comercializado en una nueva indicación terapéutica.
El objetivo principal es evaluar el efecto de la rapamicina sobre el tamaño de los AML en pacientes con ET. La variable principal es la estimación de la proporción de pacientes en los que se observa una reducción del 50% en el tamaño del AML de mayor diámetro con respecto al tamaño basal.
Como objetivos secundarios se han establecido la evaluación del efecto del tratamiento sobre la disminución de volumen, las lesiones cutáneas, la valoración del porcentaje de pacientes con complicaciones quirúrgicas (sangrados, requerimientos de embolización y/o cirugía) y la seguridad del fármaco en esta cohorte de pacientes.
La mayoría de pacientes incluidos pertenecen a la asociación de ET que se ha encargado de remitir a los posibles candidatos a la Fundación Puigvert, en al que se está realizando el estudio.
El ensayo ha sido aprobado por el Comité de Ética de Investigación Clínica de la Fundación Puigvert y por la Agencia Española del Medicamento.
Se han incluido 17 pacientes mayores de 10 años de edad, diagnosticados de ET con, al menos, un AML renal mayor de 2 cm de diámetro (independientemente de la afectación del sistema nervioso central [SNC], cardíaca, pulmonar y/o cutánea), con cifras basales de creatinina inferiores a 2 mg/dl, que firmaron el consentimiento informado (en caso de tener una edad superior a 18 años, o firmado por padres o tutores en caso de que los pacientes fuesen menores). Como criterios de exclusión se establecieron el sangrado reciente del AML, la alteración de la función hepática o del hemograma, una proteinuria estimada por ratio proteína/creatinina superior a 22,6 mg/mmol, la presencia de infección activa, el antecedente de intervención quirúrgica 8 semanas antes del inicio del tratamiento o de neoplasia en los 2 años previos, la presencia de colesterol en ayunas superior a 7,8 mmol/L, LDL superior a 5,1 mmol/L o de triglicéridos (TG) superiores a 4,6 mmol/l, así como el antecedente de alergia a macrólidos. A todas las mujeres incluidas se les realizó un test de embarazo previamente a la inclusión y en cada visita de seguimiento.
Los pacientes recibieron en la visita de inclusión una dosis de rapamicina de 1 mg/día. Se realizaron ajustes de dosis cada 2 semanas, con incrementos de 1 mg cada vez hasta obtener unos niveles plasmáticos estables de 4-8 ng/dl. Tras obtener dichos niveles, la monitorización de los niveles plasmáticos se realizó a los 3, 6, 9 y 12 meses de tratamiento, coincidiendo con las visitas de seguimiento. En cada unas de éstas se llevaron a cabo una exploración física, una evaluación de los efectos adversos y del cumplimiento terapéutico, una analítica completa de sangre (glucosa, hemograma, urea, creatinina, fórmula MDRD [Modification of Diet in Renal Disease], electrolitos, perfil hepático, bilirrubina, lípidos y urianálisis con estimación de proteinuria por ratio) y realización de fotografías de las lesiones cutáneas. La RM abdominal se realizó en el momento de la inclusión en esl estudio y a los 6 y 12 meses.
Por seguridad, aparte de las visitas concertadas, se contactó mensualmente con los pacientes por teléfono. Asimismo, dispusieron de acceso telefónico directo con el equipo investigador para cualquier incidencia durante la realización del ensayo.
Los efectos adversos han sido registrados en el cuaderno de recogida de datos valorando los siguientes aspectos: descripción, duración y tratamiento del acontecimiento, así como valoración de la causalidad realizada por el investigador. Las reacciones adversas graves e inesperadas se han notificado a las autoridades sanitarias, así como al comité ético de investigación clínica (CEIC) de acuerdo con lo establecido en el Real Decreto/2004.
Se predefinió el tamaño de muestra en 17 pacientes para tener, como mínimo, un poder estadístico del 80% para detectar una diferencia en el grupo estudiado en relación con la eficacia esperada en la población general sin tratamiento, la cual es del 0%, con una protección frente al error alfa del 5% bilateral8,9.
Dado que el diseño no es controlado, no se han realizado contrastes de hipótesis adicionales, pero se ha realizado la estimación del intervalo de confianza (IC) al 95% de la variable principal mediante métodos exactos, y se discuten los resultados en el contexto de los valores poblacionales previos observados en esta patología.
El volumen del tumor se ha analizado mediante un modelo de máxima verosimilitud restringida para medidas repetidas con la matriz de (co)varianzas declarada como no estructurada. En los modelos de diferencias y diferencias porcentuales respecto al basal, se ha introducido el valor basal como covariable. El nivel de significación se estableció en el 5% bilateral y los datos se han analizado con un software SAS versión 9.1.3 (SAS Institute Inc., Cary, NC, EE.UU.).
Limitaciones del estudio
Limitaciones del diseño
Se ha planteado un estudio no controlado con una n limitada de pacientes con las limitaciones que desde el punto de vista metodológico y de interpretación de los resultados supone. Dicho diseño se debe a la baja prevalencia de la enfermedad y a la disponibilidad limitada de pacientes en toda España; sin embargo, consideramos que es de gran interés poder hacer un ensayo clínico en una enfermedad rara para la que no hay tratamiento farmacológico disponible y a la que se asocia una elevada morbilidad. Se ha planteado como unicéntrico para intentar homogeneizar al máximo los criterios de evaluación de la respuesta.
RESULTADOS
De los 17 pacientes incluidos (8 hombres y 9 mujeres), 16 completaron el tratamiento durante 12 meses; uno de ellos tuvo que ser excluido a los 11 meses de iniciado el mismo por reactivación de eritema nudoso ya presente en el momento de la inclusión y otro paciente fue retirado tras 13 meses de tratamiento por la aparición de proteinuria de rango nefrótico que revirtió tras la suspensión del tratamiento.
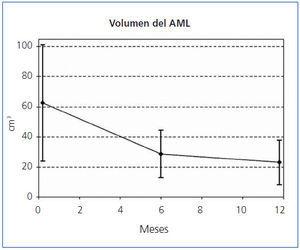
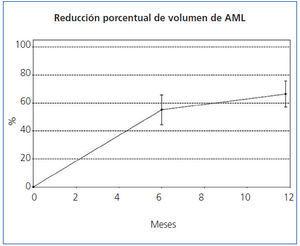
El tamaño de los AML en el momento de la inclusión, y tras 6 y 12 meses de tratamiento queda reflejado en la tabla 1, en la que también puede observarse el porcentaje medio de disminución del volumen de los AML a los 6 meses y a los 12 meses de tratamiento. A los 6 meses, el 35,3% (6/17, IC95% [14,21%, 61,67%]) de los tumores se había reducido un 50% y a los 12 meses el 82.4% (14/17, IC95% [56,57%, 96,20%]). El porcentaje medio de disminución a los 6 meses fue del 55,1% (IC95% [44,4%, 65,7%]; p <0,0001) y a los 12 meses del 66,3% ([56,9%, 75,6%]; p <0,0001). En la figura 1 y en la figura 2 se observa la evolución del volumen de las lesiones, analizada en términos de disminución absoluta de volumen y porcentaje medio de disminución.
Los angiofibromas faciales disminuyeron de tamaño, y se volvieron más pálidos y menos rugosos.
No se observaron diferencias significativas en las cifras basales de creatinina tras 12 meses de tratamiento, aunque sí se observó la aparición de microalbuminuria, sin llegar en ningún caso a superar los 300 mg/24 horas, excepto en un paciente que presentó una proteinuria nefrótica resuelta tras la suspensión del tratamiento.
Los efectos adversos más frecuentes (tabla 2) fueron la aparición de aftas orales al inicio del tratamiento (solventadas con tratamiento corticoideo tópico), hipertrigliceridemia controlada con tratamiento médico, episodios autolimitados de diarrea, acné y macrocitosis e hipocromía relacionada con el efecto antiproliferativo de la rapamicina. Un paciente requirió ingreso hospitalario por pielonefritis aguda.
DISCUSIÓN
Actualmente, dada la ausencia de tratamiento para esta enfermedad minoritaria, resulta necesario profundizar en sus aspectos biológicos, celulares y moleculares, así como investigar alternativas terapéuticas eficaces.
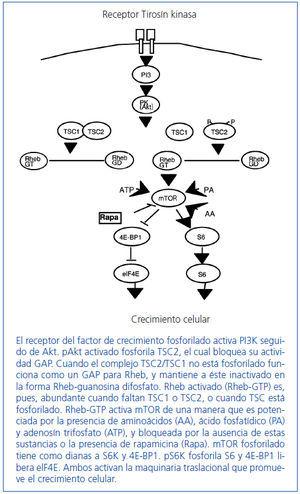
En este sentido, se han realizado experimentos en Drosophila que han demostrado que la pérdida de tuberina produce un defecto en el ciclo celular que ocasiona una repetición de la fase S sin entrar en la fase M10. En este estudio, y en otros, se descubrió que la tuberina y la hamartina eran miembros clave de la cascada de señales PI3K/PKB(Akt)/mTOR/S6K, que regula la captación de nutrientes, el tamaño celular y la proliferación celular11-13 (figura 3).
Tuberina y hamartina se asocian en un complejo que funciona como el regulador más importante para la kinasa mTOR en la cascada de Akt, a través de una proteína intermedia denominada Rheb13,14. Parece ser que mTOR media la mayoría de sus efectos sobre el crecimiento celular a través de de la fosforilación por vía de la proteína ribosomal S6 kinasa (S6K) y de los represores del factor de iniciación de la síntesis proteica eIF4EEl, el 4EBP1. S6K incrementa el crecimiento celular y la síntesis proteica, mientras que 4EBP1 inhibe estos procesos. mTOR interacciona con S6K y 4EBP1 mediante una proteína asociada: Raptor. El complejo intacto tuberina/hamartina mantiene a Rheb en un estado inactivo, no fosforilado (Rheb DGP). La fosforilación de la tuberina por parte de Akt inactiva la actividad GAP del complejo tuberina/hamartina y provoca una disociación de éste, lo que conduce a una elevación de la cantidad de Rheb-GTP, y permite la activación de dianas específicas en los pasos inferiores de la cascada de mTOR a S6 y la iniciación del factor de inhibición 4E-BP1.
Mutaciones que ocasionan la ausencia o la disfunción de tuberina o hamartina, como ocurre en los pacientes con ET, dan lugar a una inactivación constitutiva de S6K y 4E-BP1, y a pérdida del control proliferativo7.
La rapamicina (Sirolimus, Rapamune®) es un inmunosupresor que forma un complejo inhibidor con la inmunofilina (FKBP12), el cual se une a la FK-506 binding protein 12 (FKBP-12) e inhibe la capacidad de mTOR para fosforilar a S6Ks y a 4EBPs; inhibe, asimismo, la proliferación de células T. El fármaco está comercializado, indicado para la profilaxis del rechazo agudo en el trasplante renal de pacientes adultos de bajo riesgo inmunológico. Administrado por vía oral, se absorbe escasa, pero rápidamente, con una biodisponibilidad oral del 15%. La concentración plasmática máxima se alcanza a las 0,5-2,3 horas. Alrededor del 95% del fármaco se une a los hematíes y se distribuye ampliamente por todo el organismo, atravesando incluso la barrera hematoencefálica (BHE). Se metaboliza por el sistema hepático: CYP3A4, con una vida media de 57-62 horas.
La hipótesis de este ensayo es que la proliferación inadecuada que existe en la ET en forma de AML o astrocitomas puede ser bloqueada por inhibidores de la cascada de señales Akt, como la rapamicina. Se ha demostrado que ésta revierte el defecto de tamaño celular en moscas con ET y disminuye el crecimiento neoplásico en ratas y ratones con ET15. El fármaco disminuye los niveles de VEGF y, teniendo en cuenta la gran vascularización de los tumores en la ET, causada por una regulación al alza (upregulation) del factor de crecimiento endotelial vascular (VEGF), su acción antiangiogénica puede ser muy beneficiosa.
Existen datos clínicos preliminares que sugieren que la rapamicina puede desempeñar un papel beneficioso en el tratamiento de la ET. La bibliografía de la que se dispone hasta el momento se limita a la publicación de casos aislados de disminución de tamaño de astrocitomas y AML en pacientes con ET, con una buena tolerabilidad16-19 y a los resultados de un ensayo clínico20. Actualmente, existen varios ensayos clínicos en marcha. Un ensayo clínico en fase II no controlado demostró una reducción del tamaño de los AML renales (49,92% ± 15,62%) y una mejoría de las pruebas funcionales respiratorias (volumen espiratorio forzado en el primer segundo [FEV1], capacidad vital y volumen residual) en 20 pacientes tratados durante un año20,21.
Estos resultados alentadores han llevado a la planificación de dos nuevos estudios americanos actualmente en marcha: el TSC Multicenter Clinical Trial, diseñado para evaluar la eficacia de rapamicina en el tratamiento de los AML, mediante el control de la evolución de otras manifestaciones, y el estudio MILES, que evaluará en 240 pacientes el efecto del fármaco en llinfangioleiomiomatosis (LAM) esporádica o asociada con ET. En Europa, el estudio TESTAL, de rapamicina en ET, valorará el efecto del fármaco en el tamaño de los AML. Este estudio, llevado a cabo en Gran Bretaña, ha incluido hasta el momento a 12 pacientes.
En este estudio, demostramos que el tratamiento con sirolimus en pacientes afectados de ET se asocia con una disminución del volumen de los AML superior al 50% a los 12 meses de tratamiento.
Creemos que esta disminución del vouúmen se debe a un efecto doble de la rapamicina: la inhibición del crecimiento debido al efecto antiproliferativo directo e indirectamente por la inhibición de la angiogénesis.
Hemos objetivado que la mayor disminución del volumen de los AML se produce durante los primeros 6 meses de tratamiento y que probablemente se debe a la inhibición inicial de mTOR y al mayor volumen que presentan los AML; posteriormente, tras la inhibición mantenida de mTOR, observamos una menor disminución y una estabilización del tamaño de los AML, lo que nos hace plantearnos que, a largo plazo, quizás no sea necesario mantener dosis altas de tratamiento para mantener la inhibición de mTOR.
Las reacciones adversas más frecuentes que hemos registrado fueron la aparición de estomatitis (5/17), observada al inicio del tratamiento, de carácter dependiente de la dosis y fácilmente controlable con tratamiento corticoideo tópico y ajuste de la dosis del tratamiento, seguida de hipertrigliceridemia (3/17) en pacientes que previamente a la inclusión ya presentaban niveles en el límite alto y que requirieron el inicio de tratamiento médico. También, y debido al afecto antiproliferativo de la rapamicina, objetivamos microcitosis e hipocromía (3/17), con estudio del metabolismo férrico dentro de la normalidad y cifras estables de hemoglobina. Se notificó un caso de diarrea (1/17) y otro de acné (1/17) y se estableció una relación causal con la rapamicina.
Ningún paciente presentó deterioro de la función renal.
Dos pacientes se retiraron del estudio, uno de ellos por reactivación de un eritema nudoso (1/17), ya presente previamente al inicio del tratamiento, y otro paciente por la aparición de proteinuria nefrótica (1/17), resuelta tras la suspensión del tratamiento.
Los resultados de nuestro estudio demuestran que los inhibidores de mTOR son una alternativa terapéutica segura y eficaz en el tratamiento de los AML de pacientes afectados de ET. Se trata de una alternativa de tratamiento médico menos agresiva que las actuales, que provocaría una reducción del tamaño y, consecuentemente, un menor riesgo de sangrado20.
Ante la eficacia y el aceptable perfil de seguridad de la inhibición de mTOR en los pacientes con ET, es de esperar que los ensayos en marcha confirmen estos hallazgos y que estos fármacos se conviertan en una opción terapéutica muy útil en la ET.
CONCLUSIONES
1. La vía de señalización de hamartina-tuberina de mTOR es una diana terapéutica válida y efectiva en pacientes con ET.
2. El tratamiento con sirolimus durante un año reduce en más del 50% el tamaño de los AML en pacientes con ET.
3. Debido a la presencia de efectos adversos y a que nuestro estudio presenta limitaciones desde el punto de vista metodológico, al tratarse de un estudio no controlado, con una n limitada de pacientes debido a la baja prevalencia de la enfermedad, creemos necesario la realización de estudios multicéntricos que evalúen a largo plazo la eficacia y la seguridad del uso de la rapamicina en pacientes con ET.
4. No obstante, al tratarse de una enfermedad rara y carecer de otra alternativa farmacológica disponible actualmente, nuestros resultados prometedores a corto plazo parecen ofrecer una alternativa terapéutica eficaz y menos agresiva en el tratamiento de los AML de pacientes afectados de ET.
Tabla 1. Evolución del tamaño de los angiomiolipomas
Figura 1. Reducción del volumen de los angiomiolipomas.
Figura 2. Reducción porcentual del volumen de los angiomiolipomas.
Figura 3. Cascada mammalian target of rapamicin (mTOR).
Tabla 2. Efectos adversos