La principal causa de morbimortalidad en el paciente con enfermedad renal crónica (ERC) es la cardiovascular. La inflamación y las alteraciones en el metabolismo óseo-mineral en estos pacientes conllevan aumento del riesgo cardiovascular.
ObjetivosValorar el papel de paricalcitol sobre distintos parámetros séricos relacionados con inflamación, fibrosis y enfermedad óseo-mineral en la ERC.
Material y métodosEstudio prospectivo, no controlado en 46 pacientes con ERC estadios III-V sin diálisis, con niveles elevados de paratohormona, según su estadio de ERC, por lo que se introdujo tratamiento con el análogo de vitamina D paricalcitol. Durante 4 meses de tratamiento valoramos los parámetros clásicos y novedosos del metabolismo óseo-mineral en suero (calcio, fósforo, paratohormona, factor de crecimiento fibroblástico-23 [FGF-23], Klotho y calcidiol) y parámetros relacionados con el proceso de inflamación-fibrosis y anticalcificantes (interleucina-6 y 10, factor de necrosis tumoral alfa [TNF-a], factor de crecimiento transformante beta [TGF-b], proteína ósea morfogénica-7 [BMP-7], y fetuína-A).
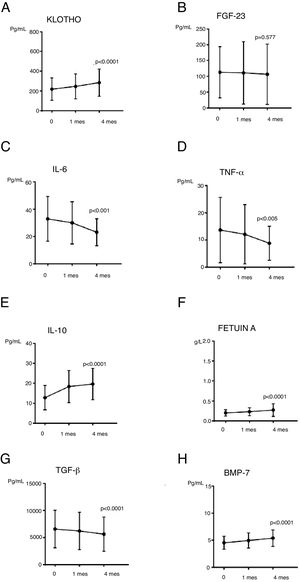
ResultadosTras el uso de paricalcitol los niveles de Klotho aumentaron (p=0,001) y los de FGF-23 se mantuvieron estables al igual que los de calcio y fósforo; calcidiol aumentó de forma significativa (p=0,010) y paratohormona descendió (p=0,002). Los parámetros de inflamación, fibrosis y calcificación mostraron una regulación benigna con descenso significativo de interleucina-6 (p=0,001), TNF-α (p=0,005) y TGF-β (p=0,001) y aumento de BMP-7 (p=0,001), fetuína-A (p=0,001) e interleucina-10 (p=0,001). El filtrado glomerular y la proteinuria se mantuvieron estables.
ConclusionesEl tratamiento con paricalcitol en el paciente renal sin diálisis parece ser beneficioso en la regulación de los parámetros inflamatorios y anticalcificantes, preservando la función renal y el eje óseo-mineral. Los marcadores elegidos en nuestro estudio podrían indicarnos un efecto positivo de paricalcitol a nivel vascular.
Cardiovascular events are the major cause of morbidity and mortality in patients with chronic kidney disease (CKD). Inflammation and mineral-bone disorder are pathological conditions that have been associated with an increased cardiovascular risk.
ObjectiveShow paricalcitol regulation overinflammatory, fibrotic and mineral disorder parameters in CKD.
Material and methodsProspective Study in 46 CKD stages III-V patients without dialysis patients whith elevated parathormone in which we introduced paricalcitol. We evaluated classic and newest mineral and bone metabolism serum parameters (calcium, phosphorus, parathormone, fibroblast growth factor-23 [FGF-23], Klotho, calcidiol), inflammatory-fibrosis and anticalcifying parameters (interleukin-6 and 10, tumor necrosis factor-a [TNF- α], transforming growth factor-b [TGF-β],bone morphogenic protein-7 [BMP-7] and fetuin-A) for four months.
ResultsAt the end of study soluble Klotho increased (p=.001), FGF-23 remained stable, calcium and phosphorus levels were not increased, calcidiol increased (p=.010) and PTH decreased (p=.002). Inflammation-fibrosis and calcification parameters showed positive regulation after paricalcitol treatment: interleukin-6 decreased significantly (p=.001) and also TNF-α did (p=.005), on the contrary, interleukin-10 and fetuin-A increased (p=.001 for both). Anti-fibrosis marker BMP-7 increased (p=.001) and TGF-b decreased (p=.001). We did not find significant changes in renal function.
ConclusionsParicalcitol treatment might be profitable in regulating inflammatory and anticalcificant parameters, unmodified calcium or phosphorus seric levels and preserving kidney function in renal patients with no dialysis. Our selected parameters could indicate paricalcitol effects in mineral and endothelial disorder related to renal disease.
La enfermedad óseo-mineral (EOM) relacionada con la enfermedad renal crónica (ERC) –EOM-ERC– conlleva alteraciones bioquímicas como aumento de calcio (Ca), fósforo (P), hormona paratiroidea (PTH), calcitriol, factor de crecimiento fibroblástico 23 (FGF-23) y descenso de Klotho1,2; estas alteraciones contribuyen a la calcificación vascular de distintas maneras: la hiperfosfatemia, el descenso de Klotho y de vitamina D activa, y el aumento de FGF-23 promueven la entrada de P por los canales Pit1/2 en las células vasculares del músculo liso con su consiguiente trasformación osteogénica3–5. Otros factores que influyen en el desarrollo de la calcificación vascular en la ERC serían la alteración de parámetros relacionados con la inflamación y la fibrosis, como el descenso de fetuína A (Ft-A) y de la proteína morfogénica ósea 7 (BMP-7) o el aumento del factor de necrosis tumoral α (TNF-α) y del factor de crecimiento transformante β (TGF-β)3-9. Este ambiente procalcificante del paciente con ERC justifica su alto riesgo cardiovascular3.
Calcitriol y los análogos para el receptor de vitamina D (AVDR), como paricalcitol (PRCT), además de regular los niveles de PTH, Ca o P, presentan efectos pleiotrópicos a nivel sistémico8; uno de ellos es la protección endotelial9,10. Distintos estudios han demostrado que calcitriol y AVDR protegen al endotelio de la calcificación al inhibir proteínas calcificantes como matrix gla proteína y reduciendo citoquinas proinflamatorias11,12. No obstante el efecto de calcitriol podría diferir al de PRCT13,14; calcitriol, a nivel vascular, podría tener dos consecuencias antagónicas
dosis-dependiente: a dosis hipercalcemiantes calcitriol presenta un efecto procalcificante sobre la CMLV mediado en parte por las acciones del P y moléculas procalcificantes a nivel celular; PRCT no parece presentar esa dualidad
dosis-dependiente13,14.
Por esta razón estudiamos el efecto de PRCT sobre la EOM-ERC y moléculas asociadas a calcificación vascular, inflamación y fibrosis en pacientes con ERC (estadios III-V sin diálisis) en búsqueda de un efecto modulador sobre los mismos.
Material y métodosPacientesSe trata de un estudio prospectivo no controlado realizado en el Hospital Universitario de La Princesa (Madrid). Preseleccionamos a 59 pacientes estadio III-V sin diálisis, mayores de edad susceptibles de utilizar PRCT por aumento de PTH según estadificación de su ERC1: estadio III>70 pg/mL, IV>110 pg/mL, estadio V>150 pg/mL (Guías SEN). Los criterios de exclusión fueron: inclusión en terapia sustitutiva renal, fallo cardíaco y/o hepático agudo, enfermedad infecciosa o inmunológica activa y alergia a PRCT (fig. 1). Finalmente seleccionamos a 46 pacientes con un seguimiento de cuatro meses en tratamiento con PRCT: 1mcg diario si PTH<500 pg/mL y 2 mcg diario si PTH>500 pg/mL. Ningún paciente superó los 500 pg/mL de PTH. Las dosis de PRCT se suspenderían si PTH<70 pg/mL. Siete pacientes tenían prescrito calcidiol; no hubo otros tratamientos relacionados con vitamina D o análogos, por lo que se realizó periodo de lavado de un mes previo al inicio del estudio. No hubo pérdidas de pacientes en el seguimiento durante estos cuatro meses.
DeterminacionesSe realizaron determinaciones analíticas sanguíneas y urinarias en el momento basal, al mes y a los cuatro meses de iniciado PRCT.
Las muestras sanguíneas de los test específicos se centrifugaron a 1200 revoluciones por minuto durante 10 minutos, se extrajo el suero, se alicuotó y almacenó a -80°C para su posterior análisis. Las determinaciones de ELISA fueron efectuadas de acuerdo al protocolo descrito por el fabricante. Las concentraciones de los parámetros se determinaron por la curva estándar y respectivas diluciones. Los parámetros bioquímicos valorados en cada una de las visitas fueron: creatinina (Cr), MDRD 4 tasa de filtrado glomerular (TFG), proteinuria mg/24h, Ca, Pi, calcidiol (Roche/Hitachi Cobas), PTHi (Roche/Hitachi Cobas®: fragmentos 1-84), fracción soluble Klotho (ELISA Cusabio®, 7,8-500 pg/mL), iFGF-23 (Millipore®; 9,9-2400 pg/mL). Parámetros relacionados con la inflamación: interleucina (IL) 6 (R & D®, HS600B; 0,156-10 pg/mL), TNF−α (ELISA R & D, HSTA00D; 0,52-32 pg/mL), IL10 (R & D, 0,78-50 pg/mL), proteína C reactiva (PCR) (Roche/Hitachi Cobas) ®. Parámetros relacionados con calcificación y fibrosis: Ft-A (Bio Vendor; 0,698-2.330g/L), BMP-7 (R & D; 31.20-2000 pg/mL) ®, TGF-β1 (R & D systems Quantikine ELISA®; 31.20-2000 pg/mL)⋅
Análisis estadísticoRealizamos un estudio analítico prospectivo no controlado antes-después. Las variables recogidas fueron analizadas por el programa estadístico SPSS-21. El análisis se hizo considerando las tres evaluaciones bioquímicas de los pacientes (basal, uno y cuatro meses). Las variables dimensionales se muestran como promedio±desviación estándar (DE). Las variables nominales se muestran como números o porcentajes. Las diferencias intragrupo fueron analizadas mediante ANOVA one way para muestras repetidas. Se consideró como resultado significativo un valor p<0,05.
Medidas de seguridad y consideraciones éticasEl presente estudio es considerado categoría II, con riesgo mínimo. En cada visita se indagó sobre la presencia de eventos adversos tomando las medidas oportunas. Se obtuvo consentimiento informado por parte de los pacientes. La recogida de datos se realizó respetando la confidencialidad del paciente según la Ley de Protección de Datos de Carácter Personal y se respetaron los aspectos éticos de la investigación en seres humanos en España.
ResultadosDescripción de la cohorteSeleccionamos 46 pacientes: 38 hombres (82%) y 8 (18%) mujeres, con una edad media de 73 años. Los porcentajes según estadificación de ERC y etiología se muestran en la tabla 1. En cuanto a los tratamientos farmacológicos 7 pacientes (15%) tomaban previamente calcidiol (periodo de lavado durante un mes previo al inicio del estudio), 6 pacientes (13%) estaban en tratamiento con captores del fósforo y 33 pacientes (71,8%) tenían prescrito inhibidores del sistema renina angiotensina aldosterona (SRAA). Ninguno de ellos presentaba tratamiento concomitante con cinacalcet.
Características etiológicas y farmacológicas de los pacientes incluidos en el estudio según grado de ERC al inicio del estudio
| Total | ERC Estadio III | ERC Estadio IV | ERC Estadio V | |
|---|---|---|---|---|
| N.° Pacientes | 46 (100%) | 19 (41,3%) | 23 (50%) | 4 (8,7%) |
| Etiología | ||||
| DM | 18 (39,13%) | 7 (36,8%) | 8 (34,7%) | 3 (75%) |
| NAE | 23 (50%) | 10 (52,6%) | 12 (52,1%) | 1 (25%) |
| GNII | 5 (11%) | 2 (10,5%) | 3 (13%) | 0 (0%) |
| Fármacos | ||||
| Captores del fósforo | 6 (13%) | 1 (5,2%) | 3 (13%) | 2 (50%) |
| SRAA inhibidores | 33 (71,8%) | 14 (73,6%) | 16 (69,5%) | 3 (75%) |
| AEE | 11 (24%) | 1 (5,2%) | 8 (34,7%) | 2 (50%) |
| Calcidiol | 7 (15,21%) | 2 (10,5%) | 4 (17,3%) | 1 (25%) |
Los porcentajes en cada estadificación se refieren al número de enfermos en cada uno de ellos.
AEE: agente estimulante de la eritropoyesis; DM: diabetes mellitus; GNII: glomerulonefritis; NAE: nefroangioesclerosis; SRAA: sistema renina angiotensina aldosterona.
Los cambios experimentados, tras la administración de PRCT, sobre las variables hemoglobina, hierro, saturación de trasferrina, CO2 total, albúmina, prealbúmina, perfil hepático y lipídico no mostraron cambios significativos.
La proteinuria no varió significativamente (p=0,299); tampoco se produjo descenso significativo (p=0,766) entre los pacientes que no presentaban tratamiento con inhibidores del SRAA (28,2%). Sí se produjo un aumento de creatinina significativo (p=0,007) y cercano a la significación estadística en la TFG (p=0,053); ante estos datos subdividimos a los pacientes según grado de ERC catalogándola como grave si TFG<30ml/min/1,73m2 (n=25) o moderada si TFG>30ml/min/1,73m2 (n=21). En los pacientes con ERC grave se produjo un descenso significativo de la TFG (p=0,002); sin embargo, entre los pacientes con ERC moderada, no hubo significación estadística (p=0,652). Estos datos los mostramos en la tabla 2.
Evolución de las variables de función renal y proteinuria durante el estudio
| Función renal y proteinuria | Rango normal | Media basal±DERango | Media 1 mes±DERango | Media 4 mes±DERango | p valor |
|---|---|---|---|---|---|
| Creatinina (mg/dL) | 0,5-1,1 | 2,54±1,05(1,3-6,1) | 2,56±1,08(1,2-6,1) | 2,69±1,18(1,1-7) | 0,007 |
| TFG MDRD 4 (mL/min/1,73m2) | Positivo<60 | 28,87±9,8(8,2-59,5) | 28,52±10,70(7,4-59,5) | 27,81±11,31(6,3-63,9) | 0,053 |
| >30 mL/min/1,73m2 | 36,11±7,17(24,2-59,5) | 28,21±11,77(30,2-59,5) | 36,69±9,62(30,3-63,9) | 0,652 | |
| <30 mL/min/1,73m2 | 22,32±6,57(8,2-29,9) | 28,78±9,98(7,4-29,9) | 20,55±5,98(6,3-28,6,2) | 0,002 | |
| Proteinuria (mg/24h) | 0-15 | 1377,81±2095,39(63-9540) | 1035,43±1687,85(48-9240) | 1167,61±1560,47(83,6-7463) | 0,299 |
Los marcadores clásicos de la EOM-ERC como Ca y P no se vieron modificados (p=0,112, p=0,066 respectivamente). No hubo aumentos de Ca por encima>10,5mg/dL ni de P>5,5mg/dL, por lo que no hubo que modificar la pauta de captores del P ni dosis de PRCT. Sí se observó un descenso significativo de PTHi (p=0,02); no obstante, los valores de PTHi se mantuvieron en rango según estadificación en todos los pacientes (Guías SEN) por lo que no hubo que suspender PRCT en ningún paciente. También observamos un aumento de calcidiol significativo (p=0,010). Datos desglosados en la tabla 3.
Evolución de las variables bioquímicas de EOM-ERC durante el estudio
| Rango | Media basal±DERango | Media 1 mes±DERango | Media 4 mes±DERango | p valor | |
|---|---|---|---|---|---|
| Ca (mg/dL) | 8,1-10,5 | 9,25±0,66(8-12) | 9,39±0,54(8,1-10) | 9,39±0,52(8,5-10,5) | 0,112 |
| P (mg/dL) | 2,7-5,2 | 3,57±0,80(2,2-5,5) | 3,72±0,78(1,8-5,3) | 3,78±0,69(2,2-5) | 0,066 |
| PTHi (pg/mL) | 15-65 | 158,17±90,23(75-472,3) | 110,34±67,6(75-307,6) | 119±87,79(40-368,3) | 0,002 |
| Calcidiol (ng/mL) | >30 | 21,35±8,59(8,2-46,9) | 22,22±10,17(5-53,5) | 26,22±13,15(10-35) | 0,010 |
| iFGF23 (pg/mL) | 9,9-2400 | 112,80±81,12(17,1-359) | 110,96±98,86(17-583,3) | 106,60±95,51(25-437) | 0,577 |
| Klotho (pg/mL) | 7,8-500 | 218,6±113,62(45,7-407,6) | 245,53±126,48(60,3-518,6) | 284,60±138,17(54,6-565) | 0,001 |
En cuanto a los parámetros más novedosos de la EOM-ERC (fig. 2), iFGF-23 no se modificó significativamente a lo largo del estudio (p=0,577); tampoco entre los pacientes en tratamiento con captores del P (n=6; p=0,125). Calculamos la diferencia de medias al finalizar el estudio (t de Student para muestras independientes) entre pacientes con o sin captores del P, el resultado no alcanzó la significación estadística (p=0,953, con una diferencia de medias de 2,48). Se produjo un aumento significativo de los niveles de Klotho (p=0,001).
Efectos de PRCT sobre parámetros relacionados con inflamación, fibrosis y calcificación vascularNo apreciamos cambios estadísticamente significativos en los niveles de PCR, aunque la tendencia fue descendente. IL6 y TNF-α descendieron de forma significativa tras el uso de PRCT: IL6 (p=0,001) y TNF-α (p=0,005). IL10, parámetro antiinflamatorio, aumentó significativamente (p<0,001). En cuanto a parámetros relacionados con la fibrosis y calcificación vascular, observamos aumento significativo de Ft-A (p<0,001) y BMP-7 (p<0,001) y descenso de TGF-β1 (p<0,001). Datos mostrados en la tabla 4 y figura 2.
Evolución de los parámetros inflamatorios, fibrosis y calcificación vascular
| Rango | Media basal±DERango | Media 1 mes±DERango | Media 4 mes±DERango | p valor | |
|---|---|---|---|---|---|
| PCR (mg/dL) | 0,00-0,80 | 1,13 (±3,24)(0,0-21,2) | 0,85 (±1,71)(0,0-7,6) | 0,70 (±1,45)(0,0-9,1) | 0,182 |
| IL6 (pg/mL) | 0,156-10 | 32,9 (±16,40)(10,1-92,9) | 30 (±15,49)(10,1-75,6) | 23,10 (±9,94)(6,2-48) | 0,001 |
| IL10 (pg/mL) | 0,78-50 | 12,80 (±6,10)(4,6-35,1) | 18,39 (±8,09)(3,6-53,6) | 19,60 (±7,91)(8,9-37,8) | 0,001 |
| TNF-α (pg/mL) | 0,5-32 | 13,70 (±12,02)(0,9-70) | 12,11 (±10,90)(1,6-56) | 8,80 (±6,28)(2,2-34,8) | 0,005 |
| Fetuína A g/L | 0,698-2,3 | 0,20±0,08(0,1-0,4) | 0,23±0,10(0,1-0,39) | 0,27±0,16(0,1-0,8) | <0,0001 |
| TGF-β1 pg/mL | 31,20-2000 | 6584,91±3468,662013,8-15892,3 | 6224,42±3462,861782,2-14805,5 | 5631,01±3167,171892,2-14587,2 | <0,0001 |
| BMP-7 pg/mL | 31,20-2000 | 4,55±1,222,58-7,12 | 4,95±1,412,56-7,76 | 5,39±1,522,67-8,12 | <0,0001 |
Durante el estudio no se produjeron reacciones adversas al medicamento, ni cambios en el tratamiento. No se produjeron ingresos ni eventos cardiovasculares.
DiscusiónEn nuestro estudio los pacientes presentaban una mejoría de parámetros relacionados con los procesos inflamatorio, fibrótico y de calcificación vascular. El impacto sobre marcadores de EOM-ERC muestran estabilidad en variables como Ca, P, FGF-23 y mejoría en otros como Klotho o PTH. La EOM-ERC y la inflamación son determinantes en el inicio y la progresión de la ERC y del RCV en estos enfermos15,16. PRCT ha demostrado, en múltiples estudios experimentales, su perfil seguro y beneficioso para regular la EOM-ERC y marcadores inflamatorios en la ERC sin agravar el proceso renal17,18.
En diferentes estudios se ha evaluado el efecto sobre la función renal y proteinuria de PRCT. El estudio VITAL19 demostró, en pacientes diabéticos tipo 2, una reducción de proteinuria significativa a dosis de 2 ug/día de PRCT. Similares resultados mostró el estudio de Agarwal et al.20 en pacientes con ERC EIII-IV. El efecto antiproteinúrico de PRCT, y vitamina D activa, tiene relación con la regulación del proceso proliferativo y fibrótico21,22 y bloqueo del SRAA19,23; la inhibición farmacológica de este eje puede condicionar que haya que aumentar la dosis de PRCT para conseguir el descenso de proteinuria. En nuestro estudio no obtuvimos diferencias significativas en la evolución de la proteinuria, tal vez debido al amplio uso de los inhibidores del SRAA (71,8%). En cuanto a la TFG, no obtuvimos datos estadísticos significativos aunque sí una tendencia al descenso tal vez debido al deterioro significativo que mostraban los enfermos con TFG<30ml/min/1,73m2. En cuanto al aumento significativo de Cr podría estar en relación a la influencia de variables externas como sexo, edad, masa muscular y estado nutricional sobre esta variable. Podríamos concluir que la activación del receptor de vitamina D con PRCT mantiene la TFG estable, coincidiendo con otros estudios24,25. Este efecto de PRCT podría conllevar la atenuación sobre el daño glomerular, tubulointersticial y endotelial que ha demostrado en ensayos experimentales mediante efectos antiinflamatorios26,27, antifibróticos28 y antiproteinúricos19,20 como comentaremos a posteriori.
Como era de esperar, PRCT redujo PTHi de manera significativa coincidiendo con diversos estudios29,30. Evidenciamos estabilidad en los niveles de Ca y P, aunque en el caso del P la tendencia era al alza. Este efecto menos hipercalcemiante e hiperfosfatemiante de PRCT viene determinado al producirse menos calbindina intestinal y a su menor afinidad por los receptores intestinales de vitamina D31, lo cual podría influir en la génesis de la calcificación vascular. No hay un claro mecanismo del aumento de calcidiol en nuestro estudio; tal vez sea debido a la estabilidad de FGF-23 (estimulante de la 24-hidroxilasa que inactiva calcidiol) que obtuvimos. En este sentido, y siguiendo en el marco de la EOM, el efecto de PRCT sobre marcadores como FGF-23 y Klotho sería relevante dado que ambos parámetros podrían modular la calcificación vascular, el estado inflamatorio y la función renal. En el caso de Klotho obtuvimos un aumento significativo de sus niveles séricos; Klotho posee efectos beneficiosos a nivel miocárdico y la hipertrofia ventricular izquierda33,34, antiinflamatorios32,36 (descenso de los niveles de IL6 y 18), antifibróticos35 (descenso de TGF-β) y efectos antiapoptoicos37 que podrían influir en la génesis de la calcificación vascular32,36. PRCT ha demostrado regular al alza los niveles de Klotho en diversos estudios como el de Lau et al.11 donde el tratamiento de PRCT y calcitriol, en ratones urémicos con calcificación vascular, aumentó de forma significativa los niveles de Klotho urinarios y séricos. En lo referente a los niveles FGF-23 nuestro estudio mostró resultados dispares frente a otros como el IMPACT38 o PARADIGM39 donde el uso de PRCT o calcitriol, en pacientes en hemodiálisis, aumentaba FGF-23. Esta discordancia podría ser debida a que nuestros pacientes no estaban incluidos en diálisis y se les presupone mayor función renal residual. No hay duda de que el aumento de FGF-23 en la ERC se relaciona con la calcificación vascular, aunque no como inductor40, y con un aumento en la morbimortalidad vascular41–43. FGF-23 suprime los niveles de calcitriol3,6 y de Ft-A41 (potente anticalcificante), provoca disfunción endotelial, desarrollo de hipertrofia ventricular izquierda y proteinuria41,42. Muchos de estos mecanismos procalcificantes de FGF-23 tienen como agravante el ambiente inflamatorio de la ERC3,44 que es estimulado por FGF-23 induciendo el aumento de IL6 y TNF-α 45. A su vez, el propio estado inflamatorio regula al alza los niveles de FGF-23: TNF-α y NF-κB pueden inhibir la matriz ósea y aumentar la producción de FGF-23 en el osteocito45. Además el estado proinflamatorio y fibrótico de la ERC modula los niveles de Klotho a la baja36.
La propia inflamación es un target terapéutico en la ERC donde PRCT ha demostrado sus efectos beneficiosos13,14. Tras el uso de PRCT nuestros pacientes presentaban un efecto bioquímico antiinflamatorio favorable al descender de manera significativamente los niveles de IL6 y TNF-α y aumentar IL10, mediado tal vez por el aumento de Klotho y estabilidad de FGF-23 o por un efecto directo del fármaco. Donate et al.22 coinciden con nuestros resultados; estos autores demostraron en pacientes con ERC y elevación de PTH (n=8; estadiajes IIIB-IV) que el tratamiento con PRCT provocó un descenso significativo de IL6 y TNF-α. El efecto antiinflamatorio de PRCT podría estar condicionado por la disminución de la producción de citoquinas por las células T26,27. Estos efectos antiinflamatorios de PRCT podrían influir sobre parámetros anticalcificantes como Ft-A o BMP-7 (descendidos en pacientes con ERC8,46), y fibróticos como TGF-β (aumentado en ERC). El aumento de Ft-A tras el uso de PRCT que obtuvimos podría mejorar el perfil procalcificante, al igual que los resultados que obtuvimos sobre BMP-7 que, además de sus efectos anticalcificantes47,48 (inhibe el cotransportador Na/Pi de las CMLV), promueve la formación ósea y presenta efectos antiinflamatorios47,49. El caso de TGF-β es el contrario a BMP-7; su descenso, significativo en nuestro estudio, podría implicar nefroprotección y una atenuación del daño vascular50 al disminuir la migración de stem cells mesenquimales osteoprogenitoras a las zonas dañadas51 promovida por TGF-β y disminuyendo la apoptosis, proliferación y diferenciación celular52.
Nuestro estudio tiene limitaciones; los pacientes son controles de sí mismos, no poseemos grupo placebo, el tiempo de observación es corto y nuestra cohorte pequeña lo cual puede conllevar alteraciones en la interpretación de resultados. Además, no diferenciamos los meses de inclusión de los pacientes que podría influir en los niveles de calcidiol al variar estacionalmente. Basamos nuestros resultados en marcadores sanguíneos y no en modelos experimentales de lesión vascular; así mismo no hemos aportado datos sobre otras moléculas como RANK-L (ligando de receptor activador del factor nuclear κ beta), osteopontina u osteoprotegerina. Como contrapunto los parámetros analizados abarcan una importante influencia en la calcificación vascular, la inflamación y la fibrosis con una posible regulación favorable tras el tratamiento con PRCT.
ConclusionesEl tratamiento con PRCT, en el paciente renal sin diálisis, parece ser beneficioso en la regulación de parámetros inflamatorios, fibróticos y anticalcificantes; así como sobre marcadores clásicos y no clásicos de la EOM-ERC preservando la función renal. No existe un marcador que valore los efectos pleiotrópicos de PRCT en la enfermedad renal. Los marcadores elegidos en nuestro estudio podrían indicarnos su efecto en la enfermedad óseo-mineral renal y, en concreto, en el proceso de calcificación vascular.
Los datos obtenidos podrían indicar un efecto modulador de PRCT positivos sobre marcadores relacionados con la calcificación vascular, el estado inflamatorio y fibrótico de la ERC.
El abordaje terapéutico de los AVDR sigue sin ser explorado en la clínica de los pacientes con ERC, quedando relegado como uso exclusivo en el hiperparatiroidismo secundario y sin la realización de ensayos clínicos con expectativas más amplias en los últimos años en la práctica clínica. Esto deja un campo aún por explorar especialmente en lo que atañe a la calcificación vascular en pacientes con enfermedad renal crónica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.