El dolor músculo-esquelético crónico (DMEC) es un síntoma muy frecuente en pacientes con enfermedad renal crónica (ERC), y contribuye de forma importante al deterioro de la calidad de vida.
ObjetivosDeterminar la prevalencia y características clínicas asociadas al DMEC en pacientes con ERC avanzada no en diálisis, analizar su relación con otros síntomas urémicos y su significado pronóstico.
Material y métodosEstudio transversal en el que se analizó la sintomatología urémica de pacientes no seleccionados remitidos por ERC estadio 4 y 5 prediálisis. Para caracterizar aquellos que presentaban DMEC, además de los datos demográficos, antropométricos, la comorbilidad y la función renal, también se recogieron parámetros de inflamación, ácido úrico, metabolismo óseo-mineral incluyendo 25-hidroxi-colecalciferol (25-OHCC), creatincinasa, y fármacos de potencial interés como alopurinol, estatinas y agentes estimulantes de eritropoyetina.
ResultadosSe incluyó a 1.169 pacientes con edad media de 65±15 años; el 54% eran hombres. Un 38% de los pacientes refería DMEC, y este síntoma fue más frecuente en mujeres que en hombres (49 vs. 28%; p<0,0001). La debilidad muscular, prurito, calambres, equimosis, insomnio, edemas y disnea fueron los síntomas más frecuentemente asociados al DMEC. No se observaron asociaciones significativas entre niveles de creatincinasa, 25-OHCC, tratamiento con alopurinol, estatinas o agentes estimulantes de eritropoyetina con DMEC. Los mejores determinantes de DMEC fueron: mujer, mayor, obesa, con comorbilidad (sobre todo diabetes, insuficiencia cardiaca o EPOC), y marcadores de inflamación elevados (proteínaC reactiva y leucocitos no neutrófilos).
Aunque los pacientes con DMEC tenían una peor supervivencia, un análisis multivariante con ajuste simple a datos demográficos descartó que el DMEC fuera un determinante independiente de la mortalidad.
ConclusionesEl DMEC es muy prevalente en pacientes con ERC avanzada, y se asocia con otros síntomas comunes de la uremia crónica. Al igual que en la población general, características como sexo femenino, edad avanzada, obesidad y comorbilidad están más frecuentemente asociados al DMEC. La elevación de los marcadores de inflamación asociada al DMEC podría ser un hallazgo relevante para explicar su patogenia.
Chronic musculoskeletal pain (CMP) is a very common symptom in patients with chronic kidney disease (CKD), and is associated with a significant deterioration in quality of life.
AimsTo determine the prevalence and clinical characteristics associated with CMP in patients with advanced CKD not on dialysis, and to analyse their relation with other uraemic symptoms and their prognosis significance.
Material and methodsCross-sectional study to analyse the uraemic symptoms of an unselected cohort of patients with CKD stage 4-5 pre-dialysis. In order to characterise patients with CMP, demographic and anthropometric data were collected, as well as data on comorbidities and kidney function. In addition, inflammatory parameters, uric parameters, bone mineral metabolism including 25-hydroxycholecalciferol (25-OHCC), creatine kinase and drugs of potential interest including allopurinol, statins and erythropoiesis-stimulating agents were recorded.
ResultsThe study group consisted of 1169 patients (mean age 65±15 years, 54% male). A total of 38% of patients complained of CMP, and this symptom was more prevalent in women than in men (49 vs. 28%; P<.0001). Muscle weakness, pruritus, muscle cramps, ecchymosis, insomnia, oedema and dyspnoea were the most common symptoms associated with CMP. There were no significant associations between serum levels of creatine kinase, 25-OHCC, treatment with allopurinol, statins or erythropoiesis-stimulating agents and CMP. The female gender, elderly age, obesity, comorbidity (mainly diabetes, heart failure or COPD), and elevated levels of inflammatory markers (C-reactive protein and non-neutrophilic leukocytes) were the best determinants of CMP.
While patients with CMP showed a worse survival rate, a multivariate analysis adjusted for demographic data ruled out the independent association of CMP with mortality.
ConclusionsCMP is highly prevalent in patients with advanced CKD and is associated with other common symptoms of chronic uraemia. As with the general population, elderly age, the female gender, obesity and some comorbid conditions are the best determinants of CMP. Increased inflammatory markers commonly observed in patients with CMP may have a relevant role in its pathogenesis.
Los síntomas de la enfermedad renal crónica (ERC) son inespecíficos y muy variados. El dolor músculo-esquelético crónico (DMEC) es un síntoma muy frecuente en la ERC1,2, que tiene una repercusión importante en la percepción de la salud y en la calidad de vida de los pacientes que lo presentan3,4.
Estudios previos han demostrado que, a pesar de la alta prevalencia de este síntoma, es habitualmente infravalorado y se suele atribuir a diversos procesos relacionados o no con la uremia crónica como las alteraciones óseo-minerales, neuritis, u osteoartritis inflamatorias o degenerativas4–7.
El DMEC en la ERC se asocia con frecuencia a otros síntomas atribuibles a la uremia como el insomnio y la fatiga1–3, o a trastornos psiquiátricos como la ansiedad o depresión8. Además, estos pacientes necesitan un uso abundante de analgésicos, lo que, unido a la alteración de la metabolización de fármacos asociada a la uremia, incrementa el riesgo de reacciones adversas9,10.
A pesar de la importancia de este síntoma en la ERC, existen muy pocos estudios que hayan analizado las características clínicas y sus determinantes. Un mejor conocimiento del origen y características del dolor podrían ayudar a diseñar estrategias de tratamiento más específicas y eficaces.
Los objetivos del presente estudio fueron determinar la prevalencia de DMEC en pacientes con ERC avanzada y analizar las asociaciones con los parámetros clínicos y bioquímicos, así como su potencial relación con fármacos, y el efecto sobre la supervivencia.
Material y métodosEn este estudio de observación transversal se incluyó a pacientes incidentes remitidos a la consulta ERCA desde enero de 2000 hasta noviembre de 2014. Todos eran mayores de 18 años y tenían un filtrado glomerular inferior a 30ml/min/1,73 m2. No se excluyó a ningún paciente.
Como parte de la entrevista clínica, siempre realizada por un nefrólogo, se obtuvo información sobre la presencia de síntomas asociados a la uremia mediante una anamnesis dirigida que de forma protocolizada se realiza a todos los pacientes en nuestra consulta ERCA. Los síntomas que se incluyeron fueron: anorexia, náuseas o vómitos, edemas, disnea, disminución de la actividad física, fatiga (debilidad muscular), prurito, equimosis o epistaxis, calambres, intolerancia al frío, insomnio nocturno, obnubilación diurna, piernas inquietas, mioclonias y DMEC.
El DMEC se definió como la presencia de dolor muscular u óseo en cualquier localización (miembros superiores o inferiores o tronco), de más de 3 meses de evolución, no atribuible a causas traumáticas, y que requería tratamiento analgésico al menos 3 veces por semana. No se recogió como dato para el estudio la intensidad del síntoma.
Se definió como calambre la contracción involuntaria, sostenida y dolorosa de músculos o grupos musculares en miembros inferiores o superiores, que ocurría de forma espontánea y preferentemente durante el reposo.
Para caracterizar a los pacientes con o sin dolor, además de los datos demográficos y el índice de masa corporal, se incluyeron como variables de potencial interés: el índice de comorbilidad de Davies, la hemoglobina, el recuento total de leucocitos y neutrófilos, el filtrado glomerular estimado mediante MDRD (eGFR), concentraciones plasmáticas de ácido úrico, calcio, fósforo, bicarbonato, PTH, fosfatasa alcalina, albúmina sérica, proteína C reactiva. Todas las determinaciones bioquímicas se realizaron por métodos convencionales de laboratorio.
Además se incluyeron los antecedentes de artritis gotosa y el uso de medicamentos de interés por su potencial relación con el DMEC como: estatinas, alopurinol y los agentes estimulantes de la eritropoyesis (AEE).
En un subgrupo de 671 pacientes no seleccionados se determinaron las concentraciones séricas de creatincinasa (CK) para estudiar la asociación entre rabdomiólisis y DMEC o calambres.
En otro subgrupo no seleccionado de 361 pacientes se determinaron los niveles séricos de 25-hidroxi-colecalciferol para compararlos entre pacientes con y sin DMEC.
Diseño del estudio y análisis estadísticoEn este estudio transversal se describe la prevalencia del DMEC, la asociación con otros síntomas, las características clínicas y bioquímicas de los pacientes que lo presentaban y las diferencias más significativas con respecto al resto del grupo de estudio. Además, para establecer si la presencia de este síntoma es predictivo de la evolución de los pacientes, se comparó la supervivencia de los pacientes con o sin DMEC de forma univariable y ajustada a sexo y edad.
Los datos estadísticos descriptivos se presentan como media y desviación estándar, o como mediana y rangos intercuartiles (IQ) para las variables continuas, y como porcentajes para las variables categóricas.
Para la comparación de las variables continuas, y dependiendo de sus características de distribución, se utilizaron pruebas paramétricas (t Student) o no paramétricas (Mann-Whitney), y para las variables categóricas se utilizó la prueba chi-cuadrado.
Para establecer la asociación independiente de las variables de estudio con el DMEC en el grupo de estudio se utilizó una regresión logística multivariante. Un primer análisis se realizó para determinar cuáles eran los síntomas mejor asociados con el DMEC. En otro modelo aparte se incluyeron las siguientes variables independientes: edad, sexo, índice de comorbilidad, diabetes mellitus, índice de masa corporal, leucocitos, neutrófilos, ácido úrico, calcio, fósforo, bicarbonato, PTH, proteína C reactiva, y tratamiento con estatinas, alopurinol o EPO. Para la selección de las variables con los mejores modelos de predicción se utilizó el proceso automático de eliminación progresiva condicional.
Para analizar las diferencias de supervivencia se utilizaron curvas de Kaplan-Meier (estudio univariable) y un modelo multivariable de riesgo proporcional de Cox, para ajustar las diferencias de supervivencia solo con la edad y sexo (no mereció la pena un ajuste más extenso).
Una p<0,05 fue considerada como estadísticamente significativa, y todos los valores de p que se muestran son bilaterales. Los análisis estadísticos se realizaron con el software IBM SPSS Statistics 21.0 (IBM Corp. Armonk, EE. UU.)
ResultadosPrevalencia de dolor músculo-esquelético crónico y síntomas asociadosSe incluyó a 1.169 pacientes con las características demográficas, clínicas y bioquímicas que se muestran en la tabla 1.
Características de los pacientes del grupo total y de los subgrupos con o sin dolor músculo-esquelético crónico
| Total | Sin dolor | Con dolor | p | |
|---|---|---|---|---|
| N.° de pacientes | 1.169 | 728 (62%) | 441 (38%) | |
| Edad, años | 65 (15) | 62 (16) | 70 (12) | <0,000 |
| Sexo, % hombres | 54 | 63 | 41 | <0,000 |
| Índice de comorbilidad: ausente, leve-moderada, severa % | 32/52/16 | 37/49/14 | 24/56/20 | <0,000 |
| Diabetes mellitus, % | 37 | 34 | 41 | 0,012 |
| IMC, kg/m2 | 29,3 (5,8) | 28,4 (5,4) | 30,8 (6,1) | <0,000 |
| Hemoglobina, g/dl | 11,5 (3,9) | 11,6 (4,7) | 11,3 (1,6) | 0,132 |
| Leucocitos totales, /mm3 | 8.048 (2.63) | 7.925 (2.64) | 8.250 (2.62) | 0,041 |
| Neutrófilos, /mm3 | 5.411 (2.20) | 5.381 (2.30) | 5.459 (2.03) | 0,556 |
| eGFR, ml/min/1,73 m2 | 14,4 (4,9) | 14,4 (4,9) | 14,5 (5,0) | 0,630 |
| Ácido úrico, mg/dl | 7,6 (1,9) | 7,7 (1,9) | 7,4 (1,9) | 0,035 |
| Calcio total, mg/dl | 9,13 (0,79) | 9,11 (0,83) | 9,18 (0,74) | 0,139 |
| Fósforo, mg/dl | 4,73 (1,11) | 4,77 (1,18) | 4,67 (0,99) | 0,130 |
| Bicarbonato, mmol/l | 21,6 (4,0) | 21,4 (4,2) | 21,7 (3,6) | 0,252 |
| PTH, pg/ml | 260 (219) | 265 (222) | 252 (214) | 0,307 |
| PTH<100pg/ml, % | 22 | 21 | 22 | 0,820 |
| PTH>500pg/ml, % | 11 | 12 | 10 | 0,369 |
| Fosfatasa alcalina, UI/ml | 105 (59) | 102 (56) | 108 (63) | 0,090 |
| Albúmina sérica, g/dl | 3,87 (0,54) | 3,88 (0,57) | 3,86 (0,49) | 0,456 |
| Proteína C reactivaa, mg/l | 3,85 [13–11,04] | 3,52 [1,27–9,35] | 4,45 [1,72–13,31] | 0,001 |
| Proteína C reactiva>5mg/l, % | 43 | 39 | 48 | 0,003 |
| Antecedentes de artritis gotosa, % | 10 | 10 | 10 | 0,898 |
| Estatinas, % | 53 | 52 | 54 | 0,357 |
| Alopurinol, % | 23 | 22 | 25 | 0,281 |
| AEE-EPO, % | 62 | 62 | 61 | 0,688 |
Un 38% de los pacientes estudiados (441 pacientes) tenían DMEC. Este síntoma fue más frecuente en mujeres que en hombres (49 vs. 28%; p<0,0001).
La mayoría de los pacientes utilizaba como analgésico paracetamol o metamizol. En el momento de la primera consulta, más de un 20% de pacientes con DMEC también tomaba de forma asidua antiinflamatorios no esteroideos. Menos del 15% mezclaba paracetamol con tramadol o codeína. Menos de un 5% de los pacientes con DMEC estaba siendo tratado con mórficos (fentanilo y similares) o modificadores de la percepción dolorosa (gabapentina o pregabalina). Son reseñables los importantes efectos adversos que mostraban los pacientes tratados con estos últimos fármacos.
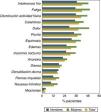
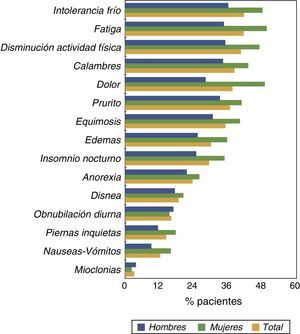
La prevalencia de otros síntomas desglosada según sexo se muestra en la figura 1. La mayoría de los síntomas eran más prevalentes en las mujeres que en los hombres. Además del DMEC, otros síntomas que destacaron por su alta prevalencia fueron: fatiga, baja actividad física, intolerancia al frío y prurito.
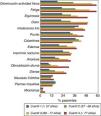
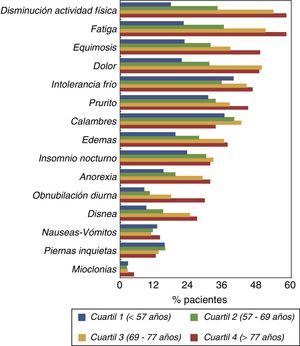
Las prevalencias de síntomas desglosadas según cuartiles de edad se muestran en la figura 2. El DMEC y otros síntomas como la fatiga y disminución de la actividad física se incrementaban notablemente en los 2 cuartiles superiores de distribución de edad (>69 años).
Por regresión logística, los síntomas más frecuentemente asociados con el DMEC fueron (tabla 2): fatiga, prurito, calambres, equimosis, insomnio, edemas y disnea.
Regresión logística multivariante. Síntomas urémicos mejor asociados con el dolor músculo-esquelético crónico
| Variable | Odds ratio | IC 95% OR | p |
|---|---|---|---|
| Fatiga (debilidad muscular) | 2,91 | 2,22 - 3,81 | <0,000 |
| Prurito | 1,75 | 1,34 - 2,28 | <0,000 |
| Calambres | 1,62 | 1,24 - 2,11 | <0,000 |
| Edemas | 1,59 | 1,19 - 2,11 | 0,001 |
| Equimosis | 1,55 | 1,18 - 2,03 | 0,002 |
| Insomnio nocturno | 1,38 | 1,04 - 1,84 | 0,027 |
| Disnea | 1,41 | 1,01 - 1,97 | 0,049 |
No entraron en el mejor modelo: anorexia, náuseas-vómitos, baja actividad física, intolerancia al frío, mioclonias, piernas inquietas, obnubilación diurna.
Para investigar si la rabdomiólisis podría ser causa o contribuir al DMEC, se incluyeron las concentraciones plasmáticas de CK analizadas a 671 pacientes no seleccionados (dicha determinación se comenzó a realizar a todos los pacientes a partir del año 2006).
La concentración media de CK según sexo no mostró diferencias significativas en los pacientes con o sin DMEC (hombres con o sin DMEC: 124±120 vs. 140±169 U/ml; mujeres con o sin DMEC: 91±59 vs. 94±79 U/ml).
Tampoco se observó una mayor frecuencia de CK por encima del límite de la normalidad (>194 U/ml) en aquellos pacientes con DMEC frente a los que no presentaban este síntoma (9,7 vs. 14,4%).
Sí se observó una concentración plasmática media de CK más elevada en los hombres que presentaban calambres frente a los que no tenían este síntoma (161±163 vs. 120±149U/ml; p=0,012). En mujeres con calambres, los niveles de CK también fueron más elevados, aunque la diferencia con respecto a las que no presentaban este síntoma estaba en el límite de la significación estadística (101±72 vs. 86±67 U/ml; p=0,058).
Una elevación de CK por encima de la normalidad fue más frecuente en todos los pacientes (hombres y mujeres) con calambres que en los que no padecían este síntoma (17,4 vs. 9,3%; p=0,002).
En 391 pacientes tratados con estatinas y en los que se determinó la CK, los niveles de esta enzima estaban significativamente más elevados que en los de los 280 pacientes que no tomaban esta medicación (133±135 vs. 94±111 U/ml; p<0,0001). También, una concentración de CK por encima del límite de la normalidad fue más frecuente entre los pacientes que estaban en tratamiento con estatinas que entre los que no tomaban esta medicación (17 vs. 6%; p<0,0001).
Niveles séricos de 25-hidroxi-colecalciferol y dolor músculo-esquelético crónicoNo se observaron diferencias significativas en los niveles de 25-hidroxi-colecalciferol determinados a 203 pacientes sin DMEC y a 158 pacientes con DMEC: 14,9±8,4 vs. 13,4±8,5ng/ml; p=0,08.
Tampoco se observaron diferencias significativas en el porcentaje de pacientes con niveles séricos de 25-hidroxi-colecalciferol inferiores a 20ng/ml entre aquellos con o sin DMEC (82 vs. 77%; p=0,317).
Determinantes del dolor músculo-esquelético crónicoEn la tabla 1 se muestran las características demográficas, clínicas y bioquímicas de los pacientes con o sin DMEC.
El DMEC fue más frecuente en mujeres mayores que presentaban comorbilidad. Además de la diabetes mellitus, otros procesos asociados significativamente con el DMEC fueron: la insuficiencia cardiaca (100% de los pacientes con este antecedente presentaban DMEC) y la EPOC (46% con DMEC). En cambio, otras comorbilidades como la cardiopatía isquémica, ACV o isquemia periférica, o antecedentes de artritis gotosa no se asociaron a una mayor frecuencia de este síntoma.
Los pacientes con DMEC eran más obesos, presentaban unos niveles de proteína C reactiva y leucocitos totales más elevados que el resto de los pacientes, pero no se observaron diferencias en los parámetros bioquímicos que caracterizan la enfermedad metabólica ósea.
No se observaron diferencias en la prescripción de estatinas, alopurinol o EPO.
Mediante regresión logística multivariable, el mejor modelo predictivo de DMEC (tabla 3) mostraba las siguientes características: mujer, mayor, obesa, con comorbilidad, y marcadores de inflamación elevados (proteínaC reactiva y leucocitos no neutrófilos).
Regresión logística multivariante. Características clínicas y analítica mejor asociadas con el dolor músculo-esquelético crónico
| Variable | Odds ratio | IC 95% OR | p |
|---|---|---|---|
| Sexo masculino | 0,458 | 0,350–0,600 | <0,000 |
| Edad,×10 años | 1,31 | 1,20–1,42 | <0,000 |
| Índice de comorbilidad, 0=ausente, 1=leve-moderada, 2=severa | 1,282 | 1,038–1,584 | 0,021 |
| IMC,×10kg/m2 | 1,55 | 1,31–1,79 | 0,000 |
| Leucocitos,×1.000/mm3 | 1,303 | 1,136–1,494 | <0,000 |
| Neutrófilos,×1.000/mm3 | 0,733 | 0,620–0,865 | <0,000 |
| Proteína C reactiva, x10mg/l | 1,09 | 1,01–1,16 | 0,028 |
No entraron a formar parte del mejor modelo de predicción: ácido úrico, bicarbonato, albúmina, PTH, fosfatasa alcalina, diabetes, estatinas, AEE-EPO, alopurinol y filtrado glomerular.
Se siguió la evolución de 1.078 pacientes, con recogida de datos sobre fallecimiento por cualquier causa y fecha, con censura por final de seguimiento (febrero de 2014), pérdida de seguimiento o trasplante renal.
La mediana del tiempo de seguimiento fue de 1.075 días (rangos IQ: 456–1.756 días). Durante este periodo fallecieron 489 pacientes (42% de la población estudiada).
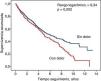
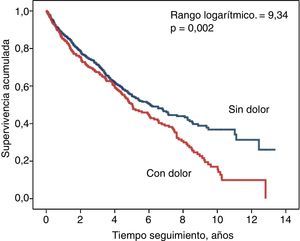
En la figura 3 se muestran las curvas de supervivencia correspondientes a los pacientes que presentaban o no DMEC como síntoma inicial. Aunque la diferencia resultó ser significativa en esta comparación univariable, al incluir simplemente la edad y el sexo en un modelo de regresión de riesgo proporcional de Cox, el DMEC dejó de asociarse significativamente con la mortalidad (Wald 0,193; p=0,661).
DiscusiónEste estudio muestra el DMEC como un síntoma muy prevalente en pacientes con ERC, que es más frecuente en mujeres mayores, obesas, con comorbilidad, sobre todo diabetes, insuficiencia cardiaca y EPOC, y asociado a marcadores de inflamación. Los pacientes con DMEC también tenían con más frecuencia fatiga, prurito, calambres, insomnio, edemas y disnea. Por el contrario, el DMEC no parecía estar asociado a las alteraciones del metabolismo óseo-mineral, ni a diferencias significativas en los niveles plasmáticos de vitamina D, rabdomiólisis, uso de fármacos (estatinas, EPO) ni artritis gotosa.
Se estima que entre un 10 y un 20% de la población general adulta padece algún tipo de dolor crónico11–13, que es más frecuente entre las mujeres con más edad, y con una influencia importante sobre su prevalencia de factores físicos (obesidad, comorbilidad), emocionales (separación, divorcio, viudedad), psicológicos (ansiedad, depresión) y sociales (nivel educativo, empleo e ingresos)14. Entre un 50 y un 70% de estos dolores son de origen músculo-esquelético (DMEC), así, el DMEC en la población general oscilaría entre el 5 y el 14%11–14. También un estudio en población española muestra que más del 20% de la población general padece DMEC15.
A pesar de esta alta prevalencia de DMEC en la población general, las cifras observadas en nuestra población con ERC fueron mucho más elevadas, lo que hace bastante improbable que este hallazgo pudiera ser atribuible a una variación dentro de la normalidad.
Se ha descrito que el DMEC es muy prevalente en pacientes tratados mediante diálisis1,3,4, pero también en la ERC en estadios prediálisis2,5,16, e incluso en trasplantados renales10.
Al igual que en la población general17,18, en este estudio se observó una mayor prevalencia de DMEC en mujeres que en hombres. La razón de esta preferencia del DMEC por el sexo femenino no es bien conocida. Además de que las mujeres suelen ser mucho más explícitas que los hombres en una anamnesis (apreciación subjetiva de los autores), hecho que además podría explicar la mayor prevalencia de otros síntomas en las mujeres con respecto a los hombres de la población incluida en nuestro estudio, se especula con la hipótesis de una mayor sensibilidad al dolor en el sexo femenino por mecanismos que pueden estar relacionados con los sistemas de percepción tanto periféricos como centrales18.
En este estudio se descarta que el DMEC esté asociado a rabdomiólisis, enfermedad que fue diagnosticada mediante los niveles séricos de CK. Sí, en cambio, se observaron niveles anormalmente elevados de CK en pacientes tratados con estatinas y en aquellos que referían calambres frecuentes.
Se ha observado que la administración de EPO puede provocar un cuadro seudogripal con aumento de la sensibilidad al dolor19. En este estudio no se observó una mayor frecuencia de tratamiento con AEE-EPO en aquellos pacientes con DMEC.
En algún estudio realizado en pacientes asiáticos con ERC se ha observado que la hiperuricemia y la artritis gotosa se asocian a una mayor frecuencia de DMEC5. En nuestro estudio no hemos observado asociaciones significativas entre DMEC y concentraciones de ácido úrico en sangre, el tratamiento con inhibidores de la xantino-oxidasa, o los antecedentes de artritis gotosa.
Se ha descrito una asociación entre niveles reducidos de vitamina D en sangre (25-hidroxi-colecalciferol) y DMEC en la población general20. Los niveles séricos bajos de vitamina D son muy frecuentes en la ERC y, aunque los pacientes de nuestro estudio con DMEC tenían niveles más bajos, la diferencia con respecto a los que no presentaban DMEC no alcanzó significación estadística.
La prevalencia de DMEC aumentó en pacientes con comorbilidad; fue especialmente llamativa la asociada con la insuficiencia cardiaca (100% de los casos). Este hallazgo también ayuda a explicar la asociación observada entre DMEC y edemas o disnea. También la diabetes mellitus y la EPOC se asociaron con DMEC. Este aumento de la prevalencia de dolor ya ha sido señalado previamente en la literatura en pacientes con EPOC21.
Un hallazgo que sorprende en este estudio es la ausencia de una asociación entre las alteraciones bioquímicas óseo-minerales y el DMEC. Otros estudios han observado una relación entre DMEC con enfermedad adinámica ósea22, y también con la enfermedad ósea de alto remodelado6,7,22; esta última, además, con la peculiaridad de que el dolor suele ser más intenso.
En este estudio, el DMEC se asoció con una peor supervivencia en comparación con los que no padecían este síntoma. Otro estudio también ha demostrado esta asociación entre DMEC y mortalidad en la ERC23. Sin embargo, cuando en nuestros pacientes se ajustó el modelo de riesgo proporcional simplemente con el sexo y la edad, se anulaba la significación estadística del DMEC sobre la predicción de supervivencia.
Al igual que ocurre en la población general24, el DMEC en nuestros pacientes se asoció a unos niveles más elevados de marcadores inflamatorios, y este hallazgo podría ayudar a entender los posibles mecanismos que subyacen en el desarrollo de dolor en la ERC25–27.
Los estados inflamatorios crónicos son capaces de sensibilizar los nociceptores (receptores del dolor) periféricos mediante las numerosas sustancias mediadoras de la inflamación (interleucinas, TNF, prostaglandinas, etc.)27. En ocasiones esta sensibilización de los nociceptores puede ser tan intensa que llega a provocar su activación espontánea sin mediación de daño27.
Estos mismos mediadores inflamatorios, y quizá ciertas toxinas urémicas, podrían jugar también un papel importante en la sensibilización de la percepción dolorosa a nivel del sistema nervioso central y del balance de inhibidores endógenos del dolor (endorfinas, endocannabioides, GABA, etc.)25–27.
Este estudio tiene limitaciones. Es un estudio transversal, en el que no se hizo una estimación de la intensidad del dolor, ni una valoración o descripción de la severidad del daño músculo-esquelético y su relación con la prevalencia de DMEC. Tampoco se recogió información sobre el estado de salud mental ni las peculiaridades socio-económico-culturales de los pacientes, que podrían tener influencia en la interpretación de los resultados.
En conclusión, el DMEC es muy prevalente en pacientes con ERC avanzada, y se asocia con otros síntomas comunes en la uremia crónica. Las principales características de los paciente que presentan DMEC son: sexo femenino de edad avanzada, obesidad, con ciertas comorbilidades y marcadores inflamatorios elevados.
Son necesarios más estudios para analizar qué tipo de analgésicos o qué medidas coadyuvantes a la analgesia podrían ser más eficaces y menos tóxicas en esta población.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.