Introducción: El riesgo de tuberculosis (TB) está aumentado en pacientes con insuficiencia renal crónica y en diálisis. La prueba de la tuberculina (PT) es el test de cribado clásico en estos pacientes, a pesar de su baja sensibilidad. En los últimos años se han desarrollado nuevos métodos diagnósticos que se basan en la producción de interferón gamma tras la estimulación con antígenos de M. tuberculosis. El objetivo de este estudio fue evaluar si el Quantiferon® TB-gold In Tube (QFT-GIT) puede contribuir en el diagnóstico de la infección tuberculosa en pacientes en diálisis peritoneal (DP). Pacientes y métodos: Se incluyeron 54 pacientes en DP. Se valoró la posibilidad de infección tuberculosa latente mediante el QFT-GIT, la PT y la valoración clinicorradiológica por parte de un neumólogo experto. Se estudiaron las concordancias entre los tests. Resultados: La prevalencia de un resultado positivo para el test de la tuberculina fue del 29,6% para el primer test y del 31,5% para el segundo (valorando el efecto booster). Una radiografía de tórax positiva aumentaba la detección de infección tuberculosa latente hasta un 42,6% y la del neumólogo hasta un 44,4%. El nivel de correlación entre el QFT-GIT y la PT fue moderado (kappa = 0,36; p = 0,006), al igual que entre la PT y la valoración del neumólogo (kappa = 0,257, p = 0,06). Conclusiones: El QFT-GIT aporta algunas ventajas en el diagnóstico de la infección tuberculosa en pacientes con insuficiencia renal crónica en DP, y puede complementar a la prueba de la tuberculina.
Objective: The risk for tuberculosis (TB) is increased in patients with chronic renal failure and dialysis. Tuberculin skin test (TST) is the classical diagnostic method for screening despite its low sensitivity. New methods based on interferon-gamma have been developed. The aim of this study was to evaluate if Quantiferon® TB-gold In Tube (QFT-GIT) could be useful in the diagnosis of TB infection in patients on peritoneal dialysis (PD). Patients and methods: Fifty-four patients on PD were included in the study. They were evaluated for latent tuberculosis with QFT-GIT, TST and an assessment by an expert pulmonologist using patient’s medical history and x-rays. Agreement between test results was determined. Results:The prevalence of a positive TST was 29.6% for the first test and 31.5% for the second (booster effect). A positive chest x-ray increased the rate of detection of patients with latent TB infection up to 42.6% and the expert physician’s evaluation to 44.4%. The correlation between QFT-GIT and TST was fair (k=0.36; P=.006), as it was between TST and expert physician’s evaluation (k=0.257; P=.06). Conclusions: According to our experience QFT-GIT represents an important advantage in the diagnosis of latent TB infection in chronic renal failure patients on PD. It may complement but not replace TST.
INTRODUCCIÓN
La prevalencia de tuberculosis (TB) en España varía dependiendo de las regiones. Durante la última década la incidencia de enfermedad tuberculosa ha descendido en nuestro país; sin embargo, es importante saber que, incluso en áreas con baja prevalencia, la incidencia de TB en pacientes inmunocomprometidos es una causa importante de morbilidad y mortalidad1.
Se sabe que la uremia se asocia con numerosas alteraciones del sistema inmune, la mayoría relacionadas con la alteración de la inmunidad celular2. La infección tuberculosa latente se caracteriza por una fuerte respuesta inmune de tipo celular en ausencia de micobacterias detectables. Ya que esta infección está controlada por la respuesta inmune celular, una alteración de la misma puede llevar a la reactivación de la infección tuberculosa latente1. En la actualidad la sensibilidad cutánea al antígeno de la tuberculina (PT) es el método utilizado para detectar infección tuberculosa latente. La respuesta a este antígeno depende de la carga de infección y el estado de inmunidad celular individual, tiene baja sensibilidad y especificidad. Además, en los pacientes urémicos hay una disminución de la respuesta inmune retardada a los tests cutáneos3 y del funcionamiento de los macrófagos2, que pueden provocar anergia cutánea y alterar la respuesta al test de la tuberculina. Por esta razón, la PT no se realiza de forma rutinaria en los pacientes en diálisis.
Al no existir una prueba gold standard para el diagnóstico de la TB, algunos grupos han estudiado los tests que utilizan los Interferon Gamma Release Aassays (IGRA) comparándolos con la PT, para clarificar su sensibilidad y especificidad en diferentes subconjuntos de población1,4-6. Las diferentes normativas en lo que se refiere al uso de los IGRA dependen de cada país; así, por ejemplo, el CDC (Center for Diseases Control) en EE.UU. recomienda sustituir la PT por los IGRA en todos los casos; por el contrario, en el Reino Unido, el Nacional Institute of Health and Clinical Excellence (NICE) recomienda el uso de los IGRA en combinación con la PT sólo en aquellos casos en los que la tuberculina haya sido positiva. Otros países como Francia o Canadá han adoptado dichas recomendaciones. Sin embargo, están basadas en estudios de coste-efectividad, comparando PT con uno de los IGRA (QFT-GIT o T-SPOT.TB) disponibles en el mercado. En un estudio publicado recientemente, Pooran, et al.7 comparan los dos tipos de IGRA, llegando a la conclusión de que usar la estrategia PT/IGRA de forma conjunta es más económico que emplear T-SPOT.TB o QFT-GIT o PT de forma aislada para el estudio de contactos, mientras que T-SPOT.TB y QFT-GIT aisladamente previenen más casos de TB activa, pero no superan al menor coste de la utilización conjunta PT/IGRA. Sin embargo, estas conclusiones dependen en gran medida de la población estudiada.
El objetivo de nuestro estudio fue comparar el QFT-GIT con el test de la tuberculina como método de cribado para la detección de infección tuberculosa latente en pacientes en DP.
PACIENTES Y MÉTODOS
Pacientes
Se incluyeron en el estudio los pacientes con insuficiencia renal crónica en programa de DP de los Hospitales Marqués de Valdecilla en Santander y Central de Asturias, en Oviedo, que no presentaran signos ni síntomas de enfermedad tuberculosa activa o extrapulmonar (entre diciembre de 2007 y julio de 2008) y que aceptaron participar en el estudio.
Se realizaron la prueba de la tuberculina y el test de QFT-GIT a todos los pacientes incluidos. Se consideraron como pacientes de alto riesgo para la infección tuberculosa latente aquellos que vivían en áreas endémicas para TB, que refirieron haber estado en contacto con afectados de TB o con antecedentes de enfermedad tuberculosa y aquellos que tenían una radiografía de tórax compatible con una TB previa.
Test de la tuberculina
El test de la tuberculina fue realizado por personal de enfermería especializado en TB. A todos los pacientes se les administró 2UI PPD Rt-23, en la región volar del antebrazo. Los resultados fueron evaluados 72 horas después de acuerdo con las normas establecidas. El test se consideró positivo con una induración >5 mm. Para los pacientes que se habían vacunado previamente con BCG, la prueba de la tuberculina se consideró positiva con induración >10 mm (excepto en aquellos casos con contacto previo con infección tuberculosa, radiografía de tórax sugestiva, infección por el virus de la inmunodeficiencia humana [VIH] o silicosis reconocida). A los pacientes que no presentaron induración en el primer test se les repitió el test a los 10 días para descartar un posible efecto booster.
Quantiferon® - TB Gold In Tube
El test de QFT-GIT (Cellestis, Carnegie, Victoria, Australia) se realizó según las instrucciones del fabricante. Las muestras de sangre se obtuvieron previamente a la realización de la PT y se procesaron de 6 a 8 h después de la extracción. La sangre se introdujo en 3 tubos diferentes, uno de ellos no contenía antígeno (control), el segundo tubo contenía antígenos de TB y el tercero contenía fitohematoglutinina (mitógeno o control positivo). El tiempo de incubación fue de 18-24 h a 37 ºC.
Los resultados fueron considerados positivo, negativo o indeterminado según la interpretación de los criterios que se establecen en el software del fabricante. La PT y el QFT-GIT se realizaron en el mismo día.
Valoración por parte del neumólogo
Dos neumólogos expertos en TB (uno en cada hospital) evaluaron los factores de riesgo para infección tuberculosa latente, que incluyeron: antecedentes personales de TB activa o contacto con un caso activo, vacunación o haber nacido en una área endémica para TB. Los resultados de la PT y la radiografía de tórax también se valoraron. Para determinar si el paciente había sido infectado previamente con M. tuberculosis se valoraron todos los datos.
Análisis estadístico
Los datos se analizaron con el programa estadístico SPSS (SPSS versión 12.0, Chicago, IL) y valores de p menores a 0,05 se consideraron significativos. Para calcular el grado de concordancia entre las dos pruebas (PT y QFT-GIT) se utilizó en índice de kappa de Cohen. Se usaron los siguientes criterios para la interpretación (según Landis y Koch): kappa menor de 0,00 pobre, 0,00-0,20 débil, 0,21-0,40 razonable, 0,41-0,60 moderada, 0,61-0,80 buena y 0,81-1,00 muy buena.
RESULTADOS
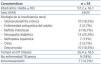
Características de la población estudiada (tabla 1)
Se incluyeron un total de 54 pacientes entre diciembre de 2007 y julio de 2008. Todos los participantes en el estudio dieron un resultado negativo para el test del VIH. Ocho de los pacientes tuvieron niveles de albúmina séricos inferiores a 3,20 mg/dl. La mayoría (31, 57,4%) no habían recibido la vacuna BCG. Diez de los pacientes tenían antecedentes personales de TB, dos de ellos se trataron de forma inadecuada y uno sufrió una recidiva de la enfermedad tuberculosa. A lo largo del seguimiento no se detectaron casos de primoinfección o de reactivación tuberculosa.
PT, QFT-GIT y la valoración por el neumólogo
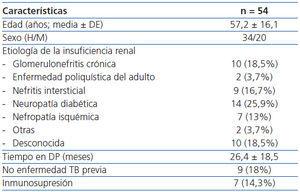
La prevalencia de positividad para la PT fue del 29,6% (16 pacientes) para el primer test y del 31,5% (17 pacientes) para el segundo. Hubo un 5,8% de falsos positivos y tres falsos negativos (8,1%) para la PT.
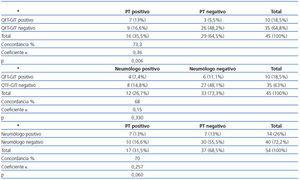
Una radiografía de tórax positiva aumentó la detección TB latente hasta 6 (42,6%) y la valoración por el neumólogo hasta 7 (44,4%). En 14 casos (26,5%) el neumólogo encontró evidencia de enfermedad tuberculosa previa.
En el QFT-GIT hubo 10 resultados positivos (18,5%), 34 negativos (62,96%) y 10 indeterminados. Nueve (26%) de los negativos tenían antecedentes personales de TB, radiografía de tórax o valoración por el neumólogo positiva. De los indeterminados, cinco fueron revaluados (uno se mantuvo negativo y los otros cuatro indeterminados). De los 9 resultados indeterminados, un paciente tenía una PT positiva y los otros tenían 0 mm de induración. Tres de los pacientes presentaban un bajo riesgo para TB y seis un riesgo alto. Los factores asociados con un resultado indeterminado de QFT-GIT se exponen en la tabla 2.
Pacientes de alto riesgo frente a pacientes de bajo riesgo
Un total de 32 pacientes (59%) tenían alto riesgo y los otros 22 (41%), bajo riesgo para infección tuberculosa latente. Ninguna de las dos pruebas (PT/QFT-GIT) fue capaz de distinguir entre pacientes de alto o bajo riesgo.
Concordancia entre PT, QFT-GIT y el neumólogo
La concordancia entre las tres modalidades diagnósticas se expone en la tabla 3. Un análisis posterior entre pruebas discordantes mostró que el QFT-GIT fue positivo en 3 pacientes que fueron negativos para tuberculina y fue negativo en 9 pacientes que fueron positivos para tuberculina. El test de la tuberculina fue positivo en 10 pacientes con valoración positiva por el neumólogo y negativo en 7 pacientes considerados positivos para TB por el neumólogo.
DISCUSIÓN
Como no existe un gold standard para diagnosticar la infección tuberculosa latente, varios autores han comparado la utilidad de los IGRA con la PT en diversos grupos de pacientes (población general, niños, pacientes hospitalizados de riesgo e inmunocomprometidos)1,4-5. La PT se ha utilizado de forma rutinaria a pesar de su baja especificidad, gran número de falsos positivos (vacunación previa con BCG o infección por micobacterias no tuberculosas), y una baja sensibilidad, con un alto número de falsos negativos (pacientes inmunocomprometidos o con anergia cutánea). En el artículo de Woeltje, et al. se estudiaron 307 pacientes en hemodiálisis, el 32% de los cuales presentaron anergia cutánea a tres tipos de alergenos diferentes y un 9% de los pacientes sin anergia fueron positivos para la PT8. En nuestro estudio, la respuesta positiva a la PT fue similar a la descrita para pacientes en hemodiálisis2. El hallazgo de 6 pacientes PT negativos con radiografía de tórax positiva se puede explicar por la tasa de anergia cutánea previamente descrita en pacientes en hemodiálisis. Se han descrito alteraciones de la inmunidad en relación con la uremia que condicionan una alta incidencia de infecciones y mortalidad9. Esta alteración de la inmunidad retardada conlleva déficit de interleucina-2, linfopenia B, incremento de la apoptosis celular, alteración en la activación de los linfocitos T y más de las células presentadoras de antígenos10-15. Todos estos cambios en las respuestas del huésped pueden justificar los resultados negativos para la PT, independientemente de la anergia cutánea.
Se ha investigado la utilidad de los IGRA en pacientes en hemodiálisis con resultados similares a los nuestros. Uno de estos estudios fue diseñado específicamente para comparar PT con QFT-GIT en 203 pacientes en hemodiálisis, encontrando una correlación razonable entre ellas, por lo que recomendaron no utilizar la PT para el cribado de TB en esta población sin la valoración de un clínico, pero sí una combinación de IGRA con la valoración del clínico16. Más recientemente, Torres, et al. demostraron un nivel de concordancia moderado entre ambas pruebas con un tamaño muestral parecido al nuestro. Este trabajo incluyó a pacientes hospitalizados con alto riesgo de sufrir TB (algunos en hemodiálisis), recomendando el uso de QFT-GIT de forma rutinaria en este tipo de pacientes, al menos en los casos en hemodiálisis, para intentar establecer cuándo tratar la tuberculosis4. En los pacientes en diálisis peritoneal, estos resultados pueden explicarse tanto por anergia cutánea como por baja producción de QFT-GIT y otras citokinas.
En este trabajo, un 16% de los pacientes fueron indeterminados para QFT-GIT. Nuestros resultados coinciden con los de Manuel, et al., aunque estos autores estudiaron a un grupo diferente de pacientes inmunocomprometidos (con enfermedad hepática crónica)5. Analizando estos datos en conjunto, podríamos asumir que los resultados indeterminados probablemente estén relacionados con el déficit inmunológico.
Este trabajo explora por primera vez la contribución del QFT-GIT a mejorar las posibilidades diagnósticas de la infección tuberculosa en pacientes en diálisis peritoneal. Su principal debilidad es el número de pacientes con prueba cutánea y/o QTF-GIT positivos. Nuestros resultados se correlacionan bien con el porcentaje de positividades observadas en las escasas publicaciones existentes y el número de pacientes estudiados es relativamente alto dada la baja incidencia y prevalencia de pacientes en DP en España17.
En conclusión, creemos que los IGRA representan un avance notable en el diagnóstico de la infección tuberculosa, que en el momento actual pueden complementar pero no sustituir a la PT. El lugar que deben ocupar en el cribado de las personas de riesgo, entre ellas los pacientes diagnosticados de insuficiencia renal crónica en programa de diálisis peritoneal, está aún por definir. Para ello se precisan estudios longitudinales que proporcionen evidencia sólida sobre su valor pronóstico sobre el desarrollo de TB a largo plazo.
Tabla 1. Características de los pacientes
Tabla 2. Análisis univariante de los factores de riesgo para resultado de Quantiferon-TB gold (QTF-G) indeterminado
Tabla 3. Concordancia entre la prueba de la tuberculina, Quantiferon-TB Gold y valoración por el neumólogo, excluyendo a los pacientes con resultado indeterminado para QFT-GIT*