La enfermedad renal crónica (ERC) ha servido de modelo y fuente de conocimiento sobre los mecanismos, la relevancia clínica y progresión acelerada de los procesos de la calcificación cardiovascular (CV), así como de sus repercusiones en la práctica clínica, aunque se trate de un fenómeno tardío y secundario de osificación sobre el que solo disponemos de evidencias circunstanciales. En esta amplia revisión se describen primero los tipos de calcificación CV que afectan al paciente con ERC y se analiza cómo su presencia está directamente asociada a eventos CV y a un aumento de la mortalidad de estos pacientes. Asimismo, justificamos la valoración de la calcificación CV en la práctica clínica nefrológica habitual, al entender que es un predictor importante de la evolución clínica de estos pacientes, y consideramos que la valoración de las calcificaciones CV es una herramienta que puede y debe ser utilizada por el nefrólogo para la toma individualizada de decisiones terapéuticas en un momento en que se requiere cada vez más de una medicina personalizada.
Chronic kidney disease (CKD) has been used as a model and source of knowledge concerning the mechanisms, clinical relevance and accelerated progression of cardiovascular (CV) calcification, as well as its consequences in clinical practice, despite we know that it is a late secondary ossification phenomenon and only circumstantial evidence is available. In this comprehensive review, we firstly describe the types of CV calcification which affect CKD patients, and we analyse how its presence is directly associated with CV events and increased mortality in these patients. We also justify the use of CV calcification assessment in regular nephrology clinical practice, because CV calcification is an important predictor of clinical outcome in these patients. Consequently, we believe that CV calcification assessment is a tool that could and should be used by nephrologists when making a decision concerning individual patients, consistent with the current trend of an ever-more-personalised therapeutic approach.
Actualmente está aceptado que la enfermedad renal crónica (ERC) es un factor independiente de riesgo cardiovascular (CV) y que sus tasas de mortalidad aumentan de modo exponencial con el deterioro progresivo de la función renal1. Aunque las primeras asociaciones entre ERC y enfermedad CV se remontan a hace más de 40 años, la dimensión real del problema se hizo evidente solo hace algo más de una década. En este sentido, han sido importantes, entre otras, varias iniciativas de la Sociedad Española de Nefrología como la de implementar la estimación sistemática del filtrado glomerular2–7, que permite la detección precoz de la ERC y hacer aflorar la ERC oculta en España8. Además, otras iniciativas recientes han despertado en médicos de otras especialidades conciencia sobre la necesidad del diagnóstico, estratificación y cuidados especiales del paciente renal, y se han generado documentos de consenso en los que han estado implicadas hasta 10sociedades nacionales6,9–11. La importancia creciente de la ERC como problema de salud y, por tanto, de la Nefrología como especialidad, se ve también reflejada en la preocupación por la valoración renal en las guías clínicas y publicaciones de otras especialidades12–16.
En el contexto del síndrome cardiorrenal17 y la estrecha relación entre ERC y enfermedad CV, existe actualmente un amplio debate sobre la relevancia clínica de las calcificaciones CV incluso más allá del enfermo renal13,18–22. De este modo, la ERC ha servido de modelo y fuente de conocimiento sobre mecanismos y relevancia clínica de la presencia y progresión acelerada de los procesos de arteriosclerosis o calcificaciones vasculares y de sus repercusiones en la práctica clínica diaria18,23–27. Los conocimientos sobre esta entidad están avanzando a tal ritmo que conviene detenerse y actualizar este tema, conectando los aspectos más básicos con los clínicos e intentando ser objetivos y realistas a la hora de concluir sobre las posibles estrategias para el cuidado de nuestros pacientes. Por ello, en esta primera parte de la revisión describiremos brevemente los tipos de calcificación CV, asociadas tanto a enfermedades de alto como de bajo remodelado óseo24,28, y analizaremos cómo su presencia está directamente vinculada a eventos CV y a un aumento de mortalidad. En la segunda parte se expondrá cómo la calcificación CV, aunque se trate de un fenómeno tardío y secundario y solo se disponga de evidencias circunstanciales19,20, es un factor de riesgo modificable y al que desafortunadamente podemos contribuir con iatrogenia indeseable18,29.
ERC, riesgo cardiovascular y «CKD-MBD»Además de los factores de riesgo CV tradicionales (edad avanzada, obesidad, tabaquismo, diabetes, hipertensión, dislipidemia), un conjunto de factores de riesgo CV no tradicionales pueden explicar la desproporcionada mortalidad observada en la población con ERC. Entre estos últimos, una serie de trastornos modificables del metabolismo óseo-mineral como alteraciones del fósforo (P), calcio (Ca), parathormona (PTH), vitamina D o el eje del factor de crecimiento fibroblástico 23 (FGF23)/klotho, entre otros, parecen ser clínicamente relevantes30–32; además, existen otros factores directa o indirectamente relacionados: inflamación, estrés oxidativo o alteraciones en la vía de señalización Wnt/β-catenina19,33–36. Con el fin de subrayar sus consecuencias sistémicas y el daño orgánico producido más allá del hueso, la nueva denominación CKD-MBD (acrónimo inglés de chronic kidney disease-mineral and bone disorder) ha sido acuñada y ampliamente aceptada37,38, aunque su traducción al español ha sido diversa y poco homogénea39,40. En este amplio concepto, además de las anormalidades bioquímicas y óseas, se han incluido también las calcificaciones vasculares, valvulares y extraesqueléticas. Estas también son reconocidas desde el punto de vista fisiopatológico en el novedoso concepto «eje hueso-vaso», que relaciona directamente la afectación ósea con el sistema CV, y describe el hueso como un nuevo órgano endocrino (glándula que secreta hormonas como el FGF23, esclerostina u osteocalcina, entre otras) y que se encuentra «en el corazón» de la ERC como importante tampón de las alteraciones óseo-minerales41–47. Esta asociación afecta no solo al paciente con ERC, sino que ha sido extendida a otras especialidades48,49.
Localización anatómica y tipos histológicos de calcificación cardiovascularLa calcificación CV puede presentarse de forma muy heterogénea. Se han descrito los siguientes tipos: 1) la ateromatosis-aterosclerosis clásica, en el contexto de cambios degenerativos de la aorta y grandes arterias elásticas, y directamente vinculada a inflamación y dislipidemia19,50; 2) la calcificación de la media o enfermedad de Monckeberg, en el contexto de engrosamiento concéntrico de la capa media de arterias de tipo muscular50; 3) la calcificación valvular cardíaca y 4) la calcifilaxis o arteriopatía urémica calcificante24,50–52. Recientemente ha sido también descrita una forma singular de calcificación vascular limitada a la lámina elástica interna53,54 y la potencial importancia de la calcificación miocárdica como inductora de trastornos eléctricos-muerte súbita55,56.
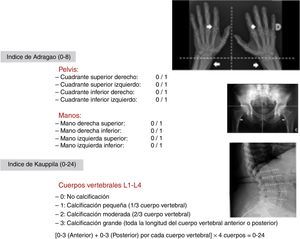
Todas las arterias hasta las más pequeñas arteriolas pueden afectarse; más raramente las venas50,57–60. Como ejemplo, las arterias radiales, cubitales e interdigitales representan arterias solo de tipo muscular, reguladoras del flujo sanguíneo con una densa capa media de músculo liso calcificable27,44,58,59. Las arterias ilíacas y femorales (arterias predominantemente pero no exclusivamente musculares) son también más susceptibles a la calcificación que la media59. Todas ellas son valoradas en radiografías (RX) simples y son utilizadas para calcular el conocido índice de Adragao58 (fig. 1). Por otra parte, el índice de Kauppila (fig. 1) evalúa una arteria de tipo elástico (aorta abdominal) que sería más susceptible a la calcificación de la íntima, dado que estas arterias elásticas (como subclavia y carótida) tienen una capa media que contiene más fibras elásticas que células musculares27,44,50,54.
Índice de Adragao:
Radiografía simple de manos y pelvis. Se determina por la suma de la ausencia de calcificación (0 puntos), presencia unilateral (1 punto) o bilateral (2 puntos) de las calcificaciones lineales de cada sección. Analiza las calcificaciones de arterias ilíacas, femorales, radiales y digitales. El valor final oscilará entre 0 y 8 puntos (0-4 en cadera y 0-4 en manos)58.
Índice de Kauppila:
Se realiza una radiografía lateral de abdomen que incluya desde la vértebra T-10 hasta las 2primeras vértebras sacras. La aorta se identifica como una estructura tubular delante de la columna vertebral. Se analizan solo los segmentos de la aorta abdominal que están por delante de las 4primeras vértebras lumbares (L1-L4). La puntuación se asigna de 1 a 3 (1: calcificación pequeña (1/3 de la longitud del cuerpo vertebral), 2: moderada (2/3), 3: grande (afecta más de 2/3 de la longitud del cuerpo vertebral) de acuerdo con la longitud de cada placa calcificada detectada. Se tiene en cuenta tanto la parte anterior como posterior de la aorta, relacionándolas con la localización según se ubiquen frente a las vértebras L1, L2, L3 o L4. Con esta gradación se obtiene una puntuación final entre 0 y 24 puntos135.
La presencia de calcificación arterial coronaria (CAC) se ha descrito en el 75% de las necropsias en los sujetos de la población general61 y en más del 95% de pacientes en diálisis62, reportándose otros resultados de prevalencia muy variables (47-98%)63,64. Estos dependen de la población y del territorio vascular analizado, así como de la sensibilidad de las distintas técnicas diagnósticas empleadas63,65,66. En este sentido, Górriz et al. describieron recientemente en pacientes con ERC (no en diálisis) que, más allá de las calcificaciones coronarias ya publicadas67, las calcificaciones vasculares detectadas por RX simples de manos y pelvis son un predictor sólido de supervivencia libre de hospitalización, mortalidad CV y mortalidad global, que es incluso superior a la calcificación aórtica59. Esta observación conlleva importantes implicaciones clínicas que comentaremos en la segunda parte de esta revisión29.
Las calcificaciones vasculares y valvulares son más frecuentes y evolucionan más rápidamente en la enfermedad renal crónica: patogenia e implicacionesLa calcificación CV no es un fenómeno nuevo ni exclusivo de la ERC24,68. Es también frecuente en pacientes diabéticos y se relaciona estrechamente con la edad/envejecimiento13,27,48. Tampoco es un factor etiológico primario de la enfermedad arterial19, puesto que la calcificación de la íntima constituye una parte de la historia natural de la ateromatosis en etapas tardías (estadio vii), aunque se asocia a eventos CV isquémicos. La calcificación de la media, como expresión de la arteriosclerosis, induce rigidez arterial y un aumento de la velocidad de la onda del pulso que contribuye al desarrollo de hipertrofia ventricular izquierda, fibrosis, disfunción ventricular, disminución de riego coronario durante la diástole e insuficiencia cardíaca. El grado de calcificación de cada lesión tiene una relación variable con la severidad de la estenosis luminal asociada y la relación entre el grado de calcificación en una lesión individual y la probabilidad de rotura de la placa es desconocida. No obstante, la presencia de cualquier tipo de calcificación vascular se asocia claramente con la carga ateromatosa total (influida por múltiples factores como edad, dislipidemia, diabetes, grado de ERC, tiempo en diálisis, etc.), y con eventos CV, hospitalización, además de mortalidad27,59,69.
Aunque la opinión de los expertos no sea uniforme19,70–75, no se ha confirmado que la calcificación de la íntima per se sea un factor de riesgo para la rotura de la placa y, por otra parte, es bien conocido que la inflamación la precede y que raramente se solapan76,77. Sin embargo, esta calcificación parece estar también asociada de forma directa a eventos CV78,79, por lo que aunque la calcificación sea un fenómeno muy tardío y probablemente secundario a otros fenómenos (marcador de progresión de una inflamación inicial y aterosclerosis), el hecho de que esta contribuya a la estabilización de la placa se ha puesto en duda80,81. La literatura reciente revela que el estrés local del tejido podría aumentar por la presencia de calcificaciones yuxtaluminales y las microcalcificaciones incrustadas en el casquete fibroso81,82. Asimismo, en pacientes con ERC la composición de la placa de ateroma se caracteriza por un aumento de la calcificación y una reducción de la cantidad de colágeno que podrían condicionar inestabilidad y rotura de la placa83,84. En cualquier caso, al menos en los pacientes en hemodiálisis, se debe tener en cuenta que la causa más importante de mortalidad no parece ser la rotura de la placa sino eventos CV no ateromatosos como la muerte súbita (24,5% de la mortalidad total en un estudio)55.
El diagnóstico diferencial de la calcificación vascular de la íntima vs. media, su importancia relativa y las consiguientes implicaciones clínicas es un tema de amplio debate18,19,54,55,59,66. Los distintos tipos de calcificación CV conllevan diferencias clínicas y pronósticas ya que condicionan eventos CV de distinta naturaleza50, así como particularidades clínicas diferentes en pacientes de la población general y en pacientes con ERC54. Además, la mayoría de los pacientes con ERC pueden tener simultáneamente ambos tipos de calcificación vascular, con la potencial superposición de procesos patológicos y clínicos27,28,50,59,62,85. Asimismo, se ha señalado que ambos tipos de calcificación vascular podrían ser un continuum de enfermedad vascular22, y que la calcificación de la media podría tener mayor valor pronóstico para identificar pacientes con ERC de alto riesgo27.
La calcificación vascular es más prevalente y más grave en los pacientes con ERC, con una frecuencia mayor a medida que disminuye la función renal62,63,86. Recientemente hemos descrito que la calcificación vascular, valorada por RX simples, ya estaba presente en el 79% de los pacientes con ERC estadios 3-5 en España (67±13 años de edad, 37% diabéticos, creatinina 2,8±1,3mg/dl, filtrado glomerular medio por MDRD de 27±12ml/min/1,73m2, incluyendo 86% de pacientes con ERC estadio 3-4)59. La calcificación vascular ya era prominente (definida como índice de Adragao≥3 o índice de Kauppila>6) (fig. 1) en el 47% de los pacientes59, y ya era conocido que esta es superior en pacientes con ERC en comparación con un grupo control54. Como ha sido mencionado con anterioridad, este curso acelerado de la calcificación CV está probablemente relacionado con la aterosclerosis o envejecimiento acelerados que afecta a los pacientes con ERC. Es probable que esto sea debido a que múltiples factores relacionados con la ERC en general (inflamación, alteraciones de la vía del óxido nítrico, estrés oxidativo, toxinas urémicas, dialitrauma, etc.) o con CKD-MBD en particular (P, Ca…) pueden actuar como poderosos catalizadores de la calcificación CV18,19,21,87–91.
Existe una amplia evidencia experimental que muestra cómo varios trastornos del metabolismo mineral que forman parte del complejo CKD-MBD actúan como promotores de la calcificación CV, sobre todo relacionados con el daño vascular inducido directa o indirectamente por el P y Ca, más allá de su precipitación pasiva en la pared del vaso89,92–95. La transformación de las células madre mesenquimales, pericitos o células musculares lisas vasculares (CMLV) en células similares a osteoblastos también está bien documentada, sobre todo en condiciones urémicas28,92,96,97. Es de destacar que recientemente se han analizado arterias mamarias con calcificación vascular en pacientes con ERC, sin encontrar ninguna evidencia de transdiferenciación osteogénica o apoptosis en las CMLV en estas arterias, lo que indica que la patogénesis de la calcificación de la media también difiere entre regiones arteriales98.
La calcificación vascular es un proceso también activo, altamente organizado y bien regulado, que comparte muchas similitudes con la formación y la mineralización del hueso. Si, en 1575, Falopio ya describió la degeneración de las arterias en hueso, en lo que los médicos de la época llamaron «osificación de las arterias»99, en 1863, Virchow describió estos cambios vasculares como «osificación, no simple calcificación, que ocurre por el mismo mecanismo por el que un osteocito forma calcio en la superficie del hueso»100,101. Por todo ello no sorprende que en la pared vascular normal también existan factores que impidan que esta se transforme en hueso. De hecho, no solo se han descrito inhibidores locales sino también sistémicos de calcificación vascular (que incluyen fetuina-A, «matrix-Gla-protein», pirofosfatos, etc.)102–104. En pacientes con ERC estos inhibidores estarían sobresaturados por una multitud de promotores que favorecen la calcificación y esto lo hacen induciendo fenómenos inflamatorios, estrés oxidativo e incluso apoptosis de las CMLV. El resultado final es un desequilibrio indeseable a favor de factores procalcificantes sobre los inhibidores de la calcificación que favorecen una calcificación vascular excesiva24,102. Existen otros factores que directa o indirectamente están relacionados con el daño a la pared vascular y que favorecen la calcificación CV: citocinas proinflamatorias, especies reactivas de oxígeno, proteínas morfogenéticas óseas, toxinas urémicas, micro-ARNs, la modulación de diferentes vías de señalización celular (i.e. Wnt/β-catenina), o el novedoso papel de las calciproteínas o elastolisis, que dan forma a la compleja fisiopatología de la calcificación CV en la ERC. Analizar con profundidad este proceso tan complejo se encuentra mucho más allá de los objetivos de este manuscrito, por lo que referimos a los lectores a otras amplias revisiones19,24,28,96,97,105–109.
Por último, muchos estudios han establecido varios puntos de enorme trascendencia que contribuyen a reforzar la importancia de las calcificaciones CV en los pacientes con ERC: 1) la calcificación vascular representa un indudable marcador de enfermedad sistémica vascular66; 2) se ha descrito una estrecha relación entre la ERC y la CAC, incluso en adultos jóvenes y, por tanto, independiente de la edad y ateromatosis23; 3) se ha establecido claramente una relación directa entre CAC global e individual y otras localizaciones de calcificación con eventos CV, hospitalización y supervivencia59,66,110–113; 4) la calcificación basal es el factor pronóstico individual más importante de predicción de progresión de la calcificación CV en los pacientes renales y algunos pacientes sin calcificación basal no progresan durante el seguimiento24,114; 5) la progresión de la CAC también ha proporcionado información pronóstica adicional más allá de los factores de riesgo conocidos y el grado de calcificación inicial24,66; 6) la progresión de la CAC se asocia al empeoramiento de otros marcadores de vasculopatía y miocardiopatía66,115 y, finalmente, 7) se ha demostrado recientemente que el análisis de las CAC mejoró el modelo de predicción de riesgo CV en pacientes con ERC116.
Detección de calcificación vascular y guías clínicasComo hemos mencionado, no hay duda de que la presencia de cualquier forma de calcificación CV se asocia y augura resultados clínicos adversos. Sin embargo, existe un amplio debate con relación a la disponibilidad y el significado de las diferentes técnicas de imagen, sistemas o índices de cuantificación, así como si es posible modificar la progresión de la calcificación. Por esta razón, en la publicación de las guías KDIGO de práctica clínica para el diagnóstico, evaluación, prevención y tratamiento del complejo CKD-MBD del año 2009 no se recomendó el cribado indiscriminado a todos los pacientes con ERC (decisión por otra parte no unánime)63. La National Kidney Foundation de EE. UU. recomendó posteriormente una postura similar a la de las KDIGO117. También se propuso que, en los pacientes con estadios 3-5D, se podría utilizar una RX lateral del abdomen para detectar la presencia o ausencia de calcificaciones vasculares y que podría utilizarse la ecocardiografía para detectar la presencia o ausencia de calcificaciones valvulares, todas ellas alternativas razonables a los métodos más caros basados en tomografía computarizada (recomendación 3.3.1, grado de fuerza de la recomendación 2C). Por otra parte, el grupo de trabajo de las European Renal Best Practice (ERBP) consideró justificado el cribado en pacientes incidentes en diálisis118. Las guías españolas119 consideraron justificable también el cribado basal en todos los pacientes con ERC con cualquier técnica (incluyendo la ecografía vascular), sin limitarse a la propuesta RX de abdomen de las guías internacionales54,120. En este sentido, varios estudios observacionales, incluyendo el estudio de Górriz et al59, han confirmado el uso de RX simples en diferentes territorios como método alternativo, económico y eficaz para la detección de calcificaciones vasculares y la evaluación de riesgo en ausencia de una evaluación más específica como la CAC54,58,59,113,121,122. Además, hemos subrayado la superioridad pronóstica independiente de la valoración del índice de Adragao≥3 e incluso del índice único de manos de Adragao>1 sobre el internacionalmente recomendado índice lumbar de Kauppila, incluso en pacientes con ERC no en diálisis. Del mismo modo, solo el índice de Adragao, y especialmente el de las manos, guardaba relación en este estudio con la severidad de disfunción renal, grado de hiperparatiroidismo secundario, hospitalización y mortalidad59, aunque, a diferencia de otros, la calcificación vascular no se asoció necesariamente a un deterioro más rápido de la función renal59. Otros autores ya habían señalado que en pacientes en diálisis la calcificación de las arterias digitales es mejor predictor de mortalidad que las calcificaciones de la aorta abdominal123. Finalmente, es importante destacar que en las guías KDIGO 2009 también se proponía que los pacientes con ERC estadios 3-5D y con calcificación vascular conocida deberían ser considerados en el grupo de mayor riesgo CV (directriz 3.3.2; 2A), así como se afirmaba que «es razonable utilizar esta información para guiar el manejo del CKD-MBD» (guía 3.3.2; sin gradación)63.
Incluso en las guías KDIGO mencionadas anteriormente se afirmó que una valoración de la calcificación vascular debería garantizarse al menos en algunos pacientes, incluyendo «cualquier paciente en el que su médico decida que el conocimiento de la presencia de calcificaciones vasculares pudiera influir en la toma de decisiones terapéuticas»63. Del mismo modo, en el comentario del ERBP sobre CKD-MBD se considera, por ejemplo, que los pacientes con calcificaciones vasculares «deberían recibir poco o ningún Ca adicional procedente de los quelantes de fósforo» a pesar de que se reconoce que hay un debate «continuo y feroz dentro de la comunidad nefrológica» acerca del uso de quelantes con Ca118, como analizaremos en la segunda parte de esta revisión29. En realidad, la calcificación vascular es un componente del complejo CKD-MBD, y existen múltiples estudios experimentales, epidemiológicos y observacionales que apoyan el que la calcificación vascular no es solo un mero marcador sino que directamente causa morbimortalidad CV en los pacientes con ERC18: análisis post-hoc de recientes estudios en pacientes en diálisis refuerzan la plausibilidad de esta hipótesis55. Sin embargo, algunos autores opinan que no hay ninguna opción terapéutica claramente demostrada que se pueda recomendar una vez que se detecta la presencia de calcificación vascular19,118. Recientemente se han publicado los resultados de una conferencia sobre controversias basadas en las guías KDIGO previas y que tuvo lugar en Madrid en el año 2013. El grupo se manifestó unánime sobre que las calcificaciones CV deberían considerarse como guía en el manejo del complejo CKD-MBD124, pero que no había nueva evidencia suficiente que garantizara una reformulación de las afirmaciones mencionadas en las guías previas63,124, aunque varios estudios posteriores podrían fortalecerlas65,125–129.
Finalmente, es importante considerar que mientras los biomarcadores séricos reflejan el riesgo a que está expuesto un individuo en el momento de la medición130, las imágenes de las calcificaciones CV representan el resultado acumulado de una exposición prolongada a uno o múltiples factores de riesgo66. De este modo, diferentes imágenes y métodos de medición han mostrado con frecuencia que son mejores predictores que la frecuente relación en forma de J, J invertida o U de los marcadores serológicos59. Es por ello por lo que se postula que las imágenes podrían permitir no solo una indudable mejor estratificación del riesgo CV13,131, incluyendo pacientes con ERC59,116,132, sino también la individualización del tratamiento, convirtiéndose en un potencial objetivo clínico nuevo66. No obstante se hace necesario demostrar previamente que la calcificación CV es un factor de riesgo modificable con la posibilidad, como mínimo, de disminuir su progresión o de no agravarla (si no pudiera revertirse) como veremos en la segunda parte de esta revisión29.
ConclusionesLos pacientes con ERC presentan un riesgo muy elevado de enfermedad CV y muerte prematuras; por ello, deberíamos ofrecerles la oportunidad de contar con la mejor prevención y tratamiento posibles. En este contexto, hemos demostrado cómo la presencia de calcificaciones CV, una característica destacada del complejo CKD-MBD, está directamente asociada a eventos CV y a un aumento de la mortalidad de estos pacientes. Justificamos que debería formar parte de nuestros protocolos y futuros estudios clínicos, ya que se trata de una característica destacada del complejo CKD-MBD, es un predictor superior de evolución clínica, es un factor de riesgo modificable29, y puede ser utilizado por el nefrólogo en su toma de decisiones terapéuticas, incluso de modo precoz en la evolución de su ERC27,29,59,132–134.
- •
Los pacientes con ERC presentan un riesgo muy elevado de enfermedad cardiovascular y muerte prematuras, no siempre asociado a ateromatosis.
- •
Las calcificaciones cardiovasculares forman parte del complejo CKD-MBD.
- •
Las calcificaciones vasculares y su progresión son predictores independientes de hospitalización, eventos cardiovasculares y morbimortalidad, también en pacientes con ERC e incluso antes de iniciar diálisis.
- •
La evolución de las calcificaciones vasculares es potencialmente modificable.
- •
Las guías KDIGO 2009 (y controversias 2015) y españolas 2011 consideran que es razonable utilizar la información sobre calcificaciones vasculares para guiar el manejo del complejo CKD-MBD.
- •
Dependiendo de los recursos, la valoración de las calcificaciones vasculares debería realizarse en cualquier paciente en el que su médico decida que el conocimiento de su presencia podría influir en la toma de decisiones terapéuticas.
- •
El índice de Adragao, en general, y el de las manos, en particular, podría enfatizar la importancia del control de los factores asociados a CKD-MBD en los pacientes con calcificaciones vasculares.
No se ha recibido financiación para la realización de este trabajo.
Conflicto de interesesEl Dr. Jordi Bover ha recibido honorarios por conferencias de Abbvie, Amgen, Genzyme y Shire, así como por consultorías de Abbvie, Amgen, Vifor/Fresenius-Pharma, Chugai, Medice y Genzyme/Sanofi. El Dr. José Luis Górriz ha recibido honorarios por conferencias y becas de Abbvie. El Dr. Pablo Ureña ha recibido honorarios por conferencias o consultorías de Amgen, Abbvie, Genzyme-Sanofi, Medice, Hemotech y Fresenius. La Dra. María Jesús Lloret ha recibido honorarios por conferencias de Sanofi y Abbvie.
AgradecimientosEl Dr. Jordi Bover pertenece a la Red Nacional RedinRen (RD06/0016/0001 y RD12/0021/0033), la Red de Biobancos Nacional Española (RD09/0076/00064) y al Grupo Catalán de Investigación AGAUR (2009 SGR-1116). El Dr. Jordi Bover colabora con la Fundación Iñigo Álvarez de Toledo (FRIAT). Queremos agradecer también al Sr. Ricardo Pellejero por su importante labor de asistencia bibliográfica.