Introducción: El sobrepeso y la obesidad se asocian a un mayor riesgo cardiovascular y mayor mortalidad en la población general, y existen datos controvertidos en la población en diálisis. Las adipoquinas (leptina, adiponectina) producidas en los adipocitos podrían jugar un papel en dicho proceso, así como los parámetros inflamatorios (proteína C reactiva [PCR], interleuquina 6 [IL-6]) pueden ser marcadores del mismo. Por otro lado, alcanzar el peso seco es hoy uno de los principales objetivos de adecuación en diálisis porque la sobrehidratación sí es un claro predictor de mortalidad. El objetivo de este trabajo es analizar la composición corporal mediante la técnica de bioimpedancia espectroscópica en pacientes en hemodiálisis (HD), evaluar la prevalencia de sobrepeso y sobrehidratación y su posible relación con adipoquinas, parámetros inflamatorios y nutricionales, técnica de HD (convencional [HDC], hemodiafiltración on line [HDF-OL]) y necesidades de eritropoyetina. Métodos: En un estudio observacional transversal, se ha realizado una bioimpedancia espectroscópica pre-HD en mitad de la semana a 77 pacientes en HD extrahospitalaria: 56 HDC y 21 HDF-OL. Se considera sobrepeso cuando el índice de masa corporal (IMC) es ≥ 25 kg/m² y sobrehidratación cuando ésta normalizada al agua extracelular es superior a 0,15. Se han analizado los parámetros clínicos y bioquímicos y se ha determinado IL-6, leptina y adiponectina. Se han comparado estos datos entre los pacientes con y sin sobrepeso, normo y sobrehidratados y con ambas técnicas de HD. Resultados: El 50% de los pacientes cumplen criterios de sobrepeso y el 21% están sobrehidratados pre-HD. Los pacientes con sobrepeso tienen una proporción de grasa y agua extracelular superior (p < 0,001). Los niveles de leptina (p = 0,001) y de PCR (p = 0,036) son más elevados, y los de adiponectina, más reducidos (p = 0,003). Existe correlación inversa entre el IMC y la masa magra (p = 0,01). Los marcadores nutricionales (prealbúmina, albúmina, proteínas totales, creatinina y transferrina) guardan relación con la masa magra (p = 0,05). Al comparar las dos técnicas de HD, se observa menor proporción de grasa en la HDF-OL (p = 0,049) sin diferencias en el grado de sobrehidratación. En el análisis univariante, la edad, la grasa, el cociente agua extracelular/intracelular, la leptina, la hipoadectinemia, la menor masa muscular y la técnica de HDC fueron predictores de sobrepeso. En el análisis multivariante, la hipoadectinemia (odds ratio [OR]: 0,86; intervalo de confianza [IC]: 0,76-0,98), la masa muscular (OR: 0,89; IC: 0,84-0,94) y la técnica de HDF-OL (OR: 0,20; IC: 0,04-0,99) predicen la ausencia de sobrepeso. Conclusión: Este estudio observacional subraya la alta prevalencia de sobrepeso en la población en HD extrahospitalaria y el hecho de que éste está en relación con la grasa y el agua extracelular. Además, se acompaña de mayor inflamación y de niveles superiores de leptina e inferiores de adiponectina. La utilización de la técnica de HDF-OL se asocia a menor sobrepeso por menor proporción de grasa. La bioimpedancia puede ser un arma más en el proceso de toma de decisiones ante los cambios de peso de los pacientes en diálisis.
Introduction: Overweight and obesity are associated to a higher cardiovascular risk and mortality in the general population and conflicting findings exist in the dialysis population. Adipokines (Leptin, adiponectin) produced in adipocytes may play a role in that process, and inflammatory parameters (CRP, IL-6) may be markers for it. Nevertheless, obtaining dry weight is today one of the main aims of adequacy in dialysis because overhydration is a clear mortality predictor. Objectives: The aim of this study was to analyse body composition using an impedance spectroscopy technique in patients on haemodialysis (HD): and evaluate overweight and overhydration prevalence and its possible relation with adipokines, inflammatory and nutritional parameters, HD technique (Conventional [CHD], on-line haemodiafiltration [OL-HFD]) and erythropoietin needs. Methods: In a cross-sectional observational study, a pre-HD multifrequency bioimpedance spectroscopy (BIS) was performed in the middle of the week on 77 HD outpatients: 56 CHD and 21 OL-HFD. Patients were considered overweight when Body Mass Index (BMI) was ≥25kg/m² and overhydrated when overhydration normalised for extracellular water was higher than 0.15l. Clinical and biochemical parameters were analysed and IL-6, leptin and adiponectin levels were determined. This information was analysed in overweight and non-overweight, regular and overhydrated patients and both HD techniques. Results: 50% of patients fulfilled overweight criteria and 21% were pre-HD overhydrated. Overweight patients had a superior fat and extracellular water content (P<.001). Leptin (P=.001) and CRP (P=.036) levels were higher and adiponectin levels were lower (P=.003). An inverse correlation did exist between BMI and lean mass (P=.01). Nutritional markers (prealbumin, albumin, total proteins, creatinine and transferrin) were related to lean mass (P=.05). Comparing both HD techniques, a lower fat content was observed in OL-HFD (P=.049) without overhydration differences. In the univariate analysis, age, fat, extracellular/intracellular water ratio, leptin, hipoadiponectinaemia, lower lean mass and CHD technique were predictors of overweight. In the multivariate analysis, hipoadiponectinaemia (OR: 0.86; IC: 0.76-0.98), lean mass (OR: 0.89; IC: 0.84-0.94) and OL-HFD technique (OR: 0.200; IC: 0.04-0.99) predicted the absence of overweight. Conclusion: This observational study emphasises the high prevalence of overweight in the outpatient haemodialysis population, as long as overweight is related with fat and extracellular water. Furthermore, it is accompanied by higher inflammation and leptin levels and lower levels of adiponectin. The use of the OL-HFD technique is associated to less overweight and fat content. Bioimpedance may prove to be a valuable ally for decisions regarding weight changes in dialysis patients.
INTRODUCCIÓN
La insuficiencia renal crónica (IRC) es un problema de salud pública que suele ir acompañado de una elevada mortalidad de origen cardiovascular1 cuya causa no ha sido claramente establecida. Entre los posibles factores que deben tenerse en consideración están la hipertensión arterial (HTA) y el sobrepeso-obesidad.
El estado anormal de sobrehidratación en los pacientes en diálisis se ha relacionado con HTA, hipertrofia ventricular izquierda y otros efectos cardiovasculares adversos2, y conlleva un riesgo demostrado de mortalidad, por lo que alcanzar el peso seco se considera en el momento actual uno de los objetivos principales de diálisis adecuada3.
En la población general, el sobrepeso y la obesidad son fenómenos cada vez más prevalentes y van asociados a un mayor riesgo cardiovascular y a mayor mortalidad4. Sin embargo, en «algunos» (aunque no en todos) estudios de supervivencia en pacientes en hemodiálisis (HD) se produce el llamado fenómeno de la «obesidad paradójica» o de la epidemiología inversa, en el que un índice de masa corporal (IMC) mayor se acompaña de una mejor supervivencia5. En esta población, que es compleja, existen datos que indican que la relación entre la adiposidad y los factores de riesgo cardiovascular no siguen los mismos patrones que en la población normal. De hecho, en la IRC en estadio 5 existe frecuentemente dislipemia e inflamación en pacientes sin sobrepeso6.
El tejido adiposo es un órgano complejo, con funciones pleiotrópicas más allá del mero almacenamiento de energía. En él se secretan un número de proteínas (adipoquinas) que incluyen la leptina y la adiponectina y también citoquinas como la interleuquina-6 (IL-6). Hoy se considera que el tejido graso juega un papel importante en el medio urémico catabólico a través de su influencia en la inflamación sistémica y la anorexia urémica en relación con la producción de estas moléculas7. La leptina regula el apetito y el catabolismo energético. Su concentración sérica es un buen marcador de la masa grasa (MG) tanto en pacientes obesos8-11 como en no obesos con IRC12. Se considera una toxina urémica de peso molecular medio (16.000 daltons), cuya eliminación es mayor con membranas de alta permeabilidad y con técnicas de hemodiafiltración (HDF)10,11. La adiponectina es una hormona secretada también casi exclusivamente por los adipocitos, que tiene por el contrario propiedades antiaterogénicas y antiinflamatorias y cuyos niveles se encuentran disminuidos en sujetos obesos12.
Entre los marcadores de inflamación, la proteína C reactiva (PCR) es, además, un marcador de riesgo cardiovascular en la población general13 y en los pacientes en diálisis14, así como también lo es el nivel plasmático de alguna citoquina como la IL-615.
El análisis de bioimpedancia eléctrica espectroscópica (BIS) es un método no invasivo, útil tanto para la medida del líquido corporal como para evaluar la MG y la masa magra, que en realidad es expresión de la masa muscular. Ha sido validado recientemente en la población en HD3 persiguiendo sobre todo el establecimiento del peso seco.
El propósito del presente trabajo es analizar la composición corporal de los pacientes en HD mediante BIS evaluando la prevalencia de sobrepeso y sobrehidratación en una población extrahospitalaria de HD y su posible relación con la técnica de HD (convencional [HDC] y técnicas de hemodiafiltración con reposición de líquido on line [HDF-OL]), adipoquinas (leptina, adiponectina), parámetros inflamatorios (PCR, IL-6) y nutricionales (prealbúmina, albúmina, proteínas totales, colesterol, transferrina) o necesidades de factores estimulantes de la eritropoyesis para mantener niveles adecuados de hemoglobina (Hb).
PACIENTES Y MÉTODOS
Este estudio incluye en un corte transversal a 77 pacientes clínicamente estables en HD (n = 77) en el centro extrahospitalario ubicado en un centro de salud dependiente del Hospital Severo Ochoa. De ellos, 56 pacientes se dializaban de forma convencional (HDC) con membrana de polisulfona de permeabilidad media (n = 56) y 21 pacientes con técnica de HDF-OL con membrana de polisulfona de alta permeabilidad y con volumen de reposición mínima de 18 litros (n = 21). El estudio fue aprobado por el comité ético del hospital. Todos los pacientes fueron invitados a participar; todos aceptaron y fueron incluidos en el estudio firmando el consentimiento. La duración mínima de la sesión de diálisis con cualquier técnica fue de 4 horas, y la frecuencia de las mismas, de tres veces por semana, utilizando agua ultrapura cuya calidad se evaluó mensualmente por cinética colorimétrica (Método Farmacopea Europea VI edic. Métodos).
La etiología de la IRC era glomerulonefritis crónica (18%), nefropatía intersticial (14%), enfermedad poliquística (6%), nefroangiosclerosis (19%), nefropatía diabética (19%), idiopática (11%) y otras causas (12%). En cada paciente, la comorbilidad se evaluó mediante el índice de comorbilidad de Charlson16. El 21% de los pacientes eran diabéticos y el 24% presentaban en la historia clínica datos de enfermedad cardiovascular.
Parámetros bioquímicos
Las muestras de sangre se extrajeron en ayunas, antes de la segunda sesión de diálisis de la semana, tras 20 minutos en posición semisentada. Los vacutainers se conservaron en frío y se colocaron inmediatamente en hielo, se centrifugaron a –4 ºC y el suero se almacenó a –40 ºC hasta el análisis. Las medidas de la creatinina sérica, colesterol, proteínas totales, albúmina, transferrina, prealbúmina y PCR fueron analizadas utilizando métodos certificados en el Departamento de Bioquímica del Hospital Severo Ochoa. La paratohormona fue medida por quimioluminiscencia (valores de referencia: 16-87 pg/ml).
Los niveles de leptina se determinaron en plasma de heparina de litio mediante el ensayo Human Leptin ELISA (Mediagnost; sensibilidad de 0,01 ng/ml, especificidad y precisión interanálisis del 7,5% e intraanálisis del 4,35%. Valores de referencia: mujeres, percentil 50 para IMC = 24: 10 ng/ml; varones, percentil 50 para IMC = 24: 2,55 ng/ml).
La determinación de adiponectina se ha realizado en plasma de heparina de litio mediante el ensayo Adiponectin ELISA (Mediagnost; sensibilidad de 0,6 ng/ml, especificidad, precisión interanálisis del 6,7% e intraanálisis del 4,7%. Valores de referencia: mujeres: 4-19,4 μg/ml; varones: 2-13,9 μg/ml).
La IL-6 se ha realizado en plasma de heparina de litio mediante el ensayo Human IL-6 immunoassay (R&D Systems; sensibilidad de 0,7 ng/ml, especificidad, precisión interanálisis del 6,4% e intraanálisis del 4,2%. Valores de referencia: 3,12-12,5 ng/ml).
Se consideró inflamados a los pacientes con niveles de IL-6 o de PCR superiores a la mediana (> 12,5 ng/ml y > 5,05 ng/ml, respectivamente).
El índice de resistencia a la eritropoyetina se definió como la dosis semanal de eritropoyetina (U/kg prediálisis/dosis) dividida por el nivel de Hb en g/dl.
El peso seco del paciente se estableció por criterios clínicos y se ajustó inmediatamente después de cada sesión de diálisis.
Se consideró sobrepeso cuando el IMC era superior o igual a 25 kg/m².
Medida de la bioimpedancia
Fue realizada inmediatamente antes de la segunda sesión de diálisis de la semana. Todos los pacientes fueron tallados y pesados. Se calculó el IMC. Se utilizó un equipo de multifreciencia (Body Composition Monitor, BCM, Fresenius Medical Care). Se determinó el agua extracelular en litros (AEC; ECW), agua intracelular (AIC; ICW), agua corporal total (ACT; TBW), masa magra total en kg (MMT; LTM) y relativa en porcentaje (rel MMT; LTM %), MG total en kg (MGT; FAT) y relativa en porcentaje (rel MG; FAT %), cociente AEC/AIC (ECW/ICW) y AEC/ACT (ECW/TBW), masa celular total en kg (MCT; BCM), ángulo de fase (Phi50), sobrehidratación (SH; OH) en l. Se indican las siglas también en inglés para facilitar la lectura de los resultados a los profesionales habituados a su utilización.
El BCM calcula la SH por la diferencia entre el AEC esperada y la medida. Este método está basado en la hipótesis de las propiedades constantes de la hidratación de los tejidos, asumiendo que la SH en los pacientes en diálisis está primariamente expresada en un espacio extracelular expandido. La SH se define en el rango de la normalidad desde el percentil 10 hasta el 90 de la población sana, variando de –1 l a +1 l17. Los sujetos con valores de SH superiores al percentil 90 (+1,1 l) se consideran sobrehidratados, y con valores inferiores al percentil 10 (–1,1 l) se consideran deplecionados. El estado de SH se normaliza con el AEC (SH/AEC;OH/ECW), dividiendo así a los pacientes en un grupo normohidratado o sobrehidratado. Se consideró SH si el cociente SH/AEC era superior a 0,153.
Análisis estadístico
Todos los análisis estadísticos se realizaron utilizando el programa SPSS versión 12 (SPSS Inc, Chicago). Las variables normalmente distribuidas se expresan como media ± desviación estándar, y las variables que no siguen una distribución normal, como mediana y rango (mínimo y máximo). También las variables categóricas se expresan como número y porcentaje. La comparación entre grupos se ha realizado mediante la t de Student, el test de Mann-Witney o de χ², según el tipo de variable. Para el análisis univariante se ha realizado la correlación de Pearson o de Spearman, según la naturaleza de la variable. Se empleó un análisis de regresión logística, tanto simple como múltiple, para evaluar la influencia de diversas variables sobre la presencia de un IMC ≥ 25 kg/m². En el análisis multivariante se incluyeron todas las variables que presentaron correlación estadísticamente significativa con el IMC y se empleó el método de pasos adelante para la selección de las variables, con la razón de verosimilitudes como criterio para la inclusión de una variable en el modelo. Se empleó un valor de probabilidad inferior a 0,05 como criterio de significación.
RESULTADOS
Características generales, niveles de adipoquinas, parámetros nutricionales e inflamatorios y análisis de composición corporal de nuestra población en hemodiálisis
Este estudio incluye a 77 pacientes prevalentes de una unidad extrahospitalaria de HD en un único centro: 56 fueron tratados con HDC y 21 con HDF-OL.
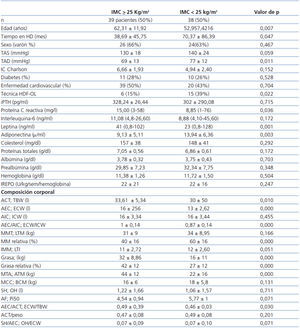
Treinta y nueve pacientes (50%) cumplían criterios de sobrepeso (IMC ≥ 25 kg/m²). El peso de éstos era de 77 ± 11 kg, y el de los pacientes sin sobrepeso, de 57 ± 7,66 kg (p = 0,001).
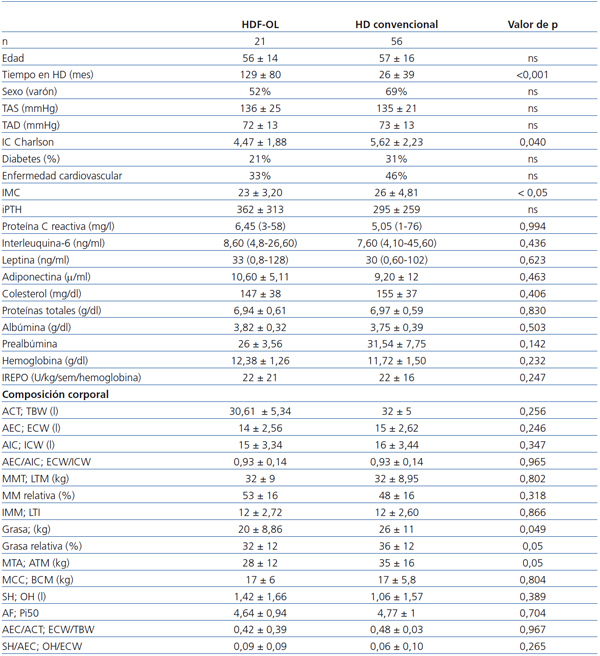
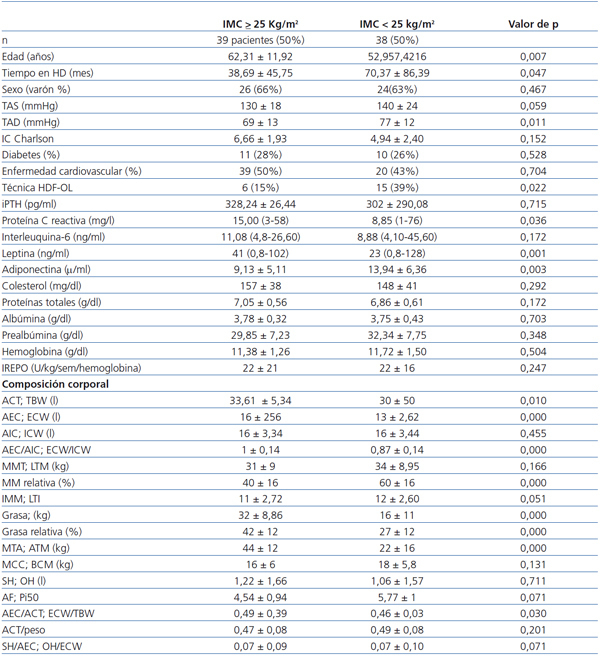
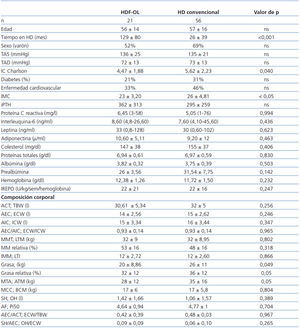
Al comparar los pacientes con y sin sobrepeso (tabla 1), se observa que aquellos con sobrepeso son mayores, llevan menos tiempo en diálisis, tienen unos niveles de tensión arterial diastólica menores y utilizan con mayor frecuencia técnicas de HD convencional. No hay mayor porcentaje de diabéticos entre los pacientes con sobrepeso. Sus niveles de PCR y de leptina son más elevados y los de adiponectina más reducidos, y no hay diferencia en los parámetros nutricionales ni en las necesidades de eritropoyetina.
En el análisis de composición corporal, los pacientes con sobrepeso tienen mayor proporción de grasa, más AEC y menor proporción de masa muscular.
Al comparar estos datos según las dos técnicas de HD (tabla 2), se observa una menor cantidad de grasa en el grupo de pacientes que se dializan con HDF-OL. El tiempo en HD es mayor, pero la comorbilidad y el IMC son menores en los tratados con HDF-OL. Los niveles de adipoquinas, parámetros nutricionales e inflamatorios, así como las necesidades de eritropoyetina, no muestran diferencias entre ambas técnicas.
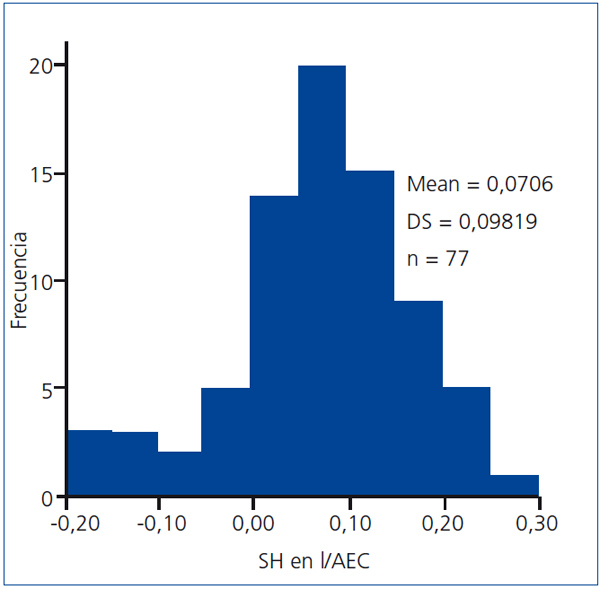
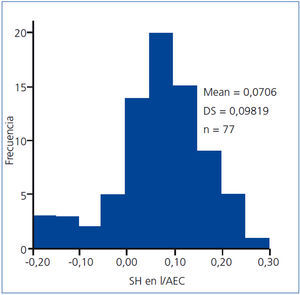
La distribución del estado de hidratación de los pacientes puede observarse en la figura 1.
Están sobrehidratados 16 pacientes (20,7%). Al comparar los pacientes sobre y normohidratados, los sobrehidratados tienen el índice de comorbilidad de Charlson mayor (6,37 ± 2,50 vs. 5,03 ± 2,04, p = 0,029), la tensión arterial diastólica menor (60 ± 70 vs. 76 ± 12, p = 0,015), muestran una tendencia a mayor AEC (15 ± 5,15 vs. 14 ± 1,89, p = 0,255) y menor AIC (15 ± 2,93 vs. 16,35, p = 0,530), por lo que el cociente AEC/AIC es mayor (1,05 ± 0,18 vs. 0,90 ± 0,11, p = 0,049), así como la SH normalizada para el AEC (0,20 ± 0,05 vs. 0,05 ± 0,06, p < 0,001). Sorprendentemente, el peso pre-HD es menor (61,49 ± 10,9 vs. 69,40 ± 14,37, p = 0,044). El resto de los parámetros clínicos, bioquímicos o de bioimpedancia no muestran diferencias entre ambos.
En el global de los pacientes, un 30% tienen niveles elevados de leptina, un 10% los de IL-6 y sólo un 1% tienen niveles de adiponectina inferiores a los valores mínimos. Los niveles de leptina fueron más elevados en mujeres, 26 ng/ml (rango: 1,4-128), que en varones, 4,70 ng/ml (rango: 2,20-58) (p < 0,01). No existían diferencias por razones de sexo en los niveles de IL-6 y adiponectina.
Correlaciones univariadas de adipoquinas, marcadores nutricionales, inflamatorios y parámetros de composición corporal con el índice de masa corporal
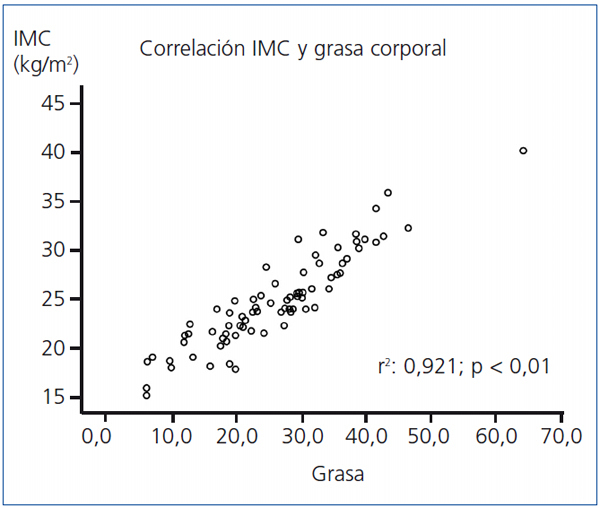
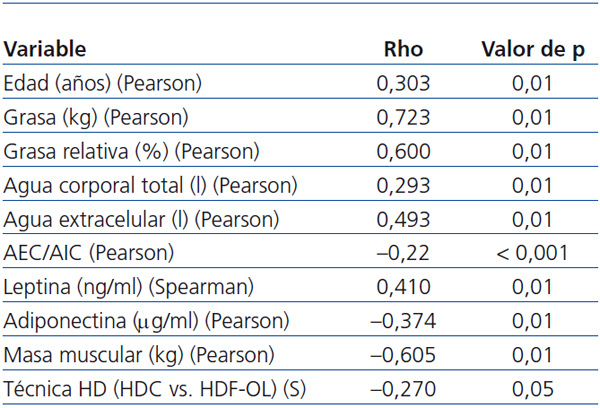
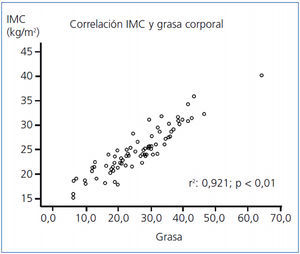
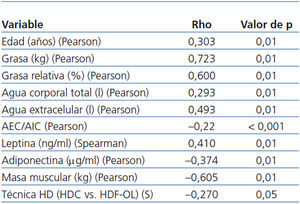
- Existe correlación entre el IMC y la edad (Pearson, p = 0,01), la grasa (Pearson, p < 0,001; figura 2), el agua corporal (Pearson, p = 0,01) y la leptina (Spearman, p = 0,01), y negativa con la masa magra (Pearson, p < 0,01), la adiponectina (Pearson, p = 0,01) y con la técnica de HD (Spearman, p = 0,05) (tabla 3). No hay correlación entre el IMC y la SH normalizada.
- Los niveles de PCR tienen una correlación positiva con la grasa total (Spearman, p < 0,05) y la IL-6 guarda relación con la edad (Spearman, p < 0,05).
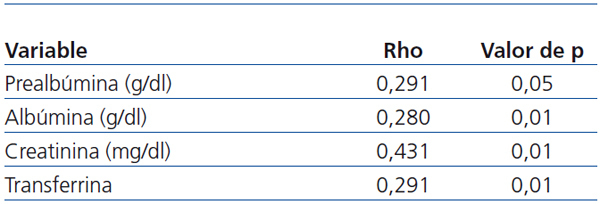
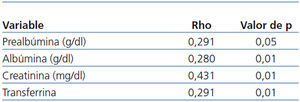
- De los marcadores nutricionales, la prealbúmina (Pearson, p < 0,05), la albúmina (Pearson, p < 0,05), las proteínas totales (Pearson, p < 0,05), la creatinina (Pearson, p < 0,01) y la transferrina (Pearson, p < 0,01) guardan relación con la masa magra total y relativa (Pearson, p < 0,05) (tabla 4).
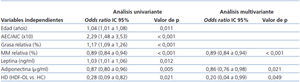
Análisis uni y multivariante de regresión lineal logística múltiple: posibles factores predictivos de sobrepeso
Los datos de este apartado se recogen en la tabla 5.
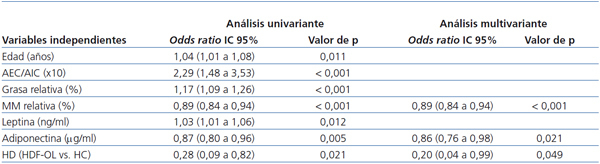
- En el análisis univariante, la edad, el cociente AEC/AIC, la grasa y la masa magra relativas, la leptina, la adiponectina y la técnica de HD (HDF-OL) fueron predictoras de sobrepeso.
- En el análisis multivariante, introdujimos como variable dependiente el IMC ≥ 25 kg/m² y como independientes las variables que habían sido predictoras del mismo en el análisis univariante. Por cada aumento en un punto porcentual de la masa muscular, el riesgo de sobrepeso desciende un 11% (odds ratio [OR]: 0,89; intervalo de confianza [IC]: 0,84-0,94); por cada aumento en un punto porcentual de adiponectina, el riesgo de sobrepeso desciende un 12% (OR: 0,86; IC: 0,76-0,98) y con la técnica de HD (HDF-OL) el riesgo de sobrepeso decrece un 80%, aunque el IC es muy amplio (OR: 0,20; IC: 0,04-0,99).
DISCUSIÓN
El presente estudio observacional analiza la composición corporal de una población extrahospitalaria de pacientes en HD y subraya en primer lugar la alta prevalencia de sobrepeso (50%), mayor que de SH (21%), y que éste es debido fundamentalmente a una proporción de grasa mayor. Además, nuestros resultados sugieren que las diferentes técnicas de HD podrían tener un efecto en la composición corporal. Específicamente, la HDF-OL se asocia a una proporción de grasa corporal menor que la HD convencional, independientemente de otras variables de confusión. Somos conscientes del pequeño tamaño de la muestra, sobre todo de los pacientes con HDF-OL, y de la naturaleza observacional de nuestro diseño, pero esperamos que estos resultados puedan ser confirmados en estudios posteriores. Hasta este momento, no tenemos conocimiento de publicaciones que muestren esta asociación entre la técnica de HD y la proporción corporal de grasa y sobrepeso. La razón por la que la HDF-OL podría contribuir a reducir la MG podría estar en relación con el hallazgo de que la concentración sérica de leptina puede estar influida por el tipo de membrana, depurándose mejor con membranas de alta permeabilidad10 y con la técnica de hemodiafiltración con reinfusión en línea11. Nosotros no lo hemos observado, pero se sabe que la leptina sufre un fenómeno de rebote que guarda relación con el aclaramiento instantáneo del soluto10, que podría ser responsable de nuestros resultados, como consecuencia de una posible mejor depuración en HDF-OL.
Se ha especulado con que la relación entre la adiposidad y los factores de riesgo vascular en los pacientes en HD podría estar en relación con la leptina producida por el tejido graso18,19. Esta adipoquina incide directamente sobre la presión arterial y puede producir daño vascular a través de un efecto central y de un efecto directo sobre los vasos y sobre el corazón20. Por el contrario, varios estudios han señalado que son los niveles disminuidos de adiponectina y el depósito abdominal de la grasa21 los realmente responsables del daño vascular, al encontrar una relación inversa entre los niveles de adiponectina y el IMC o la MG22. Es, además, la adiponectina la que tiene valor predictivo en el sobrepeso actuando como un agente protector cardiorrenal12 con propiedades antiaterogénicas y antiinflamatorias, sobre todo la adiponectina de alto peso molecular, que es la forma activa22. Existe una relación inversa con la grasa de localización abdominal visceral en los pacientes en HD7, y es ésta la que guarda relación con la inflamación, la malnutrición y el aumento de mortalidad22. Se piensa que la hipoadiponectinemia podría ser uno de los mecanismos por el que el acúmulo de grasa produce aterosclerosis. De hecho Zocalli et al. demostraron que el grupo de pacientes en HD con niveles séricos más bajos de adiponectina tenía una tasa más alta de eventos cardiovasculares en un período de observación de un año23. Parece que la grasa visceral actuaría suprimiendo de forma directa la secreción de adiponectina por los adipocitos24. En nuestros pacientes, el porcentaje con hipoadiponectinemia es muy bajo y no hubo diferencias en los niveles plasmáticos de adiponectina según el tipo de membrana utilizada. Sin embargo, los niveles de adiponectina fueron significativamente más bajos en nuestros pacientes con sobrepeso, y en este grupo hubo una proporción más alta de pacientes con enfermedad cardiovascular, aunque no alcanzara significación estadística.
Se confirma la existencia de una relación directa entre la MG y niveles de leptina y el IMC, e inversa entre ésta y los niveles de adiponectina.
La mayor supervivencia observada en algunos estudios en los pacientes con un IMC más alto podría indicar en realidad la existencia de mayor masa muscular debido a una mayor ingesta proteica25. En nuestros pacientes existe una relación inversa entre el IMC y la masa magra, que quizá se pueda explicar por el mayor sedentarismo que suele acompañar a la obesidad, como ocurre en la población general. Los parámetros nutricionales bioquímicos estudiados guardan relación con la masa magra. A mejor nutrición, más masa magra y menos IMC, y a peor nutrición, más grasa y más IMC. La masa magra es, en nuestro caso, un factor predictivo de ausencia de sobrepeso.
La HDF-OL se ha asociado a menor inflamación26, a una eliminación más eficiente de las toxinas urémicas27,28, a una incidencia menor de eventos cardiovasculares26 y a unos niveles mejores de 25 OH vitamina D29. Es posible que los menores niveles de grasa en nuestros pacientes en HDF-OL pudieran justificar lo anteriormente expuesto.
Aunque no existe evidencia de que la membrana de alta permeabilidad o la técnica de HDL-OL mejoren el pronóstico de los pacientes en diálisis, parece haber una tendencia a favor de ambas en algunos estudios30-33. Un aspecto todavía no aclarado es si la mejora del pronóstico de los pacientes en la HDF-OL se debe a la utilización de membranas de alta permeabilidad o de agua ultrapura31-36. Estudios recientes no han podido demostrar un beneficio de la HDF-OL sobre el control de la anemia, la nutrición, el metabolismo mineral, el control de la tensión arterial ni sobre el control del volumen37. Nosotros hemos observado la existencia de una proporción de grasa menor en los pacientes con la técnica de HDF-OL, pero no hemos observado diferencias en el estado de hidratación, en el control de la tensión arterial, en las necesidades de agentes estimulantes de la eritropoyesis ni en los parámetros nutricionales.
Por último, la mayor prevalencia de inflamación en los pacientes con IRC se ha puesto en relación con un aumento de la expresión del gen de la leptina38. En nuestra experiencia, la inflamación medida por la PCR está en relación directa con el aumento de grasa corporal y con el IMC, e inversa con la adiponectina. No hemos encontrado relación entre los marcadores inflamatorios y la situación de volumen extracelular como indican algunos trabajos12,39. Alrededor de un 21% de nuestros pacientes en HD están sobrehidratados en situación de prediálisis, similar a la prevalencia de otros centros con una política similar a la nuestra respecto al peso ideal40. No hemos encontrado diferencias en la masa magra o en la MG entre los pacientes con o sin SH.
De nuestro estudio podemos concluir que el sobrepeso en los pacientes en HD tiene una alta prevalencia (50%) y que las diferentes técnicas de HD se asocian a diferencias en la composición corporal.
Nuestros datos sugieren que, además de la restricción de agua y sal, debemos indicar ejercicio físico a nuestros pacientes.
La técnica de HDF-OL podría reducir uno de los factores de riesgo cardiovascular: el sobrepeso por aumento de la MG corporal.
La bioimpedancia permite la valoración continuada de los diferentes parámetros de composición corporal, pudiendo ser un arma en la toma de decisiones ante los cambios de peso de los pacientes en diálisis.
Agradecimientos
A Fresenius Medical Care, por habernos facilitado el equipo de bioimpedancia y haber financiado las determinaciones de las adipoquinas.
Al Dr. Fernando García López, por su ayuda en la revisión del trabajo.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 2. Correlación (Pearson) entre índice de masa corporal y grasa total en 77 pacientes en hemodiálisis.
Figura 1. Distribución del estado de sobrehidratación normalizado para el agua extracelular.
Tabla 2. Características clínicas, niveles de adipoquinas, marcadores nutricionales e inflamatorios y análisis de composición corporal de los pacientes según la técnica de hemodiálisis
Tabla 3. Correlación bivariada entre índice de masa corporal y variables estudiadas
Tabla 1. Características clínicas, niveles de adipoquinas, marcadores nutricionales e inflamatorios y análisis de composición corporal de los pacientes según IMC
Tabla 5. Análisis uni y multivariante de regresión lineal logística múltiple: posibles factores predictivos de sobrepeso
Tabla 4. Correlación binaria (Pearson) entre la masa muscular y los marcadores nutricionales